细基江蓠繁枝变种原生质体制备条件优化
2022-07-04何艺宾
何艺宾,郝 华
(1.厦门海洋职业技术学院海洋生物学院,福建 厦门 361100;2.厦门大学海洋生物制备技术国家地方联合工程实验室,福建 厦门 361104)
江蓠属(Gracilaria)海藻是一种重要的大型海洋经济藻类,其藻体富含藻胶,是提取工业用琼胶的主要原料[1]。细基江蓠繁枝变种(Gracilariatenuistipitatavar.liui Zhang et Xia)俗称细江蓠(Gracilariacrinale)[2],以其提取的琼胶经济价值大,而被广泛应用于食品工业和医药卫生等领域[3]。此外,细基江蓠繁枝变种是鲍鱼的优质饵料[4],在福建东山岛许多鲍鱼养殖场曾用这一品种喂养鲍鱼,引发市场供不应求,价格一度走俏,养殖经济效益显著。然而在细江蓠繁枝变种人工养殖过程中容易出现藻种老化、藻体染病和不耐高温等问题[5],因此对细基江蓠繁枝变种进行品种改良势在必行。
原生质体作为受体材料,已被广泛应用于植物基因功能研究和杂交育种等[6-7]。目前研究发现红藻的原生质体能够分化再生成新的藻体。Lafontaine N等[8]从带形蜈蚣藻(Grateloupiaturuturu)分离获得了原生质体,并通过培养获得了再生藻体;Yeong H Y等[9]从张氏江蓠(Gracilariachangii)中分离获得了原生质体并通过培养也获得了再生江蓠。原生质体作为转基因受体材料,其转化率与原生质体制备的成功率和质量的程度密切相关[10]。目前关于细基江蓠繁枝变种原生质体制备条件优化的研究尚未见报道,本研究拟从酶解液组分、酶解温度和酶解时间等因素对细基江蓠繁枝变种原生质体的制备条件进行优化,旨在分离获得产量高、活性好的原生质体,为该品种的遗传改良提供一个有效的技术途径。
1 材料与方法
1.1 材料
细基江蓠繁枝变种:从福建东山岛杏陈镇(23.751 580°N、117.396 210°E)采集。
主要实验试剂:纤维素酶R-10、离析酶R-10、果胶酶Y-23,均购自日本Yakult公司;琼脂糖酶(Agarase)、FDA染料,均购自Sigma公司。
1.2 藻种培养
细基江蓠繁枝变种从福建东山岛采集回实验室后,于无菌海水中用软毛刷清洗藻体[11],去除藻体表面的沙泥等杂物,用盐度为25的无菌海水(含200 mg/L卡那霉素)再清洗3次,然后在25℃、120 μmoL photons·m-2·s-1光照培养箱中培养1~2 d。
1.3 方法
1.3.1 藻段选择与处理
选取新鲜、幼嫩且生长状态良好的细基江蓠繁枝变种,摘取位于顶端的藻段,将其切成2~3 cm长的藻段并于含1.5%碘化钾(KI)的无菌海水中浸泡10 min后,用无菌海水冲洗2次,再将藻段切成1~2 mm2小藻块,用无菌海水冲洗2次,备用。
1.3.2 不同酶解液组分对原生质体得率的影响
1)酶解液配制
酶解液组分E1:盐度为25的无菌海水中加入10 mmol/L CaCl2、0.8 mol/L D-甘露醇、2%纤维素酶R-10、1%离析酶R-10、10 U/mL 琼酯糖酶,pH 6.3,充分溶解后,12 000 r/min、4℃离心 5 min,将上清液转移到新的50 mL离心管中,置于冰上备用。
酶解液组分E2:盐度为25的无菌海水中加入10 mmol/L CaCl2、0.8 mol/L D-甘露醇、2%纤维素酶R-10、1%离析酶R-10、0.5%果胶酶Y-23、10 U/mL 琼酯糖酶,pH 6.3,充分溶解后,12 000 r/min、4℃离心 5 min,将上清液转移到新的50 mL离心管中,置于冰上备用。
2)原生质体制备
取0.2 g藻块(1~2 mm2)分别加入到上述两种酶解液(10 mL/g)中,分别置于25、28℃恒温摇床低速摇动(80 r/min),进行黑暗酶解;分别离心收集酶解4、6、8 h的原生质体,具体步骤如下:先用40 μm一次性细胞筛滤去未被酶解的残留物,往滤出液中加入等体积的提取缓冲液(500 mmol/L NaCl、5 mmol/L KCl、5 mmol/L CaCl2、20 mmol/L Hepes、300 mmol/L 甘露糖醇、300 mmol/L 山梨糖醇,调pH值至7.2,121℃灭菌20 min),静置10 min,800 r/min离心5 min,弃90%上清液,用1 mL提取缓冲液重悬,800 r/min离心5 min,弃除残余的酶液,再用500 μL提取缓冲液重悬,取10 μL重悬液于血球计数板中计数,计算每克组织的原生质体得率,确定最佳酶解液组分。
1.3.3 酶解温度对原生质体得率的影响
取0.2 g藻块(1~2 mm2)分别加入2 mL酶解液组分E2(提取效果比酶解液组分E1好),分别置于22、25、28℃恒温摇床低速摇动(80 r/min),进行黑暗酶解;分别离心收集酶解4、6、8 h的原生质体,具体步骤同方法1.3.2中“原生质体制备”,分别取10 μL重悬液于血球计数板中计数,计算每克组织的原生质体得率,确定最佳的酶解温度。
1.3.4 酶解时间对原生质体得率的影响
取0.2 g藻块(1~2 mm2)分别加入2 mL酶解液组分E2,置于28℃(提取效果最佳)恒温摇床低速摇动(80 r/min),进行黑暗酶解;分别离心收集酶解4、6、7、8、10 h的原生质体,具体步骤同方法1.3.2中“原生质体制备”,分别取10 μL重悬液于血球计数板中计数,计算每克组织的原生质体得率,确定最佳的酶解时间。
1.3.5 原生质体活性检测
取100 μL新鲜分离获得的原生体加入1 μL 二乙酸荧光素(Fluorescein diacetate,FDA)溶液(5 mg/mL),室温黑暗放置10 min,800 r/min离心5 min,弃上清液,用100 μL新鲜的提取缓冲液重悬,于荧光显微镜(Axio Lab.A1,ZEISS,德国)中观察FDA绿色荧光,判断分离获得的原生质体活力。
1.4 数据处理
采用GraphPad Prism 5软件对实验数据进行整理分析,利用column功能生成各组数据的柱状图;运用SPSS软件分析比较不同处理组间实验数据的显著性差异并将分析结果添加到柱状图上。
2 结果
2.1 不同酶解液组分对原生质体得率的影响
酶解液组分E1和酶解液组分E2分别于25、28℃条件下的原生质体提取效果如表1和图1所示。在25、28℃条件下,酶解液组分E1和酶解液组分E2的原生质体得率随着酶解时间的增加而增加,酶解8 h的原生质体得率最高;28℃条件下酶解4、6、8 h的原生质体得率均高于25℃条件下的得率。江蓠细胞壁富含果胶,在酶解液组分E2中添加0.5%果胶酶Y-23,其在25、28℃条件下酶解8 h的原生质体得率均高于酶解液组分E1,且差异显著(P<0.05),因此后续实验中使用酶解液组分E2进行原生质体的提取。

表1 不同酶解液组分在不同时间和温度条件下的原生质体得率
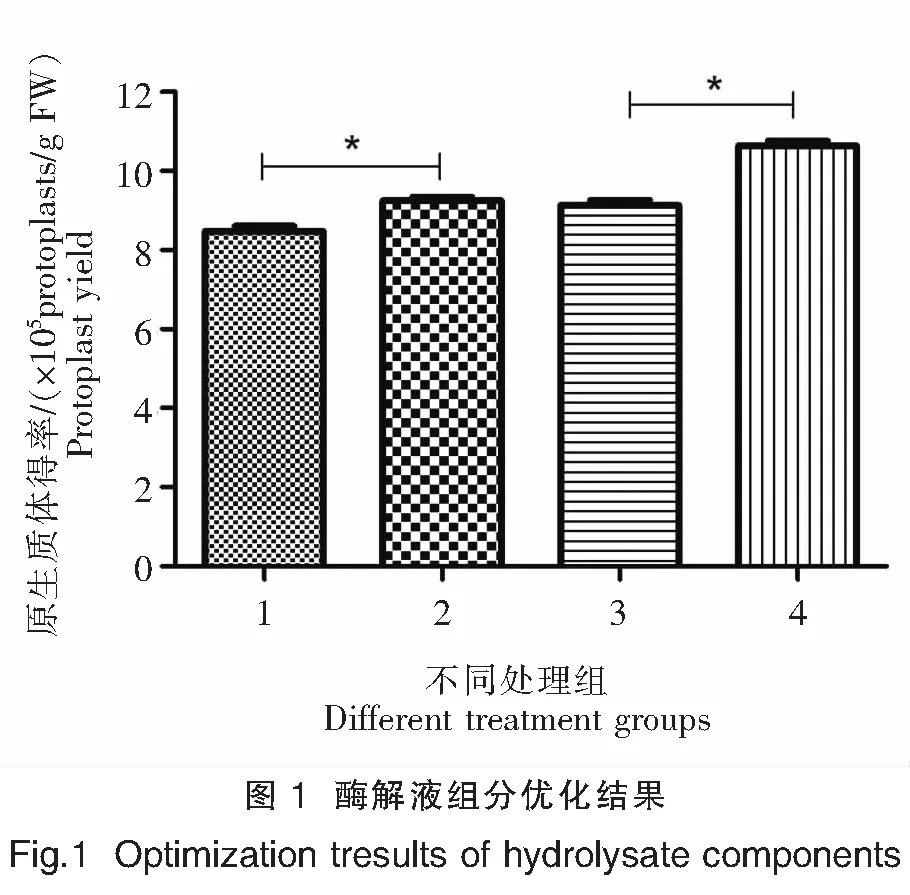
注:图1为酶解液组分E1和酶解液组分E2分别在25、28℃条件下酶解8 h的原生质体得率差异显著性分析。1.酶解液组分E1在25℃条件下酶解8 h的原生质体得率;2.酶解液组分E2分在25℃条件下酶解8 h的原生质体得率;3.酶解液组分E1在28℃条件下酶解8 h的原生质体得率;4.酶解液组分E2分在28℃条件下酶解8 h的原生质体得率。*表示P<0.05。
2.2 酶解温度对原生质体得率的影响
分别离心收集22、25、28℃条件下酶解4、6、8 h的原生质体,计算得出原生质体得率,实验结果如图2所示。22℃条件下酶解4、6、8 h的原生质体得率(×105protoplasts/g FW)分别为(2.25±0.21)、(6.84±0.12)、(8.16±0.18);25℃条件下酶解4、6、8 h的原生质体得率(×105protoplasts/g FW)分别为(2.45±0.12)、(7.76±0.23)、(9.35± 0.11);28℃条件下酶解4、6、8 h的原生质体得率(×105protoplasts/g FW)分别为(2.58±0.22)、(8.13±0.12)、(10.67±0.21)。

研究发现,28℃条件下酶解4、6、8 h的原生质体得率均高于22℃和25℃条件下的原生质体得率。当酶解时间为4 h时,22、25、28℃条件下的原生质体得率差异不明显;随着酶解时间的增加,原生质体得率升高;当酶解时间为8 h时,28℃条件下的原生质体得率为(10.67±0.21)×105protoplasts/g FW,高于22℃和25℃条件下的原生质体得率。28℃条件下酶解6 h的原生质体得率与22℃条件下酶解8 h的原生质体得率相当。
2.3 酶解时间对原生质体得率的影响
分别离心收集28℃条件下酶解4、6、7、8、10 h的原生质体,计算得出的原生质体得率如图3所示。酶解4、6、7、8、10 h的原生质体得率(×105protoplasts/g FW)分别为(2.67±0.03)、(8.17±0.11)、(10.67±0.26)、(11±0.22)、(9.17± 0.31)。酶解4~8 h内,随着酶解时间的增加,原生质体得率逐渐增加,然而酶解时间超过8 h时,由于原生质体的相互挤压破膜,导致原生质体得率反而减少,故最佳酶解时间为8 h。

2.4 原生质体活性检测结果
FDA进入活的细胞内会被胞内脂酶分解,生成有极性、能产生绿色荧光的物质——荧光素,该物质不能自由透过活的细胞膜而积累在细胞膜内,而且只有体膜完整、具有活力的原生质体才能在荧光显微镜下呈现绿色荧光。刚分离获得的原生质体经FDA染色后,在荧光显微镜下能够观察到较亮的绿色荧光,表明提取的原生质体膜完整、活力较好(图4)。
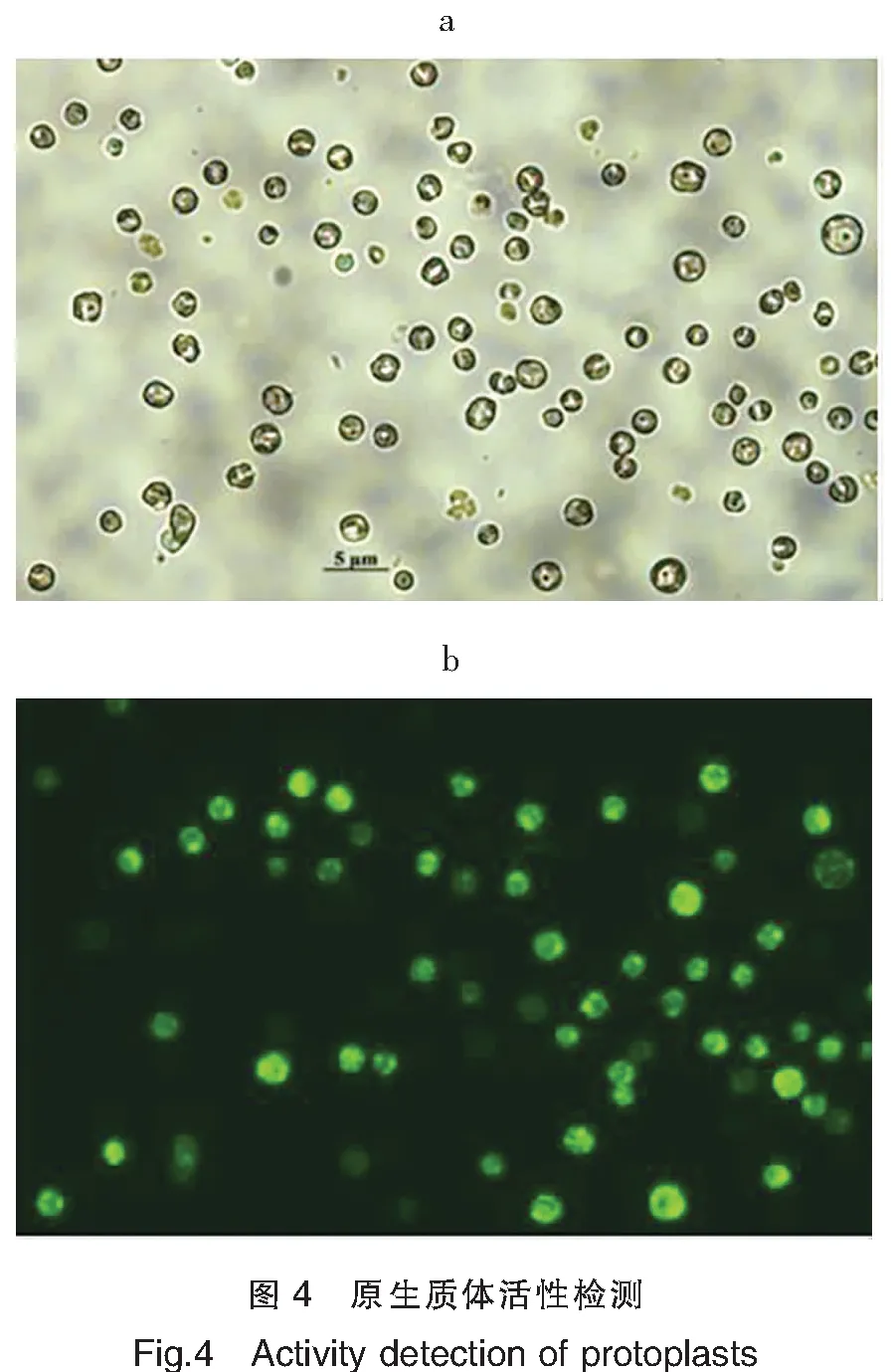
注:a为白色光下观察结果;b为488 nm激发光下观察结果。
3 讨论
3.1 实验材料对原生质体得率的影响
细基江蓠繁枝变种的生长状态、细胞壁厚度等因素都会影响原生质体的得率。Yeong H Y等[9]认为江蓠的生长状态、年龄、生长速度、实验室培养的时间和生长季节都能影响江蓠原生质体的质量和产量。Huddy S M等[12]认为较嫩的藻段因细胞壁较薄,从中可提取的原生质体质量较好,产量较高。本研究选用位于各分支藻体顶端最嫩的新生藻段并用于原生质提取,获得的原生质体活力最好,产量最高;在细江蓠生长的季节里,选用3—5月的藻体用于原生质体提取,原生质体的活力和产量均高于其他月份。这可能与江蓠进入春季后开始生长,顶端新生藻段的细胞壁较薄、生长状态良好有关。
3.2 酶解条件对原生质体得率的影响
Huddy S M等[12]报道Gracilariadura和Gracilariaverrucosa的最佳酶解条件为25℃、酶解4~6 h。Yeong H Y等[9]获得Gracilariachangii的最佳酶解条件为28℃、酶解3 h。本研究得出的细基江蓠繁枝变种的最佳酶解条件为28℃、酶解7~8 h。由此可见,从不同的江蓠品种中,提取原生质体的最佳酶解温度和酶解时间不同,这可能与不同江蓠品种的细胞壁的组成成分不同有关。果胶物质是植物细胞壁成分之一,存在于相邻细胞壁间的胞间层中,起着将细胞粘在一起的作用,酶解液中添加0.5% 果胶酶Y-23可显著提高细基江蓠繁枝变种原生质体得率。此外,细基江蓠繁枝变种富含琼脂,用于原生质体制备的琼脂糖酶的质量也是影响原生质体得率的关键因素之一。
4 结论
研究发现细基江蓠繁枝变种原生质体制备的最佳酶解条件为:1)酶解液组分:盐度为25的灭菌天然海水中加入10 mmol/L CaCl2、0.8 mol/L D-甘露醇、2%纤维素酶R-10、1%离析酶R-10、0.5%果胶酶Y-23、10 U/mL 琼脂糖酶,pH 6.3;2)酶解条件:28℃、80 r/min、黑暗酶解8 h。本研究将为后续以原生质体作为受体材料的江蓠品种的遗传改良提供一个有效的技术途径。
