手性三唑类杀菌剂氟环唑对土壤微生物的立体选择性影响
2022-07-04薛鹏飞刘潇威赵刘清贺泽英
薛鹏飞,刘潇威 ,赵刘清,贺泽英 *
(1.农业农村部农产品质量安全环境因子控制重点实验室,天津 300191;2.农业农村部环境保护科研监测所,天津 300191)
氟环唑是世界范围内最畅销的三唑类杀菌剂之一,用于预防和治疗水果、蔬菜、茶和谷物中的各种真菌病害。其作用机理是阻碍病原菌中铁卟啉铁氧络合物的形成,进而强烈地抑制麦角甾醇的生物合成,从而达到抑制病原菌细胞膜合成的目的。氟环唑分子具有2个手性中心,4种立体异构体,其商业化产品顺式-氟环唑外消旋体含有一对具有2R,3S-(+)-和2S,3R-(-)-构型的对映体(图1)。在提高农作物产量的同时,未被有效利用的氟环唑会进入土壤和水体,且其降解非常缓慢,降解半衰期根据不同的环境类型、特性和条件从几周到2 a以上不等。有关氟环唑在土壤中的持久性残留对土壤微生物的影响报道较少,其不同对映体对土壤环境的潜在威胁值得关注。
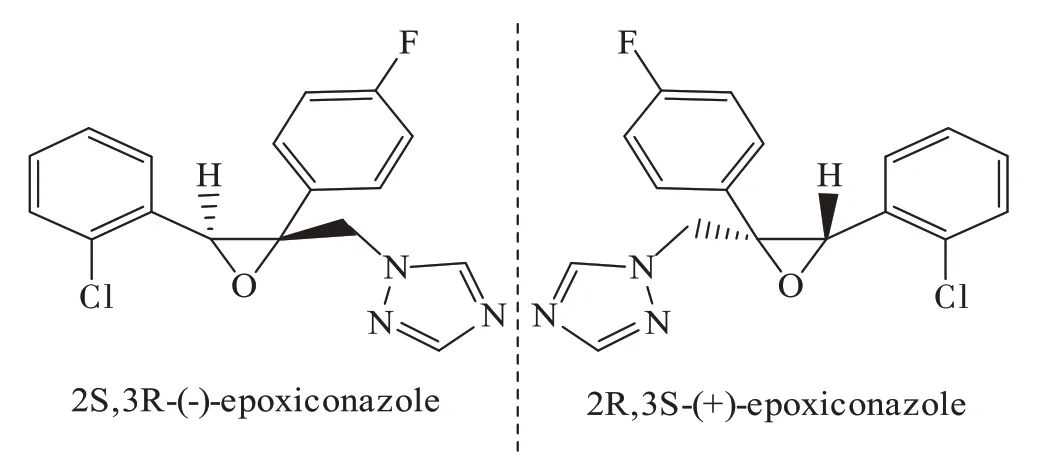
图1 顺式-氟环唑不同对映体结构式Figure 1 The structure of different enantiomers of cis-epoxiconazole
土壤微生物在维持土壤质量和作物产量方面有着至关重要的作用。然而,农药残留可能会对土壤微生物生物量和活性,以及非靶标微生物的生物多样性产生负面影响。近年来,已有三唑类杀菌剂对土壤细菌和非靶标真菌影响的研究报道。四氟醚唑的施用可显著改变苹果园土壤的微生物群落结构。戊唑醇显著降低了研究结束时土壤中氨氧化细菌和古细菌的相对丰度,而对硫氧化细菌表现出试验期间持续减少的趋势。对于丙环唑,土壤微生物生长和土壤酶活性表现出浓度依赖性反应,即低浓度的丙环唑促进土壤微生物的生长,而高浓度的丙环唑抑制微生物生长。以上研究都是针对农药外消旋体,而对于包括三唑类杀菌剂在内的手性农药,其生物活性、吸附、转移降解、对非靶标生物的毒性等均存在较强的对映体选择性。对于氟环唑,其(+)-对映体比(-)-对映体在土壤中的降解半衰期更长,生物活性更高,环境毒性(对大型蚤)也更高。同时,在蔬菜-土壤-蚯蚓系统中氟环唑存在较显著的立体选择性富集和降解。三唑类杀菌剂对非靶标生物存在潜在的影响,然而土壤微生物对氟环唑的对映体选择性响应尚未见报道。
目前基于高分辨质谱的代谢组学技术和基于高通量测序的微生物组学技术得到了广泛的应用,已成为评估污染物对土壤微生物影响的有效技术手段。为了探究氟环唑及其不同对映体暴露下土壤微生物群落组成和代谢的立体选择性响应,本研究基于非靶向代谢组学和微生物组学两大组学联合技术,通过土壤代谢组、系统发育树重建与PICRUSt基因功能预测来研究土壤微生物的立体选择性响应机制,为手性农药环境残留风险评估提供有力的理论支撑。
1 材料与方法
1.1 仪器、试剂与材料
氟环唑含量分析使用超高效液相色谱三重四极杆质谱仪,Waters UHPLC系统串联QTRAP 4500(美国Sciex公司);非靶向代谢组学分析采用超高效液相色谱-四极杆-飞行时间质谱仪(QTOF 6600,美国Sciex公司)。其他仪器包括自动管磨机(IKA,德国),涡旋振荡仪(Thermo,美国),高速离心机(Heal Force,中国香港)。
氟环唑[(±)-,纯度99.9%]、2S,3R-氟环唑[(-)-,对映体纯度>98%]和2R,3S-氟环唑[(+)-,对映体纯度>98%]购自上海勤路生物技术有限公司(中国上海)。HPLC级的丙酮、甲醇、乙腈和乙酸乙酯购自Merck(德国)。甲酸和醋酸铵购自Sigma Aldrich(德国)。无水MgSO、分散固相萃取吸附剂C18和PSA购自Agilent公司(美国)。水由Milli-Q系统制备。
1.2 实验设计
农田表层土壤(5~20 cm)取自天津市(117°27′E,38°90′N),土壤至少5 a未施用氟环唑。土壤在室温下风干,过2 mm筛。供试土壤为壤土(黏粒18.43%、沙粒50.04%、粉粒31.01%),pH值为7.81,总有机碳(TOC)、总氮、总磷含量分别为19 970、140.1 mg·kg和445 mg·kg。实验设计对照(CK)和(±)-、(-)-、(+)-氟环唑染毒共4个处理组,每组6个重复。染毒采用分步添加法,以确保染毒均匀。首先,在连续搅拌下将1 mL氟环唑丙酮溶液标品(2 mg·mL)缓慢加入到20 g土壤中,将初步染毒的土壤置于通风橱中过夜以挥发溶剂。然后加入80 g空白土壤彻底混合,最终氟环唑添加水平为20 mg·kg。最后,加水使土壤水分含量为18%。对照土壤使用等量的丙酮溶液,其他步骤相同。将土壤在20℃下避光培养4周,然后对氟环唑含量、土壤性质、土壤微生物组成和土壤代谢物进行取样测定。将所有土壤分为4份:两份在-80℃保存用于测定土壤微生物组成和土壤代谢物,第三份在-20℃保存用于测定氟环唑含量,最后一份干燥后用于测定土壤性质。
1.3 氟环唑含量测定
氟环唑及其对映体的提取采用改进的QuECh⁃ERS法。称取5 g土壤至50 mL塑料离心管中,加入5 mL去离子水使样品水化30 min。加入20 mL乙腈和一个陶瓷均质子,涡旋萃取3 min。提取后,加入5 g NaCl,将离心管剧烈振荡数次,5 000 r·min离心 5 min。取上清液6 mL转移至装有分散固相萃取吸附剂(900 mg MgSO、150 mg C18 和150 mg PSA)的15 mL离心管中,涡旋1 min,取上清液通过PTFE微孔滤膜(0.22 μm)装入进样小瓶,用于UPLC-MS/MS分析。
氟环唑及其对映体分离使用Lux 3u Cellulose-1手性色谱柱(150 mm×2.0 mm,3 μm,Phenomenex,美国)。仪器参数为:离子喷雾电压(ISVF)5 500 V;温度500 ℃;雾化气(GS1)3.45×10Pa;加热气(GS2)3.45 × 10Pa;气 帘 气(CUR)2.07 × 10Pa;碰 撞 气(CAD)中等。多反应监测(MRM)离子对以及相应参数见表1。

表1 氟环唑的质谱法参数Table 1 Mass spectrometric method parameters of epoxiconazole
液相条件:柱温40 ℃,流速0.45 mL·min,进样体积2 μL。流动相A为水相,含有2 mmol·L醋酸铵,流动相B为乙腈。梯度洗脱程序为:0~2 min,50% B;2~3.2 min,梯度增加至65% B;3.2~4.6 min,保持65% B;4.6~6 min,梯度下降至50% B;6~8 min,保留50% B。
1.4 非靶向土壤代谢组学
土壤代谢物的提取参照先前的研究并进行了一些修改。取液氮研磨土壤样品2 g于塑料离心管中,加入2 mL提取溶剂(甲醇∶HO=3∶1,/)和1 mL乙酸乙酯。将离心管涡旋3 min,然后超声(冰浴)提取5 min。样品离心(7 012,4℃)15 min,将上清液转移至新管中,以上提取过程重复3次,将所有上清液混合后在40℃水浴中氮气吹干,残渣再溶解于0.5 mL萃取溶剂中,通过PTFE微孔滤膜(0.22 μm)进行代谢组学分析。
质量控制(QC)样品通过混合所有样品制备,以进行数据采集过程中的质量控制。每5个实际样品进行一针QC样品采集,分别进行正负源分析。高分辨筛选和定性分析在UPLC-QTOF-MS(Triple TOF 6600,SCIEX)中进行,使用Exion LC UPLC系统配备HSS T3(2.1 mm×100 mm,1.8 μm,100 Å,Waters,美国)色谱柱对样品进行色谱分离。柱温设置为50 °C,流速为0.3 mL·min,进样量2 μL。流动相A为水相,含5 mol·L甲酸铵和0.1%的甲酸,流动相B为甲醇。梯度洗脱程序为:0~1.5 min,3% B;1.5~11 min,增加到80%B;11~14 min,增加到97% B;14~18 min,保持97% B;18~18.1 min,降低至3% B;18.1~21 min,保持3% B。
质谱采集分别在ESI+和ESI−电离模式下进行。电喷雾电离(ESI)源参数为:离子喷雾电压(ISVF)正离子模式5 500 V,负离子模式-4 500 V;离子源温度550 ℃;雾化气(GS1)3.79×10Pa;加热气(GS2)3.79×10Pa;气帘气(CUR)2.41 × 10Pa。采用 T OF - MS(70~1 000/)-IDA-MS/MS(50~1 000/)模式在单次运行中同时获得高分辨一级和二级全扫图。在全扫描TOF-MS实验中,去簇电压(DP)为60 V,碰撞能(CE)为10 eV。IDA-MS/MS标准:采集响应超过100 cps的离子;CE和碰撞能量扩散(CES)分别设置为35 eV和15 eV。
1.5 高通量微生物测序
1.5.1 细菌
使 用 E .Z.N.A.TM Soil DNA Kit(Omega Bio-tek,Doraville,美国)提取总基因组DNA,并储存于-80℃待进一步分析。DNA浓度和纯度使用NanoDrop 2000(Thermo Fisher Scientific,美国)测定。使用1%琼脂糖凝胶通过电泳评估DNA提取的质量。使用V3~V4可变区引物进行PCR扩增,引物为:341F(5′ -CCTAYGGGRBGCASCAG-3′)和 8 06R(5′ - GGAC⁃TACHVGGGTWTCTAAT-3′)。PCR扩增子用 A gen⁃court AMPure Beads(Beckman Coulter,美国)纯化,并使用PicoGreen dsDNA检测试剂盒(Invitrogen,美国)进行定量。在单独的定量步骤之后,将等量的扩增子合并,并使用Illumina MiSeq平台和MiSeq ReagentKit v3进行双端2×300 bp测序。
1.5.2 真菌
使用 N ucleoSpinSoil试剂盒(Macherey-Nagel)提取总DNA,并通过分光光度法(novaseq 6000 PE250,Thermo Scientific)计算DNA浓度。使用引物基因 I TS3~2024F(5′-GCATCGATGAACGCAGC-3′)和ITS4~2409R(5′-TCCTCCGCTTATTGATATGC-3′)进行内部转录间隔区(ITS2)的PCR扩增。扩增子用Agencourt AMPure XP试剂盒(Beckman Coulter,美国)清洗,用Qubit dsDNA HS检测试剂盒(Life Technolo⁃gies)定量,等量合并后使用EZNA Cycle Pure试剂盒(Omega Bio-泰克)进行测序。
1.6 多元统计分析
代谢组学原始数据使用SCIEX OS(SCIEX,美国)软件处理分析,并获取质谱峰面积。使用MetaboAna⁃lyst 5.0(http://www.metaboanalyst.ca/MetaboAnalyst/)对代谢组学数据进行多变量统计分析,经标准化的数据进行单因子方差和热图分析。
扩增子序列变体(ASV)根据原始序列信息(FASTQ格式)使用QIIME2推荐的DADA2方法进行质量控制、去噪和去除嵌合体后得到。一个操作分类单元(OUT)使用RDP分类器进行注释和分类,以获得不同分类级别的编号。使用Kruskal-Wallis和DEseq2方法对组间和样品间丰度进行差异分析,使用Benjamini-Hochberg方法调整值。由R语言ggtree包绘制物种系统进化树,选取丰度最高的前50个属。利用PICRUSt2对16S rRNA基因数据功能预测,并结合MetaCyc(https://metacyc.org/)数据库进行代谢通路比对。经注释后的通路利用ANOVA和Duncan检验进行差异分析。其他不同分组间差异检验用SPSS 23.0完成。
2 结果与讨论
2.1 氟环唑的立体选择性降解
由表2可知,土壤培育4周后未观察到氟环唑外消旋体及对映体的显著降解。实验结束时(+)-、(-)-和(±)-氟环唑的含量分别为(19.62±0.66)mg·kg、(18.63±1.43)mg·kg和(17.87±0.08)mg·kg,与原始含量无显著差异(检验)。此外,通过氟环唑的EF(对映体分数)值,未观察到显著的对映体选择性。
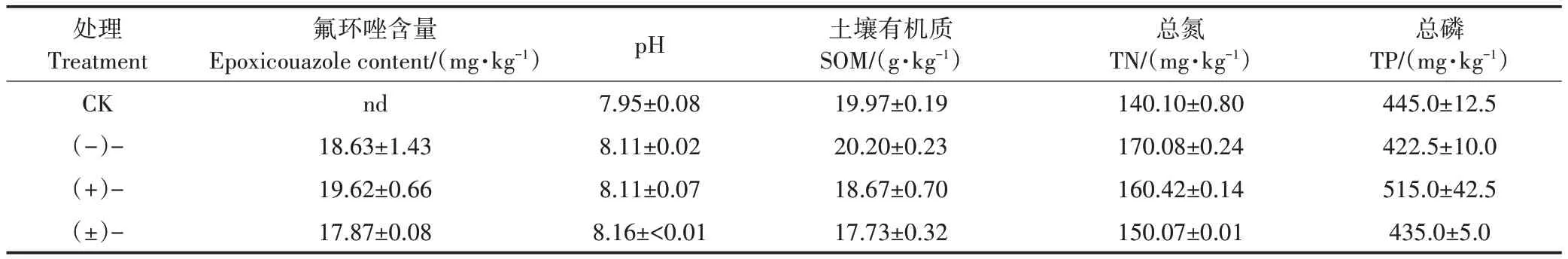
表2 土壤基本性质和氟环唑含量Table 2 Basic soil properties and epoxiconazole content
三唑类杀菌剂在土壤中的高持久性增加了其环境风险性。与氟环唑类似,其他三唑类杀菌剂在土壤中的降解半衰期也很长,如腈菌唑的半衰期为74~177 d、戊唑醇的半衰期为86~247 d、四氟醚唑的半衰期为69~87 d、苯醚甲环唑的半衰期为169~239 d,烯唑醇的半衰期为141~210 d。由于不同对映异构体的高持久性和不同环境行为,氟环唑对土壤微生物的对映体选择性影响值得进一步探究。
图2A显示了不同处理组在门水平上的相对分布情况。相对丰度排在前20的细菌物种中,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)等是氟环唑暴露下土壤中的主要细菌。与CK相比,变形菌门、酸杆菌门、绿弯菌门、芽单胞菌门等的相对丰度由于氟环唑及其对映体暴露而表现出明显的视觉差异。对于真菌,ITS2基因测序揭示了真菌对氟环唑及其对映体的响应,不同处理组在门水平上的相对分布情况如图2B所示。在相对丰度排名前20的真菌物种中,子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomyco⁃ta)、Aphelidiomycota门、罗兹菌门(Rozellomycota)等是氟环唑暴露下土壤中的主要真菌。与CK相比,氟环唑外消旋体和对映体暴露引起了土壤中子囊菌门、壶菌门、担子菌门等在视觉上的明显丰度差异。同时,变形菌门、酸杆菌门、芽单胞菌门、放线菌门、子囊菌门、壶菌门、担子菌门等也是低灌木蓝莓土壤在丙硫菌唑等杀菌剂暴露下的主要菌群,其会因多效唑的处理而发生明显变化。

图2 不同处理组对土壤门水平群落结构组成的影响Figure 2 Effects of different treatments on community structure at phylum level
氟环唑不同对映体暴露引起了部分细菌和真菌的相对丰度变化。研究表明,三唑类杀菌剂会引起土壤微生物的应激反应。多效唑可改变土壤细菌和真菌的群落组成,如绿弯菌门和壶菌门的相对丰度先增加后降低,酸杆菌门的相对丰度先降低后增加。苯醚甲环唑暴露引起了土壤细菌群落多样性的下降,同时能显著影响土壤中的细菌群落结构并表现出浓度依赖性。不同对映体引起的微生物群落变化不同,即土壤微生物群落对氟环唑表现出立体选择性。
2.2 不同对映体暴露对土壤代谢组的影响
在不同对映体环境中,生物体的代谢物组成差异在分子水平上显示出对手性化合物的立体选择性代谢响应。土壤中的氟环唑可直接或间接与土壤微生物相互作用,进而影响土壤微生物群落的代谢。土壤有机质(SOM)由溶解的细胞、植物和微生物释放的小分子代谢物组成。土壤微生物分泌的细胞内和细胞外代谢物构成了SOM的代谢物库,因此监测土壤代谢物可以间接反映微生物代谢趋向的变化。通过使用基于LC-QTOF-MS的非靶向代谢组学,共筛查出281种代谢物。根据单因子方差分析获取差异代谢物,相比于CK,共得到84种显著差异代谢物(<0.05),表明氟环唑及其对映体暴露引起了土壤代谢组的显著改变(图3A)。图3B为基于VIP分值的PLS-DA区分的代谢物热图,不同处理组热图聚类表现出明显差异。(+)-处理引起了部分代谢物的显著上调或下调,(-)-处理引起的变化较(+)-弱,同时(±)-也引起了不同程度的代谢物改变。不同对映体表现出的聚类差异反映出由(+)-驱动的立体选择性代谢响应。土壤代谢组的改变可能部分归因于微生物被动释放的细胞外化合物,以及基于SOM中的代谢物循环,氟环唑的暴露引起了土壤微生物群落组成和碳循环方式的改变。
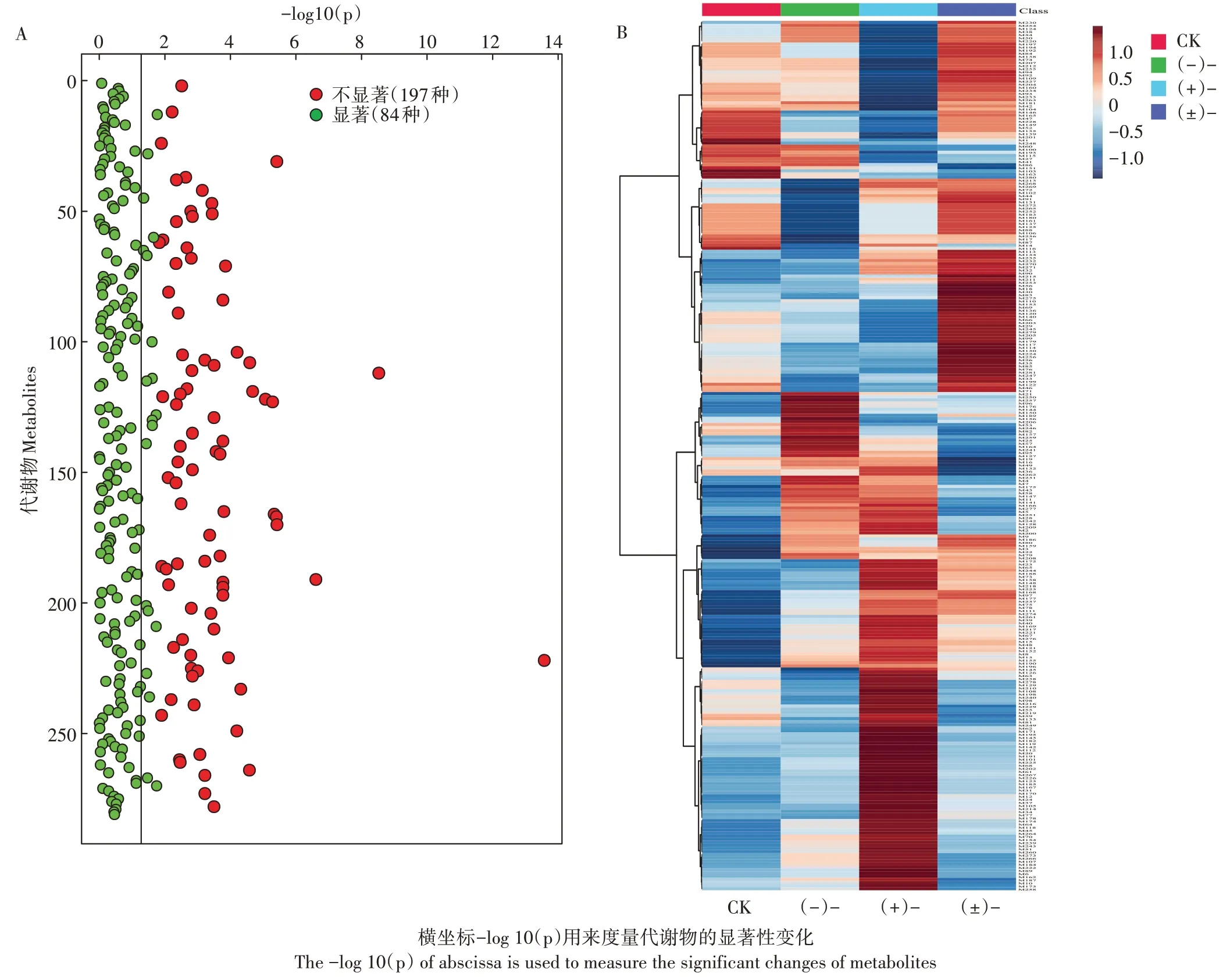
图3 单因素方差分析和基于VIP值的热图分析Figure 3 One-way ANOVA analysis and heatmap of the metabolites based on VIP values
2.3 不同对映体暴露的系统发育重建
2.3.1 细菌
图4A为不同处理组细菌系统发育多样性指数(Faith_pd)。经Wilcox检验,相比于CK、(-)-、(+)-,(±)-暴露的细菌系统发育多样性指数显著增加(<0.05),而其他组间两两比较的细菌系统发育多样性指数变化不显著(>0.05)。如图5所示,细菌的系统发育进化树及组间丰度分布热图结果显示了不同处理的细菌相对丰度差异。其中,结肠杆菌()、绣色土生单胞菌()、绿藻()具有最长的分支进化长度,结肠杆菌与属可能同源。相比于CK处理组,硝化螺旋菌属()、费氏弧菌()、罗氏菌属()、噬甲基菌属()等在(-)-处理土壤中相对丰度明显增加;食草酸嗜氨菌(s)、庞氏杆菌()、甲基营养型菌()、绿脓杆菌()等在(+)-处理土壤中相对丰度明显增加;而(±)-暴露土壤中的布鲁氏菌()、绣色土生单胞菌、属等相对丰度明显增加。相比于CK处理,氟环唑外消旋体及对映体暴露显著降低了链霉菌属()、甲基黄杆菌()、罗尔斯通氏菌属()、固氮弧菌属()等的相对丰度。不同处理组的细菌系统进化物种组成明显不同,表明土壤细菌功能基因对氟环唑的立体选择性具有差异。这些被影响的细菌在门水平上主要为酸杆菌门、拟杆菌门、放线菌门等,这与陈丽君等的研究结果相同。杀菌剂和杀真菌剂可抑制大多数微生物生长,但它们对呼吸和氮循环有混合影响,其中戊唑醇表现出较强的负面作用。这可能与显著改变的细菌,如与氮循环有关的硝化螺旋菌属、食草酸嗜氨菌、固氮弧菌属等通过呼吸和氮循环来减弱氧化胁迫过程有直接联系。

图4 Faith_pd指数的箱型图Figure 4 Box plot of Faith_pd index
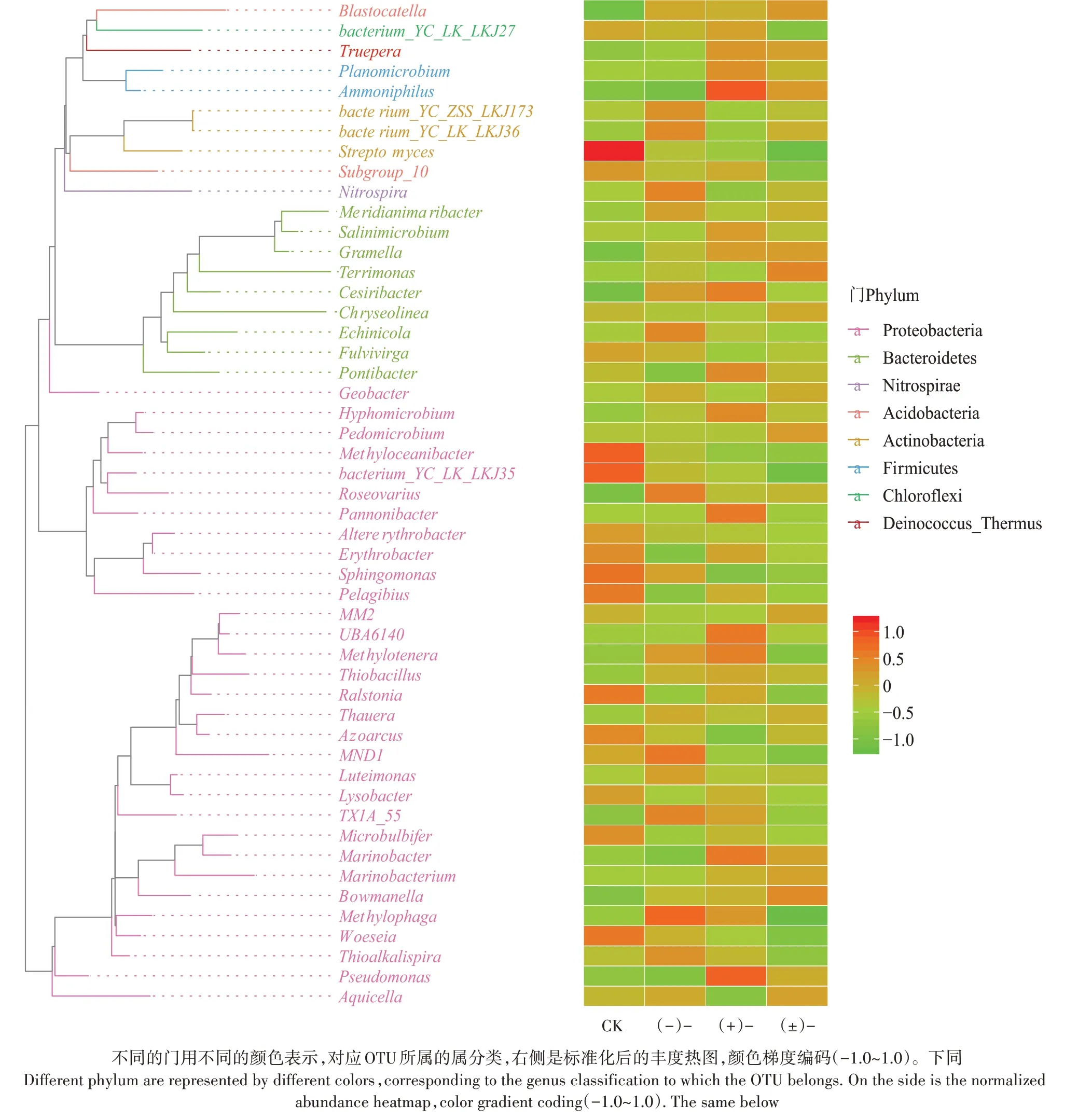
图5 系统发育进化树及组间丰度分布热图(细菌)Figure 5 Phylogenetic tree and heatmap of abundance distribution between groups(bacteria)
2.3.2 真菌
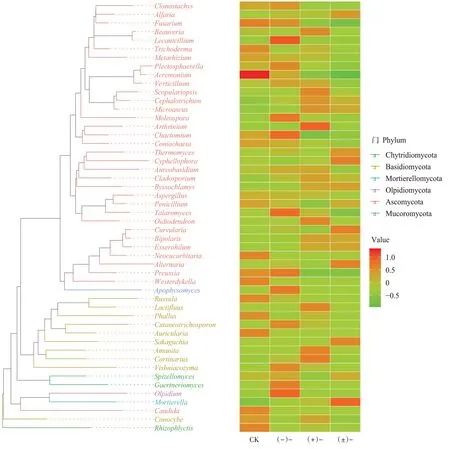
图6系统发育进化树及组间丰度分布热图(真菌)Figure 6 Phylogenetic tree and heatmap of abundance distribution between groups(fungi)
图4B为不同处理组真菌系统发育多样性指数(Faith_pd)。经Wilcox检验,相比于CK和(-)-,(±)-处理的真菌系统发育多样性指数显著减小(<0.01),而其他处理两两比较的真菌系统发育多样性指数变化不显著(>0.05)。如图 6所示,鳞球菌()、属、交链孢霉属()具有较长的分支进化长度,枝顶孢霉属()与鳞球菌()可能同源,出芽短梗霉()与属可能同源。与CK处理组相比,氟环唑外消旋体及对映体处理中的高丰度物种表现出明显差异,如属、毛壳属()、马尔尼菲篮状菌()、油壶菌属()等仅在(-)-处理土壤中相对丰度明显增加;白僵菌属()、孢霉属()、树粉孢属()、丝膜菌属()等仅在(+)-处理土壤中相对丰度明显增加;而(±)-处理土壤中,属、疣弯孢霉()、链格孢()、被孢霉属()等相对丰度明显增加。同时相比于CK处理,氟环唑处理显著降低了互生顶孢霉()、属、念珠菌()、玫瑰根霉菌()等真菌的相对丰度。氟环唑外消旋体及对映体暴露的真菌系统进化物种组成明显不同,并且存在立体选择性差异。在门水平上,这些被影响的真菌主要为子囊菌门、担子菌门、壶菌门等,多效唑也引起了这些真菌的显著变化。土壤真菌,包括前面丰度显著增加的细菌,对氟环唑在土壤中的降解起到了重要作用,部分微生物可将氟环唑作为碳源来维持自身生长,从而为土壤中微生物组成和数量的改变提供了可能。
2.4 不同对映体暴露下PICRUSt基因预测
2.4.1 细菌
PICRUSt基因预测分析应用于土壤细菌能较为准确地预测功能基因的存在与否及其丰度变化。通过PICRUSt预测和列举不同处理组中显著变化的细菌代谢通路,表现出功能上的丰富性,并基于Meta⁃Cyc数据库比对出10条不同处理组间具有显著生物学差异的代谢途径(图7)。在所列举的代谢途径中,氟环唑及其对映体暴露显著增加了L-精氨酸降解Ⅱ(L-arginine degradationⅡ)、甲基萘醌-8生物合成超级通道Ⅱ(Superpathway of menaquinol-8 biosynthesisⅡ)、GDP-D-甘油-α-D-甘露庚糖生物合成(GDPD-glycero-α-D-manno-heptose biosynthesis)通路的功能基因丰度,显著减少了甲基赤藓糖醇磷酸途径Ⅰ(Methylerythritol phosphate pathwayⅠ)、嘧啶脱氧核糖核苷酸从头生物合成Ⅲ(Pyrimidine deoxyribonucle⁃otides de novo biosynthesisⅢ)、聚(甘油磷酸)壁磷壁酸生物合成[Poly(glycerol phosphate)wall teichoic acid biosynthesis]等通路的功能基因丰度。另外,除去甲亚精胺生物合成(Norspermidine biosynthesis)和聚(甘油磷酸)壁磷壁酸生物合成通路在两对映体处理中的功能基因丰度差异不显著外,其他途径两对映体均表现出显著差异,并且(+)-氟环唑影响整体大于(-)-氟环唑。多效唑对芒果园土壤微生物的PICRUSt功能预测分析结果表明,多效唑处理会降低土壤细菌的整体代谢能力。氟环唑处理引起了农田土壤中细菌代谢功能的改变,并且(±)-和(+)-引起的差异水平大于(-)-,这种由(+)-驱动的对细菌功能基因的影响可能是(+)-毒性大于(-)-毒性的直接结果。

图7 丰度显著差异的MetaCyc通路(细菌)Figure 7 MetaCyc pathways with significant differences in abundance(bacteria)
2.4.2 真菌
根据PICRUSt预测结果,基于MetaCyc比对出22条不同处理组间具有显著生物学差异的真菌功能基因代谢途径(图8),表现出了功能上的丰富性。三唑类杀菌剂的作用靶标是基于稻瘟病等植物疾病的病原真菌,因此被影响的真菌功能代谢途径多于细菌。在所列举的代谢途径中,氟环唑及其对映体暴露增加了15条代谢途径的功能基因丰度,降低了7条途径的功能基因丰度。同时,氟环唑外消旋体能最大程度地引起功能基因丰度的增加或降低,如:L-蛋氨酸生物合成Ⅲ(L-methionine biosynthesisⅢ)、有氧呼吸Ⅰ(细胞色素c)([Aerobic respirationⅠ(cytochrome c)]、蔗糖降解Ⅲ(Sucrose degradationⅢ)等途径只在(±)-处理中被显著影响(<0.05)。而嘧啶脱氧核糖核苷酸从头生物合成Ⅰ(Pyrimidine deoxyribonucleo⁃tides de novo biosynthesisⅠ)、甲基酮生物合成(Meth⁃yl ketone biosynthesis)、腺苷核苷酸从头生物合成的超通路Ⅱ(Superpathway of adenosine nucleotides de novo biosynthesisⅡ)等途径在两对映体处理中表现出显著差异。表明氟环唑影响了土壤真菌的代谢功能,并且(±)-和(+)-引起的差异水平大于(-)-,这与在细菌中观察到的结果相同。
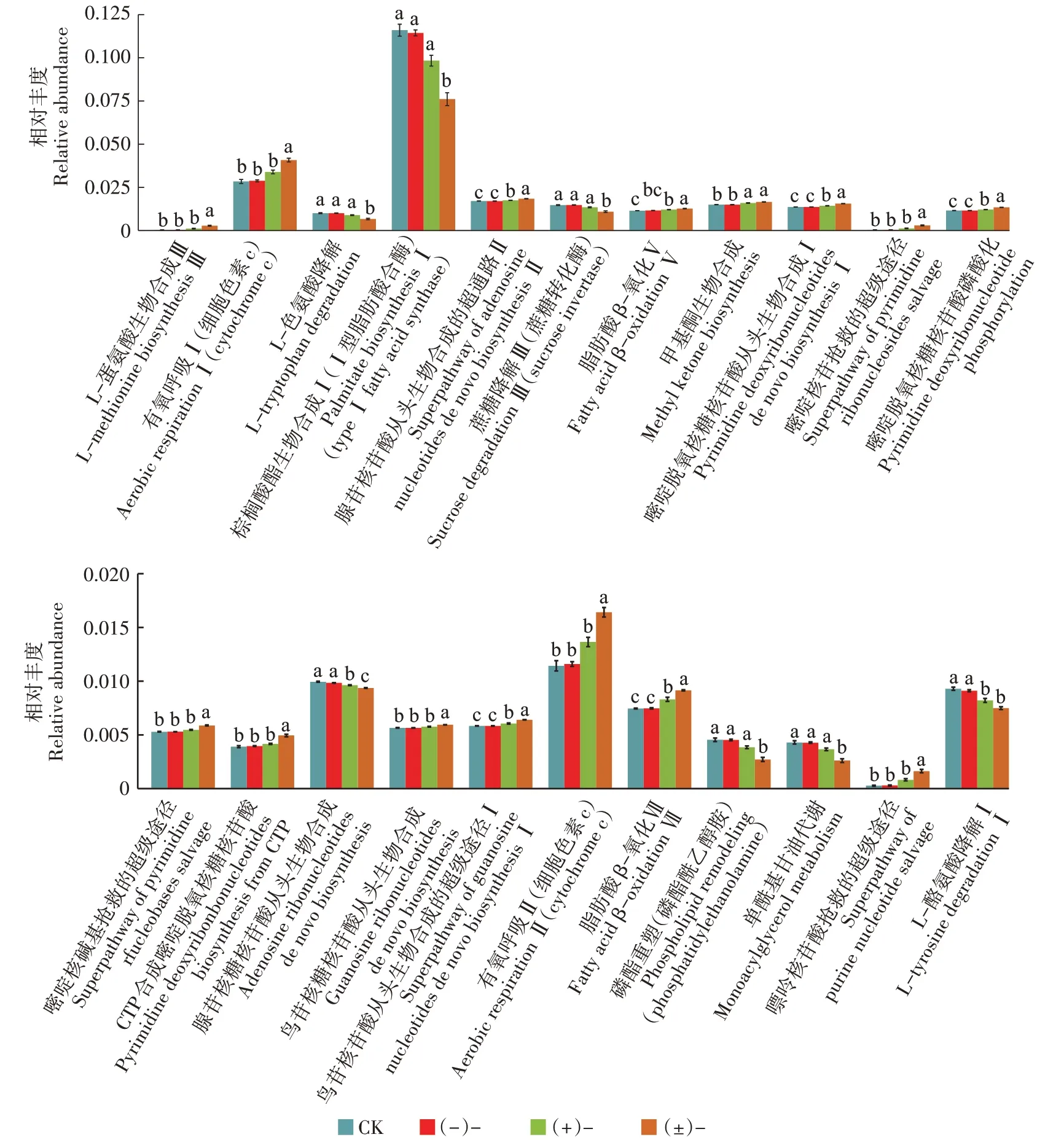
图8 丰度显著差异的MetaCyc通路(真菌)Figure 8 MetaCyc pathways with significant differences in abundance(fungi)
基于PICRUSt的细菌和真菌功能基因的代谢途径预测结果表明,氟环唑及其对映体处理均引起了细菌和真菌相关功能基因代谢水平的改变。(+)-驱动的立体选择性响应表明微生物对氟环唑胁迫执行了一定的氧化应激(ROS)措施。有氧呼吸途径在氟环唑及其对映体处理土壤中显著增强,是由于土壤细菌和真菌通过增强呼吸强度促进了胁迫反应。与核糖核酸合成代谢有关的嘧啶、嘌呤、核苷和鸟苷等路径是被影响最多的一类功能途径。嘌呤和嘧啶代谢是控制细胞生化反应各个方面的重要因子,其发生改变可能与氟环唑处理有直接关系。这些功能的变化可能是因为微生物实施了与其他压力相关功能过程重新分配能量和资源的策略。与能量循环(TCA)有关的糖代谢和氨基酸代谢过程也被影响,这可能与和跨膜运输相关的蛋白质通道中的持续氧化应激有关。同时,聚(甘油磷酸)壁磷壁酸、脂肪酸β氧化和磷脂重塑过程是微生物为维持细胞膜完整性和细胞功能而对环境条件做出的直接反应。这些过程预示着磷脂脂肪酸(PLFA)的改变,这可能是由于氟环唑诱导了ROS的过度生成,ROS可以氧化微生物细胞膜上的脂肪酸;或者,微生物群落内的群体可能会主动调整其膜的PLFA组成,以响应氟环唑诱导的压力。总之,氟环唑的暴露影响了农田土壤微生物群落相关功能基因的丰度,进而影响了微生物群落的生长代谢、信息传递等过程。
氟环唑及其对映体暴露后的农田土壤,在微生物群落的氧化应激过程中增强或减弱的代谢途径加剧了土壤代谢组向着氟环唑不同单体环境改变,从而表现出立体选择性,并且由(+)-驱动。值得注意的是,真菌群落比细菌群落对氟环唑的暴露更加敏感,氟环唑外消旋体更能引起土壤真菌代谢功能的改变。基于非靶向代谢组学、高通量测序结果的系统发育树重建和PICRUSt基因预测的联合分析,为三唑类杀菌剂氟环唑在农业土壤环境中的环境风险评估提供了有力的理论依据。
3 结论
(1)氟环唑在农田土壤中的降解不显著,该暴露过程可引起土壤代谢组的改变,细菌和真菌群落组成的改变,以及PICRUSt基因预测代谢途径的改变。
(2)PICRUSt基因功能预测结果表明,被影响的真菌功能代谢途径多于细菌,氟环唑外消旋体及对映体对土壤细菌和真菌功能基因的影响表现为外消旋体和(+)-对映体引起的差异水平大于(-)-对映体。
(3)三唑类杀菌剂氟环唑在土壤微生物群落中的立体选择性响应被揭示,并且在土壤代谢组、系统发育树重建及其组间丰度分布和PICRUSt基因预测代谢通路中表现出由(+)-对映体引起的一致性差异。