干热河谷土壤酶活性和车轴草生长对氮磷添加的响应
2022-07-03魏雅丽闫帮国和润莲李义林方海东
李 欢, 魏雅丽, 闫帮国, 孙 毅, 和润莲, 李义林, 方海东
(1.四川农业大学 资源学院, 成都 611130; 2.云南省农业科学院 热区生态农业研究所, 云南 元谋 651300)
氮(N)、磷(P)作为主要养分元素,对维持地球生物化学循环,保证生态系统物质循环和能量流动有重要作用,同时N,P也是自然陆地生态系统中的主要限制性元素[1-2]。然而由于化石燃料燃烧所产生的N沉降[3-4],导致土壤中的N含量显著提高,改变了土壤中原有的养分限制模式,主要观点认为它缓解了原有的N限制,转变成P限制,另一些观点认为土壤养分限制模式转变为N,P共同限制[5-6]。土壤酶直接参与土壤生态系统中C,N,P的循环,如参与土壤碳转化的β-D-葡糖苷酶(BG),参与土壤氮转化的β-1,4-N-乙酰氨基葡糖苷酶(NAG)和脲酶(URE),以及参与土壤磷转化的磷酸酶(AP)等[7]。这些酶对环境因子敏感,可作为评价土壤质量和养分供应能力的重要指标[8-9]。
土壤酶本身作为一种蛋白质,其合成过程对氮的需求较大[10],因此氮的丰缺对土壤酶活性也具有重要的调控作用。勒佳佳等[11]对天山高寒草原土壤酶活性研究发现氮添加显著增加BG和β-1,4木糖苷酶活性,而李欢等[12]发现干热河谷土壤BG,NAG,URE和AP酶活性与土壤C有关。樊博等[13]研究干热河谷土壤酶活性对碳氮添加的响应发现,碳氮交互作用显著影响了干热河谷土壤的AP,BG和亮氨酸胺肽酶活性。曾泉鑫等[14]研究氮添加对毛竹林土壤微生物碳磷限制时发现,氮添加显著降低了NAG活性和N∶P酶活性比,提高了AP酶活性和C∶N酶活性比,加剧了微生物C,P限制。Marklein等[15]研究发现氮添加能够提高磷酸酶活性,从促进磷循环速率。当养分限制发生变化时(如,从N限制到P限制),微生物可能会调整相关酶的生产(如增加磷酸酶的活性),以平衡营养需求(微生物需求)和供应(周围环境)之间的营养平衡[16-17]。
植物同样受到氮磷养分的限制[1-2],但是不同的土壤中植物受到氮磷限制的程度不同。事实上,植物因不同土壤而异,分别会受到氮限制、磷限制或者氮磷共限制[18]。土地利用对不同土壤上植物生长限制养分的影响还缺乏充分研究。植物与土壤酶活性对养分添加是否具有相同的响应特征还存在很大的不确定性。
元谋干热河谷是西南横断山区中的生态脆弱区,通过土壤养分管理促进植被恢复,对改善该区生态环境具有重要意义。本研究通过在不同土地利用类型土壤中设置不同的养分添加处理,以车轴草(TrifoliumrepensL.)作为模式植物,比较分析不同土地利用类型植物生长状况和酶的活性对氮磷添加的响应,探讨不同土地利用类型下植物生长的限制养分和养分对土壤酶活性的调控作用,并揭示植物生长与土壤酶活性在养分处理下的相互关系。
1 材料与方法
1.1 试验材料
元谋县干热河谷区内(101°35′—102°06′E,25°23′—26°06′N)水热矛盾突出,海拔差异大,气候呈垂直气候带状分布,年均降水量约680 mm,年均蒸发量约3 215 mm,干燥度(蒸发量/降水量)达4.5以上。随海拔升高,植被群落类型由稀树草原向灌木林和常绿阔叶林过渡。本研究在野外采集元谋县6种典型土地利用类型土壤,即灌木林地、草地、有林地、旱地、水浇地和侵蚀裸地,其土壤类型均为燥红土。每种利用类型有5个重复采样点,其中每个采样点再选取10个点采集混合样,运到云南省农业科学院热区生态农业研究所实验室内进行土壤性质分析,部分土壤置于温室大棚内进行盆栽试验。
1.2 试验设计
本试验选择车轴草(TrifoliumrepensL.)作为测试植物。车轴草是一种常见的多年生豆科草本植物,是土壤功能恢复中常用的修复植物之一[19-20]。车轴草在元谋当地野外没有分布,在当地土壤中没有特异病原体,因此不会干扰养分对植物生长的作用。试验因子设计包括6种土地利用类型,5种养分处理,每个处理重复5次(6种土地利用类型×5个处理×5种重复=150盆)。除去粗糙根和石头,土壤样品自然风干过2 mm筛并充分混合后,取一部分土样测定土壤养分性质(表1),另一部分鲜土等量装入花盆中(上直径10 cm×下直径7 cm×高度13 cm)约1 kg。将花盆分成5份,做5个处理,分别为:(1) 对照。不添加氮磷(CK);(2) 添加氮(N)(硝酸铵,0.078 5 g N/盆,相当于每1 hm2加100 kg N );(3) 添加磷(P)(磷酸二氢钾,0.039 2 g P/盆,相当于每1 hm2添加50 kg P的标准);(4) 添加氮磷(NP)(硝酸铵+磷酸二氢钾,0.078 5 g N/盆+0.039 2 g P/盆);(5) 添加有机质(OM)(几丁质+植酸钾,0.078 5 g N/盆+0.039 2 g P/盆)。每盆放15~20粒车轴草种子,萌发后,每盆只留10株植物苗,盆栽试验期间,每天浇水2次(约12.4 mm)。4个月后收获植物并采集土壤,土壤鲜土混匀并过2 mm筛放置在4℃冰箱中保存,测定土壤酶活性。

表1 土壤养分及其化学计量学特征
1.3 测试项目与方法
1.3.1 土壤性质测定 pH值采用酸度计测定(土∶水=1 g∶2.5 ml);总氮(TN)、总碳(TC)采用元素分析仪测定;全磷(TP)采用钼锑抗比色法;钙(Ca)、钾(K)、硼(B)、镁(Mg)、锰(Mn)等全量元素采用电感耦合等离子体发射光谱法(ICP)测定;铵态氮、硝态氮采用2 mol/LKCL溶液提取,分别采用水杨酸法[21]和采用氯化钒法[22];有效磷(Olsen-P)采用孔雀石绿测定法。
1.3.2 土壤酶活性测定 土壤酶活性测定采用荧光底物试验方法[23],其中测定β-D-葡糖苷酶(BG)、酸性磷酸酶(AP)、β-1、4-N-乙酰氨基葡糖苷酶(NAG)采用pH值为5.0的50 mmol/L醋酸缓冲液[24]。在微孔板中加入50 μl 4-甲基伞形酮(MUB)为标准物,另一部分孔中加入50 μl底物,分别为4-甲基伞形酮-β-D-葡糖苷(BG),4-甲基伞形酮酰磷酸酯(AP),4-甲基香豆素-2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷(NAG)。在标准物和底物基础上加入150 μl土壤悬液,并在标准物和底物孔中设置无土壤的对照[25]。所有酶测定时均放在恒温摇床在120 r/min下培养3 h,温度为25℃。然后放入Spark 20 M全波长扫描式多功能读数仪测定,测定时由仪器加样器加入10 μl mol/L NaOH到微孔板中。激发光设置为365 nm,发射光为450 nm。脲酶(URE)测定时,加入pH值为5.0的醋酸缓冲液,并加入尿素底物,至25℃恒温培养箱培养12 h后,加入60 μl水杨酸溶液和60 μl次氯酸钠溶液,反应50 min后,用650 nm波长测定吸光率,标准曲线采用铵态氮溶液测定[26]。
1.3.3 植物生物量测定 植物生物量通过70℃连续烘干植物样品至恒重称重得出。
1.4 统计分析
使用SPSS 22.0对土地利用类型和养分添加进行多因素方差分析法(ANOVA)分析;对植物生物量和土壤酶活性的影响采用LSD多重比较方法;对土壤酶活性与植物生物量的相关性采用回归分析法分析。
2 结果与分析
2.1 植物生物量对氮磷添加的响应特征分析
植物生物量对P添加具有显著响应,灌丛、草地、森林和裸地这4种土地利用类型的P或N+P添加处理的植物生物量显著大于CK和N添加处理(图1)。且灌丛、草地、森林土壤NP添加处理下的植物生物量显著高于单施P肥处理。结果显示灌丛、草地、森林、新农和裸地的+P处理生物量比CK分别增加了724.14%,782.93%,1 022.50%,37.38%,505.17%,而常农+P处理生物量比CK减少了25.73%。
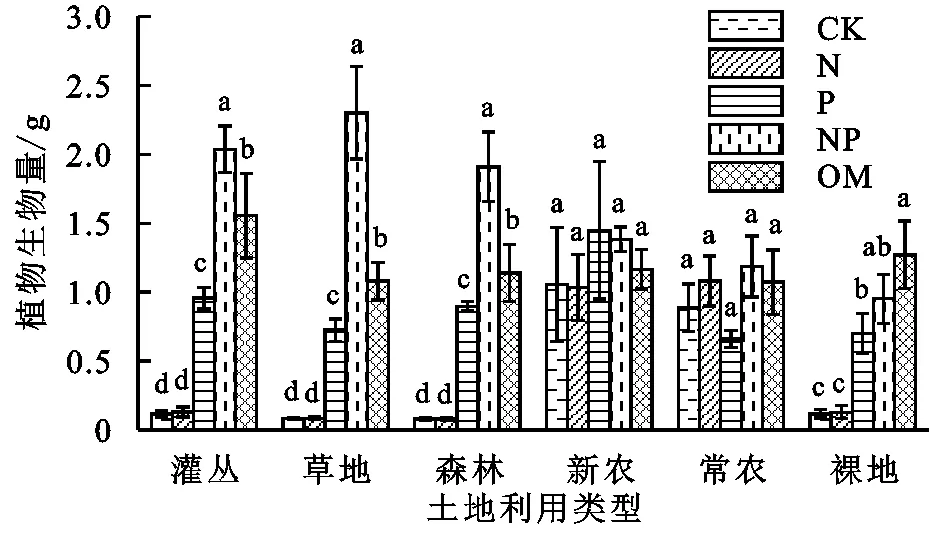
注:CK表示对照;N表示N添加;P表示P添加;NP表示N,P同时添加;OM表示有机态氮磷添加。图中不同字母表示相同土地利用类型下养分处理的差异显著(p<0.05),下图同。
然而,新农和常农的植物生物量在N,P添加处理下差异不显著,新农在P添加处理下植物生物量最大,比CK处理增加了37.38%;常农在NP添加处理下植物生物量最大,比CK处理增加了33.86%,在P添加处理下植物生物量最小,比CK处理降低了25.73%。由表2可知,植物生物量受到土地利用类型和养分添加处理显著影响,其中养分添加处理是最重要因素。
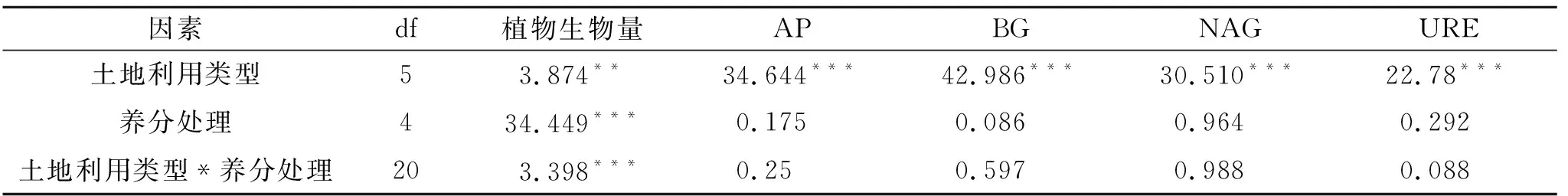
表2 土地类型与养分添加处理间的双因素方差分析(F值)
2.2 土壤酶活性对氮磷添加的响应特征分析
土地利用类型显著影响土壤酶活性,而养分添加处理对各土壤酶活性均无显著影响(表2)。灌丛土壤AP,BG酶活性中最高,显著大于其他类型的土壤,NAG活性在灌丛和草地土壤中最高,显著大于其他类型,而URE酶活性在常年耕作农田中最高,这4种土壤酶活性均在裸地土壤中最低。不同土地利用类型下,AP,BG,NAG这3种土壤酶活性大致呈灌丛>草地>森林>新农>常农>裸地变化趋势,灌丛的AP,BG,NAG比分别是裸地的9,26,16倍;URE土壤酶活性大致呈常农>新农>草地>森林>灌丛>裸地,常农的URE是裸地的7倍(图2)。
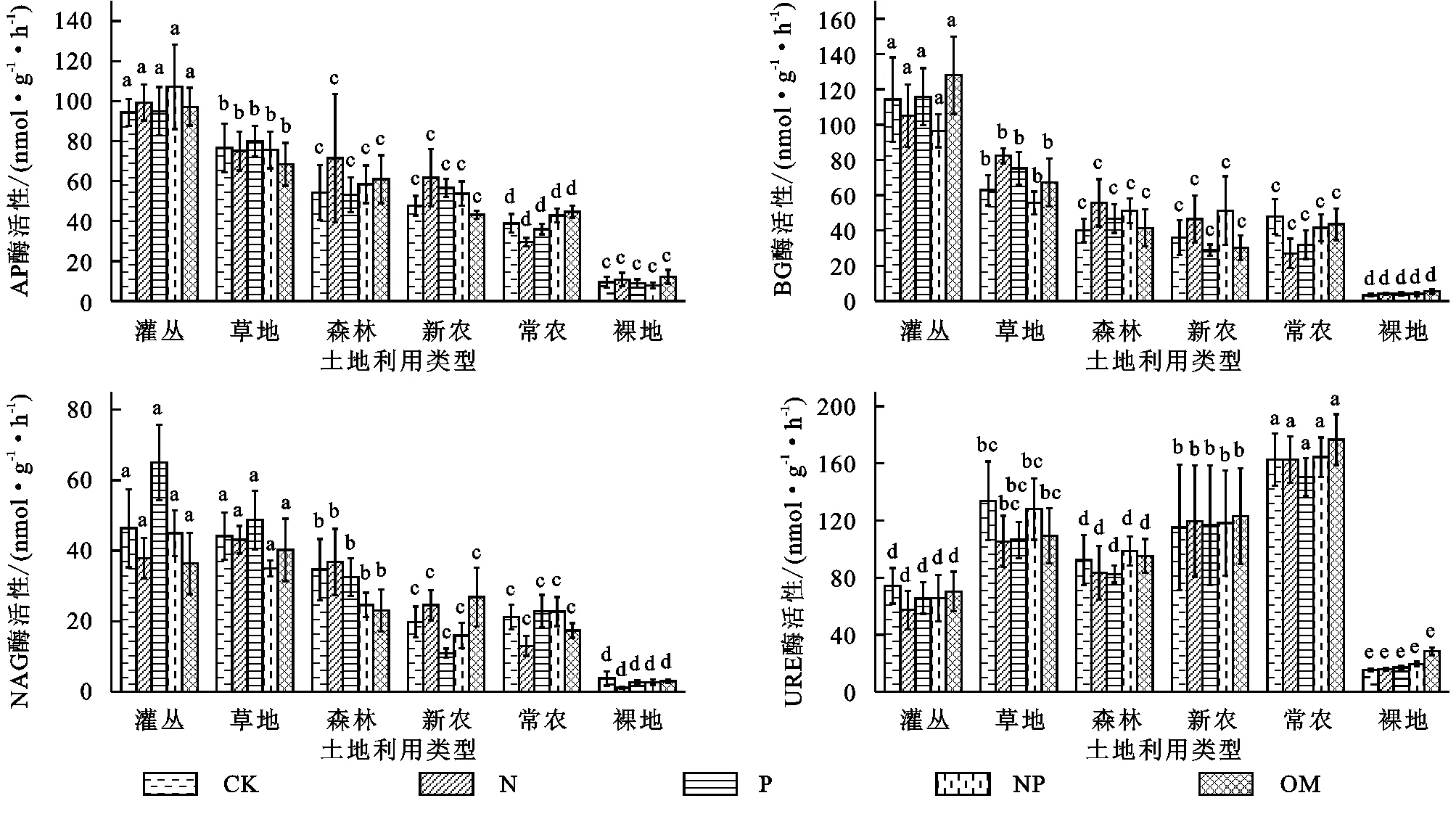
图2 不同土地利用类型和养分处理下的土壤酶活性
2.3 植物生物量、土壤酶活性与养分的相关性分析
结合植物生物量、土壤酶活性和土壤养分背景值相关指标进行相关性分析(表3)发现,植物生物量仅与土壤有效养分(铵态氮、有效磷)相关,与土壤酶活性、全量养分和硝态氮不相关;除URE酶外,其余土壤酶均与土壤TC,TN含量显著相关,且相互间呈显著相关关系;URE酶仅与有效养分(铵态氮、有效磷)相关。
3 讨 论
本研究发现植物生物量对P添加响应强烈,且在P和NP养分添加条件下灌丛、草地、森林和裸地的植物生物量显著高于CK和N养分添加处理,整体上看NP同时添加的植物生物量显著高于单施P肥处理。这可能是因为N,P同时添加,可以产生协同效应,刺激植物生长,促进P的吸收,这与卢广超[27]、范爱连[28]、Bucci[29]等研究一致。且通过双因素方差分析(表2)和相关性分析(表3)发现,植物生物仅与有效养分(硝态氮、有效磷)相关,由此可见氮磷含量是影响植物生物量变化最关键因素。进一步分析可以发现植物生长可能为序列限制(首先受到P限制,当P限制缓解后开始出现N限制,造成N,P共同添加效果大于单独的P添加)。研究区干热河谷属于热带亚热带区域,前人研究发现越来越多的P限制出现在具有高度风化土壤的热带和温带森林中[30-31],与本研究结果一致。因此,P限制是影响干热河谷地区植被生长的主要因素之一。P添加能够缓解P限制产生的影响,但会将植物生长所受的限制进一步转变为N限制或N,P共同限制,这与郑斯元[32]的研究一致。此外,本研究发现侵蚀裸地添加有机质的植物生物量最高,说明有机质可有效促进裸地的植物生长,这可能与裸地土壤中有机质严重缺乏有关。值得注意的是,本研究中采用一种豆科植物作为研究对象,其养分限制模式可能与非豆科植物不同。但是本研究中发现除了极少个例外,车轴草根系并未形成根瘤,可能与土壤中缺少对应的根瘤菌有关,因此,可以排除固氮对车轴草N,P限制的影响。
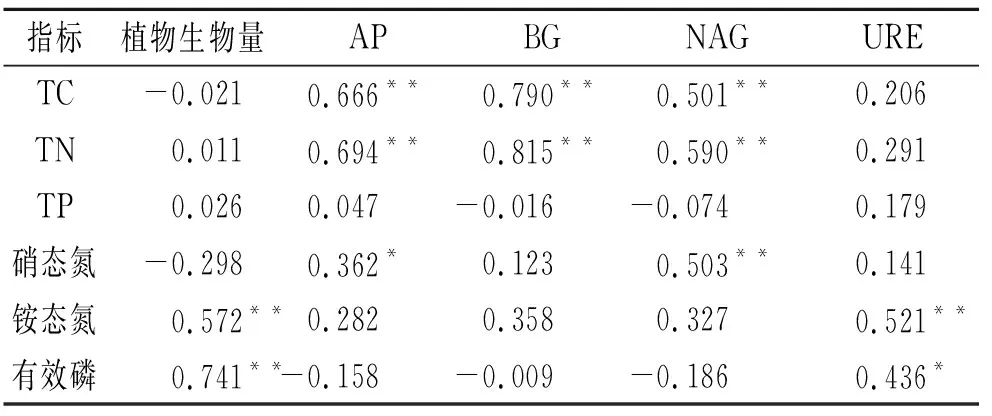
表3 植物生物量、土壤酶活性与土壤化学性质的相关性
本研究中土壤酶活性受土地利用类型的显著影响(图2),但各养分处理间差异不显著。土壤酶参与土壤的各种生化反应,其活性体现了反应的强度和转化情况[33]。土壤中的各种物质转化主要由磷酸酶、脲酶、水解酶等参与的酶促反应产生,可以有效反映土壤C,N,P养分之间的变化特征。基于资源配置理论,在添加N,P处理下,微生物生长和酶合成过程中的限制养分得以缓解,从而促进土壤酶活性增加[34]。然而这里并未发现氮磷对土壤酶活性的促进作用,表明其他因素可能限制了土壤酶活性。本研究发现同时BG,NAG和AP活性与土壤背景C含量之间具有高度相关性,说明C含量可能是限制酶活性变化的重要影响因子。同时本研究发现土壤酶活性与植物生物量不存在明显相关关系(表3)。尤为明显的是,裸地土壤中添加P,N+P和OM时植物生物量显著提高(图1),但土壤酶活性仍处于较低水平,与CK无显著差异(图2),这可能与土壤酶活性和植物生长的调控养分不一致有关。
4 结 论
元谋干热河谷土壤类型和氮磷养分都会对植物生物量产生影响,土壤氮磷养分是最关键因素。灌丛、草地、森林和裸地的植物生长受P限制,而农田土壤(新农和常农)的养分限制不明显。同时添加N,P比单施P肥对植物生长的促进作用更明显。而土壤酶活性变化与土地利用类型相关,灌丛草地的BG,NAG和AP活性较高,而农田的URE活性较高。土壤酶活性与土壤C含量紧密相关,不受氮磷添加的影响,与植物生长之间没有明显的关联特征。土壤酶活性不能作为指示土壤支撑植物生长的指标。
