香根草对磺胺类抗生素污染水体的修复潜力研究
2022-07-01荣渝虹张发明孙仕仙毅1
荣渝虹,张发明,杨 娟,李 良,吴 珂,孙仕仙①,郑 毅1,,7②
(1.西南林业大学园林园艺学院,云南 昆明 650233;2.西南林业大学国家高原湿地研究中心/湿地学院,云南 昆明 650233;3.云南省热带作物科学研究所,云南 景洪 666100;4.云南农业大学植物保护学院,云南 昆明 650201;5.西南林业大学生态与环境学院/环境修复与健康研究院,云南 昆明 650233;6.云南省动物疫病预防控制中心,云南 昆明 650201;7.云南开放大学校长办公室,云南 昆明 650223)
磺胺类抗生素(sulfanomide drugs, SAs)主要用于预防和治疗细菌性疾病,在欧洲是使用量第二大的兽药抗生素[1],也是我国生产和使用量最大的兽药之一[2-3]。国际协调委员会规定的兽药生态毒害效应触发值为100 μg·kg-1[4],我国养殖场废水中ρ(SAs)较高时可达142.9 μg·L-1[5]。人体若过量摄入磺胺类药物,可能导致高胆红素血症、脑核性黄疽等疾病[6]。2017年,磺胺甲唑(SMZ)被世界卫生组织(WHO)的国际癌症研究机构(IARC)列为3类致癌物之一。磺胺嘧啶(SDZ)、磺胺喹啉(SQX)等则被列入“饲料药物添加剂使用规范”中[7]。
生物修复包括堆肥、膜生物反应器、活性泥污、微生物、人工湿地系统等。植物是人工湿地系统中的初级生产者,能利用根圈阻隔、积累及根际修复作用降低环境中的污染风险,是目前最具潜力的生物修复技术之一[8]。禾本科香根草(Vetiveriazizanioides)因其生长迅速、具有长达3~4 m发达网状须根、环境适应能力强、水陆双栖、对污染物有很强的耐受性等优点,在植物修复方面被广泛应用[9]。
以香根草为修复植物,以磺胺吡啶(SPY)、SMZ、磺胺二甲氧嘧啶(SDM)和SQX这4种在环境中检出率高且量大的磺胺抗生素为混合目标污染物,通过温室模拟水培试验,以15 d为试验周期,选取100 μg·L-1为施药浓度,研究这4种磺胺抗生素在营养液及香根草不同组织中的残留浓度动态,寻找其吸收、去除规律,为水环境中磺胺抗生素的植物修复提供理论和技术参考。
1 材料与方法
1.1 试验植物
供试植物香根草购置于江西省红壤研究所,筛选苗龄半年、株高80 cm、根长60~80 cm、长势一致的成年植株备用,用1/2浓度霍格兰改良营养液[10](pH=6.0)作为水培溶液。
1.2 药品与试剂
4种磺胺抗生素标准品均购于德国Dr.Ehrenstorfer公司。Waters Oasis MCX小柱60 mg/3 mL购于Waters公司。色谱纯级的乙酸乙酯、乙腈、甲醇、正己烷、甲酸购于Merck KGaA公司。
1.3 水培试验设计
试验于2020年10月在西南林业大学格林温室大棚内进行,培养器皿为棕色小口栽植玻璃瓶,瓶身和瓶口用黑色塑料袋避光包裹。每个培养器皿中均加入4 L 1/2浓度霍格兰改良营养液和4种SAs混合溶液(ρ均为100 μg·L-1)。分为2组处理:第1组种植香根草,质量为(300±0.5) g,第2组不种植物(对照),每组处理4个重复。
1.4 样品采集与分析测定
1.4.1采集方法
向盛有营养液的棕色玻璃瓶中同时放入香根草和SAs,分别于第1、2、3、4、5、6、12、15天采集香根草5 g根组织、5 g叶组织、10 mL水样。每次取样前,用质量差法补齐由于蒸腾和取样造成的霍格兰营养液损失。
1.4.2提取方法
将植物组织用纯水洗净、剪碎,滤去水样残渣,参照GB 29694—2013《动物性食品中13种磺胺类药物多残留的测定 高效液相色谱法》[11]进行提取和净化。水样直接过柱处理,然后用0.22 μm孔径尼龙滤膜过滤,待高效液相色谱-串联质谱联用仪(LC-MS)测定。
1.4.3计算方法与数据分析
溶液与植物组织中SAs的残留浓度用下式计算:
CP=Ct×V/m。
(1)
式(1)中,CP为溶液或植物组织中SAs的残留浓度,μg·L-1或μg·kg-1;Ct为某时刻实测的SAs浓度值,μg·L-1或μg·kg-1;V为溶液体积或植物组织质量,L或kg;m为取样体积或质量,L或kg。
转移系数(TF)计算公式为
TF=C茎叶/C根。
(2)
式(2)中,C茎叶和C根分别为香根草茎叶和根中的SAs残留浓度,μg·kg-1。
溶液中SAs去除率计算公式为
R=(C0-Ct)/C0×100%。
(3)
式(3)中,R为溶液中SAs去除率,%;C0为溶液中SAs初始浓度,μg·L-1;Ct为t时刻溶液中SAs残留浓度,μg·L-1。
采用WPS 2020和SPSS 26软件对数据进行统计分析。采用单因素(one-way ANOVA)和Duncan法进行方差分析,Pearson法进行相关分析,最小显著差异(LSD)法进行多重比较(P<0.05)。利用Origin 2019软件作图。图表中数据为平均值±标准差。
1.5 测定仪器及参数
用液相色谱仪(赛默飞世尔 Ulti-Mate 3 000)串联三重四级杆质谱仪(赛默飞世尔TSQ Endura)进行定量分析。高效液相色谱条件:色谱柱2.1 μm×100 mm×1.9 μm,柱温 35 ℃,流速 0.2 mL·min-1,进样量 5 μL。流动相:A为φ=0.05%的甲酸水,B为甲醇(色谱纯),进行梯度洗脱。质谱条件:电喷雾电离源(H-ESI);正离子模式电压3 000 V;负离子模式电压2 500 V;鞘气压力35 psi;辅助气压力 15 psi;离子源温度 350 ℃;离子传输管温度 350 ℃;气化室温度200 ℃;采用选择反应检测扫描(SRM)模式采集。
1.6 回收率测定结果
向植物和水样品中分别添加10和100 μg·L-1标准混合SAs溶液,每个添加水平4个重复。香根草茎叶的SAs回收率为80.3%~119.5%,根为78.6%~132.2%,溶液为88.6%~113.6%,该方法准确度符合试验要求。
2 结果与分析
2.1 营养液中SAs的残留动态
所有处理组中,营养液的SAs浓度从第1天到15天显著下降(图1)。第15天时,香根草组的营养液SAs质量浓度(32.95~48.05 μg·L-1)显著低于对照(66.65~70.54 μg·L-1)。
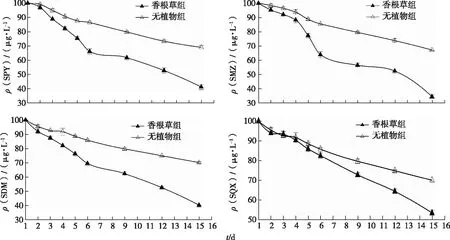
SPY—磺胺吡啶;SMZ——磺胺甲唑;SDM—磺胺二甲氧嘧啶;SQX—磺胺喹啉。
2.1.1营养液中SAs的去除率
相比于对照组,种植香根草显著提高了营养液中SAs的去除率(P<0.05)(表1)。第6天香根草组的SAs去除率较对照组提高12.3%~21.7%,第15天提高了2倍左右。此时香根草组对SAs的去除率由高到低依次为SMZ>SDM>SPY>SQX,对照组为SMZ>SQX>SPY>SDM,表明无论是否栽种香根草,SMZ的去除率均最高,但香根草显著提高了SDM的降解水平。
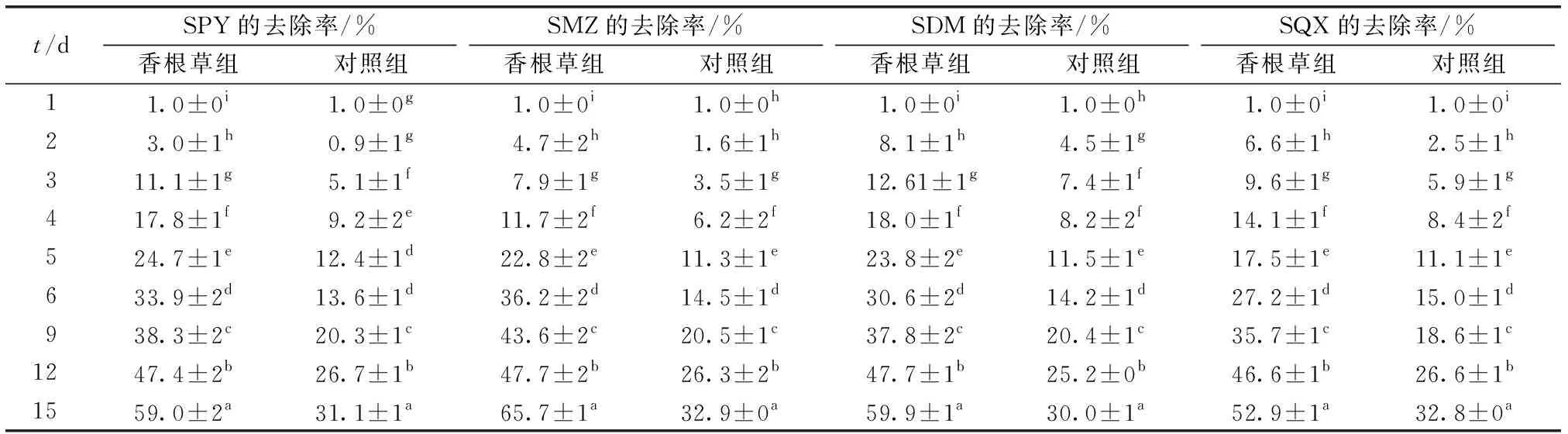
表1 营养液中不同种类磺胺类抗生素(SAs)的去除率
2.1.2营养液中SAs的去除动力学方程
在所有处理中,SAs在营养液中的降解趋势符合一级动力学方程(表2)。种植香根草组的降解速率常数是对照组的2.0~2.5倍。香根草组的SAs降解半衰期(t0.5)比对照组缩短了12~16 d(表3),表明种植香根草能显著促进水体中SAs的降解(P<0.05)。对照组SAs的降解半衰期从大到小依次为SDM>SPY>SQX/SMZ,香根草组为SQX>SPY>SDM>SMZ,表明SDM在营养液中最不易降解,而香根草能较快地去除SDM。

表2 营养液中SAs去除动力学方程
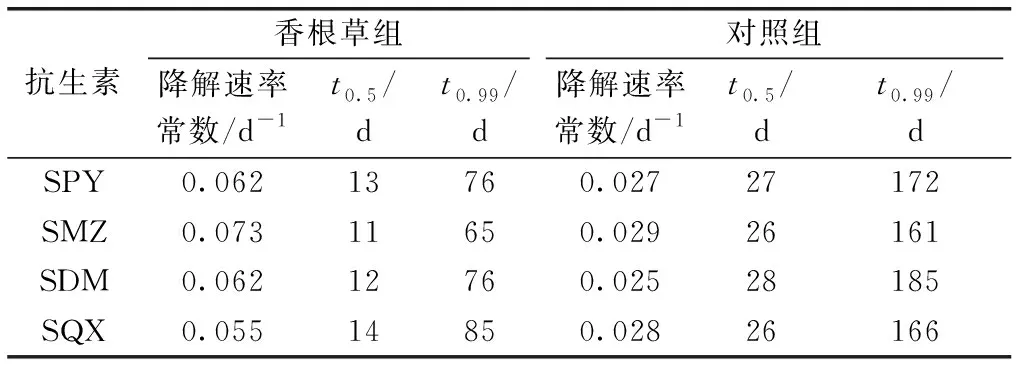
表3 营养液中不同种类SAs降解速率、半衰期(t0.5)和99%消除时间(t0.99)

2.2 香根草植物体内SAs的残留动态
香根草根中SAs的含量均呈现先增加后减少的趋势(图2),根中SAs的残留总量由高到低依次为SDM(22.97 μg·kg-1)>SQX(19.53 μg·kg-1)>SMZ(15.33 μg·kg-1)>SPY(6.60 μg·kg-1)。
香根草茎叶中SAs的含量呈现波动状态(图2),茎叶中SAs的残留总量由高到低依次为SMZ(7.02 μg·kg-1)>SDM(5.82 μg·kg-1)>SPY(4.76 μg·kg-1)>SQX(2.79 μg·kg-1)。
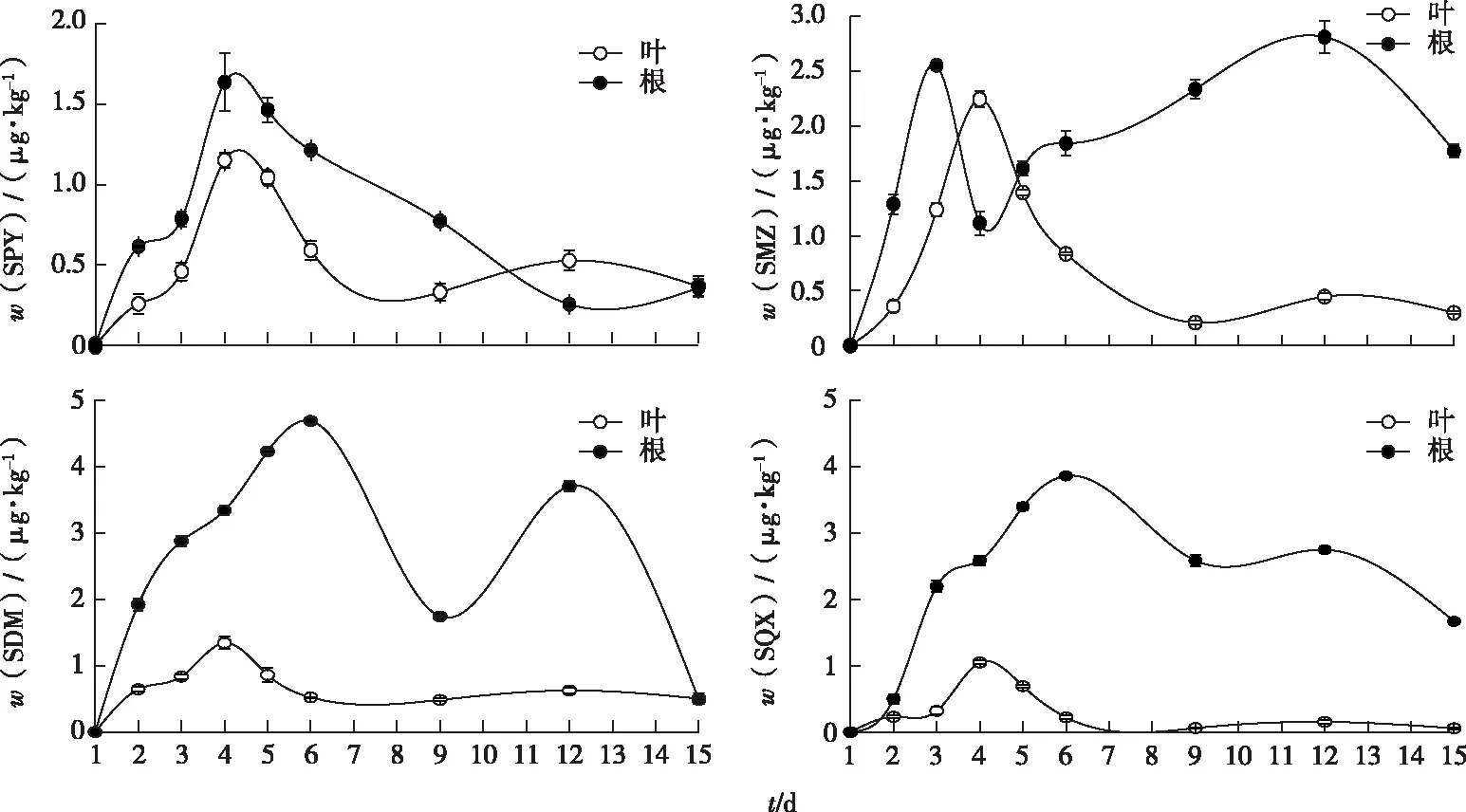
SPY—磺胺吡啶,SMZ—磺胺甲唑,SDM—磺胺二甲氧嘧啶,SQX—磺胺喹啉。
2.3 香根草对不同种类SAs的转移系数变化
转移系数是描述和评价植物将化合物从根部向地上部分运输和富集的能力,转移系数越大则转运能力越强。前人研究表明,多数磺胺类抗生素的植物转移系数小于1[12],笔者研究结果与之一致。15 d中SAs在香根草组织中的转移系数呈现波动趋势,峰值出现在第4和15天(表4)。
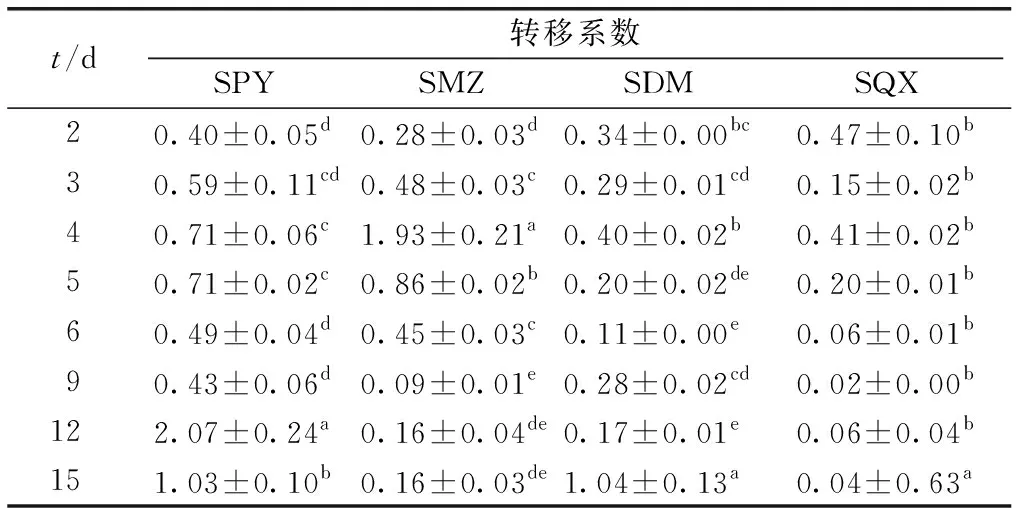
表4 香根草对不同种类SAs的转移系数
香根草对SAs转运能力从大到小依次为SPY>SMZ>SDM>SQX,到第15天SPY和SDM的转移系数均大于1,推测此时营养液中SAs的浓度已较低,植物的茎叶一起协同吸收降解SAs。
2.4 相关性分析
分析不同种类SAs的处理时间、香根草茎叶和根及营养液中SAs浓度、转移系数和去除率这几者的相关性发现,处理时间与营养液SAs浓度呈极显著负相关(P<0.01),表明随着时间延长,营养液中的SAs浓度逐渐降低,去除率逐渐增高。
香根草茎叶和根系中SPY、SDM含量与转移系数呈极显著正相关(P<0.01),与SQX呈显著正相关(P<0.05),表明香根草能将根中的SAs向地上部分运输,且对SPY和SDM的转运能力最强;香根草根中SMZ与SQX含量与营养液浓度、去除率呈极显著相关(P<0.01),而与转移系数无显著相关,推测香根草根系对SMZ有较好的吸收、去除效果,但向上转运的能力较弱;香根草茎叶与根中SPY含量与转移系数均呈极显著正相关(P<0.01),且转移系数与营养液中SPY浓度呈极显著负相关(P<0.01),表明香根草对SPY有较好的吸收、转运效果。
3 讨论
第15天香根草组对初始质量浓度为100 μg·L-1SAs的去除率为52.86%~65.69%、降解常数为0.055~0.073;对照组去除率为30.0%~32.9%、降解常数为0.025~0.029。在荣婧[13]的试验结果中,风车草、凤眼莲、水生美人蕉、菖蒲对1 mg·L-1SDZ 21 d的去除率为48.7%~59.8%,降解常数为0.032~0.039,对照组去除率为45.6%,降解常数为0.028。表明香根草对SAs的去除效果优于其他4种水生植物,这与植物生物量[14]、根系分泌物[15]、植物迁移转化能力[16]及根际微生物环境[17]等有关。
香根草根系在前6 d能快速吸收SAs并达到峰值,同时香根草营养液中SAs的降解速率也较快,表明前6 d香根草的主动吸收与溶液中SAs的降解密切相关。而茎叶在前4 d能快速吸收SAs并达到峰值,根与叶吸收时间的差异与香根草在100 μg·L-1的SAs浓度胁迫下能按正常的新陈代谢速率进行吸收和降解有关[18]。随着吸收量的增加,植物组织的损伤逐渐增大,根部的SAs达到储存极限而启动防御机制,将SAs滞留和固定在根部,以减少SAs向上运输对其他器官造成伤害[19]。待储存的SAs部分被转化、植物机能恢复后,根部又继续吸收营养液中的SAs,根部含量再次达到小峰值。当SAs暴露浓度较低时,植物能利用污染物促进自身的代谢和营养供给[20]。营养液中SAs浓度的降低及植物内部防御系统的破坏导致吸收和运输量降低[21],但随着胁迫时间的延长,香根草恢复了对SAs的去除能力[22]。这与SUN等[23]、贾继维等[24]的研究结果相似,表明香根草对SAs的吸收呈先上升后下降的波动状态。
香根草根部的SAs残留总量大于茎叶部,这与前人的研究结果[25]一致。植物吸收转运SAs的方式为主动运输,在植物组织内的SAs的含量排序为根>叶>茎。根系的SAs残留总量与茎叶SAs的残留总量比值的排序是SQX(7倍)>SDM(4.0倍)>SMZ(2.2倍)>SPY(1.4倍),由此可判断植物对SQX更为敏感,可将SQX固定在根部,尽可能地少向上运输,导致香根草根部的SQX富集比例较高。在100 μg·L-1的SAs胁迫下,水培香根草茎叶中的SAs残留增长趋势与根部积累量在1~9 d(SMZ除外)呈现一致性(图2),表明污染初期香根草对SAs具有一定的吸收、转运能力,可将SAs通过转化及蒸腾等作用排出体外;9~15 d茎叶的SAs含量处于稳定趋势,不再随根部的积累而大幅变化,表明须根系的深根是香根草修复SAs的主要器官组织,能加快水中污染物的去除,具有较好的潜力[26]。
4 结论与展望
(1)香根草对100 μg·L-1的SAs具有较好的吸收和去除能力,植物在第6和12天出现2次吸收高峰,香根草溶液中前6 d SAs的降解速率较高。
(2)SAs在营养液中的去除符合一级动力学方程。相比于对照组,香根草组在营养液中的SAs去除率于培养的第15天提高20.0%~32.8%;SAs的半衰期缩短了12~16 d。
(3)随着处理时间的延长,营养液中SAs的浓度逐渐降低、去除率逐渐升高。培养1~9 d香根草茎叶中的SAs含量随着根中SAs含量的增加而增加、转移系数也随之增加。
(4)香根草对SDM有较好的去除效果,对SMZ、SQX有较强的根部富集能力,对SPY有较强的转运能力。香根草对SAs具有较好的吸收和去除能力,可作为水体中SAs的优势修复植物,为抗生素污染修复的植物筛选提供理论依据,为湿地公园建设的生态功能方向提供一定的指导作用,但更深层次的修复机理和机制还需进一步深入探索研究。接下来的研究可向环境中的多种有机污染物[27]或有机污染物与重金属复合治理的方向延伸[28-29],修复手段可研究微生物与植物互作方向[30],以挖掘更多的治理方法和有效途径。
致谢:该研究由西南林业大学大型仪器共享平台、云南省高原湿地保护修复与生态服务重点实验室、西南林业大学环境污染与食品安全及人体健康省创新团队提供设备及研究相关支持,在此一并表示感谢。
