铅镉胁迫下柠檬酸、胡敏酸对刺槐幼苗根系发育及土壤特性的影响
2022-06-30靳晓东王霞张晓静周建
靳晓东,王霞,张晓静,周建
(1.河南科技学院园艺园林学院,新乡 453003;2.长垣市林业局)
据《全国土壤污染状况调查报告》[1]显示,全国土壤总超标率达到16.1%,而铅、镉污染分别达到7.0%、1.5%。其中,农田土壤的重金属污染尤为严重[2],对环境和人类健康形成了极大的危害。土壤中重金属可在农产品富集,然后通过食物链进入人体,给人体带来严重的健康问题,如肾功能衰竭、骨头痛、神经疼痛等[3]。因此,对土壤重金属污染的治理势在必行。
目前,重金属土壤污染修复可分为物理修复、化学修复、生物修复等。物理修复法见效快,但耗费人力,易破坏土壤结构[4];化学修复效果明显,但成本较高,修复范围受限[5];生物修复分为植物修复与微生物修复,其植物修复属原位修复,成本低廉,对环境友好,安全系数高[6],近年得到广泛应用。汤叶涛等[7]发现,圆锥南芥对Pb/Cd/Zn 复合污染土壤具有很大的潜力修复。蜈蚣草是镉超富集植物,对镉污染修复极具生态价值;凤尾蕨对铜的富集效果最好,在铜污染修复中发挥积极作用[8]。在矿区调查发现,类芦对铅有较强的富集,能在矿区正常生长[9]。
螯合剂能选择性地螯合多种金属离子[10],大致分为人工合成螯合剂,如乙二胺四乙酸(EDTA),与天然螯合剂[11],如柠檬酸、胡敏酸。目前,EDTA 在重金属污染土壤修复中应用最广[12-13]。但是,EDTA 生物降解困难,易产生二次污染[14]。相比EDTA,天然螯合剂易降解,生态安全[15],可提高植物对污染土壤的修复效率。CA 能显著活化土壤铜离子,促进烟草对铜的富集[15]。与此类似,柠檬酸可有效提高吊兰对铜的吸收与转运,使其地上部分的铜含量达到190.188 μg·g-1,明显提升污染土壤的修复效果[16]。在重金属污染稻田中,低浓度腐殖酸可促进水稻对镉的富集,但高浓度腐殖酸则显著降低了水稻中镉含量[17]。
刺槐(Robinia pseudoacacia)是豆科落叶乔木,生长速度快,根分蘖能力强,具有较强的多维抗逆性,如抗旱能力较强,在中性、酸性和含盐量低于0.3%土壤中能正常生长,具有很强的生态效应[18]。刺槐在铁尾矿废弃地的种植适应性最强[19],可作为适宜铁尾矿修复的最佳树种。同时,刺槐的铅胁迫耐受能力强[20]。王国娟[21]通过室内盆栽发现,铅离子主要富集在刺槐茎部、根部。因此,作为一种较好的生态树种,刺槐可广泛应用于非生物逆境的植物修复。
试验以刺槐为对象,在铅镉污染土壤中添加CA、HA,通过测定刺槐根系与其土壤特征,探索两者对于刺槐修复铅镉污染土壤的调控效应,为进一步强化刺槐在铅镉污染土壤修复中的应用提供理论基础和技术支撑。
1 材料和方法
1.1 试验材料
刺槐、柠檬酸、胡敏酸。
1.2 试验设计
将园土、腐叶土、基质按2∶2∶1 的体积比配制土壤,土壤容重为0.82 g·cm-1,总孔隙度为66.67%,电导率盐浓度为211.00 mg·L-1,有机质含量为2.02%。随后,加入硝酸铅和氯化镉,铅、镉离子浓度设置为600、20 mg·kg-1。最后在污染土壤中加入CA 和HA,浓度梯度均设置为0.5、5.0、10.0 mmol·kg-1,分别命名 为CA0.5、CA5.0、CA10.0、HA0.5、HA5.0、HA10.0,其质量百分数为0.009 6%、0.096 0%、0.192 0%、0.015 4%、0.154 0%、0.308 0%。同时,以仅加硝酸铅和氯化镉,不加螯合剂的土壤作为对照。
选取饱满的刺槐种子,温水浸泡24 h;随后将种子均匀放置于湿纱布上,然后再覆盖一层湿纱布,置于向阳处催芽48 h;待1/3 种子露白时播种,采用育苗盘播种。每个处理一个育苗盘,共6 个育苗孔(长、宽、高分别为5、5、5.5 cm),分3 行,每行2 个育苗孔为一个重复,共计3 次重复。每孔播种3 粒种子,覆土0.5~1 cm。最后在育苗盘的托盘中加水,使土壤充分湿润。等幼苗发育40 d 时取样,测定相关指标。
1.3 测定方法
1.3.1 土壤取样
在取土过程中,要清除残留的须根及表面杂质,保留根系范围内约1/3 的心土。将心土内须根和杂质去除后,置于烘箱中80 ℃烘10 h,直至恒重。将干土在研钵中捣碎,然后过筛(2 mm)。最后土样放入密封袋,密封保存。
1.3.2 植物根系生长指标
用Epson Expression 11000XL 根系扫描仪扫描根系。先洗净根系泥土,切忌伤根;随后于根茎处剪下根系,再用蒸馏水漂洗;将根系平放于根盘,加蒸馏水直至根系浸没;用小镊子将根系分开,呈分散状;盖好背景板,扫描根系。最后,用WinRHIZO Pro 2007 软件对根系图片进行指标分析。重复3 次。
1.3.3 植物根系活力
用TTC 染色法测定根系活力[22]。取0.5 g 左右的根尖,置入0.4%TTC 与66 mmol·L-1磷酸缓冲液(pH7.0)的等量混合液中,根尖完全浸没;样品置于恒温箱37 ℃暗反应3 h;取出烧杯,加入2 mL 1 mol·L-1的硫酸终止反应;取出根尖,滤纸吸水后移入研钵中,加入少许石英砂与5 mL 乙酸乙酯研磨;将研磨液移入离心管,取5 mL 乙酸乙酯少量多次清洗研钵,将残渣移入离心管;4 300 rpm 离心5 min,取上清液。最后,485 nm 处测定上清液OD 值。重复3 次。根据标准曲线计算TTC 还原量。
根系活力的计算公式:
TTC 还原强度(mg/g*h)=TTC 质量×1000/根系质量×时间
1.3.4 土壤pH 值
称取2.5 g 土样,置入10 mL 蒸馏水中;玻棒搅拌1 min,直至均匀;静置30 min 后,用滤纸过滤残渣;将电极插入土样滤液中,待其稳定后记录pH 值。重复3 次。
1.3.5 土壤酸性磷酸酶
采用试剂盒(苏州科铭生物技术有限公司)测定土壤酸性磷酸酶(S-ACP)活性。
(1)粗酶液提取
称取0.1 g 土样,放于离心管,加入50 μL 甲苯,轻摇混匀,常温静置15 min;加入0.4 mL 试剂一,轻摇混匀后置于恒温箱37 ℃催化24 h;完成后迅速向离心管加入1 mL 试剂二,停止酶促反应;将离心管置入离心机,25 ℃下6 000 rpm 离心10 min,最后取上层清液待用。
(2)酶活性测定
取容积1 mL 的玻璃比色皿,依次加入10 μL 蒸馏水、20 μL 试剂三、4 μL 试剂四,充分混合均匀;显色后再加入166 μL 蒸馏水,轻摇混匀,室温静置30 min;在660 nm 处测定吸光度,记为空白管。随后,将10 μL 蒸馏水换成10 μL 标准液,相同操作,标记为标准管;换成10 μL 上清液,标记为测定管。重复3 次测定。
(3)酶活性计算
按照如下公式计算酶活性:

C-标准液体积;V 总-催化体系总体积;W-土壤样品质量;T-催化反应时间
1.3.6 土壤铅镉含量测定
称取0.1 g 土样放入聚四氟乙烯烧杯,按10∶5∶3体积比依次加入硝酸、氢氟酸、高氯酸,玻棒搅匀。将烧杯置于电热板上180 ℃消解3 h;然后轻摇烧杯,待样品溶解后,开盖赶酸;待溶液赶酸至黄豆粒大小时,用0.2%稀硝酸转移消解液,定容至10 mL。最后,用原子吸光光度法测定铅含量,用ICP-MS 法测定镉含量。重复3 次。
1.4 数据处理与分析
用Microsoft excel 2010 处理数据,作图;用IBM SPSS Statistics 21.0 行方差分析。
2 结果与分析
2.1 CA、HA 对铅镉胁迫下刺槐根系生长指标的影响
如图1-a 所示,在铅镉胁迫下,柠檬酸与胡敏酸对刺槐总根表面积的影响相似。添加0.5、5.0、10.0 mmol·kg-1CA 后,总根表面积分别低于对照16.40%、21.19%、11.53%,差异不显著(P>0.05)。5.0 mmol·kg-1HA 处理显著降低了根系的总根表面积,低于对照值60.31%(P<0.05);0.5、10.0 mmol·kg-1HA 处理的总根表面积低于对照8.97%、25.43%,但差异不显著(P>0.05)。
在试验中,添加CA 和HA 后,刺槐根系的总根体积呈下降趋势(图1-b)。添加0.5、5.0、10.0 mmol·kg-1CA 后,总根体积分别低于对照23.31%、37.43%、15.96%(P>0.05)。在5.0 mmol·kg-1HA 处理中,根系总根体积显著低于对照70.06%(P<0.05);添加0.5、10.0 mmol·kg-1HA 后,胁迫植株的总根体积分别下降了16.48%、37.37%,但差异不显著(P>0.05)。
与前两者相似,柠檬酸与胡敏酸降低了刺槐根系平均直径(图1-c)。在0.5、5.0、10.0 mmol·kg-1CA处理中,根系平均直径分别低于对照5.13%、16.14%、2.49%,差异不显著(p>0.05)。添加0.5、10.0 mmol·kg-1HA 后,刺槐的平均根系直径下降,但与对照值差异不显著(p>0.05);在5.0 mmol·kg-1HA 处理中,刺槐平均根系直径显著低于对照21.51%(P<0.05)。
在铅镉胁迫下,CA 抑制刺槐根尖的发育,而HA 基本促进根尖发育(图1-d)。添加0.5、5.0、10.0 mmo·lkg-1CA 后,刺槐根尖数分别低于对照24.72%、4.55%、17.61%(P>0.05)。在0.5、10.0 mmol·kg-1HA 处理中,刺槐的根尖数分别提高23.01%、64.20%,其中高浓度处理差异显著(P<0.05);添加5.0 mmol·kg-1HA 后,刺槐根尖数低于对照34.94%(P>0.05)。
在试验中,在CA 和HA 的调控下,铅镉胁迫植株的总根长呈下降趋势,但均差异不显著(P>0.05)(图1-e)。添加0.5、5.0、10.0 mmol·kg-1柠檬酸后,刺槐的总根长分别下降10.76%、9.45%、8.55%;在0.5、5.0、10.0 mmol·kg-1HA 处理中,胁迫植株的总根长分别低于对照2.84%、48.49%、12.72%。
与总根长表现相似,CA 和HA 基本抑制胁迫植株的根系分枝数,但均差异不显著(P>0.05)(图1-f)。在0.5、5.0、10.0 mmol·kg-1柠檬酸处理中,刺槐根系分枝数分别下降20.11%、32.07%、12.85%。添加0.5 mmol·kg-1HA 后,刺槐根系的分枝数高于对照15.20%;而5.0、10.0 mmol·kg-1HA 处理植株的根系分支数量分别下降60.23%、25.59%。
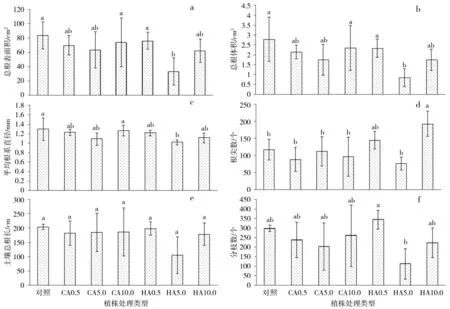
图1 CA 与HA 处理下刺槐铅镉胁迫植株的根系发育Fig.1 Root development of Pb-Cd-stressed seedlings for R.pseudoacacia under CA and HA treatments
2.2 CA、HA 对铅镉胁迫下刺槐根系活力的影响
在试验中,随着柠檬酸浓度的增加,刺槐根系活力呈下降趋势,具体见图2。添加0.5 mmol·kg-1CA 后,根系活力高于对照13.43%;在5.0、10.0 mmol·kg-1CA处理中,刺槐根系活力分别下降5.77%、31.53%,但差异均不显著(P>0.05)。与前者相反,随着HA 浓度增加,刺槐根系活力逐步上升。添加0.5 mmol·kg-1HA 后,根系活力低于对照23.74%(P>0.05);在5.0、10.0 mmol·kg-1HA 处理中,刺槐的根系活力分别上升50.97%、80.94%,其中高浓度处理差异显著(P<0.05)。

图2 CA 与HA 处理下刺槐铅镉胁迫植株的根系活力Fig.2 Root activities of Pb-Cd-stressed seedlings for R.pseudoacacia under CA and HA treatments
2.3 CA、HA 对铅镉胁迫下刺槐土壤pH 值的影响
从图3 可看出,在铅镉胁迫下,柠檬酸与胡敏酸降低了土壤pH 值,由碱性变成了微酸性。添加0.5、5.0、10.0 mmol·kg-1CA 后,土壤pH 值分别降低20.77%、20.95%、20.02%;而在0.5、5.0、10.0 mmol·kg-1HA 处理中,土壤pH 值分别降低20.55%、19.36%、20.15%,均与对照差异显著(P<0.05)。

图3 CA 与HA 处理下铅镉污染土壤的pH 值Fig.3 pH values of Pb-Cd-polluted soil under CA and HA treatments
2.4 CA、HA 对铅镉胁迫下刺槐土壤酸性磷酸酶活性的影响
在铅镉胁迫下,柠檬酸与胡敏酸对土壤酸性磷酸酶活性的影响存在差异(图4)。随着柠檬酸处理浓度增加,污染土壤的酸性磷酸酶活性先降后升,其中5.0 mmol·kg-1CA 处理的土壤酸性磷酸酶活性最低,低于对照28.93%;10.0 mmol·kg-1CA 处理的酶活性则达到峰值,高于对照57.23%,均差异不显著(P>0.05)。与前者相反,HA 调控的酸性磷酸酶活性先升后降,在5.0 mmol·kg-1处理中,酶活性达到峰值,高于对照值84.91%;10.0 mmol·kg-1处理的土壤酶活性降到最低,低于对照63.52%(P>0.05)。

图4 CA 与HA 处理下铅镉污染土壤的酸性磷酸酶活性Fig.4 Soil acid phosphatase activities of Pb-Cd-polluted soil under CA and HA treatments
2.5 CA、HA 对铅镉胁迫下刺槐土壤中铅镉含量的影响
从图5-a 中可以看出,在铅镉胁迫下,CA 与HA 对土壤铅含量的影响存在差异。添加0.5、5.0 mmol·kg-1CA后,刺槐修复的土壤的铅含量分别高于对照8.96%、5.77%(P>0.05);10.0 mmol·kg-1CA 处理降低了土壤铅含量,显著低于对照值14.45%(P<0.05)。添加0.5、5.0、10.0 mmol·kg-1HA 后,刺槐修复的土壤的铅含量明显降低,显著低于对照18.50%、21.40%、30.94%(P<0.05)。
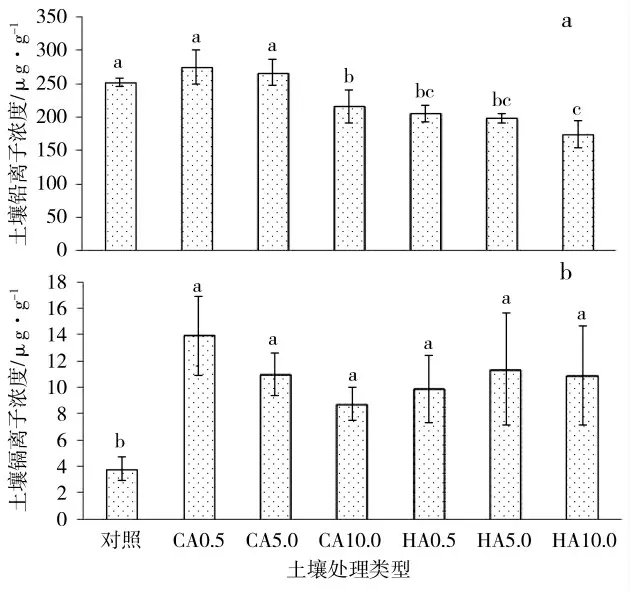
图5 天然螯合剂处理下铅镉污染土壤的离子浓度Fig.5 Soil ion concentrations of Pb-Cd-polluted soil under CA and HA treatments
与对铅的调控相反,柠檬酸与胡敏酸增加了土壤的镉含量(图5-b)。添加0.5、5.0、10.0 mmol·kg-1CA 后,土壤镉含量分别高于对照261.65%、185.28%、128.28%,均差异显著(P<0.05)。在0.5、5.0、10.0 mmol·kg-1HA 处理中,刺槐修复的土壤的镉含量显著上升,显著高于对照157.50%、196.13%、184.19%(P<0.05)。
3 讨论
试验发现,高浓度柠檬酸处理与所有胡敏酸处理的土壤铅离子含量显著低于对照,而两种螯合剂处理土壤的镉离子含量显著高于对照。表明高浓度CA、HA 提高了刺槐对铅污染的修复效率,促进刺槐对铅离子的富集;而CA 与HA 调控刺槐修复土壤镉污染的效果不明显,可能抑制了刺槐对镉的吸收。外源胡敏酸促进刺槐对土壤铅的修复,降低土壤铅浓度,这与茶树[23]的表现相似。这种促进现象应该是增加了植物组织中纤维素结合态铅的比例,促进铅通过根系维管向上转运[23],成为富集重金属离子的重要途径[24]。同时,随着CA、HA 浓度的增加,对土壤中碳酸镉的活化增强,使得生物可利用有效态Cd2+的含量降低[25],进而降低了植株对镉的富集。通过水培试验,薛卫杰[26]发现外源柠檬酸明显钝化镉的转运,降低了水稻幼苗对镉的富集。类似的,添加胡敏酸后,黑麦草对Cd2+的转运与富集能力受到明显抑制[27]。
铅镉污染土壤中添加HA 与CA 后,刺槐根系的发育低于正常水平,应该是铅离子在刺槐体内富集,从而对细胞形成生理毒害,影响了植株根系的发育[28]。其次,土壤镉含量较高,会对根系形成直接的生物毒害,造成H2O2在植物细胞中积累,导致非酶系统和抗氧化酶系统紊乱[29],进而影响根系发育。但在HA 与CA 的调控下,刺槐根系发育与正常水平差异不显著,也表明二者对植物所受的重金属毒害具有一定缓解作用[27]。
在试验中,胡敏酸与柠檬酸在一定的浓度范围降低土壤pH 值,与小飞扬草表现相似[30]。土壤由碱性变成微酸性,从而提高土壤中各种营养成分和元素的有效性,改善了土壤质量,可在一定程度上缓解根系发育的抑制[31]。同时,CA 和HA 对刺槐根系活力产生影响,但绝大部分差异不显著,而中高浓度HA显著提高了根系活力。表明这两种螯合剂,尤其是胡敏酸具有降低植物体内铅离子毒害的功能,通过增加根系细胞壁的果胶总糖和糖醛酸的含量,增强细胞壁吸附、钝化铅离子活性[23],维护细胞功能,保持根系活力。
4 结论
根据前期试验数据得出如下结论:
(1)在铅镉胁迫下,胡敏酸与柠檬酸调控刺槐根系生长发育稳定。
(2)中高浓度胡敏酸显著促进刺槐铅镉胁迫植株的根系活力,可以作为刺槐修复铅镉污染土壤的外源辅助措施。
(3)HA 与CA 将铅镉污染土壤由碱性变为微酸性,改善了土壤质量。
(4)高浓度柠檬酸与胡敏酸能提高刺槐对铅污染土壤修复效率,其中10.0 mmol·kg-1胡敏酸处理的调控效果最佳;两者对镉污染土壤修复的调控效果均不明显。
在试验中,10.0 mmol·kg-1HA 对铅镉胁迫下刺槐根系与土壤特性的综合调控效果最优,可以作为外源措施参与刺槐对铅污染土壤的修复。但试验对HA 的临界值设置还不够精准。因此,在后期要通过进一步试验,精准找出胡敏酸调控刺槐修复铅污染土壤的临界值,以便于胡敏酸在铅污染土壤修复中发挥更好的调控效果,进一步提高修复效率。
