黑碳对呼吸系统发病急性影响及气温修正效应研究
2022-06-29田梓杰张小玲王式功
马 盼,田梓杰,张小玲,2*,王式功,尹 岭
黑碳对呼吸系统发病急性影响及气温修正效应研究
马 盼1,田梓杰1,张小玲1,2*,王式功1,尹 岭3
(1.成都信息工程大学大气科学学院,高原大气与环境四川省重点实验室,四川 成都 610225;2.成都平原城市气象与环境四川省野外科学观测研究站,四川 成都 610225;3.中国人民解放军总医院,北京 100853)
为研究黑碳(BC)对呼吸系统急性发病的影响及气温的修正效应,收集北京市2009~2012年264075例呼吸系统急诊病例与同期空气污染物(BC、PM2.5、SO2、NO2)及气象数据,在划分呼吸道感染部位(上、下呼吸道)与人群年龄的基础上,采用分布-滞后非线性模型与广义相加模型进行建模.首先分别研究BC、气温与发病的(滞后)关联,继而构造二元交互模型探索气温-BC的协同关系,再分层量化BC在不同气温水平的健康影响;并同时纳入气态污染物验证BC结果的稳健性. 结果表明,对总呼吸系统、上感、下感而言,气温-发病风险的暴露-响应曲线均近似“V”型,阈值温度分别为24℃、26℃和24℃,且低温的滞后累积影响强于高温.主效应模型揭示BC诱发即时性风险,影响在3d内消失;BC浓度每升高四分位数(IQR),总呼吸系统、上感、下感的超额发病风险(ER)分别为1.97%、2.64%和1.34%.少儿(£14岁)超额发病风险最高(总呼吸系统,3.40%),而老年组(³60岁)结果不甚显著.双污染物模型显示,BC与SO2共存会放大BC关联风险,尤以上感响应明显;而BC与NO2共存会适度增强下感风险. BC-气温的非参数二元模型显示,BC升高使发病风险类似对数函数上升,且高温会显著增强BC的健康影响.分层模型得到,每IQR BC在气温高于阈值时导致的下感风险显著高于上感,分别为5.55%、1.27%(P>0.05);而低于阈值时BC所致上、下感风险相当,均在0.55%左右. BC对呼吸系统发病的急性影响与感染部位和气温水平紧密相关,不同年龄段间也体现差异化特征.
黑碳;气温;呼吸道感染;急性影响;交互效应
黑碳(BC)是PM2.5的重要组成成分,具有粒径小(0.01~1.0µm)、表面积大、强吸附性等典型特征,易富集空气中的细菌、病毒、有毒化合物等[1-2].据报道[3],空气中悬浮的黑碳极易被人体吸入,与呼吸系统、心血管疾病,高血压,癌症等有不同程度的关联.早在2010年,国际癌症机构将炭黑(Carbon Black,特定燃烧条件下的工业制品)归为2B类致癌物;2012年又将碳烟(含有机碳、BC、硫等)列为一类致癌物,且研究普遍认为BC比PM2.5或PM10具有更高的健康风险[3-4].中国BC排放总量占世界的23.8%,其中京津冀地区的BC排放量占全国总量的9.37%[5-6].
黑碳对健康的短期和长期影响,目前已报道的包括对气道炎症[7]、儿童哮喘[8]、收缩压升高[9]、动脉硬化[10]等的影响.特别是与呼吸系统疾病的联系密切,如北京大学第三医院呼吸、心血管、眼部等科室急诊均与BC浓度正相关[11]; 1999~2005年美国106个县的BC浓度与呼吸系统疾病住院风险有关[12];长期吸入BC可引起咳嗽、胸痛、嗜睡、皮肤刺激等[13];BC暴露可引发包括肺损伤在内的一系列呼吸道疾病[14].
呼吸系统疾病以呼吸道感染为主,即由细菌、病毒、真菌、结核菌等感染引起的呼吸道和肺部疾病,而感染的发生与空气质量和气象条件关系密切.受可获取资料信息限制,先前研究多以全呼吸系统疾病为着眼点,关于BC对于不同呼吸道疾病影响的研究较少.Kim等[15]研究揭示, BC暴露与哮喘和支气管炎具有关联性.Niranjan等[16]认为BC可通过氧化应激、DNA甲基化等途径引起呼吸道疾病.再者,目前关于BC健康效应的研究大多以死亡为健康结局,如张莹等[17]、欧奕含等[18]分别研究了北京市和西安市BC-死亡率的关联性并获得显著结果,但作为最终健康结局,死亡很大程度上反应污染物的长期累积影响,且并发症、遗传和医疗条件等混杂因素较多.而针对黑碳短期、急性健康影响的研究仍十分缺乏,研究亟待深入和细化.
此外,前期研究已广泛揭示气温、湿度等气象因素对呼吸道发病影响显著,并与环境因子间可能存在复杂的交互、叠加或抵消作用.一般认为高温对发病/死亡的短期效应显著,而低温的累积滞后性影响更突出[19-20].近十年来,有少数研究对气象-颗粒物的交互影响进行探索,但相关结果不甚统一,如张莹等[17]发现高温会加强BC、PM2.5对死亡的影响,而Rainham等[21]认为没有交互影响.尽管如此,气象条件对BC影响的调节作用不能忽视,需根据病种开展具体化研究.
在我国《大气污染防治行动计划》实施以前,BC平均浓度普遍较高,但监测数据的缺乏导致相关健康影响的研究极少,特别是针对BC短期、急性健康影响的研究.因此,本研究以北京市2009~2012年呼吸系统急诊数据为指标,区分呼吸道感染部位,使用国际流行的生物医学统计模型,分析了气温和BC浓度对呼吸急诊发病的影响以及二者潜在的交互作用,旨在进一步深化、细化BC-呼吸系统发病关系的研究.
1 材料与方法
1.1 资料来源
1.1.1 疾病资料 收集北京市海淀区三家大型三甲医院2009~2012年的呼吸系统疾病急诊病例,包含急诊就诊日期、医生诊断、患者年龄、性别、住址等,常住地在北京以外的病例已被去除,质控后合计264075例.已向相关医院提交了数据申请并签署保密协议.资料按照ICD-10(国际疾病分类标准第十版)进行编码,为细分不同呼吸道感染部位,从总呼吸系统(J00-J99)中,提取上呼吸道感染(简称上感, J00-J06,J30-J39)共158231例,主要包括感冒、上感、急慢性咽喉炎、鼻咽炎等;下呼吸道感染(简称下感,J20J22,J40-J47)37406例,诊断以肺炎和气管/支气管炎最为常见.上、下感分别占全部呼吸系统病例的59.92%、14.16%.此外,非感染性呼吸系统疾病主要有肺肿瘤、气道阻塞性肺病、呼吸衰竭和肺循环疾病等.
1.1.2 气象与环境资料 北京市气象台2008至2012年的逐日气象观测资料,来自中国气象数据网(http://data.cma.cn/).主要包括日均温度(℃)、相对湿度(%)、水汽压(hPa)和大气压(hPa)等,气象资料无缺测.北京市大气污染物数据包括2008至2012年的BC、SO2、NO2和PM2.5的日均浓度, 其中气态污染物和PM2.5数据由北京市气象局的准业务研究观测站(宝联大气成分观测站)测得,该测站附近大多为居民区,工业污染小,数据代表性较好.BC数据来源于大兴区的北京观象台(39°48′N,116°28′E),是当时北京市唯一连续的BC观测资料,由美国MAGEE公司的7波段Aethalometer黑碳仪(AE31)测得,使用880nm波段数据.由于研究时段和监测站点的限制,BC和其他污染物的站点位置不完全一致,可能造成研究结果的轻度偏倚.
1.2 研究方法
考虑到气象因子与空气污染物之间的交互作用,以及二者健康影响可能的滞后性与累积效应,本研究使用R语言(3.6.3版本)的“dlnm”和“mgcv”程序包进行建模,实现分布滞后非线性模型(DLNMs)与广义相加模型(GAMs)的结合构造.DLNMs的优势在于能够同时评价暴露因素(如BC)的非线性效应和滞后效应,即在模型中通过建立二维交叉基函数描述因变量(如发病人数)在暴露程度和滞后维度的分布[22].GAMs具有量化因变量与多个解释变量之间复杂非线性关系的能力,一般对空气污染物变量进行线性拟合,对关联复杂的气象因子进行平滑函数拟合,还可纳入分类变量以控制其他混杂因素[23]. GAMs也能实现利用非参数二元响应模型构造双变量交互作用的三维空间分布图.结合两种模型可充分捕获气温、BC的(滞后性)健康效应并探究其交互影响.研究步骤如下.
第一步,先构造气温的交叉基函数,利用DLNMs+GAMs建立气温的独立健康效应模型;进而线性纳入BC浓度,量化不同滞后日BC的健康影响.将逐日急诊人数作为因变量,基于前期相关研究和敏感性实验,选取气温的滞后时长为15d,交叉基采用自由度为4的自然样条函数和多项式函数.模型中控制了多种混杂因素,时间趋势与相对湿度的非线性作用采用样条函数拟合,节假日效应、星期几和供暖的混杂采用哑元变量纳入.综上,气温主效应模型具体形式如下.
log[(Y|)]=basis.+(time, df)+Holiday+DOW+
HEAT=basis.+(time, df)+(RH, df)+COVs(1)
式中:(|)为第日呼吸系统疾病急诊人数的期望值;basis.表示气温的交叉基函数;()为样条函数,df为相应自由度;time (time=1…1462)表示急诊人数序列的时间趋势;RH为相对湿度,自由度为3;混杂因素COVs包括节假日效应(Holiday)、星期几(Day of the week, DOW)、供暖效应(HEAT),均作为哑变量纳入模型.
在上述模型稳健的基础上,线性纳入不同滞后日的BC浓度并量化其健康影响.考虑到BC对发病的影响可能存在短期滞后效应,参考先前研究,分别拟合BC单滞后天数(当天的BC浓度以及0~4d前的浓度,依次记为lag0d和lag1、2、3、4d)和累积滞后天数(当天的BC浓度与前1~4d浓度的滑动平均值,依次记为lag01、02、03、04d)与急诊人数的关系,从而观察发病风险的时间变化和最大风险对应天数.此外,在BC单污染物模型的基础上,分别加入气态污染物SO2、NO2以构成双污染模型,对比两类模型结果并验证BC相关结果的稳健程度.由于流行病学研究尚不能区分PM2.5与BC的独立健康影响,且BC本身是PM2.5的组成部分,为避免重复引入,建模时未同时纳入PM2.5浓度.具体公式略.
第二步,获得气温与BC的独立健康影响后,探究二者交互作用对呼吸系统疾病发病的影响.在GAMs中构建非参数的二元响应模型,拟合出气温与BC同时对急诊人数影响的三维空间示意图,通过三维图的变化特征能直观分析出气温与BC的交互影响.模型如下:
log[(Y|)]=ST(,BC)+(time,df)+(RH,df)+COVs(2)
式中:ST()为薄板样条函数,即气温与BC对急诊人数影响的交互作用项;COVs为混杂因素项.
第三步,虽然非参数二元响应模型完成了对气温与BC交互作用的定性分析,为量化不同气温水平下BC的健康影响,利用第一步中得到的温度阈值,构建温度分层模型,再研究BC浓度对呼吸系统发病的急性影响.需要说明的是,虽然以温度为分界会导致不同分组的时间不连续,但由于不同滞后日的污染物浓度已作为单独序列与疾病资料进行匹配,因此不影响其滞后效应分析.在各分层模型中得出BC浓度变化单位量对急诊人数影响的回归系数后,可定量分析评价不同温度层BC的影响程度.本研究采用BC每增加一个四分位间距(IQR)时,呼吸系统疾病发病的相对危险度(Relative risk, RR)、超额危险度(Excess risk, ER)及相应95%置信区间,计算如下:
RR=e(IQR×a)(3)
ER=(RR-1)´100%(4)
ER%(95%CI)=[e(IQR´(a±1.95SE))-1]´100%(5)
式中:95%CI为ER的95%置信区间,SE为标准误差.
2 结果与分析
2.1 发病与气象环境因子的基本统计特征
如表1所示,2009~2012年北京市几家医院呼吸系统急诊约180例/d,变幅为50~649例/d.上感急诊数日均108例,下感急诊日均26例.总呼吸系统病人的年龄亚组中,15~59岁的中间段总量最高,约110例/d;由于资料中包含了儿科急诊,少儿组总体数量较高,为约55例/d;老年组呼吸系统急诊人数总体较少,可能与其长期、慢性呼吸系统疾病的治疗或住院为主,急诊发病相对较少.
此外,研究时段北京市年平均气温为13.1℃,气温变幅为-12.5~34.5℃.BC年均浓度为5.1µg/m³,变幅为0.4~34.4µg/m3,年均值高于美欧等地区[24].

表1 北京市2009~2012年呼吸系统疾病发病与气象环境资料的描述性统计
注:P25, P50和P75分别为变量的第25、50和75百分位数.

图1 2009~2012年北京市逐日BC浓度与总呼吸系统急诊人次的时间序列
由图1可见,北京市BC浓度的年内分布具有显著秋冬季峰值,与呼吸系统疾病急诊高峰几乎吻合;研究期间BC浓度整体呈下降趋势,尤其极高值减少显著(图1).由表2可知,BC浓度与温湿度分别呈显著的负相关和正相关,几种污染物之间均为显著的正相关.PM2.5与BC的相关性较强,尚不能区分独立健康影响[6],因此在后续建模时未纳入PM2.5.
2.2 日均气温对急诊人数的影响
探讨日均气温对呼吸系统急诊发病的影响,在充分考虑气温滞后(0~15d)效应后,得出二者的累积暴露-反应关系(图2).发现对三种疾病分类而言,曲线均近似呈“V型”,在低温侧略有不一致;三者均存在显著的气温阈值,对应最低的累积发病风险;偏离阈值越远、气温越极端,发病风险均会增加,与相关研究的结论一致[25].总呼吸、上感、下感的温度阈值分别为24℃、26℃和24℃(图2).

表2 黑碳与主要气象因子和大气污染物的斯皮尔曼相关性
注:**表示相关系数通过了显著性水平为0.01的显著性检验.
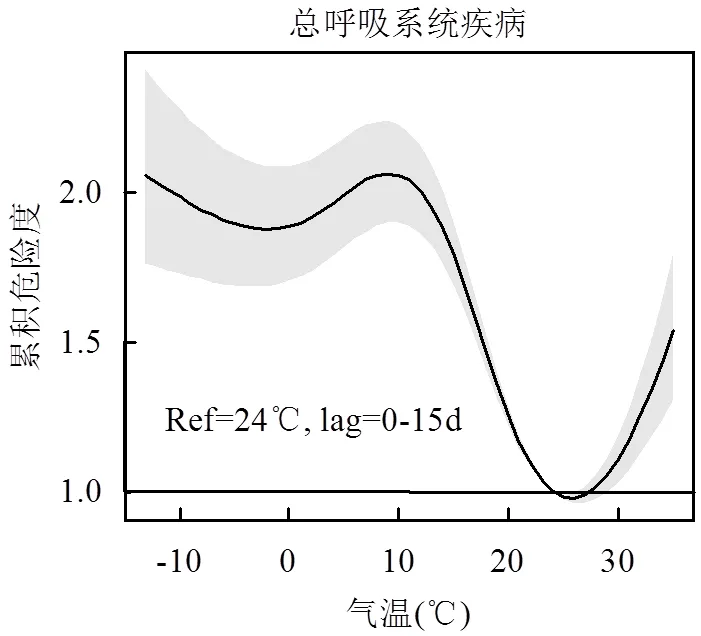
实线为急诊发病的累积相对危险度, 灰色阴影表示其95%置信区间
2.3 BC对呼吸系统发病影响的主效应模型

单滞后Lag0-Lag4,滑动滞后Lag01-Lag04
首先构造BC单污染模型,其对三类呼吸系统疾病的影响如图3左列所示,总体上超额发病风险(ER)在lag0~lag01d最高,且滑动滞后风险高于单滞后风险;BC诱发的呼吸系统急诊发病风险一般在3d内消失,体现BC的短期效应.BC对下感的影响整体未通过显著性检验,但体现出更强的滞后性.在最佳滞后日,BC每升高IQR对应总呼吸系统、上感、下感的ER依次为1.97% (95%CI: 1.40, 2.55)、2.64% (95%CI: 1.91, 3.38)和1.34% (95%CI: -0.19, 2.88).
此外,年龄差异显示,BC引起少儿(£14岁)呼吸系统超额发病风险最高,为3.40%(95%CI: 2.22, 4.59);15~59岁成年组和60岁以上人群分别为1.77% (95%CI: 1.08, 2.47)和0.62% (95%CI: -1.35, 2.61).
BC单污染模型加入SO2或NO2构成双污染模型(图3中、右列)显示,对于总呼吸系统和上感,BC与SO2共存会增加其超额发病风险,分别达2.19% (95%CI: 1.58, 2.80) 与3.26% (95%CI: 2.26, 4.25);加入NO2后危险度略有降低,为1.55% (95%CI: 0.90, 2.21)和1.98% (95%CI: 1.15, 2.82);BC对下感的影响在与SO2或NO2共存时略有增加,1.42%(95%CI: -0.19,3.05), 1.83 % (95%CI: 0.09, 3.57),整体仍不显著.需指出由于多种污染物间复杂的关联性,此处仅为特定研究时段北京市的统计结果.
2.4 BC-气温对呼吸系统发病的交互影响与分层模型构建
构造非参数二元响应模型(图4),整体观察发病风险变化与两因子数值间的关联性,此处为定性分析.总呼吸系统疾病与上感的变化规律相似(图4a,b),即发病风险与BC浓度同向变化,类似对数函数关系、增速先快后慢;且高温-高浓度BC存在协同增强效应,即高温和高浓度BC并存对应发病最高峰.下感发病特征有显著差异(图4c),同一温度下发病风险随BC浓度线性增加;当气温偏低(0~10℃)和高浓度BC共存时,急诊人数达到峰值;极端气温未体现出与BC的强协同性(图4c).
此外,由平滑曲面的变幅可知,气温有关的风险变化大于BC的影响,即由气温主导、BC起调节作用(图4).此处需指明,交互模型采用的是同期的气温和BC数据,未纳入气温的长期滞后影响.为进一步量化不同气温水平下BC的健康影响,以前文中温度阈值为分界,在其两侧分别构造BC效应模型,相关ER见图5.
表3列出在最强滞后日下(低温段Lag0d,高温段Lag04d),各类模型计算的BC所致超额风险(ER).分层后发病风险的滞后分布产生了较大差异——在高温段,BC对总呼吸系统、下感的影响十分突出,且有随时间增强的趋势;而对上感的影响总体不再显著(图5).低温分层下,BC对三类疾病均有短期滞后性影响,上、下感超额风险均在0.55%左右(图5).加入气态污染物后,相关结果基本稳健,高温段总呼吸系统和下感的超额风险分别在2%、5%以上(表3).此外,模型中加入SO2后,BC对上感的影响增强(尤以低温段突出),这与不分层模型的结果一致,提示BC和SO2共存可能对上感风险有协同增强作用.

图4 北京市日均气温-BC对呼吸系统疾病交互影响的平滑曲面

图5 2009~2012年北京市BC日均浓度每增加IQR,温度分层的总呼吸系统、上感、下感超额发病风险及95%置信区间

表3 不同温度下BC每增加IQR对几类呼吸系统疾病发病的影响

续表3
注:* 通过了显著性水平为0.05的显著性检验;总呼吸、上感的温度阈值为26℃;下感阈值为24℃.
3 讨论
3.1 BC浓度与呼吸系统发病的时间特征
黑碳(BC)作为环境空气细颗粒物的重要组成成分,不仅对地-气辐射平衡、云气溶胶、气候变化等具有直接或间接的影响,其对人体多个系统的不利影响也正在受到重视.即使BC的质量浓度年均值仅占PM2.5的十分之一左右(北京,5.1Vs. 67µg/m³),相关研究广泛证实其显著性和突出“贡献”,即使生物医学统计尚不能完全剥离BC的独立健康影响.由于强吸附性和极小的粒径,BC应被作为影响人群健康的重要空气质量指标.在我国《大气污染防治行动计划》[26]实施以前,2009~2012年北京市BC浓度较高为5.1µg/m3,2006~2011年该值为5.7µg/m3[27],整体呈缓慢下降趋势,研究期间浓度极大值数量也在减小.即使如此,我国BC平均浓度依然高出发达国家一个量级[28],且监测数据的缺乏导致相关研究进展与欧美国家存在一定差距.
世界卫生组织(WHO)[29]与政府间气候变化委员会(IPCC)第五次评估报告[30]均指明慢性病是威胁人类健康的根本因素之一.呼吸系统疾病既是高发、常见病,也是影响全球伤残调整生命年的主因之一[31].本研究发现,北京市呼吸系统发病与BC浓度有较高的同步性,秋冬季发病高峰不仅面临偏高的污染水平,还要叠加气候因子(如低温)的潜在协同效应[32].相关研究已对北京市BC的健康影响进行初步探究,主要针对全呼吸系统和循环系统的死亡数据[17,27],一方面,死亡作为最终健康结局,前期累积影响因素和混杂因子较多;另一方面,全系统死亡数据难以对比呼吸道不同部位感染与BC间的关联性.本研究收集几家大型医院的急诊数据,由于起病急、就诊快,发病与环境气象因子的同步性和关联性更强,有助于进一步揭示BC短期健康影响.
3.2 气温与BC对发病的单效应
关于气温-呼吸系统疾病的研究普遍揭示,温度-发病/死亡的关系在不同气候区一般呈U型、V型或J型,均存在温度阈值对应风险低点[17,25].通常,高温的影响相对急性(0~3d),而低温作用可在滞后0~ 14d(甚至0-28d)时段内持续.本研究发现低温的总体影响强于高温,阈值在24~26℃,与张莹等[17]针对死亡的研究高度一致.由于阈值温度两侧气温的健康影响呈反向关系,因此有必要以其分界,在两个气温水平分别建模探讨.这可以协助解释BC引起上感的超额风险在气温分层前、分层后产生了较大差异,主要源于气温十分显著的非线性混杂影响.
本研究发现温度不分层时,BC每升高四分位数对应总呼吸系统、上感、下感的急性发病风险分别增加1.97%、2.64%和1.34%,总体偏高于死亡数据结果(BC增加IQR,死亡风险增加1.8%)[17],因此BC的短期急性影响需引起更多重视.有关BC的毒理学研究为上述结果提供了科学支撑,BC对呼吸道上皮细胞、巨噬细胞等有毒害作用,还可直接到达肺泡、诱导机体发生自由基反应,使抗氧化物质消耗、抗氧化酶表达,发生氧化应激反应[33].动物实验也揭示,暴露于BC可增加小鼠血清中的抗氧化剂和过氧化氢酶,小鼠肺组织出现了肺泡间隔、肺泡腔缩小、细支气管壁增厚等现象[34].
就单、双污染物模型效果对比而言,BC与SO2共存会进一步增加上感风险(ER增加约0.3~0.7%),推测与二者同时产生的刺激性和毒性作用有关;BC对下感的影响在与NO2共存时略有增加,这提示我们针对大气污染物联合污染的研究需要进一步加强深入.一项针对江苏省污染物联合暴露与居民死亡关系的研究揭示,PM2.5、NO2浓度每升高四分位间距,对应呼吸系统超额死亡风险为1.09%和2.75%[35].另有上海的研究指出,在多污染物模型中,关于BC的结果比细粒子和粗粒子的更为稳健[28].由于多种污染物间复杂的关联性,本研究揭示的仅为北京市特定时段的统计结果.
3.3 气温与BC协同效应讨论
本研究揭示高温与高BC浓度共存的协同加强效应,对应总呼吸系统和下呼吸道感染发病峰值,与先前国内外相关研究一致[17,36].而BC对上呼吸道感染的影响则在低温段更显著,即二者存在叠加影响,这一点在之前研究中并未提及.一般除婴幼儿外,人群上呼吸道感染风险均是在低温环境下更高[32].此外,通过气温与BC的三维交互效应模型可直观获知,发病变化对气温的响应强于BC,即气温作为影响健康和舒适度最主要的气候因子,仍居于主导地位,BC在其基础上起叠加作用.此外,污染物与气象条件对健康的交互作用依然是目前研究的重难点之一,国内外学者也开展了系列探索[28,36],但由于几类条件间的复杂关系,叠加不一致的时滞影响,其量化关系和具体交互机制尚不清晰.研究的差异一方面来自区域环境和气候、医疗水平、基础设施等的差异,数据量及分析方法差异也会有显著影响[21].
3.4 局限性说明
本研究存在一些局限性.首先,由于我国医疗数据的获取难度大,时空覆盖范围相对有限,近几年较新的疾病数据尚未获得,因此无法直接比较“大气十条”执行前后BC的健康影响程度.其次,由于将有限的代表站观测数据作为污染物暴露指标,在个体暴露水平上难免会出现一定偏差,这也是相关流行病学研究面临的共性问题[37].再者,由于BC与PM2.5之间的高度相关性,统计学方法尚没有有效手段分离单个污染物的独立作用,结果可能存在一定的偏差.
4 结论
4.1 呼吸系统疾病的最低风险阈值温度约24~26℃,其两侧的气温-发病风险关联性曲线呈反向变化,低温的总体累积滞后影响强于高温.
4.2 BC可诱发呼吸系统疾病即时性风险,一般在3d内消失;BC浓度每升高四分位数,总呼吸系统疾病、上感、下感的超额发病风险分别为1.97%、2.64%和1.34%,总体高于北京市呼吸系统疾病的超额死亡风险(1.8%).
4.3 每单位BC升高诱发的少儿组(£14岁)呼吸系统发病风险显著高于成人组(15~59岁)和老年组(³60岁),需引起高度重视、并采取相应防护措施.
4.4 BC的急性影响与呼吸道感染部位和气温水平紧密相关,在气温高于阈值水平时,BC关联的下感风险显著高于上感;而气温低于阈值时,BC诱发的上、下呼吸道感染风险相当.
[1] Battye W, Boyer K, Pace T G. Methods for Improving Global Inventories of Black Carbon and Organic Carbon Particulates [J]. Journal of Geophysical Research, 2002.https://www. earthjustice.org/ sites/default/files/black-carbon/battye-and-boyer-2002-1.pdf. Accessed 15May 2020.
[2] Luben T J, Nichlis J L, Dutton S J, et al. A systematic review of cardiovascular emergency department visits, hospital admissions and mortality associated with ambient black carbon [J]. Environment International, 2017,107:154-162.
[3] Cohen A J, Brauer M, Burnett R, et al. Estimates and 25-year trends of the global burden of disease attributable to ambient air pollution: an analysis of data from the global burden of diseases study 2015 [J]. The Lancet, 2017,389(10082):1907-1918.
[4] Cao G, Zhang X, Zheng F. Inventory of black carbon and organic carbon emissions from China [J]. Atmospheric Environment, 2006,40 (34):6516-6527.
[5] Wang Y Y, Li X, Shi Z H, et al. Premature Mortality Associated with Exposure to Outdoor Black Carbon and Its Source Contributions in China [J]. Resources, Conservation & Recycling, 2021,170.
[6] 朱晓晶,钱 岩,李晓倩,等.黑碳气溶胶的研究现状:定义及对健康、气候等的影响[J]. 环境科学研究, 2021,34(10):2536-2546
Zhu X J, Qian Y, Li X Q, et al. Research Status of Black Carbon Aerosol: Definitions and Impacts on Health, Climate and Other Welfare [J]. Research of Environmental Sciences, 2021,34(10):2536- 2546.
[7] Prins S D, Dons E, Poppel M V, et al. Airway oxidative stress and inflammation markers in exhaled breath from children are linked with exposure to black carbon [J]. Environment International, 2014,73:440-446.
[8] Paunescu AC, Casas M, Ferrero A, et al. Associations of black carbon with lung function and airway inflammation in schoolchildren [J]. Environment International, 2019,131:104984.
[9] Rabito F A, Yang Q, Zhang H, et al. The association between short-term residential black carbon concentration on blood pressure in a general population sample [J]. Indoor Air, 2020,30(4):767-775.
[10] Eline B P, Tijs L, Bianca C, et al. Short-term fluctuations in personal black carbon exposure are associated with rapid changes in carotid arterial stiffening [J]. Environment International, 2016,88:228-234.
[11] Liang F C, Tian L, Guo Q, et al. Associations of PM2.5and black carbon with hospital emergency room visits during heavy haze events: a case study in Beijing, China [J]. International Journal of Environmental Research and Public Health, 2017,14(7):300-307.
[12] Bell M L, Ebisu K, Peng R D, et al. Hospital admissions and chemical composition of fine particle air pollution [J]. Am. J. Respir. Crit. Care Med, 2009,179(12):1115-1120.
[13] Ali M U, Siyi L, Yousaf B, et al. Emission sources and full spectrum of health impacts of black carbon associated polycyclic aromatic hydrocarbons (PAHs) in urban environment: A review [J]. Critical Reviews in Environmental Science and Technology, 2021,51(9):857- 896.
[14] Wang L, Bao S, Liu X, et al. Low-dose exposure to black carbon and cadmium significantly induce lung injury by promoting cellular apoptosis [J]. Ecotoxicology and Environmental Safety, 2021,224.
[15] Kim J J, Smorodinsky S, Lipsett M, et al. Traffic-related air pollution near busy roads: the East Bay Children's Respiratory Health Study [J]. Am J Respir Crit Care Med, 2004,170(5):520-6.
[16] Niranjan R, Thakur A K. The toxicological mechanisms of environmental soot (black carbon) and carbon black:focus on oxidative stress and inflammatory pathways [J]. Front Immunol, 2017, 8:763.
[17] 张 莹,辛金元,张小玲,等.北京市气温与黑碳和PM2.5对疾病死亡影响的交互效应[J]. 中国环境科学, 2020,40(7):3179-3187.
Zhang Y, Xin J Y, Zhang X L, et al. Interaction effects between ambient temperature and black carbon and PM2.5on mortality in Beijing [J]. China Environmental Science, 2020,40(7):3179-3187.
[18] 欧奕含,张小玲,张 莹,等.西安市BC、PM2.5和气温及协同作用对心脑血管疾病死亡的影响[J]. 中国环境科学, 2021,41(9):4415- 4425.
Ou Y, Zhang X, Zhang Y, et al. Influence of BC, PM2.5, temperature and their synergy on death from cardiovascular diseases in Xi'an [J]. China Environmental Science, 2021,41(9):4415-4425.
[19] 孙允宗,李丽萍,周脉耕.气温对中国五城市居民死亡率的滞后影响分析[J]. 中华预防医学杂志, 2012,46(11):1015-1019.
Sun Y, Li L, Zhou M. Analysis of the lag-effects of temperature on the five cities' mortality in China [J]. Chinese Journal of Preventive Medicine, 2012,46(11):1015-1019.
[20] Gasparrini A, Guo Y, Hashizume M, et al. Mortality risk attributable to high and low ambient temperature: a multi-country observational study [J]. The Lancet, 2015,386(9991):369-375.
[21] Rainham D, Smoyer-Tomic KE. The role of air pollution in the relationship between a heat stress index and human mortality in Toronto [J]. Environmental Research, 2003,93(1):9-19.
[22] Gasparrini A. Distributed lag linear and non-linear models in R: the package dlnm [J]. J Stat Softw, 2011,43:1-20.
[23] Hastie T, Tibshirani R. Generalized additive models for medical research [J]. Stat Methods Med Res, 1995,4(3):187-196.
[24] Sarnat S E, Winquist A, Schauer JJ, et al. Fine particulate matter components and emergency department visits for cardiovascular and respiratory diseases in the St. Louis, Missouri-Illinois, metropolitan area [J]. Environmental Health Perspectives, 2015,123(5):437- 444.
[25] Magali Hurtado-Díaz, Cruz J C, José L. Texcalac-Sangrador, et al. Short-term effects of ambient temperature on non-external and cardiovascular mortality among older adults of metropolitan areas of Mexico [J]. International Journal of Biometeorology, 2019,(63)12.
[26] 周生贤.全力落实《大气十条》让人民群众享有更多蓝天白云——在中国环境与发展国际合作委员会二○一三年年会上的讲话[J]. 环境污染与防治, 2013,35(11):1-3.
Zhou S. Fully implement the "Airborne Pollution Action Plan" and let the public enjoy more blue sky and white clouds -- Speech at the 2013 annual meeting of China International Cooperation Committee on environment and development [J]. Environmental Pollution & Control, 2013,35(11):1-3.
[27] Gong T Y, Sun Z B, Zhang X L, et al., Associations of black carbon and PM2.5with daily cardiovascular mortality in Beijing, China [J]. Atmospheric Environment, 2019,214:116876.
[28] Wang X, Chen R, Meng X, et al. Associations between fine particle, coarse particle, black carbon and hospital visits in a Chinese city [J]. Science of The Total Environment, 2013,458-460:1-6.
[29] https://www.who.int/emergencies/ten-threats-to-global-health-in-2019.
[30] Oppenheimer M, M Campos, R Warren, et al. Emergent risks and key vulnerabilities. Climate Change 2014: Impacts, Adaptation, and Vulnerability. Cambridge University Press, Cambridge, 1039-1099.
[31] Dereje N. Global burden of 369 diseases and injuries in 204 countries and territories, 1990~2019: a systematic analysis for the Global Burden of Disease Study 2019 [J]. The Lancet, 2020,396.
[32] 马 盼,王式功,尚可政,等.气象舒适条件对呼吸系统疾病的影响[J]. 中国环境科学, 2018,38(1):374-382.
Ma P, Wang S, Shang K, et al. The impact of meteorological comfort conditions on respiratory disease [J]. China Environmental Science, 2018,38(1):374-382.
[33] Ghio A J, Carraway M S, Madden M C. Composition of Air Pollution Particles and Oxidative Stress in Cells, Tissues, and Living Systems [J]. Journal of Toxicology and Environmental Health (Part B), 2012, 15(1):1-21.
[34] 郜 鑫,尚 静,杨敬林,等.黑碳和臭氧处理的黑碳对小鼠遗传损伤的比较研究[J]. 北京大学学报(医学版), 2014,46(3):400-404.
Gao X, Shang J, Yang J, et al. Comparison of genetic damage in mice exposed to black carbon and ozone-oxidized black carbon [J]. Journal of Peking University (Health Sciences), 2014,46(3):400-404.
[35] 汪庆庆,叶云杰,张嘉尧,等.江苏省大气污染物联合暴露对人群死亡风险急性效应的多中心研究[J]. 中华预防医学杂志, 2019,53(1): 86-92.
Wang Q, Ye Y, Zhang J, et al. Multi-site analysis of acute effects of air pollutants combination exposure on mortality in Jiangsu Province, China [J]. Chinese Journal of Preventive Medicine, 2019,53(1):86-92.
[36] Stafoggia M, Schwartz J, Forastiere F, et al. Does temperature modify the association between air pollution and mortality? A multicity case-crossover analysis in Italy [J]. American Journal of Epidemiology, 2008,167(12):1476-1485.
[37] Meng X, Zhang Y, Zhao Z, et al. Temperature modifies the acute effect of particulate air pollution on mortality in eight Chinese cities [J]. Science of the Total Environment, 2012,435(7):215-221.
Acute effects of black carbon on respiratory diseases and the modulating effect of air temperature.
MA Pan1, TIAN Zi-jie1, ZHANG Xiao-ling1,2*, WANG Shi-gong1, YIN Ling3
(1.Plateau Atmosphere and Environment Key Laboratory of Sichuan Province, School of Atmospheric Sciences, Chengdu University of Information Technology, Chengdu 610225, China;2.Chengdu Plain Urban Meteorology and Environment Scientific Observation and Research Station of Sichuan Province, Chengdu 610225, China;3.Chinese PLA General Hospital, Beijing 100853, China)., 2022,42(6):2921~2930
The distributed-lag nonlinear models (DLNMs) and generalized additive models (GAMs) were adopted to reveal the adverse health effects of black carbon (BC) on respiratory emergency room (ER) visits, as well as the potential modifying effect of air temperature. Daily ER visits of respiratory diseases during 2009~2012 in Beijing, daily air pollutants (including BC, PM2.5, SO2, and NO2), and meteorological data covering that period were collected. Moreover, medical data was divided into three sub-groups, including the total respiratory diseases, upper and lower respiratory infections (URI and LRI), respectively. Firstly, we explored the (lag) associations between BC, air temperature and morbidity separately. Secondly, binary interaction models were constructed to explore the synergistic relationship between temperature and BC. Afterwards the effects of BC at varied temperature levels were quantified by hierarchical models. In addition, certain gaseous pollutant (SO2or NO2) was also included to verify the robustness of basic models. The exposure-response relationships between air temperature and respiratory diseases exhibited an overall "V" type, the thresholds were 24℃, 26℃, and 24℃, respectively for total respiratory diseases, URI, and LRI. The cumulative effects of low temperature were stronger than that of high temperature. BC effect was immediately occurred and lagged for a short-term (within 3days). For each interquartile range (IQR) increase in BC concentration, the corresponding excess risk (ER) of total respiratory disease, URI, and LRI were 1.97%, 2.64%, and 1.34%, respectively. Children (£14years) had the highest excess risk (e.g., total respiratory system, ER=3.40%), while the results were not significant in the elderly group (³60years).Further, the coexistence of BC and SO2may amplify BC effect on respiratory diseases, especially for URI, while the coexistence with NO2mightincrease LRI risk. The nonparametric bivariate-response models showed that, the respiratory risk related to BC increased in a logarithmic manner, and high temperature enhanced BC effect strongly. When temperature exceeding its thresholds, an IQR increments in BC associated with5.55% and 1.27% (>0.05) increase of URI and LRI morbidity, respectively.Whereas the ERs were both approximated 0.55% for both URI and LRI under temperatures lower than the thresholds. In a word, the acute effects of BC on respiratory disease were closely related to infection sites and air temperature levels, differentiations among agegroups were also revealed.
black carbon;air temperature;respiratory tract infection;acute effect;interaction
X503.1
A
1000-6923(2022)06-2921-10
马 盼(1990-),女,甘肃定西人,讲师,博士,主要从事气象环境与人类健康方面研究.发表论文20余篇.
2021-11-17
国家重点研发计划项目(2016YFA0602004);北京市科技计划项目(Z201100008220002);四川省科技计划项目(21ZYZF-S-01);商洛气候适应型城市重点实验室基金(SLSYS2019004);攀枝花市科学技术局创新中心建设项目(2021ZX-5-1);成都信息工程大学大创项目(S202010621002X)
* 责任作者, 教授, xlzhang@ium.cn
