PM10短期暴露对人群空腹血糖和血脂的影响
2022-06-29贺颖倩王敏珍赵亚楠张露露白亚娜
贺颖倩,王敏珍,郑 山,赵亚楠,张露露,刘 婧,白亚娜
PM10短期暴露对人群空腹血糖和血脂的影响
贺颖倩,王敏珍*,郑 山,赵亚楠,张露露,刘 婧,白亚娜
(兰州大学公共卫生学院,流行病与卫生统计学研究所,甘肃 兰州 730000)
为探析PM10短期暴露对不同糖代谢水平人群空腹血糖和血脂的影响,以“金昌队列”为研究平台,收集金昌市2011~2017年污染物数据及气象数据.采用近邻模型完成个体PM10暴露评估.运用广义估计方程分析PM10对血糖和血脂指标的影响.采用广义相加混合模型绘制暴露-反应关系曲线.结果表明,PM10浓度每增加一个四分位数间距,空腹血糖(FPG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)分别升高0.58mg/dL(95%CI:0.35,0.82)、0.38mg/dL(95%CI:0.25,0.52)、0.44mg/dL(95%CI:0.31,0.57)和0.34mg/dL(95%CI:0.29,0.40),甘油三酯(TG)降低0.67mg/dl(95%CI:-0.86,-0.47).随着PM10浓度升高,FPG、TC、LDL-C和HDL-C均呈上升趋势,TG呈下降趋势. PM10对男性、年龄≥60岁者血糖和血脂指标影响更显著.因此,PM10与不同糖代谢状态人群血糖和血脂水平异常密切相关,男性和老年人应加强自身防护.
PM10;2型糖尿病;空腹血糖;血脂
随着社会经济的发展,生活方式的改变和人口老龄化,糖尿病已经成为威胁人类生命健康的重要公共卫生问题之一.国际糖尿病联合会(IDF)数据[1]显示,2021年全球约5.37亿成年人(20~79岁)患有糖尿病,预计到2030年该数字将上升至6.43亿,到2045年将上升至7.83亿;中国糖尿病现患人数为1.409亿,位居世界第一.近年来有研究发现,大气颗粒物暴露可增加糖尿病患病率、发病率和死亡率[2-5].考虑到糖尿病是一种典型的慢性代谢性疾病,血脂和血糖水平异常与其发病密切相关[6-7].因此从这两个方面探讨大气颗粒物暴露对糖尿病影响的作用机制具有一定的生物学意义.美国一项研究显示PM10暴露可导致总胆固醇(Total cholesterol,TC)、甘油三酯(Triglyceride,TG)和低密度脂蛋白胆固醇(Low density lipoprotein cholesterol, LDL-C)显著升高[8].泰国一项队列研究结果表明,长期暴露于PM10与LDL-C、空腹血糖(Fasting plasma glucose, FPG)呈正相关,与高密度脂蛋白胆固醇(High density lipoprotein cholesterol, HDL-C)呈负相关[9].目前对于空气污染与血糖和血脂关联的纵向研究相对有限,且大多是在发达国家及我国东部地区进行,而我国西部地区此类研究相对较少.
金昌市位于中国西北干旱和半干旱区,属大陆性温带干旱气候,常年受沙尘暴天气影响,其地形地貌复杂,南北海拔差达3000多米,气候差异较大[10];
此外,金昌市因矿兴企,金川集团公司镍产量占全国90%以上,该市是以金川集团公司为依托而发展起来的新型矿业城市,且生产区紧邻生活区[11].因此,金昌市因自然环境、地理特征和工业污染等因素,其空气污染问题较为突出.2005~2016年,金昌市首要空气污染物从SO2转变为PM10,2010~2014年, PM10年均浓度值超过国家二级空气质量标准, 2005~2016年间PM10浓度总体呈上升趋势[11-12].
“金昌队列”是以甘肃省金昌市金川集团股份有限公司5万职工为基础建立的大样本前瞻性队列[13].该队列人群2型糖尿病和糖尿病前期粗患病率分别为8.5%和21.2%,是影响该人群健康的重要疾病之一.因此,本研究将依托“金昌队列”平台,开展大气PM10暴露对人群血糖和血脂指标的影响研究,为进一步揭示PM10致糖尿病的作用机制提供数据支撑.
1 资料与方法
1.1 研究对象
“金昌队列”于2011~2013年完成基线调查,随后每两年进行一次随访.本研究以该队列2011~ 2017年纳入的人群为研究对象,剔除家庭住址信息不完整及糖脂代谢指标缺失者,最终纳入52274人次,其中基线纳入24285人,第一次随访纳入21703人,第二次随访纳入6286人.本研究由兰州大学公共卫生学院伦理委员会批准(伦理批准代码:2017-01).
1.2 现场调查
1.2.1 流行病学调查 采用自行设计的结构化调查问卷,由统一培训的调查员在获得研究对象知情同意后,以面对面访谈形式开展调查.主要信息包括一般人口社会学特征(性别、年龄、职业、婚姻状况、文化程度、家庭收入等)、生活行为习惯(吸烟、饮酒、体育锻炼等)、既往疾病史(心脑血管疾病史、癌症史和内分泌代谢性疾病史)及疾病家族史等.
1.2.2 健康体检与生化指标检测 研究对象体格检查与生化指标检测由金川公司职工医院专业人员完成.在体检当天采集研究对象空腹静脉血,由Hitachi日立公司全自动生化分析仪(型号:7600-020)对FPG、TC、TG、LDL-C、HDL-C指标进行检测.
1.3 环境数据来源
1.3.1 大气污染和气象要素 数据来源从金昌市环境监测站收集四个环境监测站点(新川苑、运输部、市科委和公司二招)2011年1月1日~2017年12月31日逐日PM10、SO2和NO2地面监测数据;同时从金昌市气象局采集同期气象观测数据,包括最高气温、最低气温、日平均气温、相对湿度等.采用环境监测站邻近点均值对缺失数据进行填补.以研究对象健康体检时间为匹配变量,匹配体检时间前7d大气污染物及气象要素数据的平均值.
图1 金昌市4个环境污染物监测站点和研究对象家庭住址地理分布
1.3.2 个体PM10暴露水平估计 本研究应用近邻模型来评估个体暴露水平,该模型的原理是根据个体住宅最近监测点测量的空气污染水平来评估个体暴露水平[14-15].根据每一位研究对象家庭住址以及金昌市4个环境监测站点位置,应用Google地图软件批量查询每个研究对象居住地点以及4个监测站点所处经纬度,利用ArcGIS10.3软件分别计算每个研究对象居住点与4个监测点的距离,选择距离研究对象最近的监测站点,然后依次匹配环境监测数据,如果在最近的监测站点未获得相关测量数据,则从第2相近的站点检测,直到获得确切监测数据来评估个体污染物的暴露[16].研究对象与监测点的分布情况如图1.
1.4 疾病诊断标准
糖尿病:根据美国糖尿病协会指南[17],将FPG³7.0mmol/L或自述临床诊断为糖尿病(需要患者提供具体诊断医院)或正在使用降糖类药物定义为2型糖尿病.将空腹血糖受损(5.6mmol/L£FPG< 7.0mmol/L)定义为糖尿病前期.
高血压:根据《中国高血压防治指南(2018修订版)》[18],将高血压定义为在未服用任何降压药物的情况下,收缩压(SBP)³140mmHg和(或)舒张压(DBP)³90mmHg;或自述既往有高血压病史;或正在服用降压药物.
血脂异常:根据《中国成人血脂异常防治指南(2016年修订版)》[19], TC³5.18mmol/L,TG³1.70mmol/L,LDL-C³3.37mmol/L,HDL-C<1.04mmol/L,以及自述临床诊断为血脂异常,符合以上任何一项即诊断为血脂异常.
1.5 统计学分析
采用广义估计方程(Generalized estimating equations, GEE)纵向分析PM10短期暴露对血糖、血脂指标的效应[20].模型1:纳入年龄和性别因素;模型2:在模型1基础上纳入婚姻状况、文化程度、家庭人均月收入、职业、吸烟饮酒状况、体育锻炼、高血压、BMI、蔬菜水果摄入情况、糖尿病家族史、血脂异常家族史、降脂(糖)药使用情况、血脂(TC、TG、LDL-C和HDL-C,对血糖的影响)/ FPG(对血脂指标的影响)因素;模型3:模型2基础上纳入SO2、NO2、平均气温、平均相对湿度和季节因素.根据赤池信息准则(Akaikes information criterion,AIC),采用自由度为4的自然样条函数调整模型3中的平均气温及平均相对湿度从而控制其非线性影响[21].运用广义相加混合模型(Generalized additive mixed model, GAMM) ,调整混杂因素后绘制PM10与血糖和血脂指标间的暴露-反应关系曲线[22].此外,按照性别和年龄进行分层分析.
数据分析采用SPSS24.0及R3.6.1软件.采用双侧检验,检验水准为=0.05.
2 结果
2.1 基线特征
本研究共纳入基线人群24285人,其中血糖正常17502人、糖尿病前期4717人、2型糖尿病患者2066人.糖尿病患者中男性1432人(占69.31%),女性634人(占30.69%).血糖正常、糖尿病前期与糖尿病患者平均年龄为(47.96±8.11),(51.81±8.84),(55.19±8.34)岁,平均BMI分别为(23.77±5.61),(25.22±6.69),(25.81±7.80)kg/m2,差异有统计学意义.三类人群家庭人均月收入在5000元以下、文化程度在初中及以下、职业为工人的占比较高;糖尿病患者吸烟、饮酒、有糖尿病家族史以及患高血压比例分别为55.52%、31.56%、22.60%和58.28%,均高于血糖正常与糖尿病前期人群,差异有统计学意义(<0.001).FPG、TC、TG、LDL-C和HDL-C在血糖正常者的平均值分别为89.42,85.21,32.25,52.88, 25.10mg/dL,在糖尿病前期人群中为107.13,87.99, 37.64,51.31,23.64mg/dL,在糖尿病人群中为163.84, 87.69,45.39,50.03,21.88mg/dL(表1).
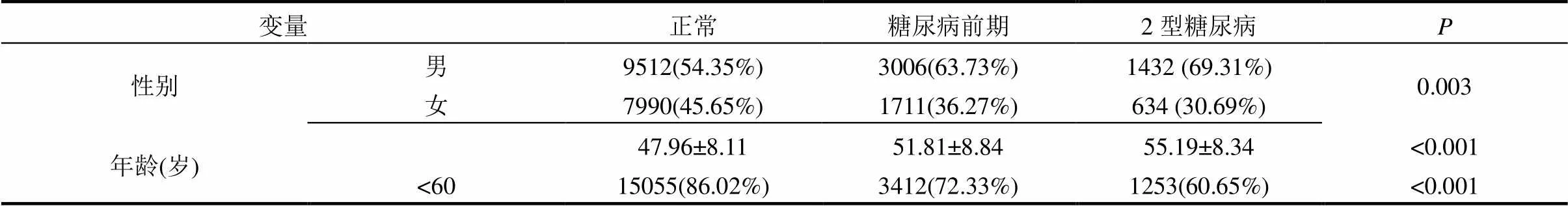
表1 基线不同糖代谢水平人群的基本特征

续表1

2.2 PM10对血糖、血脂的影响
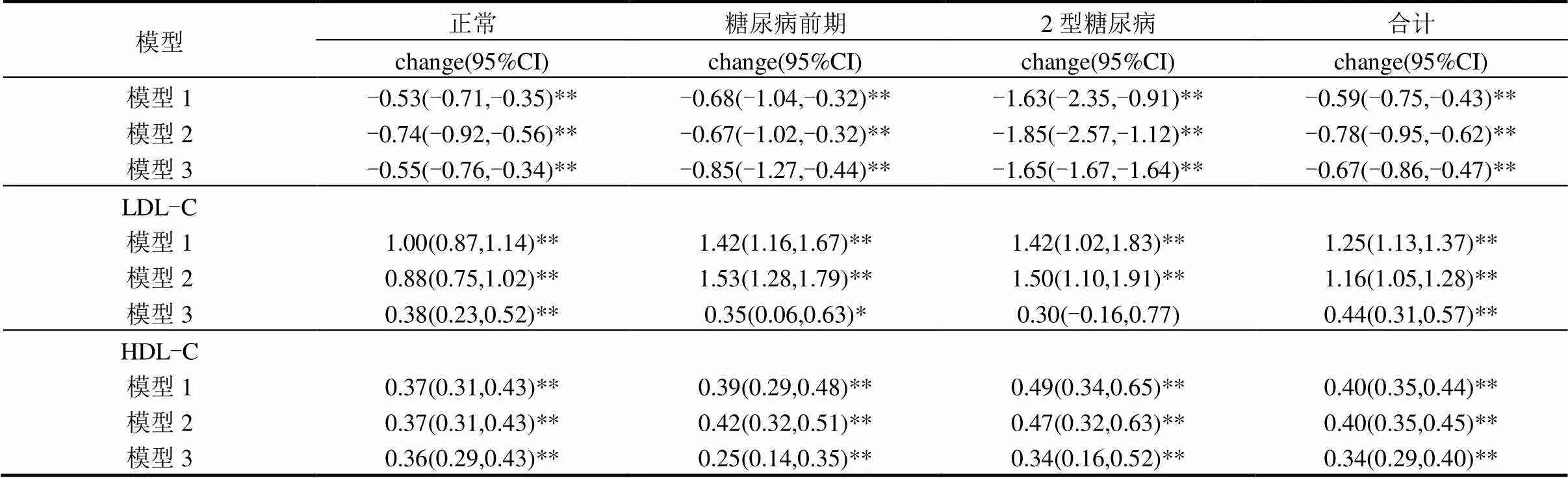
如表2所示,PM10可使人群FPG、TC、LDL-C和HDL-C水平升高,TG水平下降.调整混杂因素后,PM10浓度每增加一个四分位数间距(Inter-quartile range,IQR),总人群FPG、TC、LDL-C和HDL-C分别升高0.58mg/dL (95%CI:0.35,0.82)、0.38mg/dL (95%CI:0.25,0.52)、0.44mg/ dL(95%CI: 0.31,0.57)和0.34mg/dL(95%CI:0.29,0.40),而TG降低0.67mg/dL (95%CI:-0.86,-0.47).
暴露-反应关系图显示,在调整混杂因素后,总人群与血糖正常人群中,随着PM10浓度的升高, FPG、TC、LDL-C和HDL-C呈上升趋势,TG呈下降趋势,且PM10对TC的暴露-反应关系曲线存在阈值,在PM10浓度为400μg/m3,TC出现较明显拐点;糖尿病前期人群中,TC、LDL-C和HDL-C呈上升趋势,TG呈下降趋势;糖尿病人群中,FPG、LDL-C和HDL-C呈上升趋势,TG呈下降趋势.

表2 PM10浓度每增加一个四分位数间距与血糖和血脂变化的关系
续表2
注:模型1:调整年龄、性别;模型2:模型1+婚姻、文化程度、家庭人均月收入、职业、吸烟饮酒、锻炼、BMI、蔬菜水果摄入情况、高血压、糖尿病家族史、血脂异常家族史、降脂(糖)药使用情况、血脂(对血糖的影响)/FPG(对血脂的影响);模型3:模型2+气温、湿度、NO2、SO2和季节.*<0.05,**<0.001. change: PM10浓度每增加一个IQR, FPG,TC,TG,LDL-C和HDL-C变化情况.
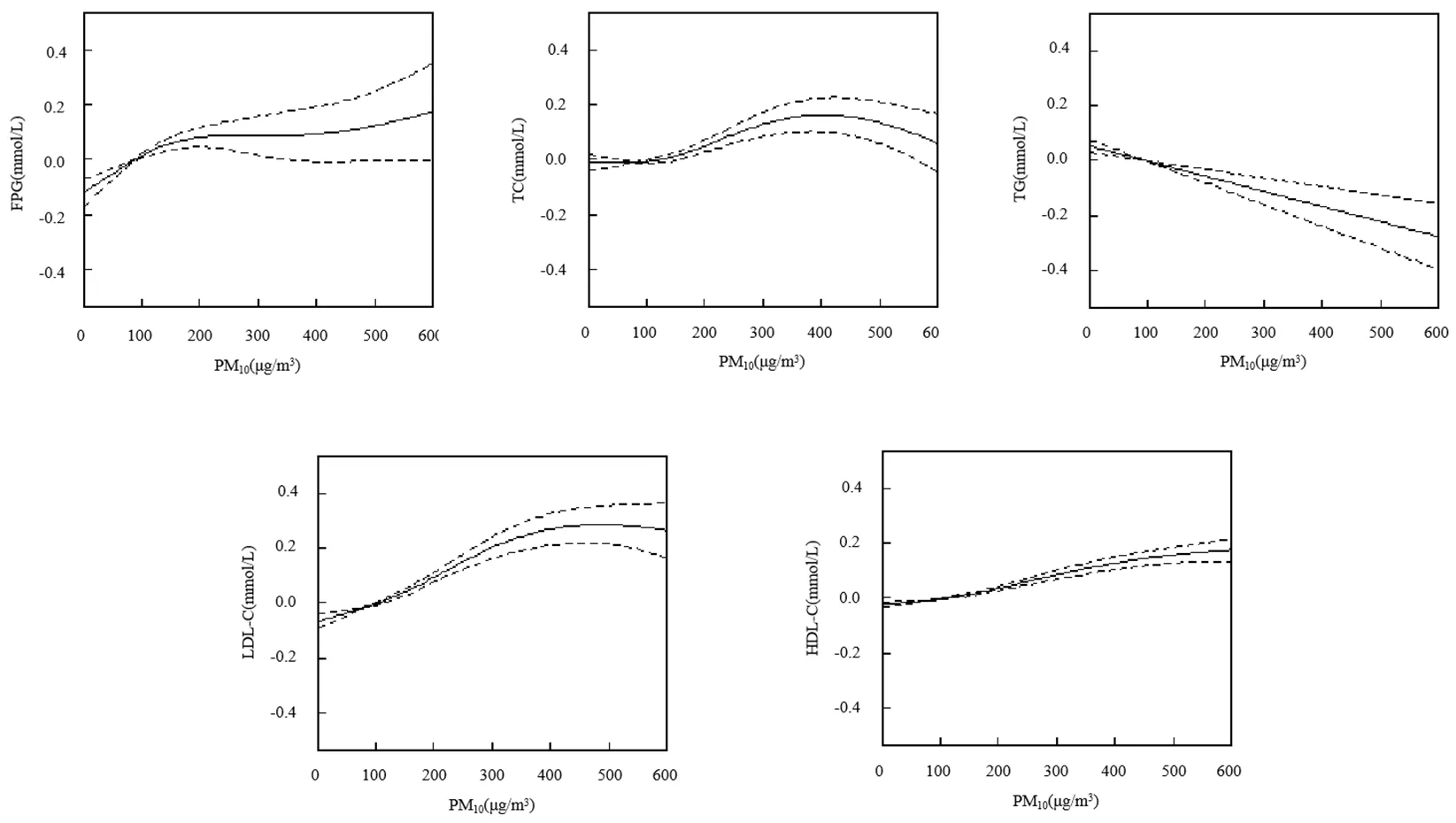
图2 PM10与总人群血糖和血脂的暴露反应关系
调整因素同表2模型3

图3 PM10与血糖正常人群血糖和血脂的暴露反应关系
调整因素同表2模型3

图4 PM10与糖尿病前期人群血糖和血脂的暴露反应关系
调整因素同表2模型3
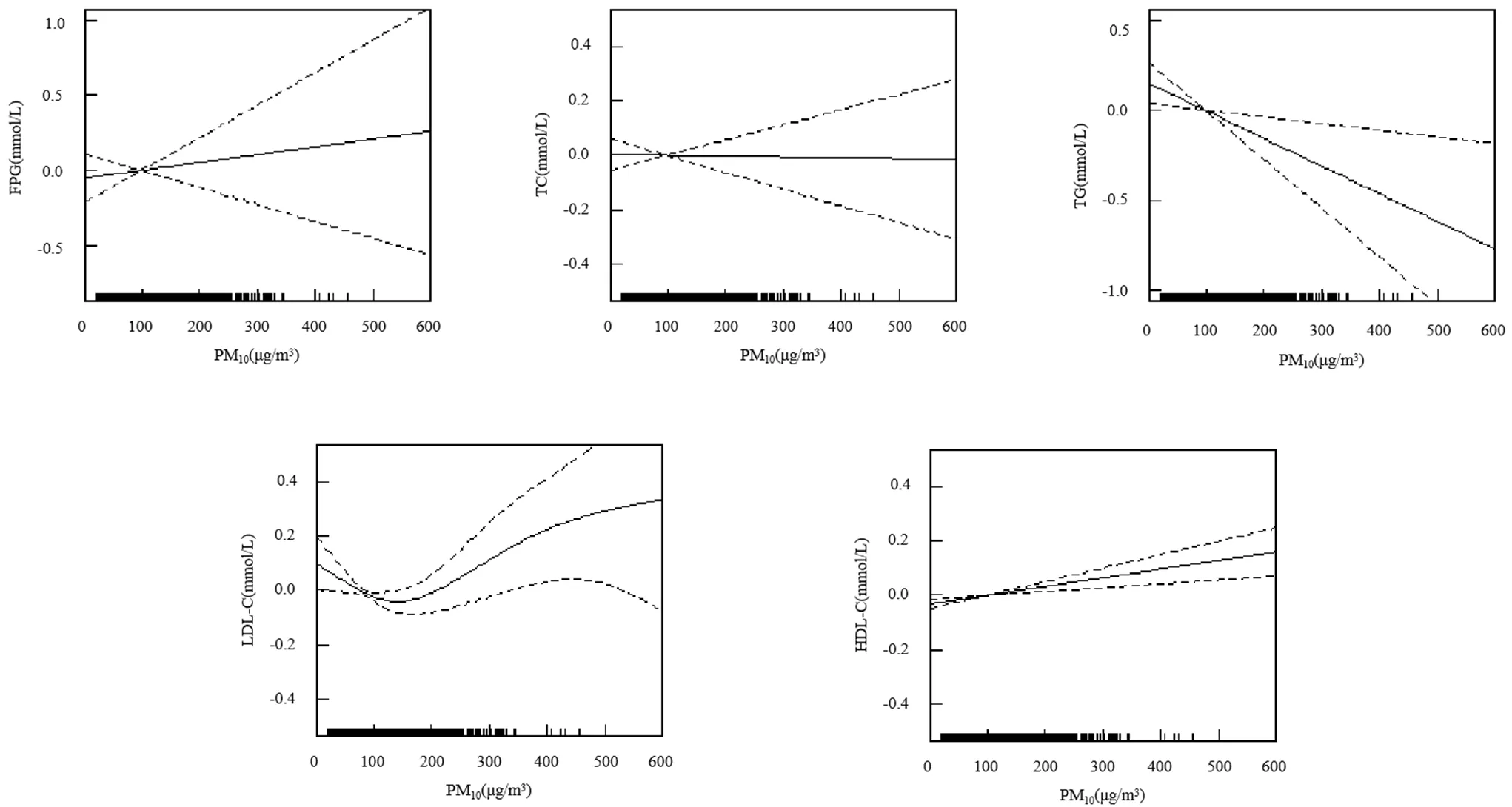
图5 PM10与糖尿病人群血糖和血脂的暴露反应关系
调整因素同表2模型3
2.3 亚组分析
性别分层分析显示,调整潜在混杂因素后, PM10浓度每增加一个IQR,男性人群FPG、TC、LDL-C和HDL-C分别升高0.58mg/dL(95%CI: 0.23, 0.92)、0.37mg/dL(95%CI:0.19,0.54)、0.51mg/ dL(95%CI: 0.35, 0.68)和0.35mg/dL(95%CI:0.28, 0.41), TG降低0.80mg/dL(95%CI:-1.08%,-0.52%);女性人群FPG、TC、LDL-C和HDL-C分别升高0.54mg/dL(95%CI:0.26,0.82)、0.42mg/dL(95%CI: 0.20,0.64)、0.27mg/dL(95%CI:0.07,0.47)和0.30mg/ dL(95%CI:0.21,0.39),TG则降低0.40mg/dL(95%CI: -0.63,-0.18)(表3).
年龄分层分析显示:调整潜在混杂因素后,PM10浓度每增加一个IQR,年龄<60岁人群FPG、TC、LDL-C和HDL-C分别升高0.58mg/dL(95%CI:0.33, 0.83)、0.22mg/dL(95%CI:0.08,0.36)、0.19mg/dL (95%CI:0.05,0.32)和0.30mg/dL(95%CI:0.24,0.36), TG则降低0.76mg/dL(95%CI:-0.98,-0.55);年龄³60岁人群TC、LDL-C和HDL-C分别升高0.96mg/dL (95%CI:0.56,1.36)、0.66mg/dL(95%CI:0.31,1.01)和0.39mg/dL(95%CI:0.25,0.52),FPG与TG的变化无统计学意义(表3).

表3 PM10浓度每增加一个四分位间距与不同亚组人群血糖和血脂变化的关系
注:调整因素同表2模型3;*<0.05,**<0.001,#:亚组间差异有统计学意义. change: PM10浓度每增加一个IQR, FPG,TC,TG,LDL-C和HDL-C变化情况.
3 讨论
本研究以金昌队列人群为研究对象,采用纵向研究揭示了PM10短期暴露可引起不同血糖代谢状态人群空腹血糖和血脂水平紊乱,其中与FPG、TC、LDL-C及HDL-C呈正相关,与TG呈负相关,男性和³60岁者易感性较高.
3.1 PM10可导致人群血糖和血脂水平异常
我国一项基于开滦队列的研究数据表明,PM10浓度每增加100μg/m3,FPG增加0.11mmol/L (95% CI: 0.07,0.15)[20];欧洲Lifelines队列研究结果显示,PM10浓度与FPG水平升高显著相关[23];这与本研究结果一致.台湾一项研究表明,PM10每增加一个IQR,TG升高2.96mg/dL(95%CI:-0.07,5.99), HDL-C降低0.90mg/dL(95%CI:-1.46,-0.34)[24].河南省农村的一项队列研究表明,较高浓度的PM10暴露导致 TC和LDL-C升高,使TG和HDL-C降低[25].伊朗一项研究结果显示,空气质量指数(AQI)与TC、LDL-C和TG呈显著正相关,与HDL-C呈负相关[26].以色列南部的一项回顾性队列研究发现,PM10中期暴露致使FPG升高0.30%(95%CI:0.15,0.45),LDL-C升高2.32%(95%CI:2.15,2.49),TG升高0.23% (95%CI: 0.02,0.42),HDL-C降低1.13%(95%CI:-1.23,-1.03);但急性暴露于PM10与FPG、TG、LDL-C及HDL-C之间没有关联[27].一项对儿童和青少年的研究表明,PM10暴露与TC、HDL-C水平呈正相关[28].交通相关污染物与LDL-C和TG之间有显著正向关联[29].以上研究在TC与LDL-C的变化趋势上与本研究结果一致,但TG与HDL-C的变化存在差异.
空气污染导致血糖和血脂指标异常的生物学机制尚不十分清楚,但有研究提出了以下几种可能的途径.一些研究表明,吸入空气颗粒物会引发炎症反应、氧化应激及自主神经失衡,进而影响胰岛素抵抗水平、脂质代谢及氧化,最终导致血脂代谢紊乱和高血糖[26,30-33].实验研究也发现空气污染物还可能通过降低DNA甲基转移酶的活性而导致异常的 DNA甲基化,从而影响脂质代谢与炎症反应[34-35].
3.2 不同血糖代调整混杂因素后,谢状态对PM10暴露效应存在差异
本研究发现,调整混杂因素后,血糖正常人群中PM10暴露对血糖及血脂指标均有影响,糖尿病前期人群中PM10与FPG无关联,糖尿病人群中PM10对FPG、TG和LDL-C的效应均无统计学意义;NHIS-NSC队列研究表明[36],PM2.5暴露对FPG或LDL-C水平异常者的FPG和LDL-C影响无统计学意义,但在指标正常者中PM2.5与FPG和LDL-C水平显著相关.可能是因为糖尿病前期及糖尿病人群存在不同程度糖代谢与脂代谢紊乱,从而对外环境暴露的敏感性降低.
3.3 男性和老年人的易感性较高
男性、年龄≥60岁者更容易受到PM10的不良影响.相关队列研究meta分析结果显示,长期暴露于空气污染中,女性患2型糖尿病的风险高于男性[37].石家庄一项研究结果表明,在老年人群中空气污染对血脂水平异常的影响更明显[38].美国一项研究表明,年龄没有显著改变 PM10与TC、TG的关联,PM10与TG和TC相关性在男性中更强[8].Sørensen等[39]研究发现,在年龄和性别分层分析中,PM2.5对TC的影响没有差异.由此可见,大气颗粒物暴露对不同性别和年龄人群的影响存在异质性.男性不良健康生活方式的暴露相比女性更加显著,如吸烟、饮酒、缺乏锻炼、摄入高糖、高脂的食物等,这可能会引发全身炎症和氧化应激[40];此外,本研究中男性工人占比较高,工人从事重体力活动可增加肺活量,在相同的环境浓度下,体力活动者的肺组织对颗粒物的暴露水平更高.老年人群的生理机能不断退化,代谢性疾病、心血管疾病与呼吸系统疾病患病率高,因此更易受到空气污染的影响;此外,老年人群的某些社会学特征能间接影响空气污染物的健康效应,研究显示[41],老年人因缺乏健康素养,导致医疗卫生服务利用水平较低,可能会加剧空气污染物对血脂和血糖代谢的不利影响.
3.4 局限性
尽管本研究基于大样本队列人群,探讨短期暴露于大气PM10对人群血糖和血脂的影响,发现了有意义的研究结果,但仍存在一定的局限性,首先,未纳入PM2.5与O3作为混杂因素.其次,因为空气污染数据收集的局限性,没有考虑人群流动性所造成的暴露,只是根据个体住宅最近监测点测量的空气污染水平来评估个体暴露水平,无法测量工作环境和室外活动的颗粒物暴露,这可能导致PM10的健康效应被低估,需要在未来实施进一步的研究.最后,尽管本研究调整了潜在混杂因素,但是仍存在一些无法衡量的残余混杂,包括绿化状况、交通相关污染物和噪声暴露等.
4 结论
4.1 大气PM10每增加一个四分位数间距,可导致总人群FPG、TC、LDL-C及HDL-C分别升高0.58mg/dL、0.38mg/dL、0.44mg/dL和0.34mg/dL,TG降低0.67mg/dL;血糖正常人群FPG、TC、LDL-C及HDL-C分别升高0.22mg/dL、0.33mg/dL、0.38mg/dL和0.36mg/dL,TG降低0.55mg/dL;糖尿病前期人群TC、LDL-C及HDL-C分别升高0.40mg/ dL、0.35mg/dL和0.25mg/dL,TG降低0.85mg/dL;糖尿病人群HDL-C升高0.34mg/dL,TG降低1.65mg/dL.
4.2 性别与年龄分层分析结果提示,男性、年龄>60岁者对PM10暴露较为敏感.
4.3 暴露-反应关系曲线表明,随着PM10浓度升高,FPG、TC、LDL-C及HDL-C呈上升趋势,TG呈下降趋势.因此,加强环境保护和治理,减轻空气污染对人体的危害,降低与空气污染有关的糖尿病发病率具有重要意义.
[1] IDF Diabetes Atlas: Diabetes around the world in 2021. International Diabetes Federation [EB/OL]. http://www.diabetesatlas.org/,[2021- 12-06/2022-04-11].
[2] Eze I C, Schaffner E, Fischer E, et al. Long-term air pollution exposure and diabetes in a population-based Swiss cohort [J]. Environment International, 2014,70:95-105.
[3] Strak M, Janssen N, Beelen R, et al. Long-term exposure to particulate matter, NO2and the oxidative potential of particulates and diabetes prevalence in a large national health survey [J]. Environment International, 2017,108:228-236.
[4] Liu C, Yang C, Zhao Y, et al. Associations between long-term exposure to ambient particulate air pollution and type 2 diabetes prevalence, blood glucose and glycosylated hemoglobin levels in China [J]. Environment International, 2016,92-93:416-421.
[5] Liang F, Yang X, Liu F, et al. Long-term exposure to ambient fine particulate matter and incidence of diabetes in China: A cohort study [J]. Environment International, 2019,126:568-575.
[6] Cui J, Sun J, Wang W, et al. The association of triglycerides and total cholesterol concentrations with newly diagnosed diabetes in adults in China [J]. Oncotarget, 2017,8(61):103477-103485.
[7] Moro E, Gallina P, Pais M, et al. Hypertrigly ceridemia is associated with increased insulin resistance in subjects with normal glucose tolerance: Evaluation in a large cohort of subjects assessed with the 1999 World Health Organization criteria for the classification of diabetes [J]. Metabolism, 2003,52(5):616-619.
[8] Shanley R P, Hayes R B, Cromar K R, et al. Particulate air pollution and clinical cardiovascular disease risk factors [J]. Epidemiology, 2016,27(2):291-298.
[9] Paoin K, Ueda K, Vathesatogkit P, et al. Long-term air pollution exposure and serum lipids and blood sugar: A longitudinal cohort study from the electricity generating authority of Thailand study [J]. Atmospheric Environment, 2021,236:113790.
[10] 冉利群.金昌市人居环境空气质量评价及预测研究[D]. 兰州:兰州大学, 2013.
Ran L Q. The assessment and prediction of living environmental air quality in Jinchang City [D]. Lanzhou: Lanzhou University, 2013.
[11] 王文路.甘肃省城市环境空气质量2005~2014年(10年)变化趋势研究[D]. 兰州:兰州大学, 2016.
Wang W L. The change trend of urban ambient air quality from 2005 to 2014 (10years) in Gansu Province [D]. Lanzhou: Lanzhou University, 2016.
[12] 丁杰萍,张亚群,周 静,等.甘肃省主要城市环境空气质量变化趋势分析研究[J]. 甘肃科技, 2018,34(14):1-4,128.
Ding J P, Zhang Y Q, Zhou J, et al. Trend analysis of environmental air quality in major cities in Gansu Province [J]. Gansu Science and Technology, 2018,34(14):1-4,128.
[13] Bai Y, Yang A, Pu H, et al. Cohort profile: The China metal-exposed workers cohort study (Jinchang cohort) [J]. International Journal of Epidemiology, 2017,46(4):1095-1096e.
[14] Xu X, Hu H, Ha S, et al. Ambient air pollution and hypertensive disorder of pregnancy [J]. Journal of Epidemiology and Community Health, 2014,68(1):13-20.
[15] 曹 蕾,王 婷,王丽君,等.邯郸市妇女空气污染暴露与妊娠期高血压[J]. 中国环境科学, 2021,21(2):161-164.
Cao L, Wang T, Wang L J, et al. Maternal exposure to ambient air pollution and gestational hypertension in Handan [J]. China Environmental Science, 2021,21(2):161-164.
[16] 施 淼,刘超斌,陈晓秋,等.大气可吸入颗粒物暴露致胎儿畸形的病例对照研究[J]. 中华围产医学杂志, 2013,16(4):200-205.
Shi M, Liu C B, Chen X Q, et al. Fetal congenital deformity resulting from ambient inhalable particulate matters: A case-control study [J]. Chinese Journal of Perinatal Medicine, 2013,16(4):200-205.
[17] American Diabetes Association 2. Classification and diagnosis of diabetes: standards of medical care in diabetes-2019 [J]. Diabetes Care, 2019,42(Suppl 1):S13-S28.
[18] 刘力生.中国高血压防治指南(2018年修订版) [J]. 中国心血管杂志, 2019,24(1):24-55.
Liu L S. 2018 Chinese guidelines for the management of hypertension [J]. Chinese Journal of Cardiovascular Medicine, 2019,24(1):24-55.
[19] 诸骏仁,高润霖,赵水平,等.中国成人血脂异常防治指南(2016年修订版) [J]. 中国循环杂志, 2016,31(10):937-953.
Chu J R, Gao R L, Zhao S P. 2016Chinese guidelines for the management of dyslipidemia in adults [J]. Chinese Circulation Journal, 2016,31(10):937-953.
[20] Chen L, Zhou Y, Li S, et al. Air pollution and fasting blood glucose: A longitudinal study in China [J]. Science of The Total Environment, 2016,541:750-755.
[21] Guo P, Feng W, Zheng M, et al. Short-term associations of ambient air pollution and cause-specific emergency department visits in Guangzhou, China [J]. Science of The Total Environment, 2018,613- 614:306-313.
[22] Zhang W, Wang Y, Li W, et al. The Association between the baseline and the change in neutrophil-to-lymphocyte ratio and short-term mortality in patients with acute respiratory distress syndrome [J]. Frontiers in Medicine, 2021,8:636869.
[23] Cai Y, Hansell A L, Blangiardo M, et al. Long-term exposure to road traffic noise, ambient air pollution, and cardiovascular risk factors in the HUNT and lifelines cohorts [J]. European Heart Journal, 2017, 38(29):2290-2296.
[24] Chuang K J, Yan Y H, Cheng T J. Effect of air pollution on blood pressure, blood lipids, and blood sugar: A population-based approach [J]. Journal of Occupational and Environmental Medicine, 2010,52(3): 258-262.
[25] Mao S, Chen G, Liu F, et al. Long-term effects of ambient air pollutants to blood lipids and dyslipidemias in a Chinese rural population [J]. Environmental Pollution, 2020,256(C):113403.
[26] Poursafa P, Mansourian M, Motlagh M E, et al. Is air quality index associated with cardiometabolic risk factors in adolescents? The CASPIAN-III Study [J]. Environmental Research, 2014,134:105-109.
[27] Yitshak Sade M, Kloog I, Liberty I F, et al. The association between air pollution exposure and glucose and lipids levels [J]. The Journal of Clinical Endocrinology and Metabolism, 2016,101(6):2460-2467.
[28] Gui Z H, Yang B Y, Zou Z Y, et al. Exposure to ambient air pollution and blood lipids in children and adolescents: A national population based study in China [J]. Environmental Pollution, 2020,266(Pt 3): 115422.
[29] Bind M A, Peters A, Koutrakis P, et al. Quantile regression analysis of the distributional effects of air pollution on blood pressure, heart rate variability, blood lipids, and biomarkers of inflammation in elderly American men: The normative aging study [J]. Environmental Health Perspectives, 2016,124(8):1189-1198.
[30] Rajagopalan S, Brook R D. Air pollution and type 2diabetes: Mechanistic insights [J]. Diabetes, 2012,61(12):3037-3045.
[31] Bourdrel T, Bind M A, Bejot Y, et al. Cardiovascular effects of air pollution [J]. Archives of Cardiovascular Diseases, 2017,110(11): 634-642.
[32] Yang B Y, Bloom M S, Markevych I, et al. Exposure to ambient air pollution and blood lipids in adults: The 33Communities Chinese Health Study [J]. Environment International, 2018,119:485-492.
[33] Brook R D, Rajagopalan S, Pope C A, et al. Particulate matter air pollution and cardiovascular disease: An update to the scientific statement from the American Heart Association [J]. Circulation, 2010,121(21):2331-2378.
[34] Chen R, Meng X, Zhao A, et al. DNA hypomethylation and its mediation in the effects of fine particulate air pollution on cardiovascular biomarkers: A randomized crossover trial [J]. Environment International, 2016,94:614-619.
[35] Li H, Chen R, Cai J, et al. Short-term exposure to fine particulate air pollution and genome-wide DNA methylation: A randomized, double- blind, crossover trial [J]. Environment International, 2018,120:130- 136.
[36] Shin W Y, Kim J H, Lee G, et al. Exposure to ambient fine particulate matter is associated with changes in fasting glucose and lipid profiles: A nationwide cohort study [J]. BMC Public Health, 2020,20(1):430.
[37] Wang B, Xu D, Jing Z, et al. Effect of long-term exposure to air pollution on type 2diabetes mellitus risk: A systemic review and meta-analysis of cohort studies [J]. European Journal of Endocrinology, 2014,171(5):R173-182.
[38] Zhang K, Wang H, He W, et al. The association between ambient air pollution and blood lipids: A longitudinal study in Shijiazhuang, China [J]. Science of The Total Environment, 2021,752:141648.
[39] Sorensen M, Hjortebjerg D, Eriksen K T, et al. Exposure to long-term air pollution and road traffic noise in relation to cholesterol: A cross-sectional study [J]. Environment International, 2015,85:238- 243.
[40] Lin H, Guo Y, Zheng Y, et al. Long-term effects of ambient PM2.5on hypertension and blood pressure and attributable risk among older chinese adults [J]. Hypertension, 2017,69(5):806-812.
[41] Zhang X, Yu B, He T, et al. Status and determinants of health services utilization among elderly migrants in China [J]. Global Health Research and Policy, 2018,3(6):8.
Effects of short-term exposure to PM10on fasting plasma glucose and blood lipids.
HE Ying-qian, WANG Min-zhen*, ZHENG Shan, ZHAO Ya-nan, ZHANG Lu-lu, LIU Jing, BAI Ya-na
(Institute of Epidemiology and Statistics, School of Public Health, Lanzhou University, Lanzhou 73000, China)., 2022,42(6):2911~2920
This study was designed to explore the effects of short-term exposure to PM10on fasting plasma glucose and blood lipids in population with different glucose metabolism levels based on the platform of "Jinchang Cohort". The pollutant and meteorological data in Jinchang city from 2011 to 2017 were collected. Individual exposure levels were estimated by the nearest neighbor model. Generalized estimating equations were employed to analyze relationships between PM10, blood glucose and blood lipids. The exposure-response relationship curves were drawn by generalized additive mixed model. For every IQR increase in PM10concentration, it was found that FPG, TC, LDL-C and HDL-C increased by 0.58mg/dL (95%CI: 0.35, 0.82), 0.38mg/dL (95%CI: 0.25, 0.52), 0.44mg/dL (95%CI: 0.31, 0.57) and 0.34mg/dL (95%CI: 0.29, 0.40), respectively, TG decreased by 0.67mg/dL (95%CI:-0.86,-0.47). With the increase of PM10concentration, FPG, TC, LDL-C and HDL-C all showed an upward trend, while TG showed a downward trend. The adverse effects of PM10on blood glucose and lipid indicators were greater in male and elder people. Findings suggest that PM10was associated with changed fasting plasma glucose and blood lipid levels among population with different blood glucose states. Male and elder people should pay more attention to personal safety protection.
PM10;Type 2 diabetes;fasting plasma glucose;blood lipid
X503.1
A
1000-6923(2022)06-2911-10
贺颖倩(1998-),女,四川达州人,兰州大学硕士研究生,主要从事环境流行病学研究.
2021-11-15
国家自然科学基金资助项目(41705122,41505095)
* 责任作者, 副教授, wangmzh@lzu.edu.cn
