聚乙烯和聚乳酸微塑料对大豆生长和生理生化及代谢的影响
2022-06-29廉宇航刘维涛史瑞滢李剑涛郑泽其
廉宇航,刘维涛,史瑞滢,王 琦,李剑涛,郑泽其
聚乙烯和聚乳酸微塑料对大豆生长和生理生化及代谢的影响
廉宇航,刘维涛*,史瑞滢,王 琦,李剑涛,郑泽其
(南开大学环境科学与工程学院,污染过程与基准教育部重点实验室/天津市城市环境污染诊断与修复技术工程中心,天津 300350)
为揭示生物可降解性不同的微塑料对农作物的毒性效应,选择聚乳酸(polylactic acid 可生物降解)和聚乙烯(polyethylene 难生物降解)微塑料(microplastics)为供试材料,以大豆为供试植物,深入探究了不同暴露水平(0.1%, 1%,/)下两种不同的微塑料对大豆()生长、光合作用、抗氧化性、营养品质以及代谢方面的影响.结果表明,聚乙烯微塑料(PEMPs)对大豆根部鲜重有促进作用,而0.1%聚乳酸微塑料(PLAMPs)则抑制根部长度.大豆的叶绿素含量在0.1% PEMPs作用下能够显著提高. PLAMPs则能够导致大豆过氧化氢酶(CAT)活性显著下降,而过氧化氢(H2O2)含量在0.1% PEMPs和1% PLAMPs下显著升高.此外,微塑料的暴露能够改变大豆根部中锰、铁以及铜的含量,其中0.1% PEMPs的效应最为显著.大豆叶片中的氨基酸代谢在PEMPs的作用下上调,而0.1% PLAMPs则引起有机酸以及糖类代谢下调.综上,微塑料的植物毒性效应与其生物可降解性及浓度密切相关,低浓度可生物降解微塑料的效应最强.这些发现有望为微塑料的植物毒理研究提供新的方向.
微塑料;植物毒性;光合作用;抗氧化酶;营养品质;代谢物
微塑料是一种新型的环境污染物,其粒径小、难降解、分布广的特点已经引起了国内外学者的高度重视[1-3].当前学术界一般将粒径小于5mm的塑料颗粒定义为微塑料[4].微塑料的来源非常广泛,一方面,如磨砂膏一类生活用品中添加的微塑料颗粒在使用过程中能够直接进入到环境介质中,从而形成初级微塑料[5];另一方面,随着塑料产量的与日俱增[6],进入到环境中的大块塑料在降解风化等过程中会逐渐形成更小的塑料碎片,这类塑料碎片为次级微塑料[7].已有研究表明,微塑料广泛存在于大气[8]、水体[7]、土壤[9-10]等各种环境介质之中.
近年来,陆地生态系统特别是农田生态系统中微塑料的分布及其生态毒理学效应引起了国内外学者的高度关注[3,11].有研究学者指出农用土壤中每年的微塑料输入量要远超于向全球海洋中的输入量[12].微塑料可通过有机肥的施用以及农用地膜降解残留等方式进入到土壤环境[11].我国的农膜使用量预计到2025年将达到228万t[13].农膜的主要成分为聚乙烯(polyethylene, PE)[14],有研究报道,农用土壤中的微塑料化学成分由约40%的聚乙烯所组成[15].此外, Ohtake等[16]推测60μm厚度的聚乙烯薄膜在土壤中的降解时长可达300a.为应对普通塑料难降解的问题,生物可降解性材料被引入应用.聚乳酸(polylactic acid, PLA)是一种以淀粉为主的材料,在土壤中短期内便可完全降解为二氧化碳和水[17].然而,目前也有研究表明生物可降解微塑料的植物毒性效应会更强[18-19].
目前,关于生物可降解性不同的微塑料对植物生长的影响研究仍处于起步阶段.已有文献开展了对植物如玉米(L.)[20]、小麦(L.)[18]和黑麦草(L.)等的影响研究.例如,Wang等[20]的研究结果表明聚乙烯微塑料对玉米的生长没有产生明显的毒性作用,而聚乳酸微塑料则能够降低植株的生物量和叶绿素含量,且高浓度下抑制效应更强;张彦 等[21]发现聚乳酸微塑料对小麦幼苗生长产生的抑制作用比聚丙烯和高密度聚乙烯微塑料更为显著; Boots等[22]的研究则表明聚乳酸微塑料对黑麦草的发芽率以及茎长的负面影响要强于高密度聚乙烯微塑料.
大豆()是一类重要的粮食作物,具有很高的蛋白质含量[23-24].此前,吴佳妮等[25]研究发现20nm和100nm的聚苯乙烯塑料会对大豆的发芽过程产生抑制作用;而Li等[26]研究表明聚乙烯和可生物降解微塑料会对大豆的株高和叶面积等产生不同的影响.然而,生物可降解性不同的微塑料在不同浓度下对大豆生长产生影响的潜在机制尚不明确.因此,本研究以大豆作供试植物,以聚乙烯微塑料(PEMPs)和聚乳酸微塑料(PLAMPs)为研究对象,探究其在不同浓度(0.1%, 1%,/)下对大豆生长、生理生化、营养品质以及代谢上的影响,以期为今后评估微塑料的生态环境风险、食品安全和人体健康风险提供基础数据.
1 材料与方法
1.1 供试材料
两种不同类型的微塑料粉末均购于广州华创塑化公司.供试大豆种子购于江苏宏蔬源种业公司.土壤取自天津市(38°59′N, 117°21′E)表层土,土壤类型为潮土.土壤的pH值为8.30,有机质含量为13.32g/kg.全氮,全磷,全钾的含量分别为1.40,2.48, 7.38g/kg.
1.1.1 微塑料表征 使用场发射扫描电镜(SEM) (JW-BK200C,精微高博,中国)对微塑料的外部形貌进行观察, SEM的加速电压为5.0kV, 工作距离为8.0mm.而后使用Image-J软件统计计算微塑料的平均粒径.
1.1.2 试验土壤的制备 将取得的土壤在室温条件下自然风干后过2mm筛网备用.微塑料的含量分别设置为0.1%和1% (/)[26-27].将微塑料和土壤混合后置于底部垫有纱布的花盆中,静置一周后浇水200mL待用.
1.2 盆栽试验
本试验共5个处理组,分别为对照, 0.1% PEMPs, 1% PEMPs, 0.1% PLAMPs和1% PLAMPs.每个处理组设置4个平行.大豆种子使用2% (/)的H2O2消毒30min,再使用去离子水反复冲洗.将大小均匀一致的种子置于室温黑暗条件下催芽.当幼芽长度达到3~4mm时,将其播种到土壤中.每盆中播种3株大豆幼芽.培养一周后,每盆中留下2株长势一致的幼苗.盆栽试验于室温6000lx光照(光照:黑暗=14h: 10h)下培养49d,每2d浇水50mL.
1.3 测定方法
1.3.1 SPAD值 培养第43d时,使用便携式SPAD- 502叶绿素仪(SPAD, Minolta Camera,日本)测定大豆幼苗的叶绿素含量.选取同一处理组中三株长势相同的植株作为试验对象,等距测定试验对象第一个三出复叶中每片完全展开的小叶上三个不同位置处的SPAD值.取其平均作为每个处理组中的叶绿素含量.
1.3.2 生长指标的测定 培养第49d时,将大豆幼苗收获.具体步骤为:将大豆植株轻轻地与土壤分离,将其分为地上部和根部.先去除根部上附着的大块土壤后,再使用自来水小心地清洗,随后使用去离子水反复冲洗干净,最后用滤纸擦干.分别使用钢尺和天平(SQP-PRACTUM224-1CN,赛多利斯,德国)测量植株的长度和鲜重.
1.3.3 抗氧化酶的测定 取约0.10g的植物新鲜叶片与1.0mL酶提取液冰浴混合,而后使用研磨机(JXFSTPRP-48,净信,中国)进行破碎,将混合液于8000, 4℃下离心分离10min,上清液用于分析超氧化物歧化酶(Superoxide dismutase, SOD),过氧化物酶(Peroxidase, POD)以及过氧化氢酶(Catalase, CAT)的活性.过氧化氢(Hydrogen peroxide, H2O2)含量的测定使用1.0mL丙酮作为植物提取液,其他步骤均与上述相同.使用酶标仪(Spark10M, Tecan,瑞士)于特定波长处测定提取液中各物质的吸光度.以上物质均使用试剂盒(苏州科铭生物技术有限公司)进行测定.
1.3.4 营养元素的测定 将地上部和根部置于烘箱中105℃杀青0.5h, 80℃烘干48h[28].使用研磨机破碎后取约0.10g地上部(约0.05g根系)于锥形瓶中,加入6.0mL硝酸和2.0mL过氧化氢.静置过夜后置于电热板上按程序升温消解,消解完全后将消解液转移到25mL比色管中,使用2% (/)硝酸定容, 0.45μm滤膜过滤后备用.使用多元素标准溶液配置系列标样.电感耦合等离子体质谱仪(ICP-MS)(Elan DRC-e, PerkinElmer,美国)用于测定大豆地上部及根部中Mn,Fe以及Cu元素的含量.
1.3.5 代谢物的测定 样品的制备按照Lian等[29]的方法并有所改进.具体步骤为:取约0.10g新鲜大豆叶片,液氮研磨后加入4.5mL提取混合液(甲醇:氯仿:高纯水=2.5:1:1,//).超声提取30min后4500r/ min离心15min,将上清液与沉淀分离后向沉淀物中再加入4.5mL提取混合液,再次超声提取后离心.将两次得到的上清液混合后加入1.0mL超纯水.甲醇/水相(上层)过0.22μm有机滤膜,氯仿相(下层)过5cm硅胶柱,分别使用3.0mL二氯甲烷和1.0mL甲醇淋洗.氮吹氯仿相后,将甲醇/水相与氯仿相混合,使用旋转离心以及冷冻干燥的方法将其浓缩后即制得样品.上机测试前使用两步法进行衍生化,首先加入50μL用吡啶溶解的甲氧氨基盐酸盐,充分混合后30℃水浴90min,再加入80μL硅烷化试剂N-甲基-N-(三甲基硅烷)-三氟乙酰胺(MSTFA), 37℃水浴30min后高速离心.将上清液转移到内衬管后上机测试.代谢物分析使用气相色谱-质谱联用仪(GC-MS)(Agilent 7890B-5977A, Agilent,美国). GC参数设置:载气流速保持在1mL/min;进样体积为1μL;注射温度: 290℃;传输线温度:280℃;升温程序:先在70℃下保持4min,然后以15℃/min的速度升至300℃,最后在此温度下保持5min. MS参数设置:离子源温度: 230℃; MS四极杆温度: 150℃;全扫描模式,质荷比范围为35~600/.
1.4 数据处理
试验结果均以平均值±标准偏差表示,采用Excel 2019处理, SPSS 26进行单因素方差分析,以LSD检验进行事后多重比较,并由Origin 2019和ImageJ软件进行绘图和图片信息的处理,使用MassHunter定性分析软件对获得的代谢数据进行分析后,与NIST14谱库对比来鉴定代谢物. MetaboAnalyst 5.0 (https://www.metaboanalyst.ca/)绘制代谢图.仅当<0.05时,认为具有显著统计学差异.
2 结果与讨论
2.1 微塑料的表征
PEMPs和PLAMPs的形貌特征如图1所示,通过SEM图观察发现: PEMPs大多呈现椭圆形(图1a),其平均粒径约为38.23μm(图1c); PLAMPs中含有大量片状与块状的不规则碎片(图1b),平均粒径约为45.69μm (图1d). PLA是一种半结晶聚合物,在室温下具有较高的强度和硬度,而断裂韧性和脆性则较低[30],在液氮研磨塑料(制作微塑料的方法)的过程中很容易形成粘连而导致片状和块状微塑料的形成.

2.2 微塑料对大豆生长的影响
大豆地上部及根部的生长情况如图2a和2d所示.与对照相比,两种微塑料的暴露均未显著(>0.05)改变大豆地上部的长度和鲜重(图2b和2c);大豆根部鲜重在PEMPs下能够显著升高(<0.05),而PLAMPs的添加对根部鲜重虽没有造成显著影响,但根部长度在0.1% PLAMPs的作用下可以显著降低28.62%(<0.05)(图2e和2f).与本研究类似,Wang等[20]研究证实10% PEMPs具有促进玉米根部(L.)干重的效应,而PLAMPs则显著抑制. PLAMPs大多呈现片状,其边缘较为锋利,在与植物根部相互作用的过程中,容易对其造成更大的机械性伤害[31-32],从而引起更强的植物毒性.然而, Li等[26]的研究发现0.1%含量的可生物降解微塑料会促进大豆()的生长、提高植株高度以及叶面积等.这可能是由于试验所使用的微塑料化学组成以及尺寸等特性上的不同而导致的结果差异性.因此,微塑料对植物生长的影响与微塑料类型、浓度以及受试植物种类等因素均有密切关系.

图2 大豆的生长情况(a, d),地上部长度(b)及鲜重(c),根部长度(e)及鲜重(f)的变化(不同小写字母表示同一指标下,不同微塑料处理组间的差异显著(P<0.05))
A.对照; B.0.1% PEMPs; C.1% PEMPs; D.0.1% PLAMPs; E.1% PLAMPs
2.3 微塑料对大豆光合作用的影响
两种微塑料在不同浓度下对大豆叶片SPAD值的影响如表1所示. 0.1% PEMPs在6d内均能够显著提高大豆叶片的SPAD值(<0.05),其平均值增幅分别为12.71%、18.09%、15.85%、16.52%、13.81%以及14.39%.而当PEMPs的含量为1%时,大豆幼苗的SPAD值与对照相比没有显著差异(>0.05); PLAMPs的暴露对大豆叶片6d内的SPAD值均无显著影响(>0.05).目前,已有很多关注于微塑料对植物光合作用影响的研究. Lian等[33]的研究揭示低浓度(0.1mg/L, 1mg/L)聚苯乙烯纳米塑料可显著提高小麦(L.)的SPAD值,而随着纳米塑料浓度的提高,植株的SPAD值与对照相比无显著差异(>0.05).这可能是由于低浓度的微塑料更容易被植物所吸收,进而导致体内的代谢物质发生了改变.

表1 微塑料对大豆植株SPAD值的影响
注:不同小写字母表示同一天下,不同微塑料处理组间的差异显著(<0.05).
2.4 微塑料对大豆抗氧化系统的影响
已有大量的研究结果表明植物在微塑料的作用下会产生过量的活性氧(ROS)[34].低浓度的ROS可以作为防御反应的信号分子,而ROS一旦过量则会导致氧化还原系统的紊乱,进而对植物的生长产生影响[35-36].为了应对微塑料导致的氧化胁迫,植物体内的抗氧化物质将会发生不同程度的改变[37]. PEMPs与PLAMPs对大豆叶片抗氧化系统的影响如图3所示.超氧化物歧化酶(SOD)是植物体内一种重要的抗氧化酶,在应对氧化的过程中可以催化超氧阴离子生成过氧化氢和氧气[38].与对照相比,微塑料的添加对SOD的活性没有造成显著差异(>0.05,图3a),但总体上来说,SOD活性具有上升的趋势.已有很多的研究表明在微塑料的作用下,植物体内的SOD活性可显著提高.例如,生菜(L.)体内的SOD活性在1%聚氯乙烯微塑料的作用下能够显著升高[39].Xu等的研究结果[40]表明不同粒径的聚苯乙烯微塑料可以显著提高大豆(L.)根部的SOD活性.
与对照相比, 1% PEMPs能够使得过氧化物酶(POD)的活性显著降低(<0.05),而其他处理组虽没有产生显著差异(>0.05),其趋势也表现为下降. 0.1% PEMPs,1% PEMPs,0.1% PLAMPs和1% PLAMPs的暴露分别使得POD活性下降了约7.39%,21.40%,11.21%和15.59% (图3b). POD是参与植物生长发育以及衰老过程的重要物质,影响木质素和乙烯的合成过程以有效抵抗外界病原体的入侵,在抗氧化的反应中起到重要作用[41-42].类似的,廖苑辰等[37]发现5μm聚苯乙烯塑料在高浓度下能够显著降低小麦(L.)叶片中的POD活性.然而, Jiang等[32]的研究表明5μm 聚苯乙烯塑料(10,50,100mg/L)可使得蚕豆()的POD活性显著上升.可见,不同类型/浓度的微塑料对不同植物的POD活性产生的影响不同.
过氧化氢酶(CAT)的活性在PLAMPs的刺激下发生显著降低(<0.05). 0.1% PLAMPs与1% PLAMPs分别使得CAT活性下降了约66.04%和46.38%; PEMPs的添加虽然对CAT活性没有造成显著差异(>0.05),其趋势也表现为下降(图3c).CAT可以将过氧化氢(H2O2)转换成水和氧气来缓解植物体内由于H2O2的积累而造成的胁迫[43].本研究中的H2O2含量在0.1% PEMPs和1% PLAMPs的作用下显著升高(<0.05),其他处理组与对照相比均无显著变化(图3d).类似地,Li等[44]发现在700nm聚苯乙烯塑料(50mg/L)的刺激下,黄瓜(L.)叶片中的CAT活性显著降低,而H2O2的含量则显著升高. H2O2是ROS的一种存在形式,这在Xu等[40]的研究结果中表现为:与对照相比,大豆(L.)根部中的ROS含量在聚苯乙烯微塑料的存在下能够显著升高.综上所述, PEMPs和PLAMPs均会使得大豆植株的抗氧化系统受到干扰,但并没有表现出浓度依赖性[28].这可能是由于植物在调控ROS的过程中,体内的抗氧化物质以及ROS水平均处于动态变化中[41].

图3 微塑料对大豆SOD (a),POD (b),CAT (c),H2O2 (d)的影响(不同小写字母表示同一指标下,不同微塑料处理组间的差异显著(P<0.05))
A.对照; B.0.1% PEMPs; C.1% PEMPs; D.0.1% PLAMPs; E.1% PLAMPs
2.5 微塑料对大豆微量营养元素的影响
微量营养元素能够参与植物体内电子传递以及酶促反应等重要过程[45].微塑料对大豆Mn、Fe以及Cu三种微量元素的影响如图4所示.添加微塑料虽然对大豆地上部中的Mn含量没有造成显著影响,但与对照相比, 0.1% PEMPs, 1% PEMPs, 0.1% PLAMPs和1% PLAMPs使得大豆地上部中的Mn含量分别变化了−29.93%,6.08%,−30.51%和−19.10%(图4a);大豆根部中的Mn含量在0.1% PEMPs的作用下显著提高了约48.75% (<0.05) (图4b). Lian等[33]的研究表明在聚苯乙烯纳米塑料的刺激下,小麦(L.)地上部中的Mn含量与对照相比均显著下降. Mn元素可以通过产生木质素和其他酚类物质以及诱导活性氧等方式来提高植物的病原菌抗性[46].因此,在本项研究中,由微塑料导致的Mn元素的变化很有可能会使得大豆幼苗抗病性发生改变,进而对其生长造成影响.
与对照相比,微塑料处理组对大豆地上部中的Fe含量没有造成显著差异(图4c); 0.1% PEMPs的刺激能够使得根部Fe含量显著上升(<0.05),增加了约45.80%,而0.1% PLAMPs则会引起根部中Fe含量显著下降(<0.05),其他处理均无显著影响(图4d).植物体内的Fe元素是参与叶绿素合成的重要物质,主要用于电子传输等过程[47].因此,本研究中0.1% PEMPs处理下的根部Fe含量升高会进一步使得大豆叶绿素含量升高,而0.1% PLAMPs对大豆根部Fe含量以及叶绿素含量的影响趋势则相反.这一结论与前面2.3中得到的关于大豆叶绿素含量的变化规律相一致.
与对照相比,微塑料处理组没有对大豆地上部中的Cu含量产生显著影响(图4e);而0.1% PEMPs, 1% PEMPs, 0.1% PLAMPs以及 1% PLAMPs作用下的根部Cu含量与对照相比均显著下降,分别下降了约33.52%,41.96%,23.72%以及21.99%(图4f).Cu元素在植物体内参与了感知乙烯、细胞壁代谢以及氧化应激保护等重要过程,植物缺Cu可能会影响幼叶以及生殖器官的发育[48].Lian等[28]最新的研究结果表明生菜(L.)在叶面暴露聚苯乙烯纳米塑料时,根部的Cu含量会显著下降,植株的抗病性可能会因此而发生改变.微塑料对大豆吸收微量营养元素的影响可能与多方面机制有关.其中,微塑料的物理堵塞作用可能会直接抑制植物根部吸收营养元素[49],从而使得大豆根部中的Mn, Fe以及Cu含量与对照相比会产生显著差异,而地上部中三种微量元素的差异性则并不明显(图4).此外,微塑料还可能会通过影响某些水通道蛋白以及离子跨膜运输,金属离子运输等过程[50-51],进而对植物吸收微量营养元素造成影响.
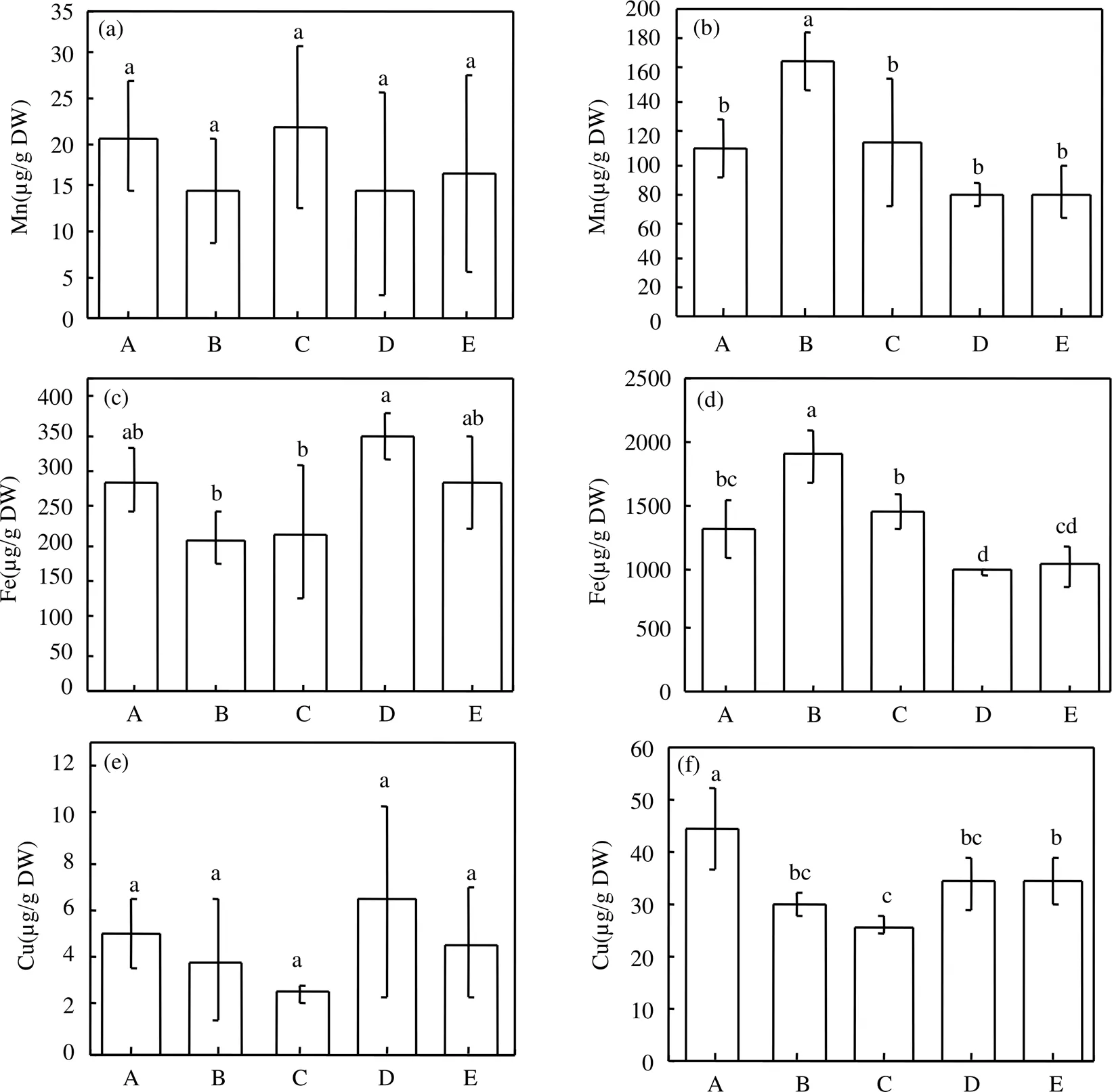
图4 微塑料对大豆地上部中Mn(a), Fe (c), Cu (e)及根部中Mn(b), Fe (d), Cu (f)含量的影响(不同小写字母表示同一指标下,不同微塑料处理组间的差异显著(P<0.05))
A.对照; B.0.1% PEMPs; C.1% PEMPs; D.0.1% PLAMPs; E.1% PLAMPs
2.6 微塑料对大豆代谢的影响
使用GC-MS方法在大豆叶片中共鉴别出了29种代谢物质.微塑料对大豆代谢的影响如图5所示. PLS-DA分析图(图5a)表明低浓度微塑料处理组与对照组分离,说明大豆叶片代谢受到了微塑料的干扰.各代谢物质的具体变化如图5b所示.与对照相比,暴露于PEMPs尤其是0.1% PEMPs下的大豆植株,其氨基酸代谢有上调的趋势,其中包括天冬氨酸、缬氨酸、丝氨酸、苏氨酸、异亮氨酸、丙氨酸、甘氨酸以及酪氨酸.氨基酸在碳氮代谢中起着重要的作用[52],它们是植物叶片中蛋白质合成的主要物质[53].因此,氨基酸代谢的上调可能是PEMPs显著提高大豆根部鲜重的原因之一.此外,氨基酸还可以通过调节离子运输、充当渗透剂、控制气孔开合以及参与防御相关的反应等方式来调节植物的生理生化功能[53-54].例如,丝氨酸是参与叶绿素合成的重要前体物质[55].在本研究中,0.1% PEMPs的处理可以使得丝氨酸代谢上调.Lian等[33]的研究表明,低浓度的聚苯乙烯纳米塑料能够使得小麦(L.)的丝氨酸代谢上调,从而对其光合作用进程造成影响.甘氨酸可以通过清除ROS和抑制炎症反应等方式起到细胞保护剂的作用,通过稳定细胞膜以及防止细胞坏死来改善免疫功能和各种类型的组织损伤[56]. PEMPs的暴露可以使得大豆甘氨酸代谢上调,说明大豆的抗氧化系统在此处理下被激活.
大豆叶片中的有机酸代谢在PLAMPs的暴露下会呈现不同程度的下调,主要包括苹果酸、棕榈酸、乳酸、丙二酸以及柠檬酸.低浓度PLAMPs的作用更为显著(图5b).有机酸是植物细胞中主要碳代谢(光合作用和呼吸作用)的中间体[57],有机酸代谢的下调表明大豆叶片中的能量消耗量可能超过了其积累量,大豆的生长状态可能会因此受到影响.此外,大豆部分氨基酸(缬氨酸、天冬氨酸、酪氨酸、亮氨酸)以及糖类(来苏糖、鼠李糖)代谢的下调也可以证实0.1% PLAMPs能够抑制大豆生长这一规律.此外,有机酸还是一类重要的阳离子螯合剂,在很多非生物胁迫的解毒反应中都发挥着重要的作用[54,58-59].例如,苹果酸是TCA循环的中间体,在植物氧化应激防御中起着重要的作用,已有研究发现它能够激活生物体的耐受能力[60].在本研究中, 0.1% PLAMPs能够使得苹果酸代谢显著下调.这一现象表明大豆的氧化应激系统受到了影响,与前面所得到的结果相一致.

图5 大豆叶片代谢物的PLS-DA分析(a)和热图(b)
A.对照; B.0.1% PEMPs; C.1% PEMPs; D.0.1% PLAMPs; E.1% PLAMPs
3 结论
3.1 PEMPs可提高大豆根部鲜重,而0.1% PLAMPs能够显著抑制根部长度.地上部长度和鲜重均无显著变化.
3.2 0.1% PEMPs主要通过上调大豆叶片中的丝氨酸代谢,提高根部中的Fe含量,进而对大豆幼苗的叶绿素含量起到促进作用.
3.3 0.1% PEMPs和1% PLAMPs可显著提高大豆叶片中H2O2含量,而CAT活性在PLAMPs作用下显著下降.表明大豆叶片的抗氧化系统受到了微塑料的干扰.
3.4 PEMPs导致大豆叶片中的氨基酸代谢上调,低浓度下效应更为显著;0.1% PLAMPs能够引起大豆叶片中有机酸以及糖类代谢下调.这可能是微塑料改变大豆幼苗长度及鲜重的原因所在.
[1] Rachman C M. Microplastics research - from sink to source [J]. Science, 2018,360(6384):28-29.
[2] Wagner S, Reemtsma T. Things we know and don't know about nanoplastic in the environment [J]. Nature nanotechnology, 2019,14(4):300-301.
[3] Zeb A, Liu W, Meng L, et al. Effects of polyester microfibers (PMFs) and cadmium on lettuce () and the rhizospheric microbial communities: A study involving physio-biochemical properties and metabolomic profiles [J]. Journal of Hazardous Materials, 2022,424:127405.
[4] Frias J P G L, Nash R. Microplastics: Finding a consensus on the definition [J]. Marine Pollution Bulletin, 2019,138:145-147.
[5] Enfrin M, Lee J, Gibert Y, et al. Release of hazardous nanoplastic contaminants due to microplastics fragmentation under shear stress forces [J]. Journal of Hazardous Materials, 2020,384:121393.
[6] Brahney J, Hallerud M, Heim E, et al. Plastic rain in protected areas of the United States [J]. Science, 2020,368(6496):1257-1260.
[7] Gong J, Xie P. Research progress in sources, analytical methods, eco-environmental effects, and control measures of microplastics [J]. Chemosphere, 2020,254:126790.
[8] Allen S, Allen D, Phoenix V R, et al. Atmospheric transport and deposition of microplastics in a remote mountain catchment [J]. Nature Geoscience, 2019,12(5):339-344.
[9] Gao H, Yan C, Liu Q, et al. Effects of plastic mulching and plastic residue on agricultural production: A meta-analysis [J]. Science of the Total Environment, 2019,651:484-492.
[10] Lian J, Liu W, Meng L, et al. Effects of microplastics derived from polymer-coated fertilizer on maize growth, rhizosphere, and soil properties [J]. Journal of Cleaner Production, 2021,318:128571.
[11] Nizzetto L, Futter M, Langaas S. Are agricultural soils dumps for microplastics of urban origin? [J]. Environmental Science &Technology, 2016,50(20):10777-10779.
[12] 骆永明,周 倩,章海波,等.重视土壤中微塑料污染研究防范生态与食物链风险 [J]. 中国科学院院刊, 2018,33(10):1021-1030.
Luo Y M, Zhou Q, Zhang H B, et al. Pay attention to research on microplastic pollution in soil for prevention of ecological and food chain risks [J]. Chinese Academy of Sciences, 2018,33(10):1021- 1030.
[13] Qi R, Jones D L, Li Z, et al. Behavior of microplastics and plastic film residues in the soil environment: A critical review [J]. Science of the Total Environment, 2020,703:134722.
[14] Wang J, Huang M, Wang Q, et al. LDPE microplastics significantly alter the temporal turnover of soil microbial communities [J]. Science of the Total Environment, 2020,726:138682.
[15] Yu L, Zhang J, Liu Y, et al. Distribution characteristics of microplastics in agricultural soils from the largest vegetable production base in China [J]. Science of the Total Environment, 2021,756:143860.
[16] Ohtake Y, Kobayashi T, Asabe H, et al. Studies on biodegradation of LDPE — observation of LDPE films scattered in agricultural fields or in garden soil [J]. Polymer Degradation and Stability, 1998,60(1): 79-84.
[17] Chen H, Wang Y, Sun X, et al. Mixing effect of polylactic acid microplastic and straw residue on soil property and ecological function [J]. Chemosphere, 2020,243:125271.
[18] Qi Y, Yang X, Pelaez A M, et al. Macro- and micro- plastics in soil-plant system: Effects of plastic mulch film residues on wheat () growth [J]. Science of the Total Environment, 2018,645:1048-1056.
[19] Yang W, Cheng P, Adams C A, et al. Effects of microplastics on plant growth and arbuscular mycorrhizal fungal communities in a soil spiked with ZnO nanoparticles [J]. Soil Biology and Biochemistry, 2021,155:108179.
[20] Wang F, Zhang X, Zhang S, et al. Interactions of microplastics and cadmium on plant growth and arbuscular mycorrhizal fungal communities in an agricultural soil [J]. Chemosphere, 2020,254: 126791.
[21] 张 彦,窦 明,邹 磊,等.不同微塑料赋存环境对小麦萌发与幼苗生长影响研究 [J]. 中国环境科学, 2021,41(8):3867-3877.
Zhang Y, Dou M, Zou L, et al. Effects of different microplastics occurrence environment on seed germinationand seedling growth of wheat (L.) [J]. China Environmental Science, 2021,41(8):3867-3877.
[22] Boots B, Russell C W, Green D S. Effects of Microplastics in Soil Ecosystems: Above and Below Ground [J]. Environmental Science &Technology, 2019,53(19):11496-11506.
[23] Zhang C, Xia S, Zhang Y, et al. Identification of soybean peptides and their effect on the growth and metabolism ofLRo8 [J]. Food Chemistry, 2022,369:130923.
[24] Trejo-Escamilla I, López L M, Gisbert E, et al. Soybean protein concentrate as a protein source for totoaba () juveniles: Effect on intermediary metabolism and liver histological organization [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2021,262:111062.
[25] 吴佳妮,杨天志,连加攀,等.聚苯乙烯纳米塑料(PSNPs)对大豆()种子发芽和幼苗生长的影响 [J]. 环境科学学报, 2020,40(12):4581-4589.
Wu J N, Yang T Z, Lian J P, et al. Effects of polystyrene nanoplastics (PSNPs)on seed germination and seedling growth of soybean () [J]. Acta Scientiae Circumstantiae, 2020,40(12):4581-4589.
[26] Li B, Huang S, Wang H, et al. Effects of plastic particles on germination and growth of soybean (): A pot experiment under field condition [J]. Environmental Pollution, 2021,272:116418.
[27] Qi Y, Beriot N, Gort G, et al. Impact of plastic mulch film debris on soil physicochemical and hydrological properties [J]. Environmental Pollution, 2020,266(Part 3):115097.
[28] Lian J, Liu W, Meng L, et al. Foliar-applied polystyrene nanoplastics (PSNPs) reduce the growth and nutritional quality of lettuce (L.) [J]. Environmental Pollution, 2021,280:116978.
[29] Lian J, Wu J, Zeb A, et al. Do polystyrene nanoplastics affect the toxicity of cadmium to wheat (L.)? [J]. Environmental Pollution, 2020,263(Part A):114498.
[30] Iglesias Montes M L, Cyras V P, Manfredi L B, et al. Fracture evaluation of plasticized polylactic acid / poly (3- HYDROXYBUTYRATE) blends for commodities replacement in packaging applications [J]. Polymer Testing, 2020,84:106375.
[31] Taylor S E, Pearce C I, Sanguinet K A, et al. Polystyrene nano- and microplastic accumulation at Arabidopsis and wheat root cap cells, but no evidence for uptake into roots [J]. Environmental Science: Nano, 2020,7(7):1942-1953.
[32] Jiang X, Chen H, Liao Y, et al. Ecotoxicity and genotoxicity of polystyrene microplastics on higher plant[J]. Environmental Pollution, 2019,250:831-838.
[33] Lian J, Wu J, Xiong H, et al. Impact of polystyrene nanoplastics (PSNPs) on seed germination and seedling growth of wheat (L.) [J]. Journal of Hazardous Materials, 2020,385:121620.
[34] Ge J, Li H, Liu P, et al. Review of the toxic effect of microplastics on terrestrial and aquatic plants [J]. Science of the Total Environment, 2021,791:148333.
[35] Czarnocka W, Karpiński S. Friend or foe? Reactive oxygen species production, scavenging and signaling in plant response to environmental stresses [J]. Free Radical Biology and Medicine, 2018,122:4-20.
[36] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants [J]. Plant Physiology and Biochemistry, 2010,48(12):909-930.
[37] 廖苑辰,娜孜依古丽·加合甫别克,李 梅,等.微塑料对小麦生长及生理生化特性的影响 [J]. 环境科学, 2019,40(10):4661-4667.
Liao Y C, Nazygul J, Li M, et al. Effects of microplastics on the growth, physiology, and biochemical characteristics of wheat () [J]. Environmental Science, 2019,40(10):4661- 4667.
[38] Alabdallah N M, Hasan M M. Plant-based green synthesis of silver nanoparticles and its effective role in abiotic stress tolerance in crop plants [J]. Saudi Journal of Biological Sciences, 2021,28(10):5631- 5639.
[39] Li Z, Li Q, Li R, et al. Physiological responses of lettuce (L.) to microplastic pollution [J]. Environmental Science and Pollution Research, 2020,27(24):30306-30314.
[40] Xu G, Liu Y, Yu Y. Effects of polystyrene microplastics on uptake and toxicity of phenanthrene in soybean [J]. Science of the Total Environment, 2021,783:147016.
[41] Song G, Gao Y, Wu H, et al. Physiological effect of anatase TiO2nanoparticles on[J]. Environmental Toxicology & Chemistry, 2012,31(9):2147-2152.
[42] Roy U K, Nielsen B V, Milledge J J. Effect of post-harvest conditions on antioxidant enzyme activity inbiomass [J]. Biocatalysis and Agricultural Biotechnology, 2020,27:101661.
[43] Liu S, Yang R. Chapter 14 - Regulations of reactive oxygen species in plants abiotic stress: an integrated overview [M]. Plant Life Under Changing Environment. Academic Press, 2020:323-353.
[44] Li Z, Li R, Li Q, et al. Physiological response of cucumber (L.) leaves to polystyrene nanoplastics pollution [J]. Chemosphere, 2020,255:127041.
[45] Peralta-Videa J R, Hernandez-Viezcas J A, Zhao L, et al. Cerium dioxide and zinc oxide nanoparticles alter the nutritional value of soil cultivated soybean plants [J]. Plant Physiology and Biochemistry, 2014,80:128-135.
[46] Eskandari S, Höfte H, Zhang T. Foliar manganese spray induces the resistance of cucumber to[J]. Journal of Plant Physiology, 2020,246-247:153129.
[47] Kobayashi T, Nozoye T, Nishizawa N K. Iron transport and its regulation in plants [J]. Free Radical Biology and Medicine, 2019,133:11-20.
[48] Puig S, Andrés-Colás N, García-Molina A, et al. Copper and iron homeostasis in: Responses to metal deficiencies, interactions and biotechnological applications [J]. Plant, cell & environment, 2007,30(3):271-290.
[49] Bosker T, Bouwman L J, Brun N R, et al. Microplastics accumulate on pores in seed capsule and delay germination and root growth of the terrestrial vascular plant[J]. Chemosphere, 2019, 226:774-781.
[50] Zhang W, Liu Z, Tang S, et al. Transcriptional response provides insights into the effect of chronic polystyrene nanoplastic exposure on[J]. Chemosphere, 2020,238:124563.
[51] Zhou CQ, Lu CH, Mai L, et al. Response of rice (L.) roots to nanoplastic treatment at seedling stage [J]. Journal of Hazardous Materials, 2021,401:123412.
[52] Pratelli R, Pilot G. Regulation of amino acid metabolic enzymes and transporters in plants [J]. Journal of Experimental Botany, 2014,65(19): 5535-5556.
[53] Chen J, Li K, Le X C, et al. Metabolomic analysis of two rice () varieties exposed to 2, 2′, 4, 4′-tetrabromodiphenyl ether [J]. Environmental Pollution, 2018,237:308-317.
[54] ZhaoL, OrtizC, Adeleye A S, et al. Metabolomics to detect response of lettuce () to Cu(OH)2nanopesticides: Oxidative stress response and detoxification mechanisms [J]. Environmental Science & Technology, 2016,50(17):9697-9707.
[55] Han T, Liang Y, Wu Z, et al. Effects of tetracycline on growth, oxidative stress response, and metabolite pattern of ryegrass [J]. Journal of Hazardous Materials, 2019,380:120885.
[56] Ratnasekhar C, Sonane M, Satish A, et al. Metabolomics reveals the perturbations in the metabolome ofexposed to titanium dioxide nanoparticles [J]. Nanotoxicology, 2015,9(8):994- 1004.
[57] Drincovich M F, Voll L M, Maurino V G. Editorial: On the Diversity of Roles of Organic Acids [J]. Frontiers in Plant Science, 2016,7:1592.
[58] Nigam R, Srivastava S, Prakash S, et al. Cadmium mobilisation and plant availability – the impact of organic acids commonly exuded from roots [J]. Plant and Soil, 2001,230(1):107-113.
[59] Zhao L, Huang Y, Hu J, et al.1H NMR and GC-MS Based Metabolomics Reveal Defense and Detoxification Mechanism of Cucumber Plant under Nano-Cu Stress [J]. Environmental Science & Technology, 2016,50(4):2000-2010.
[60] Du C, Zhang B, He Y, et al. Biological effect of aqueous C60aggregates onrevealed by transcriptomics and non- targeted metabolomics [J]. Journal of Hazardous Materials, 2017,324: 221-229.
Impact of polyethylene and polylactic acid microplastics on growth, physio-biochemistry and metabolism in soybean ().
LIAN Yu-hang, LIU Wei-tao*, SHI Rui-ying, WANG Qi, LI Jian-tao, ZHENG Ze-qi
(Key Laboratory of Pollution Processes and Environmental Criteria, Ministry of Education/Tianjin Engineering Center of Environmental Diagnosis and Contamination Remediation, College of Environmental Science and Engineering, Nankai University, Tianjin 300350, China)., 2022,42(6):2894~2903
The influence of bio (polylactic acid) and non-biodegradable (polyethylene) at two different concentrations (0.1%, 1%,/) on the growth, photosynthesis, oxidation resistance, nutritional quality, and metabolism of soybean () were deeply studied to reveal the ecotoxicological impact of microplastics with different biodegradability on crops. Results revealed that polyethylene microplastics (PEMPs) tend to increase the fresh weight ofroots. The treatment of 0.1% Polylactic acid microplastics (PLAMPs) inhibited the root length. Whereas, PEMPs enhanced the chlorophyll content ofsignificantly. The catalase (CAT) activity was decreased under PLAMPs, while the hydrogen peroxide (H2O2) content was increased by 0.1% PEMPs and 1% PLAMPs exposure. In addition, the Mn, Fe, and Cu content ofroots also changed, which had the most obvious impact with 0.1% PEMPs. Furthermore, the amino acid metabolisms inwere up regulated under PEMPs, while organic acid and sugar metabolisms were down regulated under 0.1% PLAMPs. Overall, the phytotoxicity of microplastics is closely related to their biodegradability and concentrations. Biodegradable microplastics at lower doses had the most profound effect on. These findings are expected to provide new insights into the effects of microplastics on crop plants in the future.
microplastics;phytotoxicity;photosynthesis;antioxidant enzyme;nutritional quality;metabolites
X171.5
A
1000-6923(2022)06-2894-10
廉宇航(1997-),女,河北承德人,南开大学硕士研究生,主要从事污染生态修复研究.
2021-11-05
国家自然科学基金项目(32171614);国家重点研发计划顶目(2020YFC1808800)
*责任作者, 副教授, lwt@nankai.edu.cn
