硫自养反硝化颗粒表面与间隙微生物群落特征和基因分布
2022-06-29吕小梅吴毅聪陈桂连徐剑晖胡俊杰
吕小梅,吴毅聪,陈桂连,徐剑晖,刘 鹏,胡俊杰
硫自养反硝化颗粒表面与间隙微生物群落特征和基因分布
吕小梅,吴毅聪,陈桂连,徐剑晖,刘 鹏,胡俊杰*
(东莞理工学院,广东 东莞 523808)
研究了单质硫颗粒自养反硝化柱中表面和间隙生物膜的微生物群落结构、功能基因和代谢途径等生物信息学特征.结果表明,硫颗粒表面生物膜的微生物菌群多样性低于间隙生物膜.氮代谢功能基因丰度差异较为显著,间隙生物膜中硝酸盐和亚硝酸盐的胞外转运蛋白基因丰度远高于表面生物膜,分别为0.0792%、0.109%与0.0157%、0.0314%.对于还原性反硝化代谢,表面生物膜的总基因丰度却明显低于间隙生物膜,分别为0.367%、0.406%.此外,参与反硝化过程的基因丰度明显不同,特别是将NO3-还原成NO2-以及将N2O还原成N2过程中的基因.对于硫代谢,没有观察到明显的差异.APS(硫酸腺苷)氧化是将SO32-氧化为SO42-的主要途径,其基因丰度远远高于直接氧化途径,分别为0.137%与0.0005%(表面)、0.138%与0.0007% (间隙).结果表明,在单质硫自养反硝化过程中,间隙生物膜与表面生物膜中的微生物存在合作关系,协同促进硫自养反硝化脱氮过程.
硫自养反硝化;生物膜;菌群结构;功能基因
作为氮循环过程之一,硝酸盐是地下水和地表水中普遍存在的污染物,对公众健康存在潜在的风险[1].生物反硝化脱氮是目前最主流的脱氮技术.传统异养反硝化因高效性而得到广泛应用,然而,该过程需要有机物作为电子供体,对于缺乏有机物的水体需要额外补充碳源以实现有效脱氮,这将导致处理成本的增加和二次污染的风险.
与异养反硝化相比,硫自养反硝化是以硫化合物(S2-,S2O32-,S4O62-,SO32-)和单质硫(S0)为电子供体实现反硝化脱氮[2].硫自养反硝化过程以无机碳为碳源,可避免有机碳源的投加.硫自养反硝化污泥产率低于异养反硝化,可减少后续污泥处理.此外,硫自养反硝化的运行与管理成本也相对较低.由于其优势,逐渐成为可替代异养反硝化的脱氮技术[3-4],已用于饮用水[5-6]、地下水[7-8]、废水和垃圾填埋场渗滤液[9-11]中的硝酸盐的去除.研究表明,单质硫可以达到与其他还原性硫化物类似的自养反硝化脱氮效果[12],且单质硫不溶于水,无毒害作用,价格低廉,作为自养反硝化硫源处理安全要求较高的饮用水与地下水更受青睐.
单质硫自养反硝化通常采用填充床反应器,将颗粒硫装入柱中.接种和运行后,微生物将逐渐在硫颗粒表面富集形成生物膜.研究微生物种类及其在生物膜中的分布,有助于从微观角度解释不同菌种之间的合作机制,指导反应系统宏观条件的控制[13].通过对生物滤池中硝化细菌的活性和分布研究,发现氨氧化细菌和亚硝酸盐氧化细菌在生物膜中位置相近,因此,氨氧化和亚硝酸盐氧化反应可以依次快速进行[14].基于高通量测序技术,Sun等[15]揭示了耦合甲烷氧化的反硝化脱氮MBR生物膜内侧与外侧微生物菌群结构存在显著差异.
对于单质硫自养反硝化,目前大多数研究主要关注生物膜内微生物菌群组成与空间分布.硫自养填充床反应器降解水中高浓度高氯酸盐时,反应器内的菌群结构随高度的变化而变化,硫氧化菌随反应器高度的增加而减少,由底部57.78%减少到上部的32.19%,同时硫化氢氧化菌随反应器高度的增加而增加,由底部4.35%增加到上部的22.24%[16].此外,研究表明水力停留时间(HRT)会改变反应器内部微生物群落多样性,微生物群落结构分布情况与反应器高度有关[17].然而,硫颗粒自养反硝化运行过程中,除了填料上富集有致密的生物膜,硫颗粒间隙中也存在大量的生物膜.表面与间隙生物膜之间存在怎样的菌群差异,二者在代谢过程中是否存在一定的协同作用.针对此问题,基于连续运行的颗粒硫自养反硝化填充柱,本研究采用16S rRNA测序和宏基因组测序,分析硫颗粒表面与间隙中微生物菌群结构与代谢基因的差异,分析基于单质硫自养反硝化的基质代谢利用途径.
1 材料和方法
1.1 实验仪器和方法
柱形硫颗粒硫自养反硝化反应器内径为10cm、总高度为40cm,硫磺颗粒(直径为3~5mm)填充高度为20cm,有效容积为1.57L.反应器空床停留时间(EBRT)为1.5h,进水采用自来水配置,其水质特征见表1所示.此外,1L合成废水中补充了0.3mL微量元素溶液.对进水和出水中的硝酸盐和亚硝酸盐浓度进行连续监测,以监测反硝化性能.
1.2 化学分析
NH4+-N浓度采用纳氏试剂分光光度法、NO3--N浓度采用紫外分光光度法、NO2--N浓度采用N-(1-萘基)-乙二胺分光光度法.
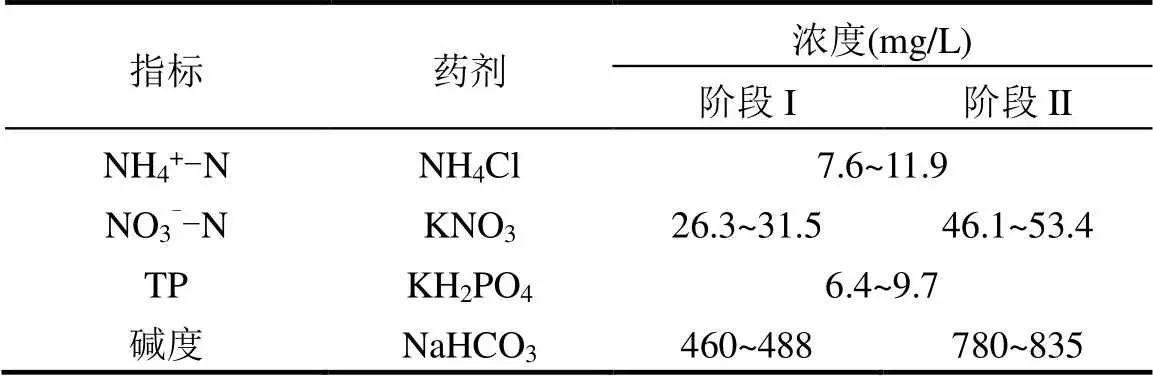
表1 进水水质
1.3 生物膜样本采集与分析
阶段II运行稳定后,排出硫柱中的水,将硫柱中的硫颗粒小心取出置于500mL烧杯中,用纯净水轻轻地洗三次,每次都收集清洗水中的生物膜.用镊子将硫颗粒放入另一个烧杯中,烧杯底部残余的生物膜与收集的上清液中生物膜混合,作为硫颗粒间隙生物膜.将装有硫颗粒的烧杯中加入少量纯净水,超声波清洗震荡仪中超声10min左右,收集脱落的生物膜,作为硫颗粒表面生物膜样品.分别取适量的间隙生物膜与表面生物膜进行后续微生物分析实验研究[15].扫描电镜样品处理方法参考文献[18].
1.4 DNA提取、PCR扩增和高通量测序
采用PowerSoil®DNA Isolation Kit(Mobio,美国)提取生物膜样品的总DNA.针对16S rRNA的V4高变异区,采用Takara Ex Taq®DNA聚合酶试剂盒、i-Cycler(BioRad,Hercules,CA,USA)、以及引物对(515F与806R)进行PCR扩增.扩增产物通过琼脂糖凝胶电泳进行验证,并使用微量紫外分光光度计(NanoDrop-1000)进行定量分析.将两个样本的扩增子混合,并保证最终混合物的质量浓度相等,通过Illumina-Miseq测序仪进行建库和测序,测序策略为成对端测序(2×250bp).
对于宏基因组测序,首先将DNA打断成300bp左右的片段.然后通过琼脂糖凝胶电泳纯化和回收目的片段,进一步构建基因文库,Illumina-Miseq测序仪上以配对末端测序(2×250bp)的策略进行测序(广州美格生物科技有限公司).
2 结果和讨论
2.1 反硝化脱氮效果
碳酸氢钠为碱度来源,水力停留时间为1.5h条件下,单质硫自养反硝化滤柱脱氮效果如图1所示.第一阶段进水硝酸盐氮浓度为26.30~31.59mg/L(平均为29.48mg/L).出水硝酸盐氮浓度从18.0mg/L逐渐下降,并稳定在1.38~1.98mg/L(平均为1.67mg/L),平均去除率为94.40%.出水亚硝酸盐氮浓度为0~ 0.26mg/L.第二阶段提高进水硝酸盐氮浓度值至45.53~53.44mg/L(平均为50.71mg/L),出水硝酸盐氮浓度为4.00~6.89mg/L(平均为5.24mg/L),平均去除率为89.67%.出水亚硝酸盐浓度为0.29~1.34mg/L,略高于第一阶段.

图1 硫颗粒自养反硝化脱氮效果
随着进水硝酸盐负荷的增加,出水硝酸盐浓度有所增加,去除率有所下降,但去除速率显著提升,分别为18.34mg/(L×h)、30.31mg/(L×h),颗粒硫自养反硝化速率明显高于活性污泥法硫自养反硝化[19].
2.2 微生物菌群特征
2.2.1 菌群多样性 基于16S rRNA的细菌多样性结果如表2所示.不同的多样性指数,包括:分类操作单元(operational taxonomic unit, OTU)数、Chao 1指数、香农指数(Shannon)和辛普森指数(Simpson)均表明,间隙生物中的细菌多样性比表面生物更丰富.维恩图分析结果显示表面生物和间隙生物共享大多数的OTU(759),但独有的OTU数量分别为138和398,亦表明间隙生物膜中的微生物多样性更加丰富.

表2 表面与间隙生物膜的菌群多样性
2.2.2 主导微生物分布 如图2所示,硫颗粒表面与间隙生物在门级别以及变形菌门中纲的丰度分布情况并无显著差异.

图2 两个样品中不同门以及变形菌门中纲的丰度
Proteobacteria是丰度最高的门,在表面与间隙生物中丰度分别为89.0%、86.4%,其次是Bacteroidetes (3.52%、4.95%)、Chloroflexi(1.93%、1.76%)、Firmicutes (0.877%、0.963%),以上主导门经常被报道于反硝化甚至自养反硝化污泥体系中[20-21].对于最高丰度的Proteobacteria,其下属的β-proteobacteria丰度最高(57.9%、54.7%),其次分别为ε-proteobacteria(12.9%、13.0%)、γ-proteobacteria(11.5%、11.3%)、α-proteobacteria(3.92%、4.51%)、δ-proteobacteria(2.75%、2.79%).
在属级别上,与硫自养微生物相关的菌属的丰度如表3所示.是最丰富的属,其次是和.上述属在表面生物膜中的丰度略高于间隙生物膜,分别为28.76%、9.50%、1.25%和26.36%、9.22%、1.17%.此外,还检测到与硫磺自养反硝化作用有关的属[22],它们在表面和间隙生物膜中的丰度为0.0341%和0.0294%.表面生物膜中硫磺自养反硝化微生物的丰度总体上高于间隙生物膜,表明表面生物膜富集了更多的功能性微生物.此外,在生物膜中也检测到了可能参与硫磺代谢和细菌间电子传递的属[23-24],但在两个生物膜样品中丰度并无明显差异.
扫描电镜结果(图3)也显示生物膜中富集了丰富的硫氧化短杆菌和少量球菌,与文献所述细菌形态一致.且表明硫表面分布了更多的硫自养反硝化微生物,分布也更密集,该结果与高通量测序结果一致.
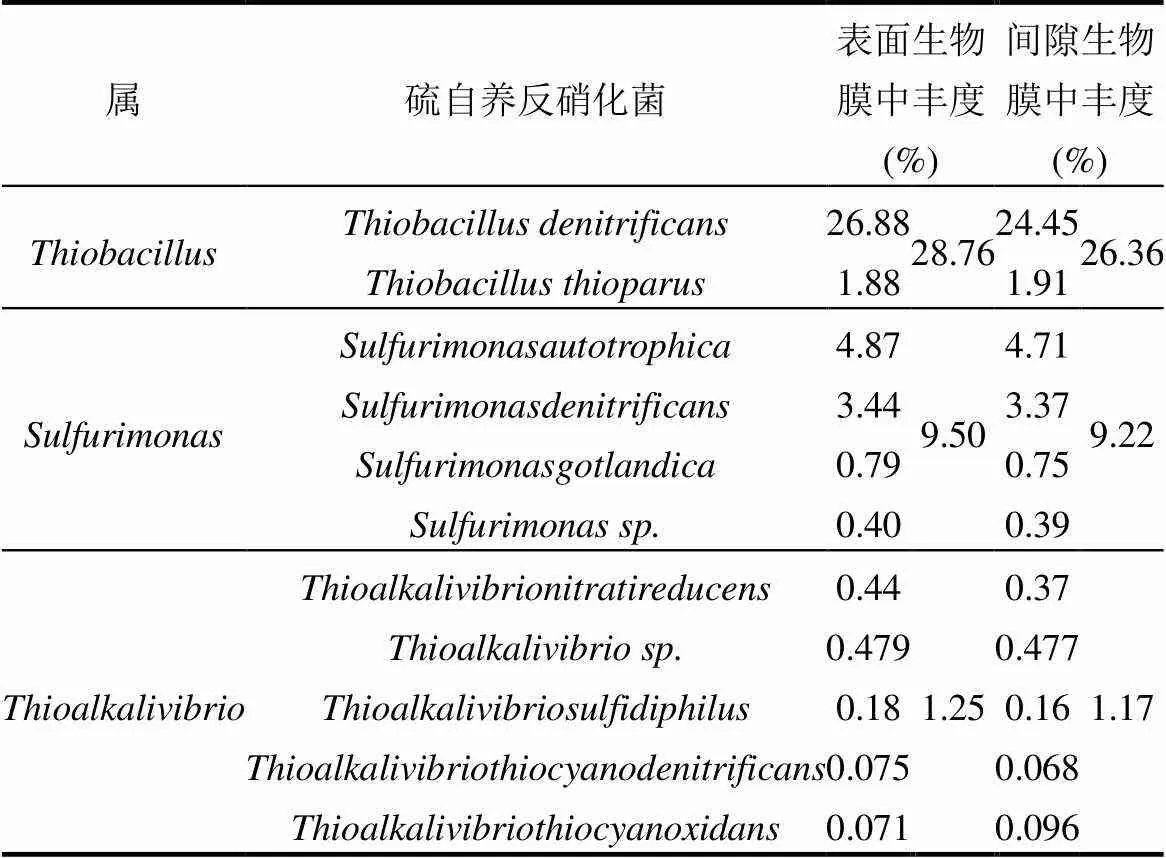
表3 不同生物膜样品的硫自养反硝化微生物丰度

图3 硫颗粒表面(a)与间隙(b)生物膜电镜图
2.3 功能基因与代谢途径
基于KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库分析了硫颗粒表面与间隙微生物的基因注释结果,重点比较了氮代谢与硫代谢的基因丰度.表面生物膜与间隙生物膜的硫代谢基因丰度基本接近,分别为0.415%、0.412%.表面生物膜的氮代谢基因丰度略高于间隙生物膜,分别为1.042%、1.008%.
2.3.1 氮代谢 污水处理厂(WWTPs)脱氮主要包括四个过程:氨化、硝化、反硝化和固氮.本研究主要关注硫自养反硝化过程,其代谢路径以及参与各还原过程的酶编码如图4所示.
硫颗粒表面与间隙微生物中负责胞外硝酸盐转运蛋白与亚硝酸盐转运蛋白的基因丰度如图5所示.硫颗粒表面微生物和间隙微生物的胞外硝酸盐转运蛋白丰度为0.0157%和0.0792%,细胞外亚硝酸盐转运蛋白丰度为0.0314%和0.109%.这表明间隙微生物的胞外氮元素转运蛋白基因丰度高很多.其原因可能是当进水流经硫填充柱时,间隙微生物能够接触更高浓度的硝酸盐,因为硝酸盐需要从外部扩散到表面生物膜的内部并得以利用[25].因此,较高的硝酸盐浓度激活了转运蛋白的调控与表达.

图4 硝酸盐反硝化脱氮代谢路径
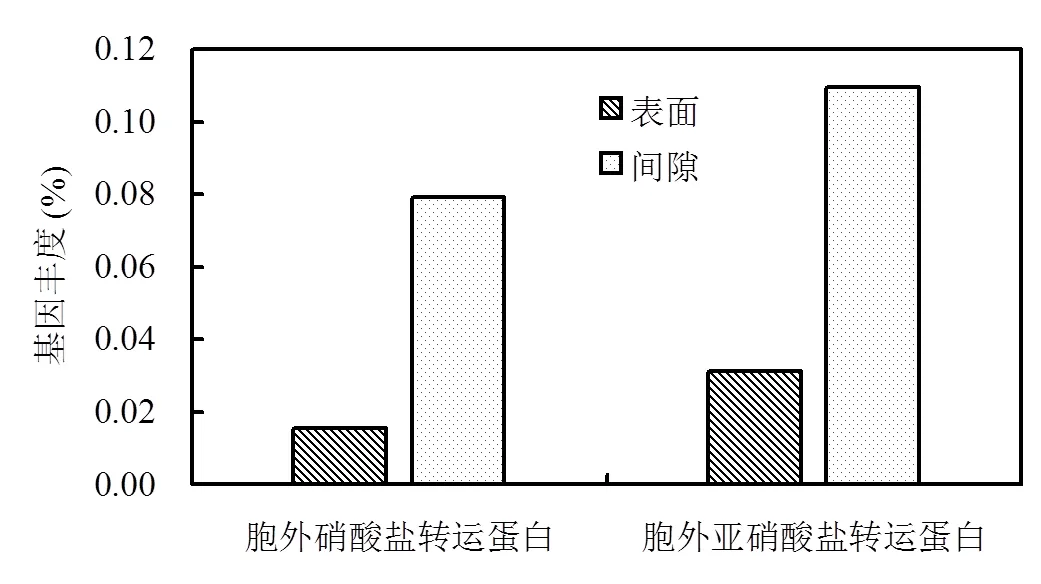
图5 胞外转硝酸盐与亚硝酸盐运蛋白丰度
硝酸盐的还原代谢包括异化还原、同化还原以及反硝化.硫颗粒表面生物膜与间隙生物膜中的三种硝酸盐还原代谢基因丰度情况如图6所示.
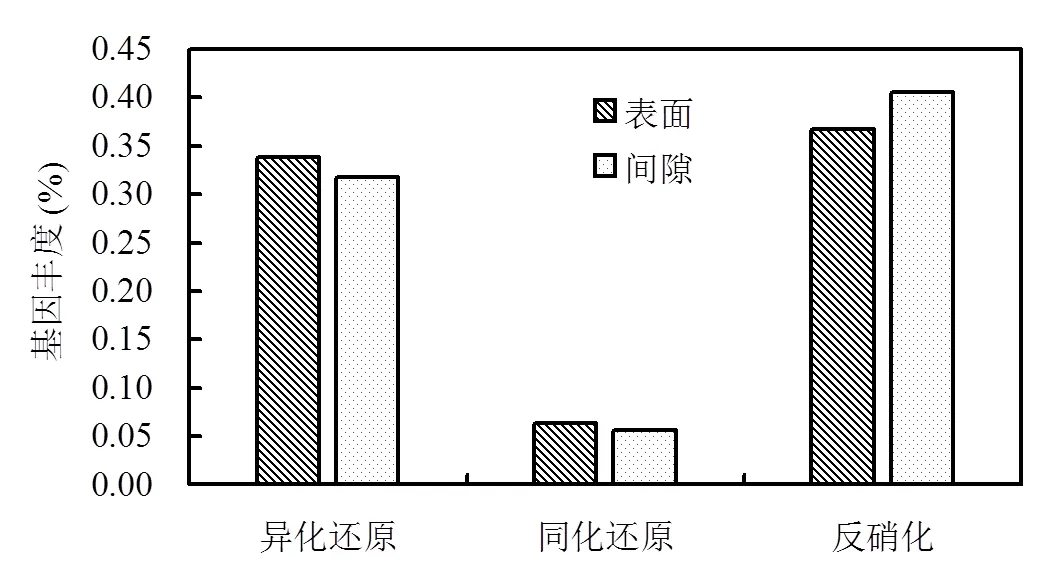
图6 反硝化还原酶基因丰度
由图6可以看出,对于参与异化还原与同化还原基因,表面生物膜中丰度分别为0.338%、0.318%;间隙生物膜中丰度分别为0.064%、0.057%.可见,表面生物膜中异化还原与同化还原基因丰度显著高于间隙生物膜,且异化还原作用明显高于同化还原作用.而对于反硝化脱氮代谢,表面基因丰度明显低于间隙生物膜,分别为0.367%、0.406%.该结果可能同样与间隙微生物接触更多的硝酸盐/亚硝酸盐有关.另外,间隙微生物中较高的转运蛋白基因丰度也可能是间隙微生物较高的反硝化代谢基因丰度较高的原因之一.
硫颗粒表面与间隙微生物硝酸盐反硝化脱氮代谢路径所需酶及其相应酶编码(EC)如图7所示,首先,硝酸盐由硝酸盐/亚硝酸盐转运酶(Nrt)通过细胞膜运输.然后,硝酸盐在硝酸盐还原酶(Nar和Nap)、亚硝酸盐还原酶(Nir)、一氧化氮还原酶(Nor)和氧化亚氮还原酶(Nos)的作用下最终还原成氮气,完成反硝化脱氮.该过程参与编码的基因的丰度如表4所示.硝酸盐还原为亚硝酸盐的基因丰度最高,分别为0.225%、0.230%,这表明硝酸盐反硝化过程中,参与硝酸盐还原为亚硝酸盐的微生物或酶较为丰富.亚硝酸盐还原过程的基因丰度,表面微生物略高于间隙微生物,分别为0.065%、0.052%.对于一氧化氮还原过程的酶基因,表面与间隙微生物的丰度均为0.062%.硝酸盐反硝化脱氮最后一步是氧化亚氮还原为氮气,该过程中的酶基因在表面微生物中的丰度远低于间隙,分别为0.016%、0.061%.基于以上结果可以推测,在硫自养反硝化滤柱中,硫颗粒与间隙微生物存在着一定的协同作用.

图7 硫氧化代谢通路

表4 各生物膜样品中与反硝化代谢途径相关的功能基因的丰度
2.3.2 硫代谢 硫代谢主要包括硫酸盐的还原代谢和硫的氧化代谢,本研究只考虑后者.硫氧化的代谢途径如图7所示,包括S2-氧化生成为S0; S0、S2-、S2SO32-氧化为SO32-; S2SO32-氧化为SO42-; SO32-氧化为SO42-;以及S2SO32-分裂分解为S2-.
无论是S0、S2SO32-或是其它还原态硫的生物氧化,SO32-是硫氧化过程中必然的中间产物[26],且SO32-可以通过两种途径氧化生成SO42-.一种是SO32-直接氧化为SO42-,即SO32-在细胞色素C还原酶和末端色素系统催化氧化为硫酸盐[27].另一种是通过APS(硫酸腺苷)途径氧化,即细胞细胞质中的腺苷酰硫酸(APS)与在细胞膜上的APS还原酶发生的亚硫酸盐氧化成硫酸盐并与AMP相连接[28].
本研究未检测到S0氧化为SO32-,S2-氧化为S0的基因.Rohwerder等研究发现,微生物利用S0的过程中,S0首先被外膜蛋白上的硫醇基团RSH活化为线状的无机或有机多硫化物,然后被输送到细胞质中,由位于周质区域内的硫双加氧酶(SDO)氧化成SO32-,最后氧化为SO42-[29].另外,需要说明的是目前关于硫氧化代谢的基因大都是基于好氧条件下硫氧化过程检测到的功能基因,对于以硝酸盐为电子受体的缺氧条件下的硫氧化过程的功能基因研究相对较少,该条件下单质硫和其他还原态硫化物的酶促氧化可能与好氧条件下有所不同,由于缺乏大量的研究以及相应的基因数据库而导致本研究中硫氧化过程中一些功能基因检测的缺失.
氧化硫代谢途径相关的功能基因丰度如图8所示,硫颗粒表面与间隙微生物中硫氧化代谢基因丰度较为接近.值得指出的是,对于SO32-氧化生成SO42-代谢,APS氧化途径(EC.1.8.2.1)的基因丰度(0.137%、0.138%)远远高于直接氧化途径(EC.1.8.99.2)(0.0005%、0.0007%),表明元素硫自养反硝化作用中SO32-到SO42-的主要氧化途径为APS氧化.
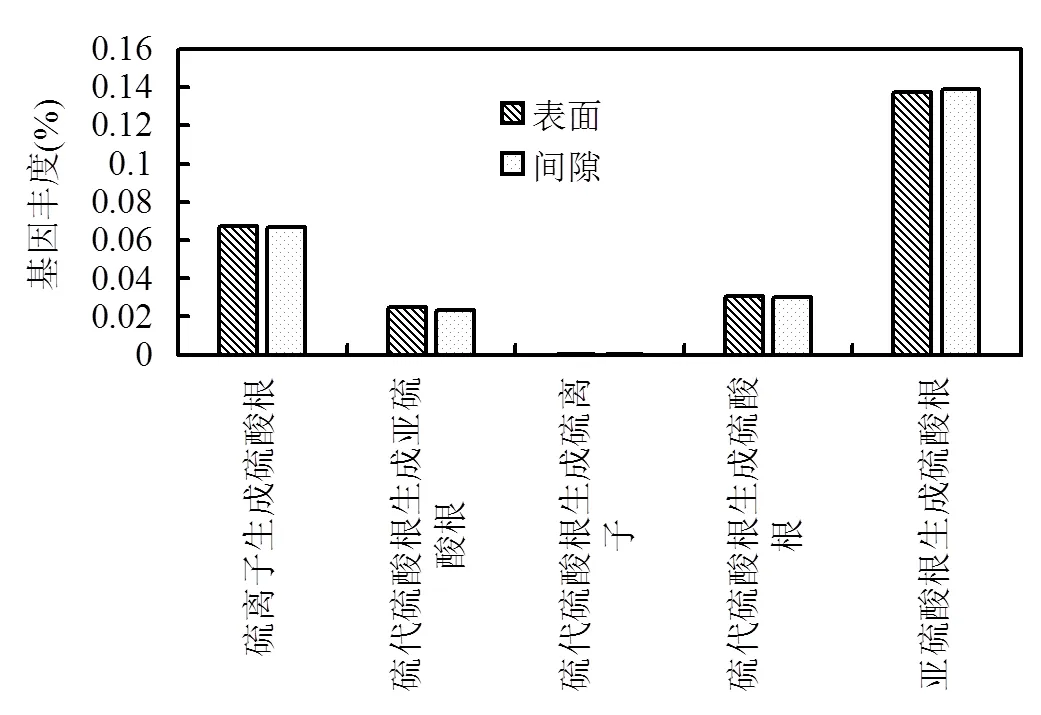
图8 样品中硫氧化代谢基因丰度
基于上述结果,可以推断出硫元素自养反硝化柱中表面和间隙生物膜中的微生物存在协同效应.尽管如此,仍应进一步研究底物、微生物和基因表达的空间分布和关系,以全面了解元素硫自养反硝化的机制.
3 结论
3.1 Proteobacteria是硫颗粒表面与间隙微生物最丰富的门类.其中,下属的β-proteobacteria丰度最高,其次是ε-proteobacteria、γ-proteobacteria、α- proteobacteria、δ-proteobacteria.
3.2 表面生物膜中的氮代谢基因丰度相对高于间隙生物膜.间隙生物膜中细胞外硝酸盐和亚硝酸盐运输基因的丰度远远高于表面生物膜.表面生物膜中参与异化还原和同化作用的基因丰度高于间隙生物膜,异化还原作用明显高于同化作用.
3.3 在还原性反硝化代谢方面,表面生物膜的基因丰度明显低于间隙生物膜,参与反硝化过程的基因丰度有明显差异,尤其是硝酸盐还原为亚硝酸盐和氧化亚氮还原为氮气过程中的基因.
3.4 两种生物膜中硫代谢的基因丰度没有明显差异.在亚硫酸盐氧化为硫酸盐的过程中,APS氧化途径的基因丰度远远高于直接氧化途径.
3.5 硫自养反硝化滤柱中,硫颗粒与间隙微生物在氮异化还原代谢与SO32-氧化中存在协同作用.
[1] Bordeleau G, Savard M M, Martel R, et al. Determination of the origin of groundwater nitrate at an air weapons range using the dual isotope approach [J]. Journal of Contaminant Hydrology, 2008,98(3/4):97- 105.
[2] Qian J, Lu H, Cui Y, et al. Investigation on thiosulfate-involved organics and nitrogen removal by a sulfur cycle-based biological wastewater treatment process [J]. Water Research, 2015,69:295-306.
[3] Sahinkaya E, Kilic A, Duygulu B. Pilot and full scale applications of sulfur-based autotrophic denitrification process for nitrate removal from activated sludge process effluent [J]. Water Research, 2014, 60:210-217.
[4] 周 娅,买文宁,代吉华,等.硫代硫酸钠联合硫铁矿自养反硝化脱氮性能[J]. 中国环境科学, 2020,40(5):2081-2086.
Zhou Y, Mai W N, Dai J H, et al. Study on autotrophic denitrification performance of sodium thiosulfate combined with pyrite system [J]. China Environmental Science, 2020,40(5):2081-2086.
[5] Zhao Y, Zhang B, Feng C, et al. Behavior of autotrophic denitrification and heterotrophic denitrification in an intensified biofilm-electrode reactor for nitrate-contaminated drinking water treatment [J]. Bioresource Technology, 2012,107:159-165.
[6] Sahinkaya E, Yurtsever A, Aktas O, et al. Sulfur-based autotrophic denitrification of drinking water using a membrane bioreactor [J]. Chemical Engineering Journal, 2015,268(1):180-186.
[7] Luna-Velasco A, Sierra-Alvarez R, Castro B, et al. Removal of nitrate and hexavalent uranium from groundwater by sequential treatment in bioreactors packed with elemental sulfur and zero-valent iron [J]. Biotechnology and Bioengineering, 2010,67(2):933-942.
[8] Zhang L, Zhang C, Hu C, et al. Denitrification of groundwater using a sulfur-oxidizing autotropic denitrifying anaerobic fluidized-bed MBR: Performance and bacterial community structure [J]. Applied Microbiology and Biotechnology, 2015,99:2815-2827.
[9] Lv X, Shao M, Li J, et al. Nitrate removal with lateral flow sulphur autotrophic denitrification reactor [J]. Environmental Technology, 2014,35(21):2692-2697.
[10] Kong Z, Li L, Feng C, et al. Comparative investigation on integrated vertical-flow biofilters applying sulfur-based and pyrite-based autotrophic denitrification for domestic wastewater treatment [J]. Bioresource Technology, 2016,211:125-135.
[11] Cortez S, Teixeira P, Oliveira R, et al. Denitrification of a landfill leachate with high nitrate concentration in an anoxic rotating biological contactor [J]. Biodegradation, 2011,22:661-671.
[12] Fu C X, Li J, Lv X M, et al. Operation performance and microbial community of sulfur-based autotrophic denitrification sludge with different sulfur sources [J]. Environmental Geochemistry and Health, 2020,42(3):1009-1020.
[13] Almeida C, Azevedo N F, Santos S, et al. Discriminating multi- species populations in biofilms with peptide nucleic acid fluorescence in situ hybridization (PNA FISH) [J]. Plos One, 2011,6(3):e147863.
[14] Okabe S, Naitoh H, Satoh H, et al. Structure and function of nitrifying biofilms as determined by molecular techniques and the use of microelectrodes [J]. Water Science and Technology, 2002,46(1/2): 233-241.
[15] Sun F Y, Dong W Y, Shao M F, et al. Aerobic methane oxidation coupled to denitrification in a membrane biofilm reactor: Treatment performance and the effect of oxygen ventilation [J]. Bioresource Technology, 2013,145:2-9.
[16] 张 超,陶华强,宋圆圆,等.硫自养填充床反应器降解水中高浓度高氯酸盐的特性及菌群分析 [J]. 环境科学, 2017,38(1):247-252.
Zhang C, Tao H Q, Song Y Y, et al. Characteristics of perchlorate reduction and analysis of consortium structurein a sulfur-based reactor at a high perchlorate concentration [J]. Environmental Science, 2017, 38(1):247-252.
[17] 万东锦,李 琦,刘永德,等.硫自养反硝化过程中含硫副产物产生规律及微生物群落结构的空间分布 [J]. 环境科学研究, 2018,31(6): 1152-1159.
Wan D J, Li Q, Liu Y D, et al. Production rule of sulfur by-products in sulfur autotrophic denitrification and microbial community special distribution analysis [J]. Research of Environmental Sciences, 2018, 31(6):1152-1159.
[18] 郑照明,杨函青,马 静,等.SNAD反应器中颗粒污泥和絮体污泥脱氮特性[J]. 中国环境科学, 2015,35(10):2996-3002.
Zheng Z M, Yang H Q, Ma J, et al. The nitrogen removal performance of granules and flocs in SNAD reactor [J]. China Environmental Science, 2015,35(10):2996-3002.
[19] 马潇然,郑照明,卞 伟,等.硫自养反硝化系统运行效能和微生物群落结构研究[J]. 中国环境科学, 2020,40(10):4335-4341.
Ma X R, Zheng Z M, Bian W, et al. Study on operation efficiency and microbial community structure of sulfur-based autotrophic denitrification system [J]. China Environmental Science, 2020,40(10): 4335-4341.
[20] Fernandez N, Sierra-Alvarez R, Field J A, et al. Microbial community dynamics in a chemolithotrophic denitrification reactor inoculated with methanogenic granular sludge [J]. Chemosphere, 2008,70(3): 462-474.
[21] 赵 晴,杨伟明,王 瑶,等.硫化物自养反硝化细菌颗粒污泥及其物化特征[J]. 环境工程学报, 2017,11(6):3884-3890.
Zhao Q, Yang W M, Wang Y, et al. Granulation and physical chemical characterization of sulfur-oxidizing bacteria sludge [J]. Chinese Journal of Environmental Engineering, 2017,11(6):3884- 3890.
[22] An S, Tang K, Nemati M. Simultaneous biodesulphurization and denitrification using an oil reservoir microbial culture: Effects of sulphide loading rate and sulphide to nitrate loading ratio [J]. Water Research, 2010,44(5):1531-1541.
[23] Rotaru A E, Shrestha P M, Liu F, et al. Direct interspecies electron transfer betweenand[J]. Applied and Environmental Microbiology, 2014,80(15): 4599-4605.
[24] Huang L, Liu X, Tang J, et al. Electrochemical evidence for direct interspecies electron transfer betweenand[J]. Bioelectrochemistry, 2019,127:21-25.
[25] Wang Y, Bott C, Nerenberg R. Sulfur-based denitrification: Effect of biofilm development on denitrification fluxes [J]. Water Research, 2016,100:184-193.
[26] Kappler U, Bennett B, Rethmeier J, et al. Sulfite: Cytochrome coxidoreductase frompurification, characterization, and molecular biology of a heterodimeric member of the sulfite oxidase family [J]. Journal of Biological Chemistry, 2000, 275(18): 13202-13212.
[27] Takeuchi T L, Suzuki I. Effect of pH on sulfite oxidation bycells with sulfurous acid or sulfur dioxide as a possible substrate [J]. Journal of Bacteriology, 1994,176(3):913-916.
[28] Kappler U, Dahl C. Enzymology and molecular biology of prokaryotic sulfite oxidation [J]. Fems Microbiology Letters, 2001,203(1):1-9.
[29] Rohwerder T, Sand W. The sulfane sulfur of persulfides is the actual substrate of the sulfur-oxidizing enzymes from Acidithiobacillus and Acidiphiliumspp [J]. Microbiology-SGM, 2003,149(7):1699-1709.
Community structure and gene distribution of the surface and interstitial biofilm in the particle sulfur autotrophic denitrification.
LÜ Xiao-mei, WU Yi-cong, CHEN Gui-lian, XU Jian-hui, LIU Peng, HU jun-jie*
(Dongguan University of Technology, Dongguan 523808, China)., 2022,42(6):2764~2770
Bioinformation including microbial community structure, functional genes and metabolic pathways of surface and interstitial biofilms in the particle elemental sulfur autotrophic denitrification column were investigated in the present study. Bacterial diversity of microorganisms in the surface biofilm of sulfur particles was lower than that of interstitial biofilm. Differences in the abundance of functional genes for nitrogen metabolism were significant. Abundance of extracellular nitrate and nitrite transportation genes in the interstitial biofilm was much higher than that in the surface biofilm, with the abundance of 0.0792%, 0.109% and 0.0157%, 0.0314%. For reductive denitrification metabolism, the total gene abundance in surface biofilm was significantly lower than that in interstitial biofilm, with their abundance of 0.367%、0.406% respectively. Moreover, abundances of genes participated in denitrification process were remarkably different, especially the genes in the process of reducing nitrate to nitrite and nitrous oxide to nitrogen gas. Regarding sulfur metabolism, no obvious difference was observed. APS (adenosyl phosphosulfate) oxidation was the major pathway for oxidation of sulfite to sulfate, with its gene abundance was much higher than the direct oxidation pathway, and their abundances were 0.137% and 0.0005% (surface), 0.138% and 0.0007% (interstitial). Results indicated that microorganisms in interstitial biofilms cooperated with that in the surface biofilms, contributing to sulfur autotrophic denitrification synergistically.
sulfur autotrophic denitrification;biofilm;community structure;functional gene
X172
A
1000-6923(2022)06-2764-07
吕小梅(1984-),女,湖北襄阳人,博士,主要从事环境污染物生物治理与修复技术研究.发表论文50余篇.
2021-11-23
广东省自然科学基金项目(2019A1515110750,2021B1515140023);东莞市社会发展科技重点项目(2020507140150,20211800904652, 20211800905532)
* 责任作者, 副教授, hujunjie022@126.com
