硝酸根电化学还原去除过程阴极电位振荡研究
2022-06-29吴燕翔舒建成陈绍勤赵志胜唐金晶刘作华陈梦君
胡 玲,吴燕翔,舒建成*,陈绍勤,赵志胜,唐金晶,刘作华,陈梦君
硝酸根电化学还原去除过程阴极电位振荡研究
胡 玲1,吴燕翔2,舒建成1*,陈绍勤1,赵志胜1,唐金晶2,刘作华2,陈梦君1
(1.西南科技大学环境与资源学院,四川 绵阳 621000;2重庆大学化学化工学院,重庆 401331)
硝酸根在电化学还原去除过程中存在多价态变化行为,该过程是一个典型的远离平衡态的非线性体系.为探明硝酸根在去除过程中发生的电化学行为,研究了H2SO4浓度、电流、反应温度及NO3-浓度对阴极电位振荡的影响规律.采用循环伏安法、XRD、SEM-EDS及XPS表征方法,分析了反应体系循环伏安特性,以及反应前后阴极Cu表面的物相组成、微观形貌、表面电子价态等变化规律.研究结果表明,在恒流条件下(Pt作为阳极、Cu作为阴极),H2SO4-NaNO3体系发生了明显的电位振荡;当H2SO4浓度为0.10mol/L,电流为12mA,温度为20℃,NaNO3浓度为0.20mol/L最佳电位振荡条件下,振荡平均振幅为1.15V,振荡平均周期为3s.另外,硝酸根在电化学还原去除过程产生的周期性电位振荡主要原因是阴极Cu表面生成的致密CuO薄膜不断溶解和形成,以及阴极表面H2的周期性产生与消失.
硝酸根去除;电化学还原;非线性;电位振荡;阴极铜电极
NO3-是氮循环的重要组分之一,其主要来源是固氮菌固氮以及空气中N2和O2化合.饮用水中高浓度的硝酸盐会导致肝病、癌症[1]、“蓝宝宝综合症”等健康问题[2-3].欧盟规定饮用水中NO3-浓度成人不应超过50mg/L,儿童不应超过15mg/L(以NO3-计);美国EPA及我国均规定饮用水中NO3-浓度不应超过10mg/L(以NO3--N计).水源中NO3-污染的主要来源有过度使用的农业氮肥、固体垃圾渗滤液、工业废水及生活污水的随意排放和大气中含氮污染物的沉降[4],这也是大多数地区饮用水中的NO3-浓度超标的主要原因.
目前NO3-的去除方法包括物理化学方法、电化学还原法等.物理化学方法主要有电渗析[5]、反渗透[6]、离子交换树脂[7]及氢催化还原[8]等方法.然而上述方法有反应速率低、连续监测、副产物量大、H2消耗量大等缺点.电化学还原法具有选择性强、去除彻底、不需要还原剂、能在较高的NO3-浓度下使用且运行费用低等优势,引起了众多学者的关注.刘蕾等[9]以钛为阳极、石墨作为阴极,氯离子存在的酸性条件下,硝酸根的去除率达到97.1%.Wang等[10]构建铜改性活性炭为阴极、钛为阳极的电化学体系, 中性条件下处理30min,硝酸盐去除率96.05%.朱海洋[11]采用泡沫铁为阴极、Ru/IrO2为阴极,硝酸盐氮的去除率为97.41%.大量学者在不同电解体系中都实现NO3-的高效还原去除[8-11],但对NO3-在阴阳电极表面所发生的电化学行为研究还较少. Mukouyama等[12-13]研究发现,在强酸溶液中,NO3-在阴极铜上产生了非线性、周期性的电化学振荡现象;同时,在NO3-电化学还原过程中,电化学振荡现象伴随水还原而产生H2气泡.然而,该研究只对NO3-的电化学振荡现象进行了简单描述,并未做系统研究.
事实上,电化学振荡是指当电化学体系远离平衡时产生的一种时空有序的现象.在理论研究方面,可以从电化学振荡的周期性行为(如振荡的频率、振幅甚至波形等)中得到电极反应的信息,了解各基元步骤及各基元步骤之间耦联作用的本质,并推测可能发生的反应历程,完善电化学振荡行为的反应机理[14-15].此外,也可以利用电化学振荡体系在远离平衡条件下的特殊动力学行为来改进电催化、电合成和电沉积过程,从而调控各化学反应进程[16-17].因此,在恒流条件下(Pt为阳极、Cu为阴极),探究NO3-在电化学还原去除过程中的电化学振荡规律及过程机理,对处理含有NO3-类废水的治理具有指导意义.
本文探究了在H2SO4-NaNO3体系下,H2SO4浓度、电流大小、温度及NO3-浓度对NO3-电位振荡的影响规律,结合XRD、SEM-EDS、XPS等分析测试手段,分析了电化学振荡前后阴极铜电极表面的物相组成、微观形貌、表面电子价态变化情况.在此基础上,结合国内外研究现状,推导出了NO3-在阴极Cu产生电位振荡的主要原因,研究结果将为NO3-的电化学还原去除研究提供理论支持.
1 材料与方法
1.1 实验材料
电极材料:阳极材料Pt丝(=0.5mm,=0.5cm,纯度为99.99%)、阴极材料和参比电极材料Cu丝(=0.5mm,=0.5cm,纯度为99.99%),均于上海三麝实业有限公司购买.实验药品:硝酸钠(NaNO3,分析纯)于重庆北碚化学试剂厂购买;硫酸(H2SO4,分析纯)于成都市科龙化工试剂厂购买.实验用水均为超纯水(UPT-I,18.2MΩ·cm).
1.2 实验过程
实验装置如图1所示,由电极体系(Pt电极为阳极,Cu电极为阴极和参比电极)、电化学工作站(CHI660d,上海辰华仪器公司)以及电子计算机三部分组成.实验参数设置情况见表1.实验步骤如下:(1)电极的制备:取长度为10cm,直径为0.5mm的Pt丝和Cu丝,工作端长度为0.5cm,用PVC塑料管将非工作部分密封制成Pt电极和Cu电极;(2)电极的工作端部分用600#、800#及1000#的金相砂纸打磨光滑,用蒸馏水冲洗后采用超声波清洗机(DY-4.5-180DT)清洗5分钟,最后用蒸馏水冲洗净待用;(3)采用电化学工作站进行循环伏安扫和恒电流法扫描,依据振幅、周期及电解能耗筛选出电位振荡稳定、周期性明显的参数;(4)采用SEM-EDS、XRD和XPS分析电位振荡前后阴极Cu的微观形貌、物相以及元素电子价态变化规律,分析NO3-电化学还原去除过程阴极的电位振荡反应机理.

图1 电化学反应测试装置

表1 参数设置
1.3 分析方法
采用的循环伏安扫描模式均为Positive,扫描电压为0~6V,扫描速度为0.1V/s,采样间隔为0.001V,静置时间2s,灵敏度为0.1,扫描段数为6,实验结果分析时默认选用3~4段;采用的恒电流扫描模式均为Anodic,扫描电压为0~5V,阴阳极时间为10s,数据存储间隔为0.01s,扫描段数为1.Cu电极组成和特征采用X射线衍射仪(XRD,SHIMADZU-6000,日本)分析,微观形貌采用扫描电子显微镜-能谱仪(SEM- EDS, hitachi u8020 /8010,Zeiss Sigma HD)分析,元素电子价态采用X射线光电子能谱(XPS, Thermo Scientific Escalab 250Xi)分析.采用《地下水质检验方法-分光光度法测定亚硝酸根(DZ/T 0064.60-93)》方法测定溶液中NO2-浓度.
2 结果与讨论
2.1 硫酸浓度对阴极NO3-电位振荡规律的影响
由图2a可知,硫酸浓度为0.01mol/L时无振荡产生,硫酸浓度为0.05mol/L时有微弱的振荡产生,继续增大硫酸浓度为0.10,0.15,0.20mol/L时,产生规律性的电位振荡.结合图2b分析可知,当硫酸浓度为0.10mol/L和0.20mol/L时,随着时间的增加,振幅先增加再趋于稳定;当反应时间为100s时,振幅达到最大值;当硫酸浓度为0.15mol/L时,在0~100s振幅上升,100~400s趋于稳定,最后在400s及之后振荡消失.周期与振幅在相对应的时间序列呈现规律性的变化.当硫酸浓度为0.10mol/L时,随着电化学振荡的进行,周期先上升后缓慢下降,当反应时间为100s时达到最大值3.2s,100s之后周期缓慢减小,最小值为2.4s;当硫酸浓度为0.15mol/L时,周期先急剧上升,再缓慢上升,最后急剧下降,在反应时间为300s时达到最大值4.4s,400s之后周期为0;硫酸浓度为0.20mol/L时,从反应100s后开始,在振荡周期值为5.0s的附近上下波动.由图2c电解能耗分析可知,电位振荡的基准高电位和低电位都随着硫酸浓度的增大而减小,这表明电解能耗随着硫酸浓度的增大而减弱.综上可知,当硫酸浓度为0.10mol/L时,体系的电位振荡更稳定、周期性更明显.

0.20mol/L NaNO3、电流12mA、温度20℃、电极间距0.5cm
2.2 电流对阴极NO3-电位振荡规律的影响
由图3a可知,电流值为4mA时未出现电位振荡,电流值在8mA、12mA、16mA三个体系中,电位振荡的波峰数量随电流增大而增加,周期性更加显著.当电流为20A时,振荡消失,这表明电流在8~16mA处于交叉环内[18]伴随着正负反馈发生.
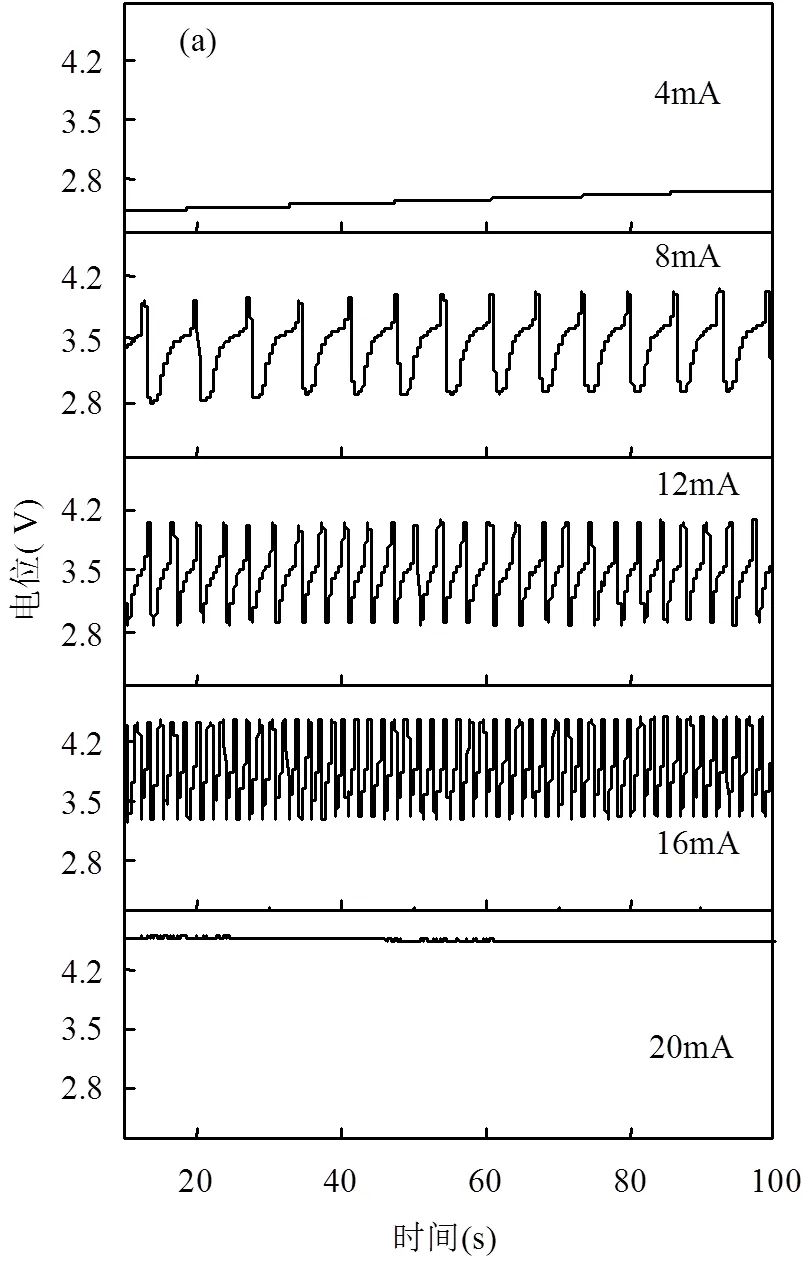
0.10mol/L H2SO4、0.20mol/L NaNO3、温度20℃、电极间距0.5cm
由图3b可知,4mA和20mA两个体系下,未发生电位振荡,故周期和振幅均为0;电流在8~16mA下,平均振幅随着电流的增大而增大,平均周期随着电流的增大而减小.在8mA时平均振幅为1.0V,16mA时平均振幅为1.2V;在8mA时平均周期为5.5s, 16mA时平均周期降到1.6s,这说明电流对NO3-的电位振荡有促进作用.由图3c可知,基准高、低电位随电流值的增大而线性增大,表明电解能耗随电流值的增大而增大;当电流为12mA时,基准高电压和基准低电压分别为4.1V和3V.综上可知,电流为12mA体系电位振荡最稳定.
2.3 温度对阴极NO3-电位振荡规律的影响
在电化学振荡过程中,体系温度增加导致平衡常数值增加,振荡的频率逐渐增加,当超过温度阈值,导致电流振荡消失[19].由图4a可知,温度为80℃时,振荡时间较短,仅为160s,这表明当温度超过80℃时,电流随着时间变化无周期性,电流振荡消失.在20~65℃内,电位振荡呈规律性的周期性变化,温度升高,平均振幅先增大再减小,平均周期先减小后增大.由图4b可以看出,随着体系温度的升高,低温区域(20~50℃)平均振幅缓慢升高,50℃时平均振幅为1.4V,平均周期缓慢下降,从3s降为2.5s;高温区域(50~80℃)平均振幅下降,80℃时平均振幅降为1.8V,平均周期先急剧上升到4.7s后又急剧下降至1.8s.电解质的传质速率会随着温度的升高而增大,在20~50℃温度传质速率适当,传质过程与NO3-的电化学过程耦合效率较高,产生的NO3-电化学振荡效果明显;而当温度升高至65℃甚至80℃时,传质速率过高导致耦合效率较低,进而导致电位振荡不稳定.由图4c可知随着体系温度的升高,基准高电位及基准低电位均线性减小,基准高电位从4.10V降至3.33V,基准低电位从2.91V降至2.38V,表明电解能耗随着体系温度的升高而减小,温度升高对NO3-的电位振荡有减弱作用.综上可知,温度为20℃体系电位振荡最稳定.

0.10mol/L H2SO4、0.20mol/L NaNO3、电流12mA、电极间距0.5cm
2.4 NO3-浓度对NO3-电位振荡规律的影响

0.10mol/L H2SO4、电流12mA、温度20℃、电极间距0.5cm
由图5a可知,NO3-浓度为0.10mol/L时未出现振荡,NO3-在0.15~0.25mol/L内电位振荡的幅度和频率呈现出周期性的变化,当NO3-浓度为0.30mol/L时,电位振荡信号消失,表明随着NO3-浓度的增加,电位振荡呈现先增大再减弱的变化趋势,并且NO3-浓度过高会抑制体系内NO3-的还原以及CuO的生成与溶解.由图5b可知,NO3-浓度在0.10mol/L和0.30mol/L时未发生电位振荡,振幅和周期均为0;但NO3-浓度在0.15~0.25mol/L内,随着NO3-浓度升高平均振幅减小,最后稳定在1.15V,且平均周期增大,振荡诱导期变长.基准电位的变化情况如图5c所示,除NO3-浓度为0.10mol/L和0.30mol/L外,随着NO3-浓度的升高,基准高电位和基准低电位均先增大后减小,表明电解能耗先增加后减少.综上可知,NO3-浓度为0.20mol/L时电位振荡最稳定,平均振幅为1.15V,平均周期为3s.
2.5 机理分析
图6循环伏安曲线可知,在电位4V和4.15V附近出现了明显的还原峰,说明NO3-阴极区发生了电化学还原,溶液中的NO3-被还原为NO2-、NH4+和N2[29-30,34];在3~5V区间内不仅出现了振荡峰,还出现了因多个反扫电流值大于正扫电流值而形成的封闭交叉环,这表明该体系存在相互重叠的正负反馈机制,并且每一对相互交叠的正负反馈还可能对应多个电极反应[18].根据交叉环实验判据[20-21],正反馈和负反馈交替出现于统一区间,是电化学振荡产生的必要条件,也是电化学振荡现象的基本特征之一.循环伏安曲线图中在3~4V和4~5V两个区间内发生多个因电流突跃形成窄而尖锐的交叉环,表明在此电势范围能够发生电流振荡现象.
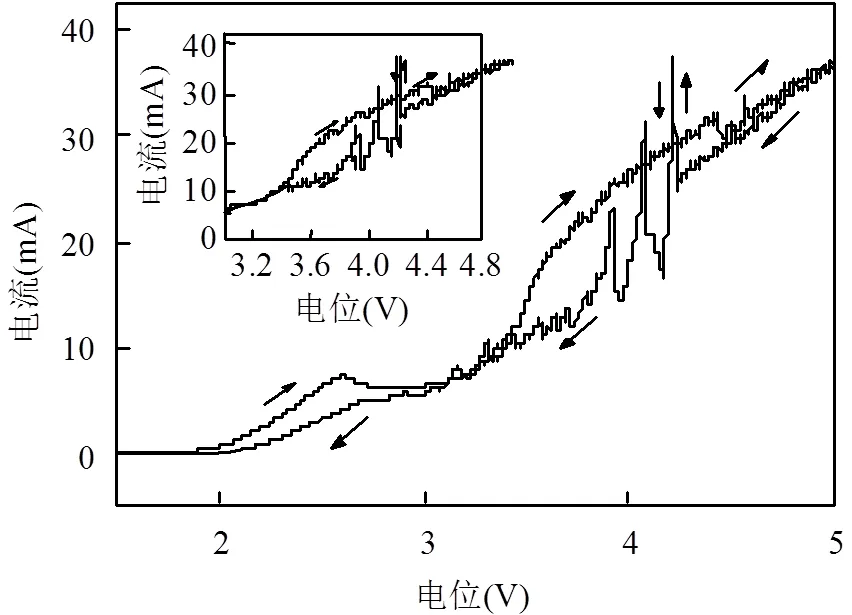
图6 循环伏安曲线
0.10mol/L H2SO4、0.20mol/L NaNO3、温度20℃、电极间距0.5cm、电位0~6V、扫描速度50mA·s-1
阴极Cu表面的物相分析如图7所示,反应前后在2为74.12°、50.45°及43.32°处均出现具有晶型结构的Cu峰,其分别对应Cu(111)、Cu(200)和Cu(220)晶面,但反应后对应Cu的衍射峰强度变弱,其原因是电解后阴极Cu表面生成了一层氧化物.根据图8、图9反应前后阴极Cu的SEM分析可知,在低倍数下表面呈现平整、光滑结构;在高倍数下反应前阴极Cu表明存在少量的凹凸、沟壑,这是铜丝本身的原因;同时观察到反应后阴极Cu表面轮廓模糊、呈蓬松状,其原因是反应过程表面发生腐蚀或者生成氧化膜.结合Cu、O、N、Na、S的EDS能谱分析,反应后阴极Cu表面的铜含量微量减少、氧含量微量增加,同时根据Mapping分析可知,电解前后阴极Cu表面的Cu、O、N、Na、S分布均匀且颜色变化不大,说明阴极表面元素含量变化不大,且XRD中未发现CuO明显的特征峰,结合现有其它研究结果[22-24],分析产生上述现象的原因是阴极Cu表面产生的CuO薄膜在不断生成和溶解.
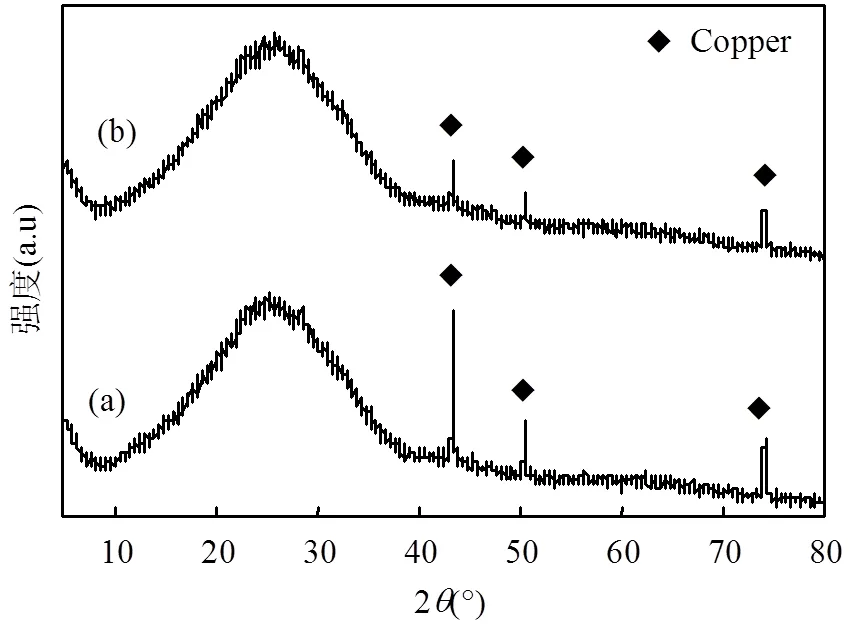
图7 阴极铜XRD谱图 (a-反应前和 b-反应后)
0.10mol/L H2SO4、0.20mol/L NaNO3、电流12mA、温度20℃、电极间距0.5cm

图8 反应前阴极铜SEM图
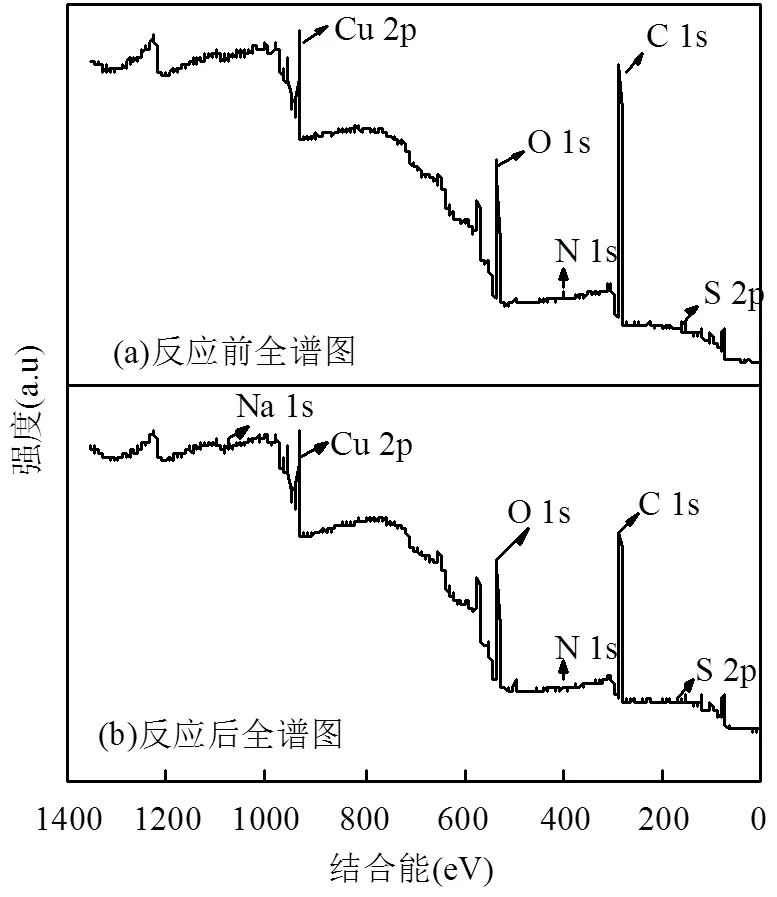
从图10a和图10b对比可以看出,反应后阴极Cu存在Na元素,这表明溶液中的Na+被吸附到电极表面.此外,反应前Cu电极表面检测到O、N、S元素,原因是O2、N2及硫氧化物被吸附到电极表面.图10(a1)是反应前Cu2p的XPS光谱图,使用XPS PeakFit4.1分峰软件对Cu2p谱峰进行了拟合,共分为7个特征峰.结果显示在932.51eV、933.55eV和934.9eV位置的特征峰属于sp2杂化的铜[25-26],在952.39eV和954.28eV位置的特征峰属于sp杂化的铜,而在941eV和944eV处微弱的卫星峰表明存在sp2杂化的CuO,结果表明阴极Cu表面可能氧化生成了CuO.同图10(b1)相比,反应后的Cu和CuO峰结合能出现偏移,其中在935.46eV位置的特征峰处属于sp2杂化的铜,对应CuSO4的结合能[26],说明电解液中的SO42-被吸附到电极表面;在941eV和944eV处的卫星峰增强[27],则表明电化学振荡后铜电极表面的吸附膜为CuO.

图9 反应后阴极铜SEM 图
0.10mol/L H2SO4、0.20mol/L NaNO3、电流12mA、温度20℃、电极间距0.5cm、电化学振荡时间1000s
0.10mol/L H2SO4、0.20mol/L NaNO3、电流12mA、温度20℃、电极间距0.5cm


图12 亚硝酸根浓度变化
0.10mol/L H2SO4、0.20mol/L NaNO3、电流12mA、温度20℃、电极间距0.5cm
根据XRD、SEM-EDS和XPS综合分析可知,阴极Cu表明能产生电位振荡,其原因是Cu电极表面生成了一层CuO吸附膜,随着电化学反应的进行,吸附膜不断地形成和溶解.此外,阴极区域H2的周期性产生促进CuO吸附膜的溶解.实验观察到阳极Pt表面因电解水连续产生大量气泡(O2),而在振荡产生起阴极Cu出现间断性气泡,Mukouyama等[10-11]证明Cu电极表面产生的气泡是由于水还原产生H2.然而,体系可能还存在一系列副反应,使溶液中的NO3-被还原为NO2-、NH4+、N2.实验过程中观察到当铜电极表面从电极底端迅速产生气泡,此时振荡波形呈上升趋势,实验现象如图11a所示,波形对应图11c中①~②;当气泡消失时振荡波形呈下降趋势,无气泡产生时电化学振荡消失,实验现象如图11b所示,波形对应图11c中②~③.由此可以看出,体系内周期性振荡信号的发生与阴极铜表面气泡产生消失有关.采用《地下水质检验方法-分光光度法测定亚硝酸根(DZ/T 0064.60-93)》检测溶液中的NO2-浓度.由图12可知,随着电化学振荡时间的增大,溶液中NO2-浓度呈现先增大再平缓的趋势.另外,结合国内外电化学还原硝酸根研究进展[28-36],阴极Cu表面产生电位振荡过程可能发生的化学反应式如下:
(Cu·)ads+ NO3-→ (Cu·NO3-) + 2H+→ [CuPt]ads+NO2-+ H2O(1)
[CuPt]ads→ (Cu·)ads(2)
H2Oads→ 2H++ 1/2O2+ 2e-(3)
1/2O2→ (O·)ads(4)
(Cu·)ads+(O·)ads→ CuOads(5)
2H2O +2e-→ H2+ 2OH-(6)
CuO + H2→ Cu+ H2O(7)
NO3-+ 6H++ 5e-→ 1/2N2+ 3H2O(8)
2NO3-+ 3H2→ N2+ 2OH-+ 2H2O(9)
NO3-+ H++2e-→ NO2-+ H2O(10)
NO2-+ 4H++ 3e-→ 1/2N2+ 2H2O(11)
NO3-+ 3H2→ NH4++ 2OH-(12)
3 结论
3.1 在恒流条件下(Pt作为阳极、Cu作为阴极), H2SO4-NaNO3体系发生了明显的电位振荡,当H2SO4浓度为0.10mol/L,电流为12mA,温度为20℃,NaNO3浓度为0.20mol/L时,振荡振幅为1.15V,振荡周期为3s.
3.2 硝酸根在电化学还原去除过程产生的周期性电位振荡其主要原因是阴极Cu表面生成的致密CuO薄膜不断溶解和形成,以及阴极表面H2的周期性产生与消失.
[1] Ward M H, Jones R R, Brender J D, et al. Drinking water nitrate and human health: an updated review [Z]. 2018:1557.
[2] Rayaroth M P, Aravindakumar C T, Shah N S, et al. Advanced oxidation processes (AOPs) based wastewater treatment - unexpected nitration side reactions - a serious environmental issue: A review [J]. Chemical Engineering Journal, 2022,430:133002.
[3] 毕晶晶,彭昌盛,骨慧真.地下水硝酸盐污染与治理研究进展综述[J]. 地下水, 2010,32(1):97-102.
Bi J J, Peng J S, G H Z. Summary of research progress on groundwater nitrate pollution and treatment [J]. Groundwater, 2010,32(1):97-102.
[4] 张 鑫,张 妍,毕直磊,等.中国地表水硝酸盐分布及其来源分析[J]. 环境科学, 2020,41(4):1594-1606.
Zhang X, Zhang Y, Bi Z L, et al. Distribution and source analysis of nitrate in surface water in China [J]. Environmental Science, 2020,41 (4):1594-1606.
[5] 叶舒帆,张 杨,宋跃群,等.非贵金属催化电解无害化去除硝酸盐氮的反应机制[J]. 环境化学, 2013,(5):755-761.
Ye S F, Zhang Y, Song Y Q, et al. The reaction mechanism of non- precious metal catalyzed electrolysis harmless removal of nitrate nitrogen [J]. Environmental Chemistry, 2013,(5):755-761.
[6] 迟 峰.反渗透法脱除地下水中硝酸盐的研究[D]. 上海:华东理工大学, 2011.
Chi F. Research on removal of nitrate from groundwater by reverse osmosis method [D]. Shanghai: East China University of Science and Technology, 2011.
[7] Kalaruban M, Loganathan P, Shim W G, et al. Removing nitrate from water using iron-modified Dowex 21K XLT ion exchange resin: Batch and fluidised-bed adsorption studies [J]. Separation and Purification Technology, 2016,158:62-70.
[8] 张志强.电化学/催化加氢耦合工艺去除水中硝酸盐氮的效能研究[D]. 哈尔滨:哈尔滨工业大学, 2014.
Zhang Z Q. Study on the efficiency of electrochemical/catalytic hydrogenation coupling process for removing nitrate nitrogen from water [D]. Harbin: Harbin Institute of Technology, 2014.
[9] 刘 蕾,张冬梅,褚衍洋.电化学法去除水中的硝酸根[J]. 环境工程学报, 2013,7(11):4195-4200.
Liu L, Zhang D M, Chu Y Y. Electrochemical removal of nitrate from water [J]. Journal of Environmental Engineering, 2013,7(11):4195- 4200.
[10] Wang Q, Huang H, Wang L, et al. Electrochemical removal of nitrate by Cu/Ti electrode coupled with copper-modified activated carbon particles at a low current density [J]. Environmental Science and Pollution Research. 2019,26(17):17567-17576.
[11] 朱海洋.电催化还原/氧化协同去除废水中硝酸盐氮的研究 [D]. 天津:河北工业大学, 2020.
Zhu H Y. Study on the synergistic removal of nitrate nitrogen from wastewater by electrocatalytic reduction/oxidation [D]. Tianjin: Hebei University of Technology, 2020.
[12] Mukouyama Y, Yamamoto S., Nakanishi S, et al Newly found electrochemical oscillations during reduction of nitrate ions [J]. ECS Transactions, 2013,50(48):61-70.
[13] Mukouyama Y, Yamamoto S., Nakanishi S, et al Electrochemical oscillations during reduction of nitrate ions on Cu and Ag [J]. ECS Transactions, 2014,58(25):85-97.
[14] 丁莉峰,陈冲艳,邹子荣,等.电化学研究过程中金属电极的电流和电势振荡行为[J]. 电镀与涂饰, 2020,39(11):722-732.
Ding L F, Chen C Y, Zhou Z R, et al. Current and potential oscillation behavior of metal electrodes in the process of electrochemical research [J]. Plating and Finishing, 2020,39(11):722-732.
[15] Calderón-Cárdenas A, Hartl F W, Gallas J A C, et al. Modeling the triple-path electro-oxidation of formic acid on platinum: Cyclic voltammetry and oscillations [J]. Catalysis Today, 2021,359:90-98.
[16] Matsuda T, Hommura H, Mukouyama Y, et al. New current and potential oscillations for reduction reactions on platinum electrodes in Acid Solutions Containing High Concentration Hydrogen Peroxide [J]. Journal of The Electrochemical Society. 1997,144(6):1988-1994.
[17] Moradighadi N, Nesic S, Tribollet B. Identifying the dominant electrochemical reaction in electrochemical impedance spectroscopy [J]. Electrochimica Acta. 2021,400:139460.
[18] Li Z, Ren B, Niu Z, et al. On the criteria of instability for electrochemical systems [J]. Chinese journal of chemistry. 2002,20(7): 657-662.
[19] 杨殿鹏.氧化锰催化电流振荡对电解锰阳极的影响 [D]. 重庆:重庆大学, 2015.
Yang D P. Effect of catalytic current oscillation of manganese oxide on electrolytic manganese anode [D]. Chongqing: Chongqing University, 2015.
[20] 侯 军.电解锰阳极过程动力学的研究 [D]. 重庆:重庆大学, 2013.
Hou J. Study on the kinetics of electrolytic manganese anode process [D]. Chongqing: Chongqing University, 2013.
[21] 白 佛.碳基/过渡金属(Co、Cu)氧还原催化剂的制备及其电化学性能研究[D]. 长春:吉林大学, 2016.
Bai F. Preparation of carbon-based/transition metal (Co, Cu) oxygen reduction catalysts and their electrochemical properties [D]. Changchun: Jilin University, 2016.
[22] Li T, Cao S, Yang C, et al. Electrochemical water oxidation by in situ-generated copper oxide film from [Cu(TEOA)(H2O)2] [SO4] complex [J]. Inorganic Chemistry, 2015,54(6):3061-3067.
[23] Chen H, Gao Y, Lu Z, et al. Copper oxide film in-situ electrodeposited from Cu(II) complex as highly efficient catalyst for water oxidation [J]. Electrochimica Acta, 2017,230:501-507.
[24] 印霞棐,李秀芬,华兆哲,等.铜纳米线导电微滤膜的制备、性质表征及应用 [J]. 中国环境科学, 2018,38(10):3729-3738.
Yin X N, Li X F Hua Z Z, et al. Preparation, property characterization and application of copper nanowire conductive microfiltration membranes [J]. China Environmental Science. 2018,38(10):3729- 3738.
[25] 招国栋,凌显勇,邓真宁,等. FeCu/BT的绿色合成及其除铀性能研究[J]. 工业水处理, 2020,40(12):83-87.
Zhao G D, Ling X Y, Deng Z N, et al. Green synthesis of FeCu/BT and its uranium removal performance [J]. Industrial Water Treatment, 2020, 40(12):83-87.
[26] 柴晴雯,吕 艳,张 周,等.Cu2O@ZnO复合光催化剂对难生物降解有机物的光降解 [J]. 中国环境科学, 2019,39(7):2822-2830.
Chai Q W, Lv Y, Zhang Z, et al. Photodegradation of refractory organic compounds by Cu2O@ZnO composite photocatalyst [J]. China Environmental Science. 2019,39(7):2822-2830.
[27] 方梦媛.铜基类芬顿催化剂的制备及其光助氧化性能研究[D]. 上海:上海交通大学, 2019.
Fang M Y. Preparation of copper-based Fenton-like catalysts and their photo-assisted oxidation performance [D]. Shanghai: Shanghai Jiao Tong University, 2019.
[28] 李金城,宋永辉,汤洁莉.电化学氧化法去除兰炭废水中COD和NH3-N [J]. 中国环境科学, 2022,42(2):697-705.
Li J C, Song Y F, Tang J L. Electrochemical oxidation for the removal of COD and NH3-N from lancet wastewater [J]. China Environmental Science. 2022,42(2):697-705.
[29] 施翼杰.电化学方法去除水中NO3-离子的研究[D]. 杭州:浙江工业大学, 2019.
Shi Y J. Study on the removal of NO3-ions from water by electrochemical methods [D]. Hangzhou: Zhejiang University of Technology, 2019.
[30] 张冬梅.电化学催化还原去除水中NO3-的研究[D]. 青岛:青岛科技大学, 2013.
Zhang D M. Electrochemical catalytic reduction of NO3-in water [D]. Qingdao: Qingdao University of Science and Technology, 2013.
[31] Yang P, Ji Y, Lu J. Transformation of ammonium to nitrophenolic byproducts by sulfate radical oxidation [J]. Water Research. 2021, 202:117432.
[32] Hasnat M A, Rashed M A, Ben Aoun S, et al. Dissimilar catalytic trails of nitrate reduction on Cu-modified Pt surface immobilized on H+conducting solid polymer [J]. Journal of Molecular Catalysis A: Chemical, 2014,383-384:243-248.
[33] de Vooys A C A, van Santen R A, van Veen J A R. Electrocatalytic reduction of NO3−on palladium/copper electrodes [J]. Journal of Molecular Catalysis A: Chemical, 2000,154(1):203-215.
[34] 李 弯.电化学还原去除废水中硝酸盐氮的研究[D]. 南京:南京航空航天大学, 2017.
Li W. Study on the removal of nitrate nitrogen in wastewater by electrochemical reduction [D]. Nanjing: Nanjing University of Aeronautics and Astronautics, 2017.
[35] 侯明涛.电化学还原水中NO3-的铜电极改性研究[D]. 北京:北京化工大学, 2016.
Hou M T. Study on copper electrode modification for electrochemical reduction of NO3-in water [D]. Beijing: Beijing University of Chemical Technology, 2016.
[36] 顾雨薇,李 雪,陈 硕,等.高盐水中硝酸根的电化学去除方法[J]. 科学通报, 2020,65(26):2880-2894.
Gu Y W, Li X, Chen S, et al. Electrochemical removal method of nitrate in high salt water [J]. Chinese Science Bulletin, 2020,65(26): 2880-2894.
Potential oscillation of cathode in nitrate electrochemical reduction removal process.
HU Ling1, WU Yan-xiang2, SHU Jian-cheng1*, CHEN Shao-qin1, ZHAO Zhi-sheng, TANG Jin-jing2, LIU Zuo-hua2, CHEN Meng-jun1
(1.School of Environment and Resource, Southwest University of Science and Technology, Mianyang 621000, Sichuan, China;2.School of Chemistry and Chemical Engineering, Chongqing University, Chongqing 401331, China),, 2022,42(6):2662~2670
Nitrate has a polyvalent behavior in electrochemical reduction removal process, it is a typical nonlinear system far from equilibrium. To investigate the electrochemical behavior of nitrate during the removal process, the influence of H2SO4concentration, current, reaction temperature and NO3-concentration on cathode potential oscillation was systematically studied. The cyclic voltammetry characteristics of the reaction system and the changes of the phase composition, microstructure and surface electron valence state of the cathode Cu surface before and after the reaction were analyzed by cyclic voltammetry, XRD, SEM-EDS and XPS. The results show that the H2SO4-NaNO3system had obvious potential oscillation under constant current conditions (Pt as anode and Cu as cathode). When concentration of H2SO4and NaNO3were separately 0.10, 0.20mol/L, the current 12mA, the temperature 20℃, the oscillation average amplitude was 1.15V and the oscillation average period was 3s. In addition, the periodic potential oscillation of nitrate in the process of electrochemical reduction removal was mainly caused by the continuous dissolution and formation of the dense CuO film on the Cu surface of the cathode, and periodic generation and disappearance of H2on cathode surface.
nitrate removal;electrochemical reduction;nonlinearity;potential oscillation;cathode copper electrode
X703
A
1000-6923(2022)06-2662-09
胡 玲(1995-),女,四川邻水人,西南科技大学硕士研究生,主要从事污染控制化学方面研究.
2021-11-08
国家自然科学基金资助项目(52174386)
* 责任作者, 教授, shujc@swust.edu.cn
