反硝化除磷工艺实现亚硝酸盐积累的参数优化
2022-06-29隋倩雯高超龙徐东耀魏源送
狄 斐,隋倩雯,高超龙,钟 慧*,徐东耀,魏源送,3
反硝化除磷工艺实现亚硝酸盐积累的参数优化
狄 斐1,2,隋倩雯1,高超龙1,2,钟 慧1*,徐东耀2,魏源送1,3
(1.中国科学院生态环境研究中心,水污染控制实验室,北京 100085;2.中国矿业大学(北京)化学与环境工程学院,北京 100089;3.江西省科学院能源研究所,南昌 330096)
为促进反硝化除磷与厌氧氨氧化工艺的耦合,实现污水氮、磷的同步高效去除,构建序批式反应器(Sequencing batch reactor, SBR),优化了反硝化除磷工艺实现亚硝酸盐积累的工艺参数.SBR在厌氧-缺氧-微好氧运行条件下,缺氧段投加模拟硝酸盐工业废水逐步实现了反硝化除磷过程的亚硝酸盐积累.结果表明,经过142d的培养驯化,在进水C/P比为55时,缺氧段引入NO3--N浓度为23mg/L时,亚硝酸盐积累率为51.01%,NO3--N→NO2--N转化率为40.22%,硝酸盐去除率为72.14%,PO43--P去除率最高达88.17%.出水COD浓度低于25mg/L,COD去除率维持在90%以上.微生物群落结构分析表明,拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)为系统内优势菌门.通过参数优化实现了聚磷菌的驯化,Accumulibacter为代表的反硝化聚磷菌丰度增加(累积丰度由1.49%增加到5.08%),以Competibacter为代表的反硝化聚糖菌丰度增加更为明显(累积丰度由1.02%增加到15.49%),聚磷菌与聚糖菌的共同作用有利于实现除磷过程的亚硝酸盐累积.
反硝化除磷;部分反硝化;亚硝酸盐积累;微生物群落
城镇污水处理厂排放的氮、磷是我国部分湖泊和河流发生富营养化的主要原因之一,对人体健康及生态环境造成极大危害[1],因此城镇污水厂的脱氮除磷是行业研究与发展的热点问题.
目前污水除磷主要有生物法和化学法,但化学除磷[2]需要投加大量药剂并产生大量化学污泥,不仅会对环境产生进一步影响,也导致处理成本的大幅增加.生物除磷[3]指利用聚磷菌(Phosphorus Accumulating Organism, PAOs)在厌氧条件下进行磷酸盐的释放,再利用氧气为电子受体进行过量吸磷,最后通过排出富磷污泥达到除磷的效果.传统的生物除磷工艺存在碳源竞争、剩余污泥产量高等问题[4-5].20世纪90年代,Kuba等[6]发现了反硝化除磷菌(Denitrifying Phosphorus Accumulating Organisms, DPAOs),其与传统聚磷菌具有相似的代谢机制,但DPAOs利用NOx--N(NO2--N或NO3--N)代替O2作为电子受体实现氮、磷的同步去除,克服了传统生物除磷工艺聚磷菌和反硝化菌竞争碳源的矛盾.Lu等[7]构建具有反硝化除磷(Denitrifying Phosphorus Removal,DPR)功能的多级缺氧-好氧反应器处理模拟废水,结果表明在节约曝气能耗及碳源需求的优势下,系统可以实现碳、氮、磷的同步去除.
随着主流厌氧氨氧化工艺的兴起,部分反硝化(Partial denitrification, PD)为厌氧氨氧化工艺提供亚硝酸盐得到一定研究[8].反硝化聚糖菌(Denitrification Glycogen Accumulating Organisms, DGAOs)驱动的内源性部分反硝化可实现亚硝酸盐积累,Wang等[9]研究发现内源反硝化过程亚硝酸盐积累率可达到53%~67%.本文通过提高反硝化除磷过程产生的亚硝酸盐浓度,促进厌氧氨氧化工艺与生物除磷工艺的耦合,能够实现碳、氮、磷的同步去除.
本研究接种城市污水处理厂的活性污泥,在厌氧与缺氧阶段引入人工配水和模拟硝酸盐工业废水,探究影响反硝化除磷和亚硝酸盐积累的工艺参数,以及碳源在不同异养菌间的分配.本研究结果将为反硝化除磷耦合厌氧氨氧化工艺,促进低浓度污水的同步高效脱氮除磷提供技术支撑.
1 材料与方法
1.1 实验装置
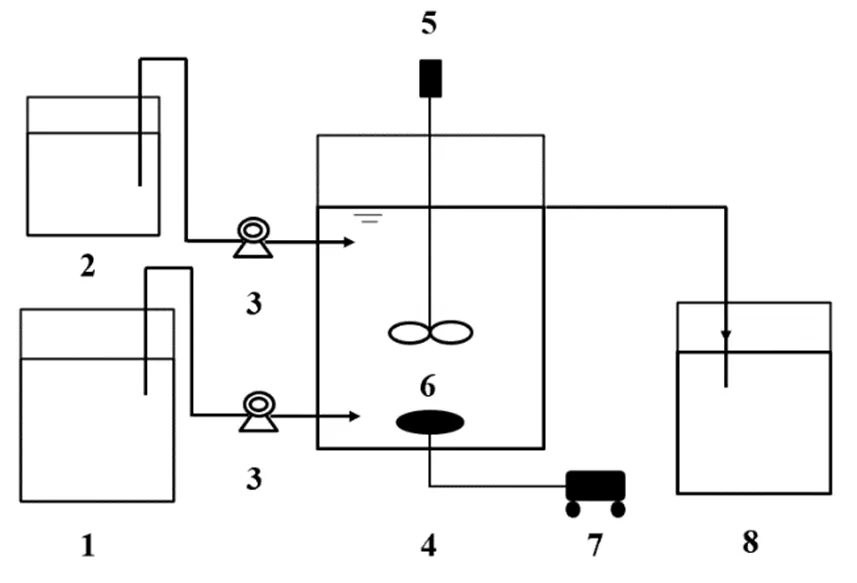
图1 反应装置示意
1.模拟污水进水箱;2.模拟NO3--N废水进水箱;3.进水泵;4.SBR反应器;5.搅拌器;6.曝气盘;7.空气压缩机;8.出水箱
实验装置采用有机玻璃制成的长方体形的序批式活性污泥反应器(Sequencing Batch Reactor, SBR),具体见图1.有效容积为10L(长´宽´高=20cm× 30cm×30cm).反应器采用全混反应器构型,顶部配有机械搅拌装置,底部装有微孔曝气盘,采用空气压缩机(V-10,海利)及气体流量计(LZB-1WB,中国振兴)控制曝气强度.蠕动泵、搅拌器、空气压缩机采用时控开关(KG316T,德力西)控制,实现进水、搅拌、曝气、沉淀、闲置、排水等工序.
1.2 反应器进水和接种污泥
实验用水为人工配水,以乙酸钠为有机碳源, KH2PO4为磷源,模拟NO3--N工业废水采用KNO3配制,并投加微生物生长所需的微量元素[3].
反应器接种污泥取自河北某城市污水处理厂生化反应池,该污泥具有稳定的除磷效果,PO43--P去除率稳定在80%以上.接种后反应器内污泥浓度约为3500mg/L.
1.3 实验设计与运行
反应器共运行142d.阶段I采用厌氧-好氧运行模式实现PAOs的驯化,每天运行4个周期,共运行30d.阶段II至IV采用厌氧-缺氧-微好氧运行方式,实现DPAOs和DGAOs的富集,每天运行3个周期,每周期运行8h,其中,在缺氧初投加模拟硝酸盐工业废水,投加量根据不同进水COD浓度进行调整,使阶段II~IV,进水COD/P比分别为25、40和55,厌氧初COD浓度与缺氧初NO3--N浓度之比维持在6.0左右.
SBR排水比为50~60%,水力停留时间为12.0~ 16.0h.系统通过排泥保证MLSS维持在3000~ 3500mg/L,SRT为25~30d.反应器在室温条件下运行,温度18~24ºC,具体运行参数见表1.

表1 反应器运行操作参数与水质浓度
注:*DO为好氧阶段溶解氧浓度,**该NO3--N浓度为经搅拌混合后缺氧初的NO3--N浓度.
1.4 分析方法
根据《水和废水监测分析方法》(第四版)测定水质指标,其中PO43--P采用钼锑抗分光光度法; NH4+-N采用纳氏试剂分光光度法;NO2--N采用N-(1-萘基)-乙二胺光度法;NO3--N采用紫外分光光度法;COD采用HACH试剂测定;DO为在线电极检测(WTW, Multi 340i,Germany).
为考察系统中各阶段的微生物菌群结构变化,采集接种及四个阶段的污泥样品进行菌群分析.DNA提取、PCR扩增和高通量测序技术根据标准指导方法进行[10].污泥样品(混合液5mL)DNA提取,采用FASTDNA Spin Kit for Soil (MP Biomedicals, USA)提取DNA.采用PCR技术扩增16S rRNA基因,扩增区域采用了V4区515F(GTG- CCAGCMGCCGCGGTAA)和806R(GGACTACHV- GGGTWTCTAAT),对提取的总DNA进行PCR扩增、建库,于Illumina Mi Seq PE 300高通量测序平台进行高通量测序[11].原始数据已提交至NCBI,登录号为PRJNA647062.
1.5 计算方法
亚硝酸盐氮积累率(NO2--N accumulation rate,NAR)、硝酸盐转化率(Nitrate-to-nitrite transformation ratio,NTR)、硝酸盐去除率(NO3--N removalrate,NRR)、污染物去除率()、内碳源储存量(CODintra)、内碳源储存率(CODintraefficiency)、PAOs和聚糖菌(Glycogen Accumulating Organism, GAOs)在厌氧段对内碳源储存贡献(PAO,ɑ和GAO,ɑ)的计算如公式所示.




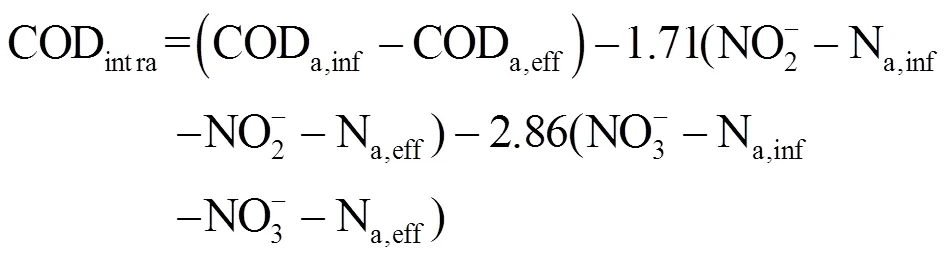
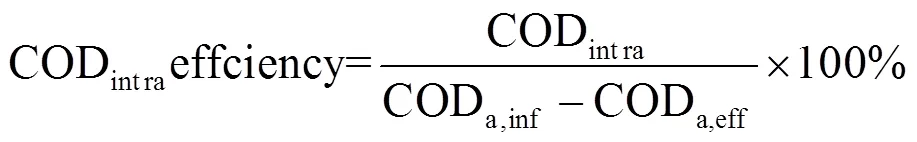
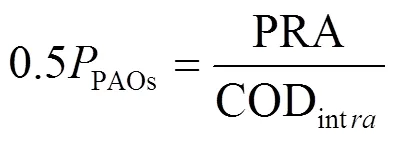

式中:NO2--Nan,inf、NO2--Nan,eff与NO3--Nan,inf与NO3--Nan,eff分别为缺氧初和缺氧末亚硝酸盐氮与硝酸盐氮浓度(mg/L);Cnf与eff为系统污染物进、出水浓度(mg/L);CODa,inf与CODa,eff分别为厌氧初与厌氧末COD浓度(mg/L);NO2--Na,inf、NO2--Na,eff与NO3--Na,inf与NO3--Na,eff分别为厌氧初始和末期亚硝酸盐氮与硝酸盐氮浓度(mg/L),2.86和1.71为每单位NO3--N、NO2--N发生反硝化时COD理论消耗量;PRA为厌氧段磷酸盐释放量(mg/L),0.5为理论计量系数[12].
2 结果与讨论
2.1 不同运行阶段N、P去除效果
第一阶段(1~30d),反应器在厌氧-好氧交替条件下运行,如图2(a)所示,系统进水的PO43--P浓度为5.80mg/L,厌氧末PO43--P浓度由最初的9.15mg/L稳定到11mg/L左右,平均释磷量(PRA)为8.21mg/L.好氧段DO浓度为1.0~2.0mg/L,出水PO43--P浓度轻微波动,最终稳定在0.7mg/L, PAOs在好氧段发生了过量吸磷,吸磷量(PUA)达10.39mg/L,系统PO43--P去除率为87.64%.接种污泥较快的实现了PAOs的富集,具备稳定的除磷效果.
第二阶段(31~72d),该阶段采用厌氧-缺氧-微好氧运行方式,缺氧初引入模拟硝酸盐废水,使系统NO3--N浓度达10mg/L,调整进水COD、PO43--P浓度分别为120,5mg/L.经过40d的污泥驯化,反硝化除磷效果逐渐增强,缺氧末PO43--P浓度降低至2mg/L左右.缺氧末NO2--N、NO3--N分别为0.39、3.65mg/L,NAR、NTR、NRR为9.65%、6.14%、63.5%.系统出水PO43--P浓度为0.81mg/L,去除率为75.29%,亚硝酸盐积累效果差,NO2--N浓度仅为0.05mg/L.分析原因在较低C/P比条件下异养反硝化菌会优先利用污水中的有机碳源进行外源反硝化[13],使得PAOs释磷过程中碳源不足且内碳源储存量减少,导致后续吸磷过程及部分反硝化可利用的内碳源不足,引起出水PO43--P浓度升高.
第三阶段(73~108d),提高进水COD浓度到200mg/L,缺氧初NO3--N浓度提高到16mg/L.该阶段厌氧释磷效果明显提高,厌氧末PO43--P浓度增加至10.93mg/L.缺氧吸磷后,PO43--P浓度降低至1.61mg/L,去除效果较上一阶段明显提高.缺氧末NO3--N浓度为7.84mg/L,NO2--N得到积累,平均浓度为3.32mg/L, NAR也由9.65%逐步增加至29.75%,其中最高达37.64%,NRR为51.00%,NTR增加至40.69%.随着进水COD浓度的增加,磷酸盐实现高效去除,亚硝酸盐得到稳定积累.微好氧结束时,出水PO43--P、NO3--N、NO2--N浓度分别0.68,9.31,2.55mg/L.

图2 不同运行阶段PO43--P、NO2--N、NO3--N浓度变化及N转化关系
第四阶段(109~142d),进水PO43--P浓度不变,C/P比提高到55,缺氧段进水NO3--N增加至23mg/L.提高进水C/P比后,PRA进一步增加到11.02mg/L,厌氧末PO43--P浓度为12.71mg/L,PAOs的厌氧释磷效果增强.缺氧反应结束后,PO43--P浓度为1.71mg/L.该阶段NO3--N实现了较好的反硝化效果,稳定运行后缺氧末NO3--N浓度为6.06mg/L, NO2--N浓度达6.31mg/L,NAR由29.75%提高至51.01%左右,NTR、NRR为37.25、73.65%.说明进一步提高进水COD浓度使内碳源储存量增加,利于磷酸盐去除与部分反硝化的同步发生.王等[14]也通过数值模拟得出硝酸盐浓度在一定范围内增加(<30mg/L)有利于系统更好的实现硝酸盐的去除及稳定的亚氮积累.好氧段PO43--P去除量与上一阶段持平,PO43--P去除率为87.37%.
经过142d的驯化培养,系统PO43--P的去除率稳定在86.79%,NAR达60%,实现了氮、磷的同步去除.实验发现在氮负荷(从0.007至0.016kgN/m3·d)提高的情况下系统仍能实现稳定的脱氮除磷效果,表明该系统具有一定耐受能力.
2.2 不同运行阶段COD的去除效果及碳源利用特征
厌氧阶段COD的去除主要依赖反硝化反应和内碳源的储存,缺氧段发生内源性部分反硝化反应进一步消耗COD,好氧段微生物利用残留COD进行好氧代谢进一步提高出水水质.对系统COD去除及内碳源储存量进行分析,各阶段系统内碳源储存量及转化率如图3和表2所示.
第一阶段,系统通过厌氧-好氧方式进行污泥培养.进水COD浓度为100mg/L,厌氧末COD为37.80mg/L,COD在厌氧段得到有效去除,出水COD浓度为28.20mg/L,系统COD去除率为74.41%.第二~四阶段,系统采用厌氧-缺氧-微好氧运行方式, COD浓度由120mg/L提高到200,275mg/L.尽管进水COD负荷由0.18增加至0.41kgCOD/m3·d,出水COD浓度均低于30mg/L,去除率分别为78.75、85.19、91.06%,说明系统具有较好的COD去除能力并能耐受一定的有机负荷.厌氧末COD浓度维持在40mg/L左右,CODintra由最初的32.42mg/L大幅提高至124.78mg/L,说明随着进水COD浓度的增加,有利于提高厌氧段内碳源的储存.CODintraefficiency反映了进水COD在厌氧条件下作为细胞内碳源储存的比例,可以看作是PAOs和GAOs能够利用的有机物[15].系统运行的四个阶段CODintraefficiency均处于较高水平(>85%).
四个阶段,PRA/CODintra均低于报告的PAOs模型值(0.5molP/molC)[9],表明PAOs和GAOs都参与了细胞内碳源的储存,通过运行参数调整PRA/ CODintra呈降低趋势,表明系统内GAOs的优势明显增强,更多内碳源被其利用,有利于内源性反硝化及反硝化除磷反应的发生.此外,第二~三阶段∆PO43--P/ ∆NO3--N比从1.11上升到1.33,这表明,具有反硝化除磷功能的DPAOs逐步取代了PAOs,利用NO3--N作为电子受体的DPAOs被有效地聚集,从而获得了良好的除磷效率.同时,每去除1mg PO43--P消耗了大约0.82~1.36mg NO3--N,这也与先前研究结果(0.86~1.41)相近[16].第四阶段, ∆PO43--P/∆NO3--N降低至0.77,远低于理论值(1.41)[9],表明该阶段DGAOs成为驱动反硝化反应的主体.GAOs和PAOs相对比例的变化也反应了这一情况,随进水C/P的增加,GAOs随PAOs的降低逐步增加,证明GAOs逐渐成为厌氧段内碳源储存的主要贡献者,系统内GAOs相对于PAOs成为优势微生物,更利于亚硝酸盐的积累.

表2 反应器碳源转化及磷酸盐去除计量关系
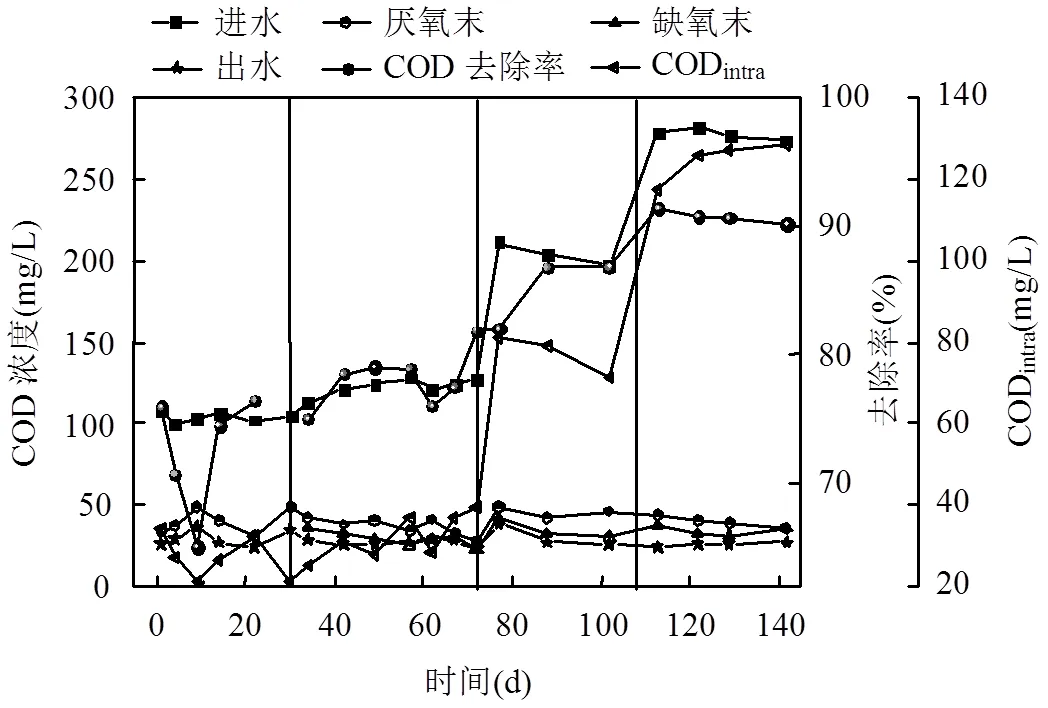
图3 不同运行阶段COD浓度、去除率及CODintra的变化
2.3 典型周期系统脱氮除磷效果
为了进一步研究系统内亚硝酸盐积累及磷酸盐去除性能,选取第Ⅳ阶段(134d),测定单周期内PO43--P、NO3--N、NO2--N浓度变化,如图4所示.
厌氧段(0~120min),厌氧释磷主要发生在前80min,在100min时达到PO43--P浓度的峰值(12.33mg/L),厌氧阶段的后20min出现了PO43--P的轻微降低,厌氧末PO43--P浓度为11.96mg/L.上一周期残留的NO2--N、NO3--N在COD作用下发生外源反硝化,经120min厌氧反应后完全去除.

图4 系统运行第134d典型周期基质浓度变化
缺氧段(120~300min),混合体系NO3--N浓度为21.52mg/L.DPAOs、DGAOs利用厌氧段储存的内碳源发生反硝化除磷及内源性反硝化,随着硝酸盐的消耗,亚硝酸盐逐步产生,在缺氧反应过程中的第80min达到峰值8.85mg/L,NAR、NTR、NRR分别为42.13、83.08、46.71%,随后浓度逐渐降低,持续到缺氧段结束.原因可能是由NO3--N主导的部分反硝化过程几乎终止,并且缺氧时间过长,发生了NO2--N进一步还原[17].相比之下, PO43--P整体呈现下降趋势,这也表明亚硝酸盐也可能作为反硝化聚磷菌的电子受体发生磷酸盐的去除.缺氧末PO43--P浓度为1.12mg/L,NO3--N、NO2--N浓度分别为4.02、7.7mg/L,NAR为65.70%, NTR为44.00%.
微好氧段(300~300min),DO浓度控制在0.3~ 0.5mg/L,观察到明显的好氧磷吸收现象,出水PO43--P为0.61mg/L.同时系统内发生硝化反应, NH4+-N、NO2--N和NO3--N浓度有小幅度的变化.正如Carvalheira等[18]建议,增加短曝气期可能是增强磷去除的有效方法,但不会对NO2--N积累产生明显影响.
2.4 微生物群落结构分析
污泥样品在门水平的微生物种群组成如图5(a)所示.尽管进水硝酸盐浓度和有机物负荷不同,但系统在门水平上的微生物群落在四个阶段的运行中没有产生很大的变化,体现了菌群结构的稳定性和物种群落的多样性.
运行期间优势菌门主要包括拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)四类.大量研究[8,19]表明Bacteroidetes门和Proteobacteria门是废水处理系统中重要且常见的种群,已被广泛证实含有PAOs和DPAOs,它们具有降解有机物、脱氮除磷的能力,可增强传统活性污泥法系统中生物处理效果.Proteobacteria门为占比最大的菌门,平均丰度由接种污泥内的19.54%增加到49.12%. Bacteroidetes门丰度变化不大,平均丰度为20.59%. Chloroflexi门等丝状菌在活性污泥体系中起支撑骨架和生物载体的作用[11],它们的丰度在整个培养过程中未出现显著变化,显示了整个系统的稳定性.同时Actinobacteria等微生物菌门的存在能够进行有机物的降解并能在系统内发生反硝化反应[20],其平均丰度为1.42%.
为进一步阐述运行过程中微生物种群的变化情况,在属水平上分析了功能微生物的丰度变化.如图5(b)所示,Accumulibacter作为一种常见的聚磷菌[19],在反应中与磷的释放能力有很大的关系,其能够利用NO3--N或NO2--N发生反硝化除磷反应[20],相对丰度从接种污泥的0.02%升高至第三阶段0.05%,最终稳定在0.81%,保证了系统磷酸盐的释放.同样属于PAOs的[21]其丰度从0.01%增加到2.43%.通过提高进水COD浓度及在缺氧段投加NO3--N有利于实现DPAOs的富集,丰度增加(接种泥丰度为0.77%),在第二阶段达到峰值为4.70%,通过系统稳定运行,最终丰度维持在1.14%左右.Xu等[22]研究发现丰度的增加有利于反硝化除磷效果的增强.
Competibacter作为GAOs中三大优势菌属[23],其中Competibacter能够利用自身合成的PHA完成内源性反硝化过程[24-25],其丰度由1.02%增加到4.19、5.45、9.19、15.49%.Cech等[26]研究表明Competibacter会与DPAOs竞争碳源,无法参与系统的除磷.但最新研究[27-28]发现其在实现亚硝酸积累的同时也能够促进DPAOs的除磷效果.被称为属于α-变形菌的GAOs,具有将碳源转化为PHA的能力,并且更容易利用NO3--N作为电子受体发生反硝化[24],其相对丰度由0.02%增加到0.16%.GAOs的内源性反硝化与DPAOs反硝化除磷的协同作用还可以充分利用内部碳源,解决污水处理过程中碳源不足的问题.三类聚糖菌丰度的增加也符合表2中内碳源的分配规律,能够保证系统实现稳定的亚氮积累及磷酸盐去除.

图6 属水平上PCA和RDA
此外,与接种污泥相比,还检测到具有代表性(0.36%~2.47%)、(0.11%~0.26%)等普通异养菌(Ordinary Heterotrophic Organisms, OHOs).据报道,是一种与NO3--N还原和NO2--N积累相关的关键部分反硝化细菌[29].另一方面,检测到丰度为9.05%的,随着进水碳源的增加,外源反硝化作用增强[30].第四阶段,Accumulibacter、和等PAOs的累积丰度为5.08%.与PAOs相比,Competibacter、等GAOs在整个菌群分布中具有更大的优势,累积丰度为15.70%,利于系统实现较好亚氮积累效果.总之,系统中PAOs和GAOs共存,协同实现氮、磷去除.
在属水平上采用PCA分析,比较不同反应阶段优势菌属群落结构分布.图6(a)第一和第二排序轴共同解释了优势菌属分布变化的77.76%,较好的揭示了样品中微生物分布情况.第Ⅰ、Ⅱ阶段分布较远,表明通过将系统运行方式由厌氧/好氧调整为厌氧/缺氧/好氧,并在缺氧段投加硝酸盐废水导致系统优势菌属发生改变,系统内反硝化除磷菌丰度增加[31],开始出现亚氮积累.第Ⅲ、Ⅳ阶段分布集中,尤其距离第Ⅰ阶段较远,表明经过污泥驯化,优势菌属变化明显,最终系统趋于稳定.值得注意的是第Ⅱ阶段反应器的样品分布距离第Ⅲ、Ⅳ阶段较远,表明微生群落受到硝酸盐浓度的影响较大,进水硝酸盐浓度的提高,导致系统聚糖菌及聚磷菌的变化.通过RDA揭示了水质参数对典型聚糖菌、聚磷菌的影响.亚硝酸盐的积累率及进水氮负荷与Competibacter两类聚糖菌呈正相关.NRR与硝酸盐的去除率(PRR)与PAOs的丰度呈正相关,表明系统实现了以硝酸盐为底物的反硝化聚磷菌的富集,同时实现了磷酸盐及硝酸盐的去除.
3 结论
3.1 系统采用厌氧-缺氧-微好氧运行方式,通过调整系统C/P比及缺氧段NO3--N浓度,实现SBR的稳定运行.在进水C/P为55、缺氧初NO3--N浓度为23mg/L,系统实现了高效的反硝化除磷与亚硝酸盐积累.PO43--P去除率最高达90.8%,NRR、NAR、NTR分别为72.14、58.94%、40.22%.
3.2 系统COD的去除主要是在厌氧阶段通过PAOs或GAOs的内碳源储存实现.提高进水COD负荷并未影响系统的COD去除性能,系统COD出水浓度均低于30mg/L.提高进水C/P比,COD去除率和CODintra相应增加,在进水COD为275mg/L、C/P比为55的条件下,COD去除率达91.06%,CODintra为124.78mg/L.
3.3 微生物群落结构分析表明,系统内主要以Bacteroidetes、Proteobacteria、Chloroflexi、Acidobacteria为主要菌门.Accumulibacter、等聚磷菌及Competibacter等聚糖菌的丰度相对于接种污泥都有较明显增加,累积丰度分别由接种污泥的1.49%、1.06%增加至第四阶段5.08%、15.70%,聚磷菌与聚糖菌的共同作用有利于实现除磷过程的亚硝酸盐累积.
[1] 杜 睿,彭永臻.城市污水生物脱氮技术变革:厌氧氨氧化的研究与实践新进展[J]. 中国科学:技术科学, 2021,52(3):389-402.
Du R, Peng Y Z. Technical revolution of biological nitrogen removal from municipal wastewater recent advances in Anammox research and application. [J]. Scientia Sinica Technological, 2021,52(3):389-402.
[2] 韦佳敏,刘文如,程洁红,等.反硝化除磷的影响因素及聚磷菌与聚糖菌耦合新工艺的研究进展[J]. 化工进展, 2020,39:4608-4618.
Wei J M, Liu W R, Cheng J H et al. Influencing factors of denitrifying phosphorus removal and advance research on novel process of coupling PAOs and GAOs [J]. Chemical Industry and Engineering Progress, 2020,39:4608-4618.
[3] Liu Y, Peng L, Chen X, et al. Mathematical modeling of nitrous oxide production during denitrifying phosphorus removal process [J]. Environmental Science & Technology, 2015,49:8595-8601.
[4] 王秋颖,于德爽,赵 骥,等.PD-DPR系统处理城市污水与高硝酸盐废水实现稳定亚硝酸盐积累和磷去除的特性[J]. 环境科学, 2020, 41(3):1384-1392.
Wang Q Y, Yu D S, Zhao J, et al. Stable nitrite accumulation and phosphorus removal from high-nitrate and municipal wastewaters in a combined process of partial denitrification and denitrifying phosphorus removal (PD-DPR) [J]. Environmental Science, 2020, 41(3):1384-1392.
[5] Kerrn-Jespersen J P. Biological phosphorus uptake under anoxic and aerobic conditions. Water Research [J]. 1993,27(4):617-624.
[6] Kuba T, Smolders M C M V L G, Heijnen J J. Biological phosphorus pemoval from wastewater by anaerobic-anoxic sequencing batch reactor. Water Science Technology [J]. 1993,27(5/6):241-252.
[7] 卢瑞朋,徐文江,李安峰,等.新型多级缺氧-好氧工艺的反硝化除磷效能及微生物群落特征 [J]. 中国环境科学, 2022,42(4):1706-1713.
Lu R P, Xu W J, Li A F,et al. Denitrify phosphorus removal performance and microbial community characteristics of novel multistage anoxic-oxicprocess [j]. China Environmental Science, 2022,42(4):1706-1713.
[8] Sengar A, Aziz A, Farooqi I H, et al. Development of denitrifying phosphate accumulating and anammox micro-organisms in anaerobic hybrid reactor for removal of nutrients from low strength domestic sewage [J]. Bioresource Technology, 2018,267:149-157.
[9] Wang X, Wang S, Zhao J, et al. A novel stoichiometries methodology to quantify functional microorganisms in simultaneous (partial) nitrification-endogenous denitrification and phosphorus removal (SNEDPR). Water Research [J]. 2016,95:319-329.
[10] Sui Q, Jiang L, Di F, et al. Multiple strategies for maintaining stable partial nitritation of low-strength ammonia wastewater. Science of the Total Environmental [J]. 2020,742:140542.
[11] Sui Q, Di F, Zhang J, et al. Advanced nitrogen removal in a fixed-bed anaerobic ammonia oxidation reactor following an anoxic/oxic reactor: nitrogen removal contributions and mechanisms [J]. Bioresource Technology, 2021,320:124297.
[12] Smolders G J, Meij J, Loosdrecht M C M V, et al. Model of the anaerobic metabolism of the biological phosphorus removal process: stoichiometry and pH influence [J]. Biotechnology Bioengineing, 1994,43:461-470.
[13] 甄建园,于德爽,王晓霞,等.进水C/P对SNEDPR系统脱氮除磷性能的影响 [J]. 环境科学, 2019,40(1):343-351.
Zhen J Y, Yu D S, Wang X X, et al. Effect of the influent C/P ratio on the nutrient removal characteristics of the SNEDPR system [J]., 2019,40(1):343-351.
[14] 王 聪,王淑莹,张 淼,等.多因素对反硝化除磷过程中COD、N和P的去除分析 [J]. 化工学报, 2015,66:1467-1475.
Wang C, Wang S Y, Zhang M, et al. Analysis of COD, N and P in denitrifying phosphorus removal under multivariate condition [J]. CIESC Journal, 2015,66:1467-1475.
[15] Du S, Yu D, Zhao J, et al. Achieving deep-level nutrient removal via combined denitrifying phosphorus removal and simultaneous partial nitrification-endogenous denitrification process in a single-sludge sequencing batch reactor [J]. Bioresource Technology, 2019,289: 121690.
[16] Zhang M, Wang Y, Fan Y, et al. Bioaugmentation of low C/N ratio wastewater: effect of acetate and propionate on nutrient removal, substrate transformation, and microbial community behavior [J]. Bioresource Technology, 2019,306:122465.
[17] Wang X, Zhao J, Yu D, et al. Stable nitrite accumulation and phosphorous removal from nitrate and municipal wastewaters in a combined process of endogenous partial denitrification and denitrifying phosphorus removal (EPDPR) [J]. Chemical Engineering Journal, 2019,355:560-571.
[18] M. Carvalheira, A. Oehmen, G. Carvalho, et al. The impact of aeration on the competition between polyphosphate accumulating organisms and glycogen accumulating organisms [J]. Water Research, 2014,66: 296-307.
[19] He Q, Song Q, Zhang S, et al. Simultaneous nitrification, denitrification and phosphorus removal in an aerobic granular sequencing batch reactor with mixed carbon sources: reactor performance, extracellular polymeric substances and microbial successions [J]. Chemical Engineering Journal, 2018,331:841-849.
[20] Zeng W, Bai X, Guo Y, et al. Interaction of "Candidatus" and nitrifying bacteria to achieve energy-efficient denitrifying phosphorus removal via nitrite pathway from sewage [J]. Enzyme and Microbial Technology, 2017,105:1-8.
[21] 范亚骏,张 淼,季俊杰,等.A2/O-BCO系统中碳源类型对反硝化除磷及菌群结构的影响 [J]. 中国环境科学, 2022,42(1):172-182.
Fan Y J, Zhang M, Ji J J, et al. Effect of carbon source types on denitrifying phosphorus removal and microbial community in the A2/O - BCO process [J]. China Environmental Science, 2022,42(1): 172-182.
[22] Xu X, Qiu L, Wang C, et al. Achieving mainstream nitrogen and phosphorus removal through simultaneous partial nitrification, anammox, denitrification, and denitrifying phosphorus removal (SNADPR) process in a single-tank integrative reactor [J]. Bioresource Technology, 2019,284:80-89.
[23] Dai Y, Yuan Z, Wang X, et al. Anaerobic metabolism ofvanus related glycogen accumulating organisms (GAOs) with acetate and propionate as carbon sources [J]. Water Research, 2007,41(9):1885-1896.
[24] Ji J, Peng Y, Li X, et al. A novel partial nitrification-synchronous anammox and endogenous partial denitrification (PN-SAEPD) process for advanced nitrogen removal from municipal wastewater at ambient temperatures [J]. Water Research, 2020,175:115690.
[25] Wang X, Zhao J, Yu D, et al. Evaluating the potential for sustaining mainstream anammox by endogenous partial denitrification and phosphorus removal for energy-efficient wastewater treatment [J]. Bioresource Technology, 2019,284:302-314.
[26] J.S. CECH, P. HARTMAN. Competition between polyphosphate and polysaccharide accumulating bacteria in enhanced biological phosphate removal system [J]. Water Research, 1993,27(7):1219- 1225.
[27] F.J. Rubio-Rincon, C.M. Lopez-Vazquez, L. Welles, et al. Cooperation betweenCompetibacter andAccumulibacter clade I, in denitrification and phosphate removal processes [J]. Water Research, 2017,120:156-164.
[28] Wang X, Wang S, Xue T, et al. Treating low carbon/nitrogen (C/N) wastewater in simultaneous nitrification-endogenous denitrification and phosphorous removal (SNDPR) systems by strengthening anaerobic intracellular carbon storage [J]. Water Research, 2015,77: 191-200.
[29] Wang D, Zheng Q, Huang K, et al. Metagenomic and metatranscriptomic insights into the complex nitrogen metabolic pathways in a single-stage bioreactor coupling partial denitrification with anammox [J]. Chemical Engineering Journal, 2020,398.
[30] Li J, Peng Y, Zhang L, et al. Enhanced nitrogen removal assisted by mainstream partial-anammox from real sewage in a continuous flow A2/O reactor [J]. Chemical Engineering Journal, 2020,400:125893.
[31] Zhang J, Sui Q, Lu T, et al. Sludge bio-drying followed by land application could control the spread of antibiotic resistance genes [J]. Environment International, 2019,130:104906.
Parameter optimization for the achievement of nitrite accumulation by denitrifying phosphorus removal process.
DI Fei1,2, SUI Qian-wen1, GAO Chao-long1,2, ZHONG Hui1*, XU Dong-yao2, WEI Yuan-song1,3
(1.Laboratory of Water Pollution Control Technology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;2.China University of Mining & Technology, Beijing School of Chemical and Environmental Engineering, Beijing 100089, China;3.Institute of Energy, Jiangxi Academy of Sciences, Nanchang 330096, China)., 2022,42(6):2647~2655
To promote the coupling of denitrification phosphorus removal and anaerobic ammonia oxidation process, and achieve simultaneous efficient removal of nitrogen and phosphorus from wastewater, a sequencing batch reactor (SBR) was constructed to optimized the operational parameters for the nitrite accumulation by denitrifying phosphorus removal process. Under anaerobic-anoxic-microaerobic operational conditions, SBR gradually realized nitrite accumulation during denitrifying phosphorus removal process by feeding synthetic nitrate industrial wastewater in the anoxic section. The results showed that after 142 days of cultivation and domestication, when the influent C/P ratio of 55 and the nitrate concentration in the anoxic section was 23mg/L, the nitrite accumulation rate achieved 51.01%, the NO3--N→NO2--N transformation rate was 40.22%, nitrate removal rate was 72.14% and the highest removal rate of PO43--P was 88.17%. The effluent COD concentration was lower than 25mg/L, and COD removal rate was maintained above 90%. Analysis of the microbial community structure showed that Bacteroidetes, Proteobacteria, Chloroflexi and Acidobacteria were the dominant phylum in the system. Through parameter optimization, the abundance of denitrifying phosphorus accumulating organisms represented byAccumulibacter increased (the cumulative abundance increased from 1.49% to 5.08%), and a more remarkable increase in the abundance of glycogen accumulating organisms represented byCompetibacter (from 1.02% to 15.49%). The combined effects of phosphorus accumulating organisms and glycogen accumulating organisms contributed to the accumulation of nitrite in the phosphorus removal process.
denitrifying phosphorus removal;partial denitrification;nitrite accumulation;microbial community
X703.5
A
1000-6923(2022)06-2647-09
狄 斐(1996-),女,山东济南人,中国矿业大学(北京)硕士,主要从事污水生物处理.
2021-11-10
国家重点研发计划项目(2021YFC3200601);中国科学院青年创新促进会项目(2021042);广西重点研发计划项目(AB21196036)
* 责任作者, 助理研究员, zhhui@rcees.ac.cn
