小球藻强化餐厨废水处理效果及机理
2022-06-29贾艳萍单晓倩张海丰张兰河
贾艳萍,丁 雪,单晓倩,李 硕,张 健,张海丰,李 正,张兰河
小球藻强化餐厨废水处理效果及机理
贾艳萍,丁 雪,单晓倩,李 硕,张 健,张海丰,李 正,张兰河*
(东北电力大学化学工程学院,吉林 吉林 132012)
利用小球藻对混凝出水进行处理,考察小球藻接种量对COD、DTP和TN去除率的影响,通过扫描电子显微镜(SEM)、红外光谱、比表面积微孔分析仪分析小球藻形貌和组成结构的变化,采用紫外可见光谱和三维荧光光谱研究餐厨废水中有机物成分的变化,探究小球藻降解餐厨废水的机理.结果表明:当小球藻接种量为25%时,COD和TN去除率最高(分别为79.73%和78.28%);当小球藻接种量为35%时,DTP去除率最高(85.55%).反应前的小球藻细胞表面相对光滑,反应后的小球藻细胞表面粗糙,比表面积增大,并粘附大量颗粒态物质;小球藻细胞表面的羧基、氨基和磷酸基团等官能团参与污染物的吸附沉淀;小球藻破坏了腐殖质结构,降低了腐殖质芳香性;小球藻在降解可溶性微生物副产物和类腐殖酸的同时,产生芳香类蛋白物质.
小球藻;餐厨废水;吸附;降解;机理
餐厨废水成分不稳定、有机物丰富、悬浮物浓度高[1-3],普遍采用混凝和生物法相结合的工艺进行处理.混凝沉淀能够去除悬浮物和部分有机污染物,但是经过混凝沉淀处理后废水中的污染物浓度仍较高,含有大量溶解性有机物和氮磷物质,不能达标排放,需要进一步处理.小球藻可利用废水中N、P营养物质进行生长,它的光合作用效率高、适应环境能力强、生长快[4-8],采用小球藻处理混凝后的餐厨废水有望实现溶解性有机物和氮磷物质的高效降解.小球藻的形态微小、结构简单、比表面积大,含有纤维素和多糖组成的细胞壁,细胞表面含有羧基、氨基和磷酸等多种官能团,吸收有机物和重金属的能力强[9].Loganathan等[10]采用小球藻和斜生栅藻组成的微藻群处理乳制品废水,结果表明,在光照时间为10d,接种量为40%,光照强度为25μmol/(m2∙s)的条件下,磷酸盐、氨氮及COD去除率分别为70.19%、86.22%及54.72%.Azianabiha等[11]采用小球藻处理棕榈油厂废水,当光照强度为200μmol/(m2∙s),光照12h,接种量为28%时,NH4+-N和PO43--P去除率分别为93.36%和94.50%.成娟[12]采用小球藻处理经校园污水稀释的餐厨垃圾厌氧消化液,在光照强度为75μmol/(m2∙s),曝气量为0.6L/min的条件下,总氮、氨氮和总磷的去除率分别为94.7%、98.6%和99%.叶庆[13]采用小球藻处理经臭氧预处理后的厨余垃圾发酵沼液,其COD、氨氮和总磷的去除率分别为99%、99%和68%.目前,关于小球藻处理餐厨废水的相关报道尚少,并且以上研究主要探讨了小球藻对废水中污染物去除率的影响,但并未对小球藻处理餐厨废水前后的表面特征和官能团变化等方面进行深入探究,小球藻处理餐厨废水的降解机理尚不明确.
本研究利用小球藻处理餐厨废水,分析小球藻对COD、TN和DTP去除率的影响,采用紫外可见光谱和三维荧光光谱分析小球藻处理餐厨废水前后有机物成分及结构的变化,采用扫描电子显微镜(SEM)、红外光谱、比表面积微孔分析仪分析小球藻形貌和组成结构的变化,探究小球藻处理餐厨废水的机理,为提高餐厨废水的处理效率提供理论依据.
1 材料与方法
1.1 分析项目及检测方法
采用pH计(pHSJ-3F型,上海仪电科学仪器有限公司)测定pH值;采用紫外可见智能型多参数水质分析仪(LH-3BA型,兰州连华环保科技有限公司)测定COD、TN、DTP及浊度;采用紫外可见光谱分析小球藻处理餐厨废水前后物质种类及含量变化;采用三维荧光光谱仪(RF-5301PC型,日本岛津)分析小球藻处理餐厨废水前后的荧光物质结构及官能团变化,光源为氙灯,激发光波长(x)和发射光波长(m)均为200nm~600nm,狭缝宽度为5nm,扫描速度为6000nm/min,扫描间隔x和m均为5nm,光谱带宽x和m均为3nm.
采用场发射环境扫描电子显微镜(XL- 30ESEMFEG型,美国FEI公司)分析小球藻的微观形貌变化;将小球藻进行冷冻干燥,再采用FTIR(布鲁克公司,Tensor27,德国)对小球藻藻体进行红外光谱测定,扫描范围为400~4000cm-1;采用全自动比表面积微孔分析仪(ASAP-2020M,美国Micro-meritics公司)分析小球藻吸附污染物前后的比表面积和孔结构.
1.2 实验方法
1.2.1 餐厨废水预处理 实际餐厨废水取自某大学食堂,其水质指标见课题组前期发表文章中的表1[14].将实际餐厨废水灭菌后,采用FeCl3混凝预处理,再利用小球藻处理混凝后的餐厨废水.
1.2.2 小球藻的培养和驯化 小球藻(, FACHB-30)购自中国科学院水生生物研究所淡水藻种库,小球藻培养基为BG11培养基[8],在光照培养箱中培养,培养温度为26℃,光照强度为3000lx,光暗比为12h:12h.
小球藻接种量按20%(约5´105个/mL)接入预处理后的餐厨废水中进行培养,培养7d后,依次将小球藻接种到含60%、80%直至100%混凝后的餐厨废水中驯化,小球藻接种量分别为20%、25%、30%及35%,利用500mL的三角瓶进行光照培养(废水量为300mL),每组3个平行实验,每天振荡3次(每次1min),培养周期为20d.实验过程中每2d取样20mL, 10000r/min离心5min,取上清液经0.45μm滤膜过滤,测定废水的COD、DTP及TN等指标的变化.
2 结果与分析
2.1 小球藻的生长曲线
由图1可知,不同接种量的小球藻生长趋势基本相同,小球藻在接种前2d时,藻细胞处于停滞期,生长缓慢.从第4d开始小球藻生长速度加快,进入对数生长期,在第14d左右小球藻生长进入稳定期,这说明经过混凝后的餐厨废水适合小球藻生长.其中,在预处理后餐厨废水中接种量25%为小球藻的最适生长接种量,该接种量下的小球藻生物量增长速率明显快于对照组,这是因为餐厨废水含有部分能被小球藻吸收利用的有机物.随着运行时间的增加,一部分小球藻死亡,生长曲线呈下降趋势.在培养液中,非离子状态或游离氨(NH3)与铵离子(NH4+)存在离解平衡,如方程式(1)所示.

培养液中pH值升高会导致水中OH-增加,这些OH-与水中的NH4+反应生成游离氨,与铵离子相比,游离氨对小球藻细胞的毒害性更强[15],所以生长曲线呈下降趋势.与接种量为25%的实验组相比,其他实验组小球藻的生长较慢,这是由于接种量小时,藻体延滞期较长,不利于藻细胞的快速繁殖,藻体易老化,生长周期延长;当接种量大时,对营养物质的消耗加快,造成后期营养供应不足[16].由此可见,小球藻处理餐厨废水的最适接种量为25%.
2.2 不同接种量的小球藻对餐厨废水处理效果的影响
2.2.1 废水pH值的变化 如图2所示,接种前废水pH值均为7.09左右,连续培养2d后,4个实验组废水pH值均上升至7.5左右;当小球藻在废水中培养14d后,废水pH值缓慢上升并稳定在8.67左右.这是因为废水中存在CO2和HCO3-的平衡[17],如式(2)所示.
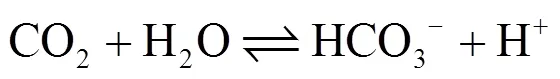
图2 不同小球藻接种量下废水的pH值
Fig.2 Thewastewater pH at different inoculation amounts of C. vulgaris
当小球藻进行光合作用时利用CO2作为碳源,不断消耗CO2,使平衡向左移动,从而使pH值不断上升,因此小球藻生长是一个产碱的过程[18],适合小球藻生长的pH值范围为7~9[19],当pH值高于9,小球藻的生长与代谢就会受到一定程度的抑制作用,本研究废水pH值稳定在8.67左右,小球藻的生长不会受到抑制.
2.2.2 不同接种量的小球藻对污染物去除率的影响 由图3(a)和表1可知,在小球藻接种量分别为20%、25%、30%及35%的条件下,废水中COD的最低浓度分别为397.3,347.6,536,625mg/L,此时对应的去除率分别为76.83%、79.73%、68.75%及63.56%.当小球藻接种量为25%时,小球藻对废水中COD的去除效果最好,COD去除率最高,这是由于小球藻处于对数生长期,有机化合物被藻细胞催化降解[20],培养至14d后,其COD浓度变化也趋于稳定,是因为小球藻细胞生长到达稳定期.当小球藻接种量为30%和35%条件下,COD浓度有较明显的上升趋势,这是因为过高的初始接种量,部分藻细胞裂解,释放大量的溶解性有机碳[21-22],导致COD浓度升高.
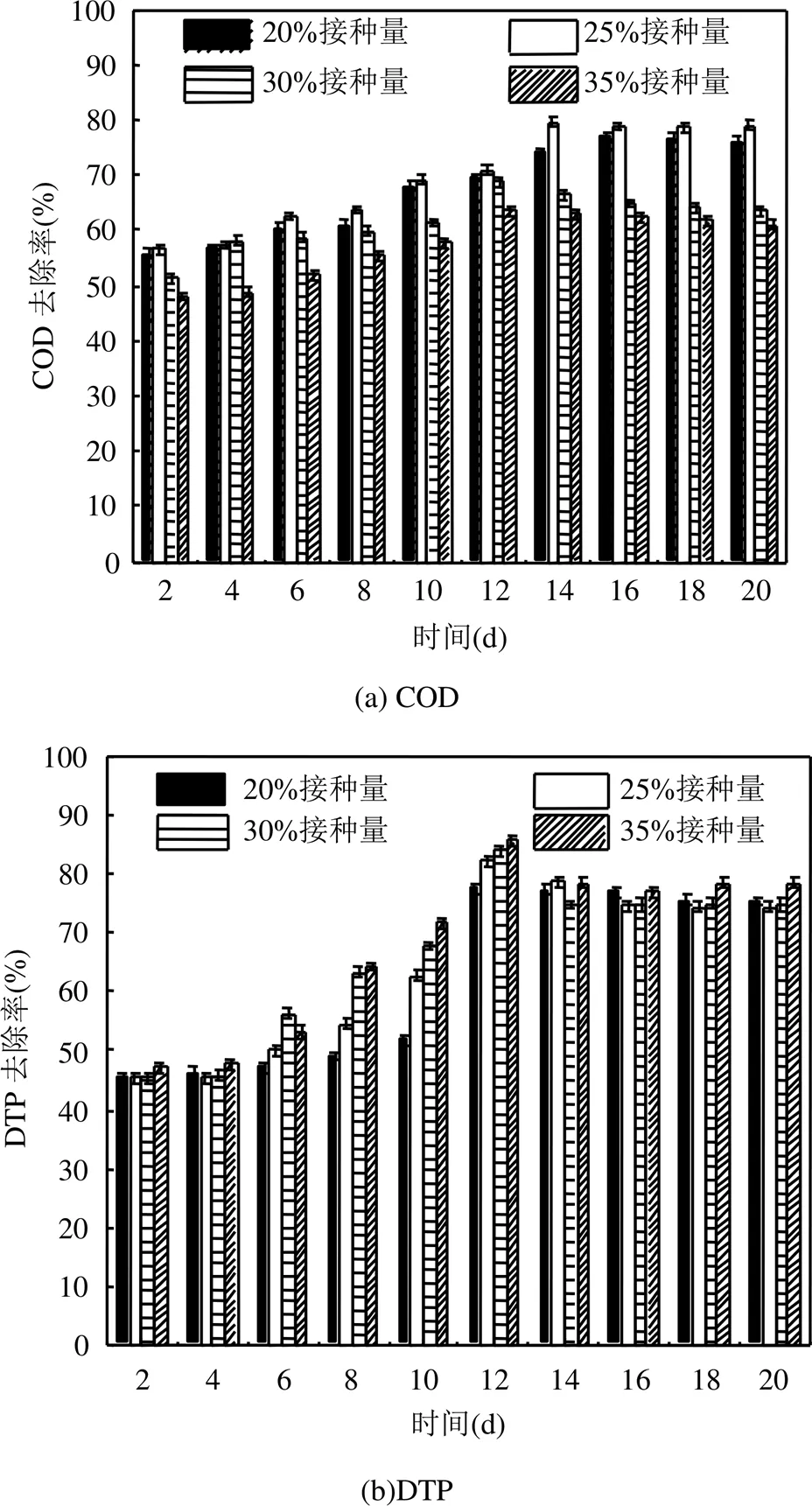
由图3(b)和表1可知,在小球藻接种量分别为20%、25%、30%及35%的条件下,当培养至第4d时,DTP浓度迅速下降;当培养至第12d时,DTP浓度均达到最低,分别为0.824mg/L、0.653mg/L、0.529mg/L及0.412mg/L,DTP去除率分别为77.49%、82.16%、83.93%及85.55%.由此可知,小球藻的初始接种量越大,DTP去除率越高,这是由于细胞密度较大,对磷的利用率较快[20].磷是藻细胞新陈代谢过程中的重要元素,小球藻通过磷酸化作用优先摄取H2PO4-和HPO42-合成有机物,该过程消耗的能量通常来自呼吸作用、线粒体电子传递系统或光合作用中的光能[23].
小球藻不同接种量对TN去除率和浓度的影响,分别如图3(c)和表1所示.由图3(c)和表1可知,随着小球藻的生长,TN浓度逐渐降低.当小球藻培养至8d时,接种量分别为20%、25%及30%条件下,TN浓度最低,分别为7.65mg/L、6.55mg/L及9.55mg/L,TN去除率分别为74.63%、78.28%及68.33%;培养至10d时,接种量为35%条件时,TN浓度最低为9.89mg/L,去除率为67.20%.由以上可知,小球藻培养至8d,且接种量为25%的条件下,TN浓度最低,去除效果最好,原因是25%接种量条件下的小球藻对于废水中氮化合物的吸收作用较好[24].由表1还可知,在不同接种量的条件下,TN浓度达到最低后均有增加的趋势,这是因为不同时期小球藻分泌的含氮物质种类和含量不同,此外,也存在小球藻藻体及其胞外产物被微生物分解,导致TN浓度增加[10].
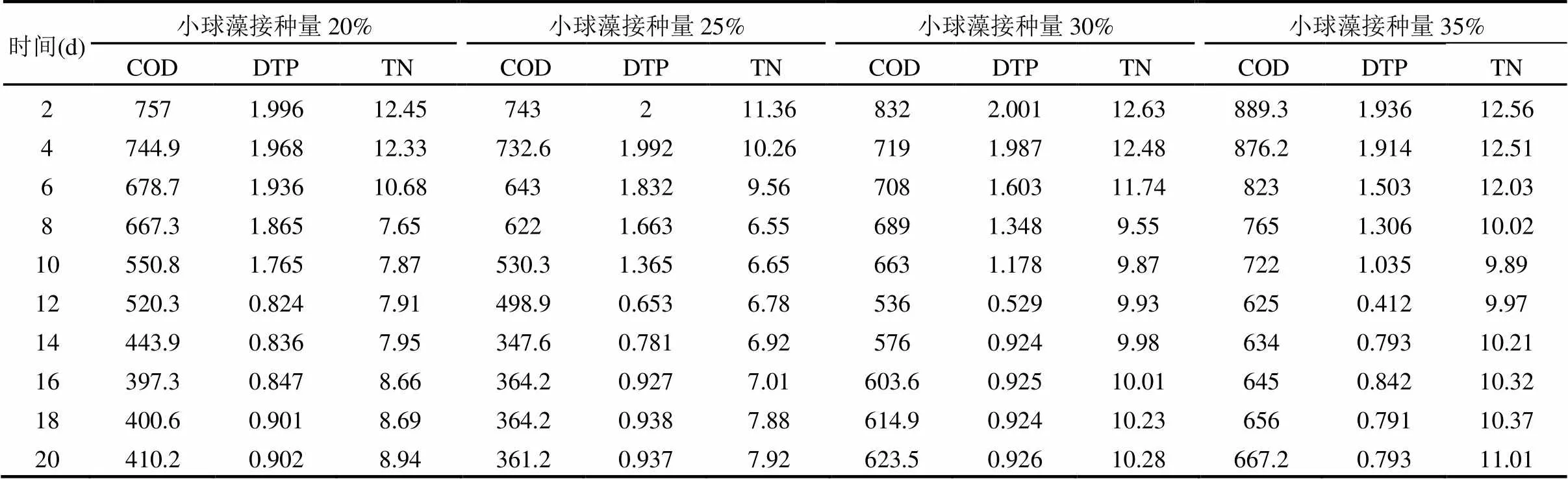
表1 在小球藻不同接种量下各污染物浓度的变化(mg/L)
小球藻去除废水中的磷主要有生物吸收和沉淀两种途径.一方面,小球藻可吸收废水中的无机磷,在自身生长时,吸收的无机磷在ADP与ATP的转化过程中被消耗;另一方面,当pH值或溶解氧浓度升高时,可溶性磷酸盐以沉淀的形式析出[25].由图2可知,不同接种量条件下的废水中pH值最低为7.09,培养14d后废水pH值上升并稳定在8.67左右.因此,餐厨废水中磷的主要去除途径是以沉淀的形式析出.小球藻对无机氮的去除主要通过其细胞膜的同化作用将无机氮吸收,小球藻首先在ATP、硝酸盐还原酶的作用下将硝酸盐转化为亚硝酸盐,再通过亚硝酸盐还原酶将亚硝酸盐还原为铵盐,还原后的铵盐被纳入碳骨架,最终在藻细胞内合成氨基酸或者蛋白质[26-27].
2.3 小球藻对餐厨废水组分的影响
在培养温度为26℃,光照强度为3000lx,光暗比为12h:12h,接种量为25%的条件下,对原废水和出水进行紫外可见光谱和三维荧光光谱分析.
2.3.1 紫外可见光谱分析 原废水和小球藻处理后的废水紫外可见吸收光谱,如图4所示.从图4可以看出,原水没有明显的吸收峰,说明餐厨废水中有机污染物含量大、组成结构复杂.餐厨废水在紫外光区(400nm以下)出现了较强的吸收峰,在可见光区(400~760nm)具有较低的吸收强度,说明餐厨废水中腐殖质的共振能量较大,芳香性较高.随着反应的进行,出水的吸收强度在整个紫外光区都呈现了逐步下降的趋势,推测可能是因为小球藻使腐殖质极大程度的被破坏,降低了腐殖质的芳香性[28].

图4 原水和小球藻处理后出水的紫外可见光谱
2.3.2 三维荧光光谱分析 由图5(a)可知, 原水检测的荧光峰为:可溶性微生物副产物A(x/m=288/ 338nm),类腐殖酸荧光峰B(x/m=323/412nm),代表腐殖酸类物质.由图5(b)可知,当小球藻接种量为20%时,废水中仍可检测到可溶性微生物副产物(x/m=303/366nm),类腐殖酸荧光峰(x/m=349/ 452nm),同时产生芳香类蛋白-II荧光峰C(x/m= 240/366nm),但小球藻的存在导致可溶性微生物副产物和类腐殖酸荧光峰向m轴分别红移28nm和40nm,浓度减小,荧光峰的红移是由含烷氧基的羰基、羟基、氨基及羧基等官能团的出现引起,小球藻生长到一定程度,开始释放出大量类蛋白荧光,部分衰老和死亡细胞的破碎降解可能是类蛋白荧光物质的一个重要来源[29].

图5 原水和小球藻处理后出水的三维荧光光谱
2.4 小球藻的表面特征
2.4.1 红外光谱分析 图6(a)可知,利用BG11培养的小球藻在3422cm-1附近存在一个较宽的吸收峰,可能是O−H或者N−H的伸缩振动产生,说明小球藻细胞表面含有水分子、羟基(−OH)及胺基(−NH2)[30];在指纹区1120cm-1处观察到C−O伸缩振动峰,这证明了羟基的存在.2960~2850cm-1范围内存在一个吸收峰(2928cm-1),是由饱和碳的C−H不对称伸缩振动产生,这说明细胞表面含有脂肪族化合物[31-32]. 1700~1500cm-1的吸收峰来源于生物质中的蛋白质;1539~1337cm-1为糖类C−H变角振动;在1200~ 1025cm-1范围内吸收峰表示多聚糖中C−C和C−O的伸缩振动;900~700cm-1为糖类的环振动吸收区,627cm-1吸收峰是C−H的伸缩振动[33].
由图6(b)可知,从废水中分离得到的小球藻的红外光谱峰位和峰强度均发生了变化,位于3435cm-1处的吸收峰移动到3423cm-1处,这表明蛋白和多聚糖中的氨基(−NH)和羟基(−OH)在吸附污染物过程中起吸附作用[34].1643cm-1移动到1641cm-1,表明来自于小球藻体内氨基己糖、蛋白的氨基基团与污染物发生吸附作用[35].2928cm-1移动到2925cm-1,1400cm-1移动到1386cm-1,1120cm-1移动到1143cm-1,这说明细胞中蛋白质和糖类所含C−H、C−O等基团与废水中污染物发生反应[36].同时,废水中小球藻的峰强度有所降低,说明小球藻细胞所含的O−H、N−H及C−H等基团在废水中污染物的吸附和降解过程中起到了重要的作用[37].
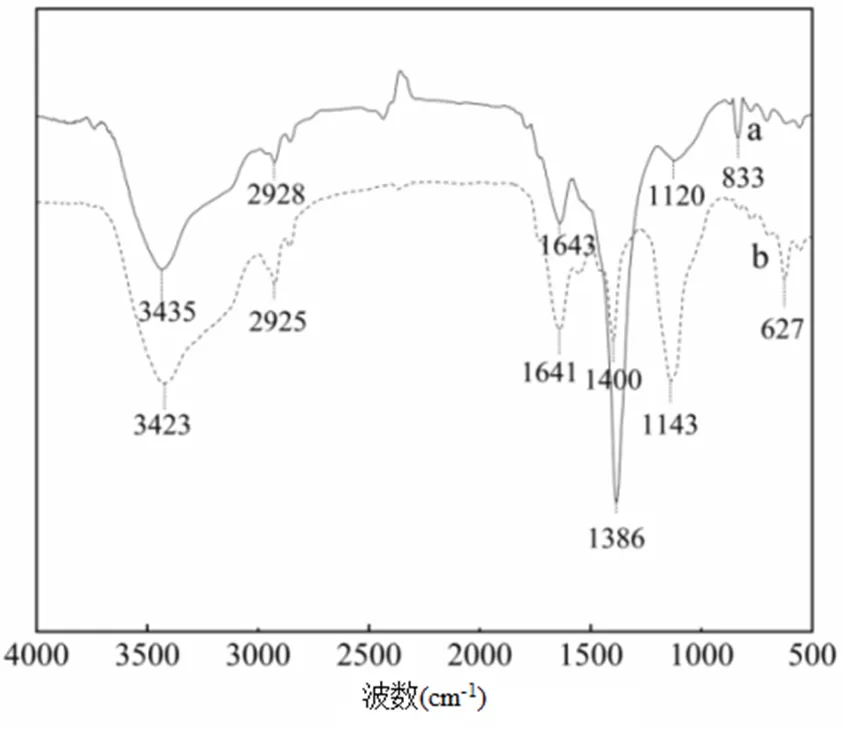
图6 处理废水前后的小球藻红外光谱
a:BG11培养基中的小球藻;b:废水中的小球藻
2.4.2 小球藻SEM及比表面积微孔分析 图7(a)表明,在BG11培养基中生长的小球藻细胞表面相对较光滑,有明显清晰的褶皱,小球藻细胞间空隙适当,无颗粒结构;由图7(b)表明,处理废水后的小球藻细胞表面分布大量颗粒态物质,呈球体结构,部分球体镶嵌入藻体.颗粒结构可能是结晶体的结晶点,细胞表面生成沉积物质,形成多孔结构对水体中营养盐物质进行吸附[38].
小球藻孔隙结构变化,如表2所示.小球藻在吸附污染物之后,其比表面积由原来的14.941m2/g上升到18.599m2/g,微孔面积由原来的21.551m2/g降低至15m2/g.小球藻吸附污染物之前,其细胞壁的平均孔径为13.40nm,吸附污染物之后细胞壁的平均孔径降低至8.47nm;孔体积由0.05004mL/g降低至0.0394mL/g.由表2可知:小球藻在吸附污染物之后,其细胞表面的比表面积增加,细胞壁中微孔面积、细胞壁表面的平均孔径和孔体积都减小.这是由于污染物吸附在小球藻细胞壁表面时,部分污染物进入小球藻细胞壁的孔隙,发生堵塞现象,使吸附污染物之后的微孔面积减小,平均孔径和孔体积减小;部分污染物附着在细胞壁表面,造成了小球藻细胞壁表面的粗糙度增加,比表面积增大.


表2 小球藻细胞壁在吸附污染物前后表面孔隙结构的变化
3 结论
3.1 采用小球藻处理餐厨废水,当小球藻的接种量为25%时,COD和TN去除率最高,分别为79.73%和78.28%,而小球藻接种量为35%时,DTP去除率最高,为85.55%.
3.2 通过SEM分析可知,处理废水前的小球藻细胞表面相对较光滑,处理废水后的小球藻细胞表面粗糙,并分布大量颗粒态物质;通过红外光谱分析可知,藻细胞表面的羧基、氨基和磷酸基团等官能团参与前期污染物的吸附沉淀;通过比表面积微孔分析仪结果可知,小球藻在吸附污染物之后,其细胞表面的比表面积增加,细胞壁微孔面积、细胞壁表面的平均孔径和孔体积都减小.
3.3 通过三维荧光光谱图分析可知,废水中可溶性微生物副产物和类腐殖酸被降解的同时产生芳香类蛋白物质;通过紫外光谱分析可知,小球藻能够有效降解腐殖质.
[1] 姜萌萌,林 敏,郑晓宇,等.高温厌氧膜生物反应器处理餐厨废水的启动[J]. 中国环境科学, 2020,40(12):5318-5324.
Jiang M M, Lin M, Zheng X Y, et al. Start-up operation of anaerobic membrane bioreactor treating food wastewater under thermophilic condition [J]. China Environmental Science, 2020,40(12):5318-5324.
[2] 聂丽君,钟华文,周如金,等.混凝/厌氧/兼氧-好氧膜生物反应器组合新工艺处理制革废水[J]. 化工学报, 2016,67(9):3995-4003.
Nie L J, Zhong H W, Zhou R J, et al. Treatment of tanning wastewater by integrated process consisted of coagulation, anaerobic baffled reactor and anoxic/aerobic-membrane bioreactor [J]. CIESC Journal, 2016,67(9):3995-4003.
[3] 何 磊,王志伟,吴志超.餐饮废水MBR处理过程中DOM的三维荧光光谱分析[J]. 中国环境科学, 2011,31(2):225-232.
He L, Wang Z W, Wu Z C. Excitation-emission matrix fluorescence spectra analysis of dissolved organic matter in MBR used for restaurant wastewater treatment [J]. China Environmental Science, 2011,31(2):225-232.
[4] Abdel-Raouf N, Al-Homaidan A A, Ibraheem I B M. Microalgae and wastewater treatment [J]. Saudi Journal of Biological Sciences, 2012,19(3):257-275.
[5] Whitton R, Ometto F, Pidou M, et al. Microalgae for municipal wastewater nutrient remediation: Mechanisms, reactors and outlook for tertiary treatment [J]. Environmental Technology Reviews, 2015, 4(1):1-16.
[6] 王亚茹,潘 晓,于清男,等.共生细菌对盐生小球藻亚砷酸盐代谢的影响[J]. 中国环境科学, 2019,39(10):4303-4312.
WangY R, PanX, YuQ N, et al. Effect of a symbiotic bacterium on the accumulation and transformation of arsenite by[J]. China Environmental Science, 2019,39(10):4303-4312.
[7] 丁 一,侯旭光,郭战胜,等.固定化小球藻对海水养殖废水氮磷的处理[J]. 中国环境科学, 2019,39(1):336-342.
Ding Y, Hou X G, Guo Z S, et al. Studies on the treatment of nitrogen and phosphorus in seawater aquaculture wastewater by immobilized[J]. China Environmental Science, 2019,39(1):336-342.
[8] 卢诗焕,陈 彬,尹 璐,等.地钱浸提液对小球藻的生长抑制效应[J]. 中国环境科学, 2020,40(2):824-831.
Lu S H, Chen B, Yin L, et al. The inhibiting effect on inhibition ofgrowth by liverwort aqueous extract [J]. China Environmental Science, 2020,40(2):824-831.
[9] 吴正云.小球藻异养培养的动力学分析与优化[D]. 上海:上海交通大学, 2007.
Wu Z Y. Kinetic analysis and optimization for heterotrophic cultivation of[D]. Shanghai: Shanghai Jiao Tong University, 2007.
[10] Loganathan B G, Orsat V, Lefsrud M. Phycoremediation and valorization of synthetic dairy wastewater using microalgal consortia ofand[J]. Environmental Technology, 2020,1(3):1-14.
[11] Azianabiha A, Khalid H, Yaakob Z, et al. Analysis of the elemental composition and uptake mechanism offor nutrient removal in agricultural wastewater under optimized response surface methodology (RSM) conditions [J]. Journal of Cleaner Production, 2019,210(3):673-686.
[12] 成 娟.生活污水稀释餐厨垃圾厌氧消化液培养微藻及氮磷去除的研究[D]. 济南:山东大学, 2017.
Cheng J. Study on the microalgal cultivation and removal of nitrogen and phosphorus cultivated in anaerobically digested effluent from kitchen waste diluted with campus sewage [D]. Jinan: Shandong University, 2017.
[13] 叶 庆.涡流闪光柱式反应器促进微藻固定烟气CO2和净化废水研究[D]. 杭州:浙江大学, 2019.
Ye Q. Vortex flow strengthened flashing-light in column bioreactors to promote CO2fixation and wastewater purification [D]. Hangzhou: Zhejiang University, 2019.
[14] 贾艳萍,单晓倩,宋祥飞,等.响应面法优化餐饮废水混凝工艺研究[J]. 化工学报, 2021,72(9):4931-4940.
Jia Y P, Shan X Q, Song X F, et al. Optimization of coagulation process of catering wastewater by response surface methodology [J]. CIESC Journal, 2021,72(9):4931-4940.
[15] Zimmo O R, Steen N P, Gijzen H J. Comparison of ammonia volatilisation rates in algae and duckweed-based waste stabilisation ponds treating domestic wastewater [J]. Water Research, 2003,37(19): 4587-4594.
[16] Singh S K, Singh A, Pandey G N. Methanogenesis of water hyacinth in the presence of boron compounds [J]. Renewable Energy, 1993, 3(1):45-47.
[17] 邵 瑜.微藻对养猪废水氮磷的资源化利用研究[D]. 杭州:浙江大学, 2016.
Shao Y. Research on the nitrogen/phosphorous recovery of piggery wastewater by microalgae [D]. Hangzhou: Zhejiang University, 2016.
[18] Yeh K L, Chen C Y, Chang J S. pH-stat photoheterotrophic cultivation of indigenousESP-31for biomass and lipid production using acetic acid as the carbon source [J]. Biochemical Engineering Journal, 2012,64(19):1-7.
[19] 白丽菊,侯 博,江 波,等.化学吸收剂强化微藻固碳研究进展[J]. 化工进展, 2020,39(2):106-114.
Bai L J, Hou B, Jiang B, et al. Research progress of CO2fixation by chemical absorbents enhanced microalgae [J]. Chemical Industry and Engineering Progress, 2020,39(2):106-114.
[20] 韩 浩.基于小球藻培养的猪场发酵沼液净化与油脂生产耦合研究[D]. 广州:广东工业大学, 2018.
Han H. Decontamination of fermented biogas liquid in piggery coupling with lipid production based oncultivation [D]. Guangzhou: Guangdong University of Technology, 2018.
[21] 叶琳琳,史小丽,吴晓东,等.西太湖秋季蓝藻水华过后细胞裂解对溶解性有机碳影响[J]. 中国环境科学, 2011,31(1):131-136.
Ye L L, Shi X L, Wu X D, et al. The effect ofon dissolved organiccarbon post thebloom in autumn in Western Lake Taihu [J]. China Environmental Science, 2011,31(1):131-136.
[22] 余宗苡.基于蛋白核小球藻培养的高效处理富铵废水联产生物质研究[D]. 广州:华南理工大学, 2019.
Yu Z Y. High efficiency treatment of ammonium-rich wastewater based on cultivation ofwith biomass co- production [D]. Guangzhou: South China University of Technology, 2019.
[23] 周浩媛,陈 军,盛彦清.微藻技术在污水处理中的应用与展望[J]. 环境科学与技术, 2020,43(11):160-171.
Zhou H Y, Chen J, Sheng Y Q. Research progress of microalgae wastewater treatment technologies [J]. Environmental Science and Technology, 2020,43(11):160-171.
[24] 王愿珠,程鹏飞,刘德富,等.生物膜贴壁培养小球藻净化猪粪沼液废水的效果[J]. 环境科学, 2017,38(8):3354-3361.
Wang Y Z, Cheng P F, Liu D F, et al. Purification effect of piggery wastewater withby immobilized biofilm- attached culture [J]. Environmental Science, 2017,38(8):3354-3361.
[25] Cai T, Park S Y, Li Y. Nutrient recovery from wastewater streams by microalgae: Status and prospects [J]. Renewable and Sustainable Energy Reviews, 2013,19(1):360-369.
[26] 马浩天,李润植,张宏江,等.基于微藻培养处理畜禽养殖废水的研究进展[J]. 生物技术通报, 2018,34(11):83-90.
Ma H T, Li R Z, Zhang H J, et al. Research progress on the treatment of wastewater from poultry and livestock breeding based on the microalgae cultivation [J]. Biotechnology Bulletin, 2018,34(11): 83-90.
[27] Vílchez C, Garbayo I, Lobato M V, et al. Microalgae-mediated chemicals production and wastes removal [J]. Enzyme and Microbial Technology, 1997,20(8):562-572.
[28] 陈炜鸣,张爱平,李 民,等.O3/H2O2降解垃圾渗滤液浓缩液的氧化特性及光谱解析[J]. 中国环境科学, 2017,37(6):2160-2172.
Chen W M, Zhang A P, Li M, et al. Decomposition of organics in concentrated landfill leachate with ozone/hydrogen peroxide system: Oxidation characteristics and spectroscopic analyses [J]. China Environmental Science, 2017,37(6):2160-2172.
[29] 任保卫,赵卫红,王江涛,等.胶州湾围隔实验中溶解有机物三维荧光特征[J]. 环境科学, 2007,28(4):4712-4718.
Ren B W, Zhao W H, Wang J T, et al. Three-dimensional fluorescence characteristic of dissolved organic matter in marine mesocosm experiment in jiaozhou bay, China [J]. Environmental Science, 2007, 28(4):4712-4718.
[30] 孙 晶.重金属影响微藻生长富集油脂的机理研究[D]. 杭州:浙江大学, 2015.
Sun J. Influence of heavy metals on microalgal growth and lipids accumulation [D]. Hangzhou: Zhejiang University, 2015.
[31] Yee N, Benning L G, Phoenix V R, et al. Characterization of metal-sorption reactions: A combined macroscopic and infrared spectroscopic investigation [J]. Environmental Science and Technology, 2004,38(3):775-782.
[32] 施 雯.富里酸对蛋白核小球藻富集Pb的影响机制[D]. 杭州:浙江工业大学, 2020.
Shi W. Effect mechanism of fulvic acid on Pb bioaccumulation by[D]. Hangzhou: Zhejiang University of Technology, 2020.
[33] Saleh T A. Nanocomposite of carbon nanotubes/silica nanoparticles and their use for adsorption of Pb(II): From surface properties to sorption mechanism [J]. Desalination and Water Treatment, 2015, 57(23):1-15.
[34] Pradhan S, Singh S, Rai L C. Characterization of various functional groups present in the capsule of microcystis and study of their role in biosorption of Fe, Ni and Cr [J]. Bioresource Technology, 2007, 98(3):595-601.
[35] 孙福红,廖海清,陈艳卿,等.微囊藻对锑(V)生物吸附作用研究[J]. 中国环境科学, 2016,36(11):3383-3389.
Sun F H, Liao H Q, Chen Y Q, et al. Studies on biosorption of antimony (V) by microcystis [J]. China Environmental Science, 2016,36(11):3383-3389.
[36] 韩 冉,林文挺,杨 鹏,等.微藻矿化去除Pb2+的研究[J]. 高校地质学报, 2015,21(4):608-615.
Han R, Lin W T, Yang P, et al. Study on the removal of Pb2+by biomineralization media via microalgae [J]. Geological Journal of China Universities, 2015,21(4):608-615.
[37] 刘冬梅,倪佳鑫,冮苗苗,等.小球藻对多种重金属吸附性能的研究[J]. 环境科学学报, 2020,40(10):3710-3718.
Liu D M, Ni J X, Gang M M, et al. Research on adsorption properties of several heavy metals by[J]. Acta Scientiae Circumstantiae, 2020,40(10):3710-3718.
[38] 雷国元.大型丝状绿藻去除氮磷和抑制微藻的特性及其作用机制[D]. 哈尔滨:哈尔滨工业大学, 2009.
Lei G Y. The characteristics and mechanisms of nitrogen and phosphorus removal and inhibition of microalgal species by filamentous green algae [D]. Harbin: Harbin Institute of Technology, 2009.
Effect and mechanism ofintensified treatment of kitchen wastewater.
JIA Yan-ping, DING Xue, SHAN Xiao-qian, LI Shuo, ZHANG Jian, ZHANG Hai-feng, LI Zheng, ZHANG Lan-he*
(School of Chemical Engineering, Northeast Electric Power University, Jilin 132012, China)., 2022,42(6):2603~2610
C() was used to treat the coagulation effluent and the effects ofinoculation amount on the removal efficiencies of COD, DTP and TN were investigated. The changes of morphology and structure ofwere analyzed using the scanning electron microscope (SEM), infrared spectroscopy and specific surface area micropore analyzer. The component changes of organic matters in kitchen wastewater were studied using ultraviolet visible spectrum and three-dimensional fluorescence spectrum. Mechanism ofdegrading kitchen wastewater was explored. The results showed that when the inoculation amount ofwas 25%, the removal efficiencies of COD and TN were the highest (79.73% and 78.28%, respectively), while the highest DTP removal efficiency (85.55%) was achieved at the inoculation amount of 35%. Before inoculation, the surface ofcells was relatively smooth, while it became rougher after application. The specific surface area ofincreased with the attachment of a large amount of particulate matters. The carboxyl, amino and phosphate groups on the surface ofcells involved in the adsorption and precipitation of the pollutants.destroyed the structure of humus and reduced the aromaticity of humus. Aromatic protein substances were produced whendegraded the soluble microbial by-products and humic acids.
;kitchen wastewater;adsorption;degradation;mechanism
X703
A
1000-6923(2022)06-2603-08
贾艳萍(1973-),女,吉林省吉林市人,教授,博士,主要从事废水处理理论与工艺的研究.发表论文60余篇.
2021-11-23
国家自然科学基金资助项目(52070035);吉林省科技发展计划项目(20180201016SF)
* 责任作者, 教授, zhanglanhe@163.com
