基于核酸切割机理的荧光分析法检测水相中铜离子
2022-06-29胡伶俐刘长辉
胡伶俐,曾 超,肖 颖,刘长辉*
(1. 湖南城市学院 材料与化学工程学院,湖南 益阳 413000;2. 湖南省产商品质量检验研究院,长沙 410007)
铜离子(Cu2+)是生物体内一种不可或缺的微量元素,在生理和病理过程中发挥着非常重要的作用[1-2].人体内Cu2+的缺乏会引发白细胞减少和骨质疏松症等疾病[3],而过量的Cu2+则会损伤肝、肾等器官[4].已有研究表明,从食物、饮用水或其他来源吸收过量的Cu2+会引发严重的神经衰弱等疾病[5-6].因此,开发一种选择性检测水样中Cu2+的方法具有非常重要的意义.近年来,传统的高灵敏度、高选择性Cu2+检测方法,诸如原子吸收光谱法[7]、电感耦合等离子体原子发射光谱法[8]等,引起了人们的广泛关注.与传统方法相比,荧光光谱法具有操作简单、灵敏度高、选择性好等优势而备受关注[9-12].
核酸荧光探针具有物理和化学特性稳定、易合成等性质,且核酸具有被核酸酶和羟基自由基切断的特性[13-14].该探针已被应用于酶活性[14-16]、DNA[17]、蛋白质[18]及金属离子[13,19-20]的检测.众所周知,核酸与某些小分子、聚合物能够产生聚集诱导效应[21-23],从而改变小分子染料的荧光发射光谱.抗癌药物阿霉素(Dox)是一种具有荧光特性的有机分子,它在水相中能够产生强烈的荧光,但在双链DNA(dsDNA)中易被诱导聚集而使荧光淬灭[24-25].本文利用Dox 在dsDNA 中聚集后的荧光淬灭和过氧化氢(H2O2)与Cu2+间发生芬顿反应所产生的羟基自由基(·OH)切断dsDNA 的机理,构建了一种选择性检测水相中Cu2+的荧光分析方法.
1 实验部分
1.1 主要仪器与试剂
U-3010 型紫外-可见分光光度计(日本岛津公司);F-4600 型荧光光度计(日本岛津公司).
DNA(生工生物工程(上海)股份有限公司),其他试剂购自北京百灵威科技有限公司,所用试剂均为分析纯.实验用水为超纯水系统(Barnstead/Thermolyne Corp., Dubuque, IA)制备的超纯水(18.2 MΩ·cm).
1.2 dsDNA 母液配制
取200 μmol/L 互补单链DNA 各125 μL,加入48 μL HEPES 缓冲溶液(10 mmol/L,pH=7.0);继续加入1.5 μL MgCl2溶液(1.0 mol/L)和0.5 μL KCl 溶液(5.0 mol/L);于沸水浴中加热5 min 后,放入冰箱上层冷却,制得dsDNA 母液,备用.
1.3 光谱测定
在比色皿中加入10 mmol/L HEPES 缓冲液400 μL,再加Dox 溶液(5.0 mmol/L)5.0 μL;继续加入一定量的dsDNA 母液、0.5 mmol/L H2O2和一定量的Cu2+溶液,测定其紫外-可见吸收光谱;以480 nm 作为激发波长,保持狭缝为10 nm/10 nm 不变,测定其荧光发射光谱.
1.4 Cu2+含量测定
测定方法同1.3,用0.5 mL 待测液替代Cu2+标准溶液,利用标准工作曲线计算样品中的Cu2+浓度.每份样品平行测定3 次.
2 结果与讨论
2.1 铜离子核酸探针的构建
为了考察Dox 与dsDNA 作用前后的光物理性质的变化情况,在HEPES(10 mmol/L,PH=7.0)缓冲溶液中加入5.0 L 的Dox 溶液(5.0 mmol/L),再加入一定量的dsDNA 母液,测定其紫外-可见吸收光谱和荧光发射光谱,结果如图1 所示.
由图1A 可知,Dox 在480 nm 处展现特征吸收;dsDNA 的加入使其在260 nm 处产生了DNA的特征吸收峰;芬顿试剂(H2O2+Cu2+)的加入使得260 nm 处的吸收峰形状发生了明显变化,但480 nm处的吸收峰形状保持不变.图1B则表明,Dox在550 和590 nm 处产生强的荧光信号,且随着dsDNA 的加入,荧光信号显著减弱,而芬顿试剂(H2O2+Cu2+)又使体系的荧光信号明显增强.其原因可能是:Dox 具有聚集诱导荧光淬灭的性质,其分子嵌入dsDNA 的空隙后形成聚集态,导致了荧光淬灭;而芬顿试剂产生的·OH 切断了DNA,释放出Dox,使体系的荧光增强.这表明核酸探针(Dox/dsDNA)被成功构建.

图1 Dox 加入dsDNA 和芬顿试剂(H2O2+Cu2+)前后的紫外-可见吸收光谱(A)和荧光发射光谱(B)
2.2 可行性研究
为了验证该检测体系的可行性,在HEPES(10 mmol,pH=7.0)缓冲溶液中,固定H2O2含量(0.5 mmol/L),考察探针Dox/dsDNA 与芬顿试剂的响应情况,结果如图2 所示.
由图2A 可知,Dox/dsDNA 在550 和590 nm处的荧光强度很弱,加入H2O2和Cu2+对其荧光信号的变化可以忽略不计,芬顿试剂(H2O2+Cu2+)的加入却使体系的荧光强度明显增强.由图2B发现,Dox 展现较强的荧光信号;dsDNA 的加入使体系的荧光信号显著减弱;H2O2的加入对体系的荧光信号无影响;Cu2+的加入却使体系的荧光信号明显增强,且响应速率快(<100 s),可实现对Cu2+的快速检测.其原因可能是H2O2和Cu2+发生芬顿反应产生·OH 切断了DNA,破坏了其聚集状态并释出Dox 分子,从而恢复了Dox 的荧光.
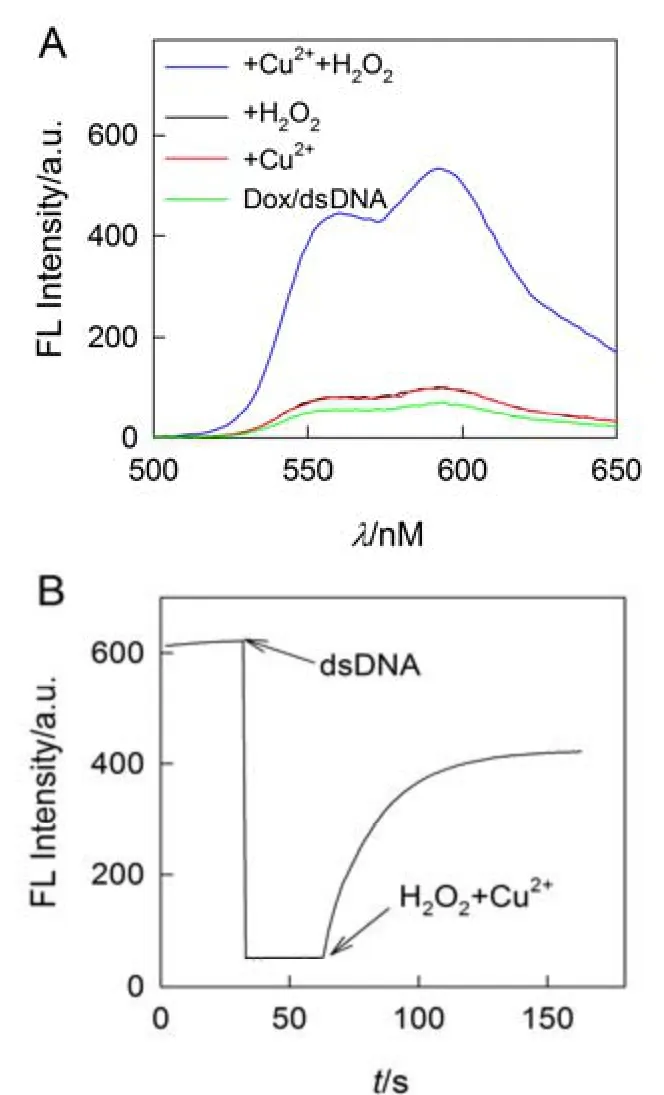
图2 探针Dox/dsDNA 加入H2O2、Cu2+和H2O2/Cu2+前后的荧光发射光谱(A);Dox 加入dsDNA 和H2O2/Cu2+后的荧光响应速率(B)
2.3 dsDNA 长度对Cu2+响应的影响
在HEPES(10 mmol,pH=7.0)缓冲溶液中加入含不同碱基数的dsDNA 与Dox 作用,再与Cu2+响应,考察dsDNA 的长度对体系荧光恢复程度的影响,结果如图3 所示.
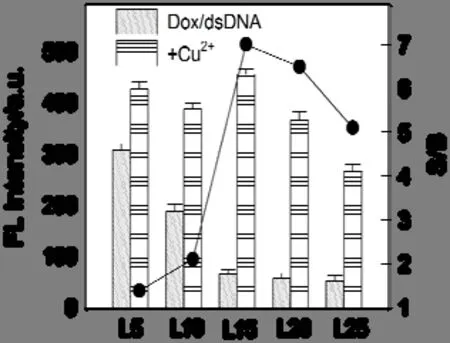
图3 dsDNA 长度对探针Dox/dsDNA 加入Cu2+前后的荧光恢复程度的影响
由图3 可知,固定Dox 的浓度,加入不同碱基数的dsDNA 均可使Dox 的荧光信号展现不同程度的淬灭现象,Cu2+的加入则使体系的荧光信号均有不同程度的恢复;当dsDNA 为15 个碱基时,体系的荧光强度增幅最大.因此,在后续实验中,选择的dsDNA 长度均为15 个碱基.
2.4 干扰实验
在相同实验条件下,依次加入Fe3+、Zn2+、Mg2+、Al3+、Ag+、Cu2+、Ca2+、Hg2+、Cl-、Na+、F-、K+、CO32-、Ni2+、SO42-、PO43-、HPO42-、Pb2+、ClO-和NO3-等常见离子,分别考察体系荧光信号的变化情况,结果如图4 所示.

图4 探针Dox/dsDNA 对常见离子的响应
由图4 可以看出,仅有Cu2+展现显著的荧光增强.此结果表明,探针Dox/dsDNA 仅在芬顿试剂中有响应,可选择性检测Cu2+.
2.5 Cu2+检测
在HEPES(10 mmol,pH=7.0)缓冲溶液中,固定H2O2含量(0.5 mmol/L),考察Cu2+浓度对探针Dox/dsDNA 的影响,结果如图5 所示.
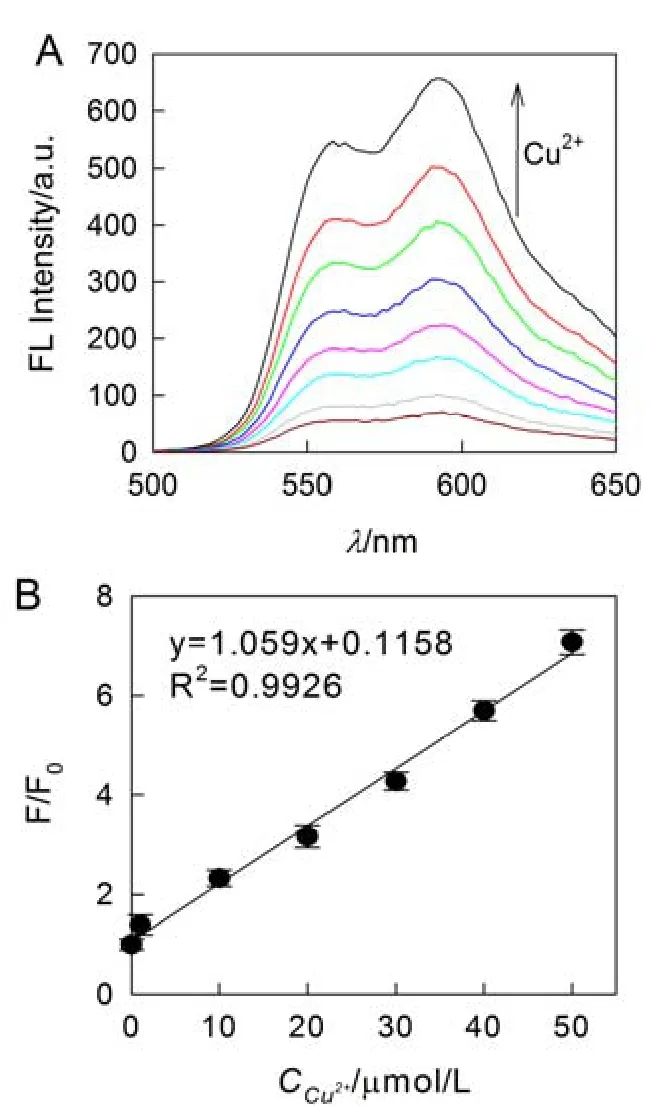
图5 探针Dox/dsDNA 对不同Cu2+浓度的响应(A);Cu2+浓度与体系荧光强度变化的关系(B)
由图5A 可知,体系在480 和590 nm 处展现较弱的荧光信号;随着Cu2+浓度的增加,480 和590 nm 处的荧光信号显著增强;当Cu2+浓度为100 mol/L 时,在590 nm 处的荧光强度增加了9.7倍.由图5B 可知,当Cu2+浓度为1.0~50.0 mol/L时,体系荧光强度的变化程度与Cu2+浓度呈良好的线性关系,其回归方程为y=1.059x+0.115 8,线性相关系数R2=0.992 6,检测限为0.3 mol/L.这表明该Dox/dsDNA 探针可有效检测Cu2+.
2.6 实际样品检测
在HEPES(10 mmol,pH=7.0)缓冲溶液中,固定H2O2含量(0.5 mmol/L),将Dox/dsDNA 探针用于饮用水中Cu2+的检测,结果如表1 所示.
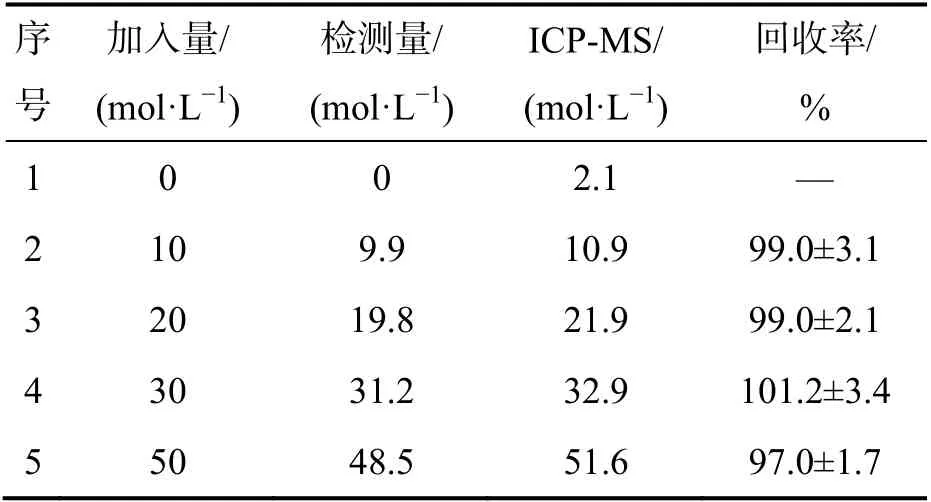
表1 饮用水中Cu2+的检测
由表1 可以看出,Dox/dsDNA 探针对Cu2+的加标回收率为97.0%~101.2%,获得了满意的测定结果.因此,核酸探针Dox/dsDNA 可有效地测定实际样品中的Cu2+含量.
3 结论
根据dsDNA 诱导Dox 聚集并淬灭其荧光信号,以及Cu2+与H2O2反应产生的·OH 可以切断DNA 而恢复Dox 荧光信号的机理,建立了核酸探针选择性检测Cu2+的荧光分析方法.结果表明,当Cu2+浓度为1.0~50.0 mol/L 时,其与检测体系的荧光信号强度变化呈良好的线性关系,检测限为0.3 mol/L.该体系响应速率快(<100 s)、选择性好、灵敏度高,且具有较强抗干扰能力,可用于实际水样的Cu2+检测.由于该探针的构建是通过Dox 与dsDNA 间的嵌合作用,故其稳定性有待进一步提高.
