转录因子GRHL3调控GPR108基因表达及其作用机制
2022-06-28倪鸣岳刘源立涂珍珍郭立钰臧丹丹周海胜
倪鸣岳 刘源立 涂珍珍 郭立钰 臧丹丹 周海胜,*
(1.安徽医科大学基础医学院生物化学与分子生物学教研室,合肥 230032;2. 安徽医科大学科研实验中心,合肥 230032)
果蝇头状因子(grainyhead-like,GRHL) 基因家族成员序列具有高度保守的特点,所编码的蛋白质作为细胞核内转录因子在胚胎发育过程中发挥关键的调控作用[1-5]。果蝇头状因子3(GRHL3)作为GRHL家族成员,在表皮的形成、伤口愈合和屏障功能等方面发挥着重要的调节作用。GRHL3通过激活鸟嘌呤核苷酸交换因子,促进肌动蛋白细胞骨架重组,调节细胞附着和运动,有助于伤口愈合过程中角质形成细胞的定向迁移[5]。GRHL3也可以通过结合谷氨酰胺转氨酶1基因的启动子,调控谷氨酰胺转氨酶1表达进而影响交联蛋白和脂质作用形成表皮角化层[6]。研究[7-8]证实在肿瘤发生过程中,GRHL3与miR-21存在相互拮抗的作用,miR-21抑制了GRHL3的表达,从而抑制了下游的PTEN的生成,并激活PI3K/AKT/mTOR信号通路促进了肿瘤的发生。GRHL3可以作为阻遏物,与靶基因调控区的保守序列5′-AACC(A)GGTT-3′或5′-AACCTGTT-3′特异性结合,从而抑制靶基因表达[9-10]。
G蛋白偶联受体(G protein-coupled receptor,GPCR)是与三聚体G蛋白偶联的细胞表面受体,含有7个穿膜区,是迄今发现的最大的受体超家族。 G蛋白偶联受体108(G protein-coupled receptor 108,GPR108)属于GPCR超家族成员之一,尚未发现天然配体故属于孤儿受体。研究[11]证实GPR108主要分布在细胞高尔基器膜及细胞膜,是一种核因子κB(nuclear factor kappa-B,NF-κB)激活剂,可以负向调节Toll样受体信号通路。研究[12-13]显示GPR108在腺相关病毒感染的细胞免疫应答中具有重要的作用,因为GPR108可以作为腺相关病毒的受体,通过与胞壳蛋白VP1结合,介导腺相关病毒在靶细胞内转导作用。但是,有关GPR108基因表达调控及其分子机制目前不清楚。前期笔者分析人GPR108基因结构时,发现其启动子序列中存在一保守序列5′-AACCGGTG-3′,推测可能是潜在的GRHL3结合基序。本研究旨在证实GRHL3的负调控GPR108表达并探讨其调控机制。
1 材料与方法
1.1 细胞系、菌种与载体
人胚胎肾细胞系(293T)、人永生化表皮细胞系(HaCaT)、人皮肤鳞癌细胞系(A-431),人肝癌细胞系(Hep G2)等细胞系均为本实验室保存;人神经母细胞瘤细胞株(SH-SY5Y)为山东大学药理教研室惠赠;感受态大肠杆菌TOP10(TSC-C12)购自北京擎科生物科技有限公司;真核细胞表达载体pCMV-2B(L5620),用于检测启动子活性的荧光素酶报告基因载体pGL3-basic(E1751)、pGL3-promoter(E1761)、海肾萤光素酶报告基因载体pRL-TK载体(E2241)购自美国Promega公司;克隆载体pMD18-T(6011)购自日本TaKaRa公司;过量表达GRHL3的表达载体pCMV-2B-GRHL3由本实验室构建。
1.2 主要试剂
DMEM高糖培养基(SH30022.01B)购自美国Hyclone公司;胎牛血清(10099-141)购自美国Gibco公司;质粒提取试剂盒(D6943-02)购自美国Omega公司;双荧光素酶报告基因检测试剂盒(E1910)购自美国Promega公司;Ex Taq酶(RR53A)购自日本TaKaRa公司;转染试剂(IMA202001S)购自北京IMAGEN公司;兔源抗Flag抗体(14793s)、ChIP试剂盒(9002S)购自美国Cell Signaling Technologies公司;反转录试剂盒(Q204)购自新贝生物有限公司;突变试剂盒(SMK-101)购自日本TOYOBO公司;SYBR©Green试剂盒(AG11701)购自艾科瑞生物有限公司。
1.3 引物设计与合成
在UCSC网站(http://genome.ucsc.edu/)中,获得GPR108序列,设计并获得GPR108启动子序列,在NCBI网站(https://www.ncbi.nlm.nih.gov/)中,利用Primer-BLAST在线软件进行引物设计,在正向和反向引物的5′端分别添加NheⅠ和Hind Ⅲ酶切位点;在NCBI网站中获得GRHL3和GPR108的CDS序列,以此为模板分别设计反转录定量聚合酶链反应(reverse transcription quantitative polymerase chain reaction, RT-qPCR)检测GRHL3和GPR108的引物;定点突变GPR108启动子引物以GPR108启动子序列为模板,根据突变试剂盒说明书设计删除突变引物;以GPR108启动子序列为模板,根据染色质免疫共沉淀(chromatin immunoprecipitation assay, ChIP)试剂盒说明书设计验证GPR108启动子的PCR引物和qPCR引物序列。所有引物均由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 引物序列Tab.1 Primers sequence
1.4 GPR108启动子克隆和pGL3-GPR108-promoter表达载体构建
以人HaCat细胞基因组DNA为模板,通过PCR克隆获得野生型的GPR108启动子DNA片段,作为人GPR108基因的候选启动子DNA,片段为992 bp。将PCR产物连接在pMD-18T质粒构建pMD-18T-GPR108-promoter重组载体,NheⅠ和Hind Ⅲ进行双酶切鉴定和测序鉴定。用NheⅠ和Hind Ⅲ双酶切后获得目的DNA与pGL3-basic载体连接,构建含有GPR108启动子的重组表达载体pGL3-GPR108-promoter。
将含有野生型GPR108基因启动子的表达载体pGL3-GPR108-promoter和含有突变的GPR108基因启动子表达载体pGL3-Mut-GPR108-promoter分别转染293T细胞,并同时转染过量表达GRHL3的pCMV-2B-GRHL3表达载体或对照载体pCMV-2B,通过检测荧光素酶活性以验证GRHL3与GPR108启动子的结合位点及其对启动子调控作用。
1.5 双荧光素酶报告基因检测
按照转染试剂说明书,将阳性对照pGL3-promoter、阴性对照pGL3-basic、pGL3-GPR108-promoter、pCMV-2B-GRHL3重组表达载体以及pCMV-2B空载体分别与pRL-TK共同转染239T细胞;24 h后收集样品,根据荧光素酶试剂盒说明书进行荧光素酶活性测定。各组5个复孔。
1.6 定点突变构建pGL3-Mut-GPR108-promoter表达载体
以pGL3-GPR108-promoter质粒DNA为模板,利用突变引物进行常规PCR反应。PCR结束后在PCR产物中用2 μL Dpn I,37 ℃作用1 h以消化环形质粒DNA。加T4连接酶将PCR产物进行自身环化。环化DNA转化感受态细菌TOP10,提取单克隆的质粒DNA进行测序鉴定突变克隆。
1.7 ChIP与RT-qPCR
将带有Flag标签的pCMV-2B-GRHL3过表达载体转染293T细胞,放置于37 ℃并含5%(体积分数) CO2的培养箱中培养24 h,去培养基后,用16%(质量分数)多聚甲醛固定细胞。按照ChIP试剂盒说明书操作,利用Flag抗体捕获GRHL3结合的DNA。通过PCR验证捕获GPR108基因启动子DNA,同时利用实时荧光定量PCR(ChIP qPCR)进行定量分析,使用Input样品百分数方法,计算免疫沉淀(immunoprecipitation,IP)效率。
利用Trizol试剂快速提取法提取细胞总RNA,按照反转录试剂盒说明书操作合成cDNA。按照SYBR©Green试剂盒说明书添加反应体系进行PCR。ChIP实验的实时荧光定量PCR(qPCR),运行程序:95 ℃、3 min;95 ℃、15 s,60 ℃、1 min,40个循环。
1.8 生物信息学分析与统计学方法
在CCLE数据库(https://portals.broadinstitute.org/ccle/about)中获得了32种组织癌症的肿瘤细胞系基因表达矩阵,使用R软件对原始数据集进行数据的可视化,分析GRHL3和GPR108的原始数据集在各种组织肿瘤细胞系中的表达。通过公共数据肿瘤细胞系测序分析,检测GRHL3和GPR108的表达水平,筛选差异明显肿瘤细胞系及其疾病以上分析通过R v4.0.3软件包ggplot2(v3.3.3)构建。

2 结果
2.1 GPR108基因启动子结构分析
在数据库中找到人GPR108在染色体上的位置,分析并确定GPR108启动子位置。通过对启动子序列分析发现,近端启动子调控区域的一段序列5′-AACCGGTG-3′,GRHL3可能负调控GPR108基因的表达(图1)。

图1 GPR108基因位置及GRHL3调控GPR108示意图Fig.1 Schematic diagram of GPR108 gene location and GRHL3 regulationGRHL3:grainyhead-like;GPR108:G protein-coupled receptor 108.
2.2 GRHL3与GPR108在肿瘤细胞中的表达谱
首先利用CCLE数据库,对32种人肿瘤组织来源的1 000多种肿瘤细胞系的GRHL3和GPR108表达水平进行可视化分析。这些组织来源的肿瘤包括:脂肪肉瘤、神经母细胞瘤、肾上腺癌、白血病、骨癌、肝癌、皮肤癌、甲状腺癌、脑癌、肉瘤、淋巴瘤、肾癌、骨髓瘤、工程化组织、眼癌、肺癌、畸胎瘤、横纹肌样瘤、胚胎癌、子宫内膜/子宫癌、卵巢癌、胃癌、宫颈癌、胆囊癌、胆管癌、胰腺癌、膀胱癌、前列腺癌、乳腺癌、结肠癌、食管癌、头颈癌。结果显示这些组织来源的肿瘤细胞系中GRHL3表达水平较低,而GPR108具有较高的表达水平(图2)。

图2 肿瘤细胞的GRHL3和GPR108表达谱Fig.2 Expression profile of GRHL3 and GPR108 in tumor cells
根据肿瘤细胞系的表达水平,进一步筛选出GRHL3和GPR108基因表达差异明显的肿瘤细胞系及其对应的疾病,筛选出16种癌症疾病,这些疾病为:弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBC)、多发性骨髓瘤(multiple myeloma, MM)、急性髓系白血病(acute myeloid leukemia, LAML)、皮肤黑色素瘤(skin cutaneous melanoma, SKCM)、肝细胞癌(liver hepatocellular carcinoma, LIHC)、恶性胸膜间皮瘤(mesothelioma, MESO)、多形性胶质母细胞瘤(glioblastoma, GBM)、神经母细胞瘤(neuroblastoma, NB)、肾透明细胞癌(kidney renal clear cell carcinoma, KIRC)、急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)、 脑低级别胶质瘤(brain lower grade glioma, LGG)、甲状腺癌(thyroid carcinoma, THCA)、髓母细胞瘤(medulloblastoma, MB)、前列腺癌(prostate adenocarcinoma, PRAD)、尤文肉瘤(ewing’s sarcoma)、慢性淋巴细胞白血病(chronic lymphocytic Leukemia, CLL)。并在肿瘤细胞系测序数据中分析GRHL3和GPR108的基因表达分布见图2。在数据库提供的多种肿瘤细胞系中GRHL3与GPR108表达谱显示二者具有明显的对立表达方式。
2.3 RT-qPCR验证
为了进一步验证生物信息学分析的数据,从中任意选取了A-431、Hep G2以及SH-SY5Y共3种肿瘤细胞系,利用RT-qPCR以检测GRHL3和GPR108的表达水平。结果显示,在A-431、Hep G2以及SH-SY5Y等细胞中,GRHL3的表达水平均较低;3种细胞中GPR108具有较高的表达水平(图3)。

图3 RT-qPCR检测肿瘤细胞中GRHL3和GPR108表达Fig.3 RT-qPCR detection of GRHL3 and GPR108 expression in tumor cells
2.4 pGL3-GPR108-promoter表达载体构建和GPR108基因启动子活性鉴定
为了验证GRHL3对GPR108的表达可能存在负调控作用,本研究以人HaCaT细胞基因组DNA为模板,通过PCR获得人GPR108启动子。候选的人GPR108基因启动子DNA片段为 992 bp,连接到克隆载体pMD18-T上并将其菌液进行PCR鉴定。PCR结果显示,提取的单克隆中为阳性重组载体。将单克隆进行扩增、提取质粒DNA并进行NheI和Hind III 双酶切鉴定,琼脂糖凝胶电泳显示条带位置与目的片段一致的DNA。将此目的DNA亚克隆到pGL3-basic载体并进行双酶切鉴定,获得992 bp的目的DNA。将重组载体进行DNA测序,测序结果与原序列进行比对证实目的基因无突变。这些结果证实成功构建了pGL3-GPR108-promoter表达载体。
为验证克隆的DNA是否具有启动子活性,将pGL3-GPR108-promoter表达载体转染293T细胞,进行双荧光素酶报告基因检测系统,以检测GPR108启动子活性,结果证实,GPR108基因启动子能够驱动下游荧光素酶报告基因的表达,提示具有启动子功能,并且pGL3-basic、pCMV-2B与pCMV-2B-GRHL3均无荧光活性(图4)。
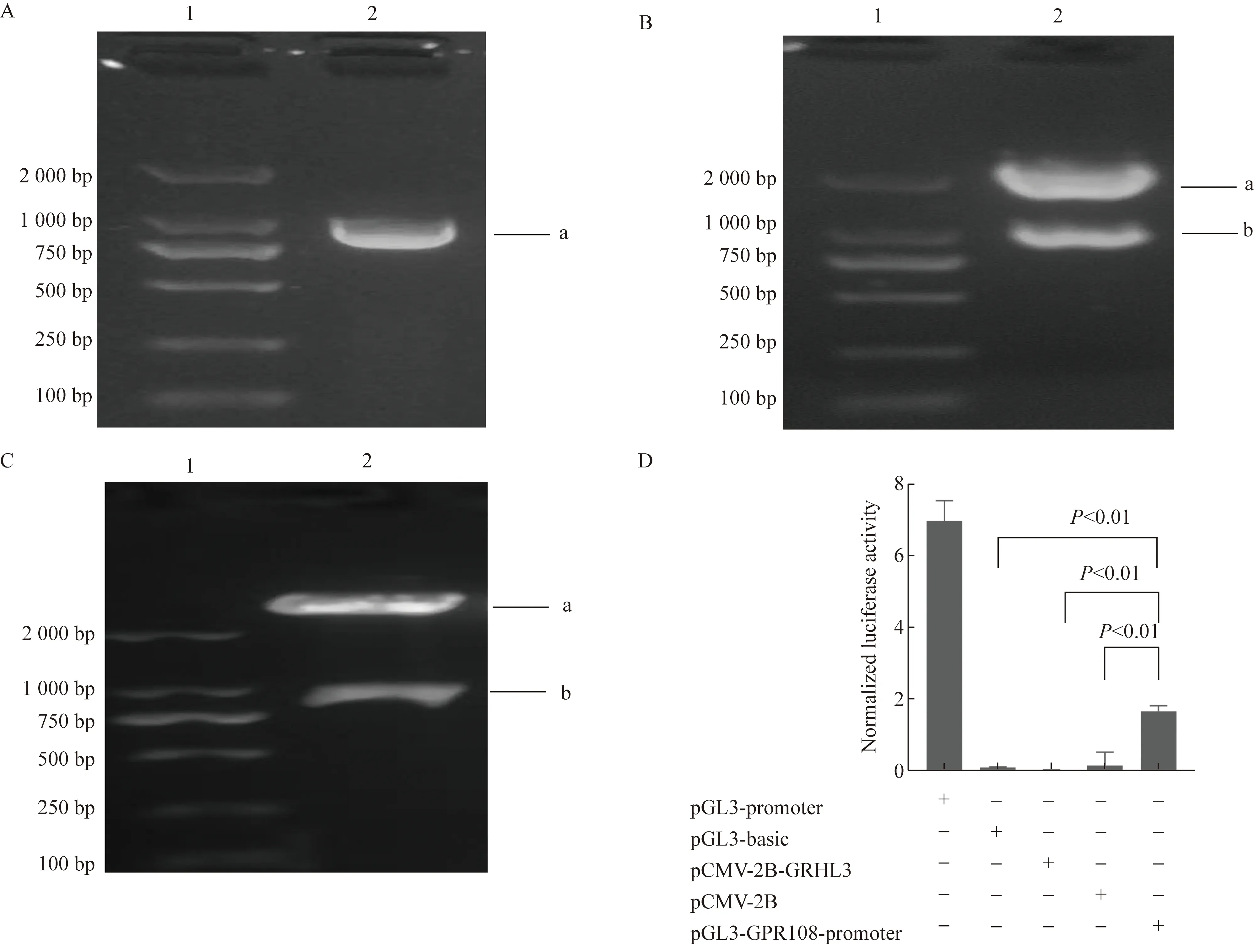
图4 pGL3-GPR108-promoter 表达载体构建Fig.4 Construction of pGL3-GPR108-promoter expression vector
2.5 GRHL3与GPR108基因启动子调控关系及作用位点鉴定
获得GPR108基因启动子并找到潜在结合位点。通过同源比对检测,在GPR108近端启动子区域中发现了一个高度保守的GRHL结合位点,比对同源物种分别为:人类、东北虎、中华菊头蝠、花豹、家猫以及猎豹。设计特异引物,利用PCR方法将pGL3-GPR108-promoter中与GRHL3相结合的潜在位点5′-AACCGGTG-3′进行删除突变,将突变后的表达载体再进行DNA测序验证。
测序结果显示GPR108基因启动子GRHL3潜在位点已被成功删除,从而获得突变启动子的表达载体pGL3-Mut-GPR108-promoter(图5)。
在过量表达GRHL3的情况下,突变的GPR108基因启动子表达载体的荧光素酶活性较野生型启动子明显增加,GRHL3结合位点突变后,GRHL3与GPR108基因启动子结合能力减弱,负调控作用减弱;同时发现在没有GRHL3过量表达情况下,突变的GPR108基因启动子表达载体的荧光素酶活性比过量表达GRHL3时明显增高,GPR108基因启动子可能还存在其他GRHL3的结合位点。在两组空载体对照组中,野生型GPR108基因启动子的活性低于突变型GPR108基因启动子,其原因可能与293T细胞内源的GRHL3抑制作用有关。
根据GPR108基因启动子的基序5′-AACCGGTG-3′上游和下游设计引物分别进行PCR(扩增产物192 bp)和qPCR(扩增产物99 bp)。PCR扩增后的琼脂糖凝胶电泳结果显示,获得扩增的DNA片段与预期一致;同时qPCR结果显示,转录因子GRHL3可以结合GPR108启动子,并且可以与后者的特定序列相结合(图5F)。

图5 转录因子GRHL3调控GPR108启动子Fig.5 Transcription factor GRHL3 regulates GPR108 promoter
3 讨论
GRHL家族成成员其主要功能是作为核内转录因子,参与调控多种靶基因的表达[14-22]。例如,GRHL通过多巴脱羧酶(DOPA decarboxylase,Ddc)基因的反式激活来维持角质层的完整性[5,23];Grhl1和Grhl3通过协同调控转谷氨酰胺酶(transglutaminase,TGMs)维持小鼠表皮通透性屏障[1,24];GRHL2调控口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)细胞中人类端粒酶反转录酶(htelomerase reverse transcriptase,hTERT)基因的表达,提示在细胞永生过程中端粒酶的激活起作用[21]。在果蝇和小鼠中,Grhl3调节许多类型的终端分化基因,这些基因是表皮屏障形成所需的[25]。GRHL3作为一种促进分化和迁移的转录因子,在角化细胞分化过程中,它优先结合到超增强子,而在迁移过程中,它优先结合到启动子,抑制迁移抑制剂的表达[26]。GRHL3也可直接或间接结合到近端E-cadherin启动子中的E-boxes,抑制E-cadherin基因表达,从而导致细胞的迁移和侵袭能力显著增加[27]。这些研究表明,GRHL3可以结合基因的启动子并进行调控。
GPR108作为G蛋白偶联受体家族成员,其表达规律及调控机制均不清楚。利用公开数据库,本研究分析了GRHL3与GPR108在许多不同肿瘤细胞中的表达规律,结果显示二者的表达谱存在负调控的特点;随机选取的3种肿瘤细胞系进行RT-qPCR验证GRHL3与GPR108的表达水平,结果与数据库表达谱一致。因此,GRHL3可能在肿瘤发生过程中发挥抑制作用,而GPR108在肿瘤发生过程中具有促进作用。
研究[27]发现,Grainyhead转录因子及GRHL3在参与调控靶基因表达时,靶基因的启动子等调控区存在其结合的到特定保守序列。其中常见的保守结合序列为5′-AACCGGTT-3′或5′-AACCTGTT-3′,当GRHL3结合后显著抑制靶基因的表达。目前有关GPR108的表达调控机制未见报道。通过对GPR108基因启动子序列分析,发现GPR108基因上游调控区的基因启动子区域,在第一个外显子上游的-992 bp位点,存在GRHL3的结合保守序列5′-AACCGGTG-3′,提示GRHL3通过结合该序列对GPR108的表达存在负调控作用。这也是大多数真核细胞转录调控的主要方式之一。在本研究中,通过基因克隆技术成功克隆GPR108基因外显子上游992 bp的DNA,利用荧光素酶分析证实其具有启动子功能;当与GRHL3过量表达载体共转染时,GPR108启动子活性被有效抑制。从而证实GPR108的表达受到GRHL3的负调控。
生物学信息学分析发现GPR108基因中的启动子区域高度保守序列5′-AACCGGTG-3′,可能是GRHL3潜在结合位点,其位于转录起始点上游-171 bp。为进一步验证其结合GRHL3的调控作用,对该保守序列进行定点删除突变和荧光素酶活性分析,结果证实GRHL3抑制GPR108表达是与该序列密切相关;ChIP结果也证实GPR108基因的5′-AACCGGTG-3′是GRHL3的特异结合位点;GRHL3抑制GPR108表达的主要机制是GRHL3与GPR108启动子的5′-AACCGGTG-3′发生了相互作用。同时,本研究结果显示对该保守序列进行定点突变的启动子,在GRHL3存在情况下,GPR108基因启动子活性仍然有一定的抑制作用,提示GPR108基因启动子区域除存在保守结合序列外,可能存在多个GRHL3结合位点,这将在后续研究中进一步进行验证。
本研究利用分子生物学方法成功克隆人GPR108基因上游调控区DNA,并证实其具有启动子功能;该启动子存在转录因子GRHL3特异性结合的保守序列5′-AACCGGTG-3′,GRHL3可以通过结合该保守序列DNA,对GPR108基因表达发挥明显的抑制作用。这为后续研究GPR108的表达规律、揭示其生理功能及其在炎性反应中作用奠定重要基础。
