3D肝脏分析软件用于复杂型肝癌切除术前评估
2022-06-28龚梅林刘丽丽何佩佩肖林康
龚梅林,刘丽丽,冉 雄,何佩佩,肖林康,李 康*
(1.重庆市人民医院放射科,2.肝胆胰外科 肝胆胰腺外科研究所,重庆 400013)
原发性肝癌发病率仅次于肺癌、结肠癌及胃癌,居全球恶性肿瘤第4位[1],我国肝癌发生率居全球首位。根治性肝切除术为治疗肝癌的最有效方法[2]。现代“精准肝脏外科”理念强调,应在完整切除病灶的前提下最大限度地保留残肝结构和功能的完整性[3],使得精准术前评估的重要性日益凸显。传统CT 2D后处理技术仅能基于二维图像观察肝脏内部解剖结构,无法满足“精准外科”的需求。有学者[4]认为3D打印模型有助于精准切除肝脏肿瘤,但费用较高。本研究观察3D肝脏分析软件用于复杂型肝切除术前评估原发性肝细胞癌(hepatocellular carcinoma, HCC)的价值。
1 资料与方法
1.1 一般资料 收集2018年9月—2020年10月重庆市人民医院30例于肝脏切除术前接受3D肝脏分析软件评估的原发性HCC患者(3D组)及2016年1月—2018年8月30例接受2D后处理软件术前评估的原发性HCC患者(2D组)。3D组男18例、女12例,年龄19~76岁,平均(50.2±11.1)岁;2D组男17例、女13例,年龄21~79岁,平均(51.9±9.9)岁;均由同一名医师主刀施行复杂型肝脏切除术[5-6],术前增强CT提示原发性肝癌,术前未接受放射、化学治疗及任何肝脏相关手术,亦无其他恶性肿瘤病史,术后病理证实为HCC,且术中均R0切除HCC;CT增强扫描与手术时间间隔≤2周,术后随访1年。本研究获院伦理委员会批准。检查前患者均签署相关知情同意书。
1.2 仪器与方法 采用Philips Brilliance 64 slices及IQon Spectral多层螺旋CT。嘱患者仰卧,先行腹部平扫,扫描范围为膈顶至肝脏下缘水平,参数:管电压120 kV,管电流采用自动控制技术,螺距1,准直器宽度64×0.625 mm;之后以3~4 ml/s流率经肘静脉注射80~100 ml碘克沙醇(320 mgI/ml),采用阈值监测手动触发扫描,将ROI置于肝门水平腹主动脉中心,CT值达120 HU(约需15 s)后延迟15 s手动触发扫描,获得动脉晚期图像,再分别延迟约45 s及105 s手动触发扫描,获得门静脉期及实质期图像。以层厚1.0 mm、层间距0.5 mm进行图像重建。
1.3 图像分析 由2名具有5年以上腹部影像学诊断经验的放射科医师分别采用图像存储与传输系统(picture archiving and communications system, PACS)或以3D肝脏分析软件进行阅片,意见产生分歧时经协商达成一致。
1.3.1 3D组 将门静脉期原始图像传输至3D肝脏分析软件工作平台(liver analysis application,Philips星云太空站,V6.0),采用自动及半自动算法进行分割和计算。先以软件自动识别肝内血管及肝段并加以手动校正;之后手动勾画肿瘤轮廓,生成3D图像,并以不同颜色表示肝脏解剖结构;最后自动计算肝内血管体积、癌灶体积、总肝体积(包括肝实质、肝内血管及癌灶体积)、有效肝体积(除去肝内血管及HCC癌灶后的肝实质体积)、拟切除肝体积(手术切缘距肿瘤边缘大于1 cm)及其占总肝体积的百分比和残肝体积及其占总肝体积的百分比(图1、2)。
1.3.2 2D组 于PACS观察图像并进行多平面重建和容积再现,测量肝脏肿瘤各径线,观察肝动脉、门静脉、肝静脉和胆管解剖结构及肿瘤与肝内血管和胆管的关系。
1.4 观察指标 记录手术时间、术中出血量、手术方式改变率和术后并发症(主要包括肝衰竭、腹腔出血、胆瘘、感染、腹腔积液)发生率、术后住院时间、术后1年死亡率及1年复发转移率。
1.5 统计学分析 采用SPSS 24.0统计分析软件。以±s表示符合正态分布的计量资料,采用独立样本t检验进行组间比较;以频数表示计数资料,采用χ2检验或Fisher精确概率法进行组间比较。P<0.05为差异有统计学意义。
2 结果
3D组1例、2D组8例术中改变了原计划手术方式,增加了切除肝段数量或转为肝叶切除。3D组手术时间、术中出血量及术中手术方式改变率均明显少于2D组(P均<0.05,表1)。
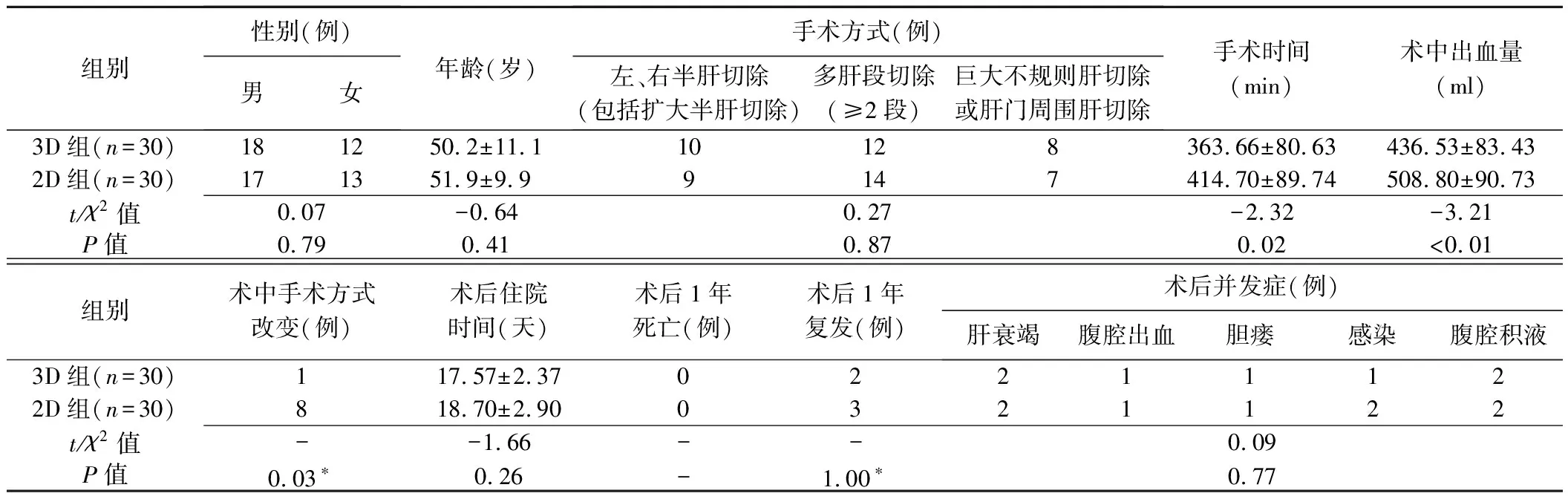
表1 复杂肝肿瘤切除术前接受3D与2D软件评估的原发性HCC患者临床资料比较
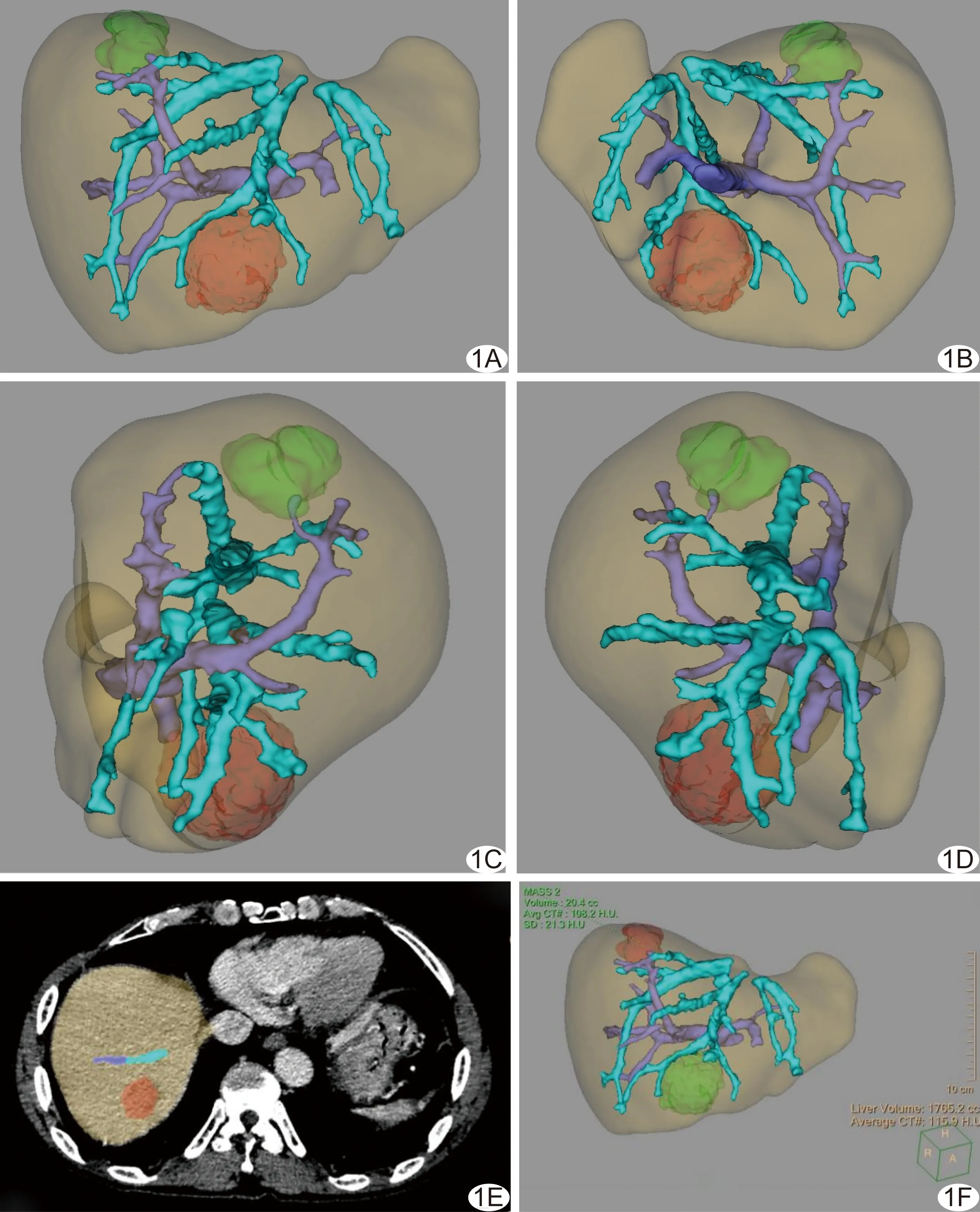
图1 患者男,48岁,原发性HCC,术前以3D肝脏分析软件进行评估 A~D.肝脏3D图像,黄色示肝实质、紫色示门静脉、蓝色示肝静脉,绿色及橙色示2个癌灶; E、F.基于肝脏轴位CT(E)及3D图(F)计算有效肝体积为1 637.6 cm3,总肝体积为1 765.2 cm3,肿瘤体积分别为20.4及55.3 cm3,肝内血管体积为58.8 cm3

图2 患者,男,53岁,原发性HCC,术前以3D肝脏分析软件进行评估 基于肝脏轴位CT图(A,紫色示拟切除区域)及残余肝组织3D图像(B,黄色示肝实质、紫色示门静脉、蓝色示肝静脉)计算拟切除肝体积及其占总肝体积的百分比分别为955.0 cm3及51.7%,残肝体积及其占总肝体积的百分比为891.4 cm3及48.3%
3 讨论
精准切除肝脏肿瘤术前行影像学评估有助于临床制定合理手术方案、选择最佳手术方式。本研究对比观察3D肝脏分析软件与传统2D影像学后处理技术用于复杂肝脏肿瘤切除术前评估的效果,发现术前采用CT 2D后处理技术进行评估时,由于无法显示肿瘤与肝动脉、门静脉、肝静脉及胆管的空间关系,制定手术计划存在较强主观性[7];而3D肝脏分析软件可自动识别肝内血管及肝段、重建肝脏3D图像,支持进行多角度旋转以直观显示肝脏复杂解剖结构,并有助于精准计算肿瘤体积及术后残肝体积等,其效果基本等同于3D打印模型[4,7],具有较高的客观性。
AN等[8]观察2D与3D技术用于超声引导下射频消融治疗HCC的差异,发现3D组首次消融成功率明显高于2D组,而病灶局灶性进展率明显低于2D组。本研究3D组1例及2D组8例术中改变了原计划手术方式,额外增加了切除肝段数量或转为肝叶切除;3D组手术时间、术中出血量和手术方式改变率均少于2D组,与上述研究结果相符合。
肝脏体积可反映肝实质细胞数量,用于评估肝功能储备情况。既往研究[9]报道,切除HCC后的残肝体积与术后肝衰竭发生率具有明显相关性,提示采用3D肝脏分析软件计算残肝体积有助于预估术后肝衰竭可能性。对发生肝衰竭概率较高的患者,需在保证病灶R0切除的前提下适当调整切除范围,以尽可能减少切除的肝脏体积。3D肝脏分析软件还可用于肝移植术前评估,有助于减少术后供体并发症发生率[10]。有学者[11]采用3D肝脏分析软件评估肝脾容积,结合纹理分析及实验室指标判断肝硬化程度,结果显示其诊断效能优于超声弹性成像。此外,3D肝脏分析软件亦可用于教学[12]。
综上所述,3D肝脏分析软件用于复杂型HCC切除术前评估具有一定价值。然而,本研究样本量小,且术后随访时间较短,有待后续进一步完善。
