不同砧木对欧亚种葡萄‘丹娜’果实类黄酮物质的影响
2022-06-28韩晓杨航宇陈为凯王军何非
韩晓,杨航宇,陈为凯,王军,何非
不同砧木对欧亚种葡萄‘丹娜’果实类黄酮物质的影响

中国农业大学食品科学与营养工程学院葡萄与葡萄酒研究中心/农业农村部葡萄酒加工重点实验室,北京 100083
【目的】类黄酮物质是酿酒葡萄的重要代谢产物,对葡萄果实及其葡萄酒的品质有重要影响。研究不同砧木对‘丹娜’(L. cv. Tannat)葡萄基本理化指标和类黄酮物质的影响,为砧木的选择利用提供理论依据。【方法】以‘丹娜’葡萄新梢为接穗,绿枝嫁接‘1103P’‘101-14’‘SO4’和‘贝达’(‘Beta’)等4种不同砧木,在分析不同嫁接苗商业采收期(2016、2017和2019年)葡萄果实基本理化指标(可溶性固形物、可滴定酸、pH、百粒重)的基础上,利用高效液相色谱-质谱联用(HPLC-MS)技术,检测‘丹娜’葡萄不同砧穗组合和自根苗的类黄酮物质组成和含量。【结果】砧木对‘丹娜’葡萄果实百粒重影响较小,自根苗和‘101-14’嫁接的‘丹娜’葡萄可溶性固形物较高;Tannat/1103P、Tannat/101-14和Tannat/Beta组合果汁可滴定酸浓度高于自根苗;Tannat/SO4组合的花色苷和黄酮醇含量最低,Tannat/101-14组合与自根苗花色苷和黄酮醇含量较高;Tannat/101-14组合果皮中的黄烷醇含量较高,Tannat/1103P组合果皮中花色苷、黄酮醇含量较低,但黄烷醇含量较高。通过OPLS-DA模型,发现与自根苗相比,Tannat/101-14组合差异化合物主要是二甲花翠素类花色苷;Tannat/Beta组合主要差异化合物为二甲花翠素类、花翠素类和乙酰化类花色苷、槲皮素类黄酮醇以及总黄烷醇;而Tannat/SO4组合与自根苗差异化合物二甲花翠素类、花翠素类、花青素类和乙酰化类花色苷及槲皮素类黄酮醇;Tannat/1103P组合的差异化合物则主要为乙酰化类和二甲花翠素类花色苷、槲皮素类黄酮醇。【结论】在北京地区,4种砧木嫁接都有降低‘丹娜’葡萄果实中甲基花青素类、甲基花翠素类、花青素类、非酰化类、乙酰化类、香豆酰化类花色苷以及梅酮类和西伯利亚落叶松黄酮类黄酮醇物质的趋势。‘101-14’嫁接的‘丹娜’葡萄果皮中花色苷、黄酮醇、黄烷醇等类黄酮物质积累较多,有利于酿酒品质的提升,推荐使用;而‘SO4’嫁接的‘丹娜’葡萄类黄酮物质积累较少,不推荐使用。
酿酒葡萄;‘丹娜’葡萄;砧木;类黄酮;高效液相色谱-质谱联用(HPLC-MS)
0 引言
【研究意义】类黄酮物质是酿酒葡萄果实中一类重要的次生代谢产物,对葡萄酒的色泽和口感有很大影响,可以赋予葡萄果实及其酿造的葡萄酒以独特的品质,多年来备受关注[1-4]。葡萄果实中的类黄酮物质主要包含花色苷、黄酮醇和黄烷醇3大类,主要在酿酒葡萄的果皮和种子(黄烷醇)中积累[5-7]。影响酿酒葡萄类黄酮物质积累的因素多种多样,如葡萄品种、光照、温度、土壤环境、水分条件和栽培方式等。研究不同砧木对接穗葡萄果实类黄酮物质的影响,有助于明确不同砧穗组合间类黄酮代谢物的差异,为葡萄酒定向酿造提供参考。【前人研究进展】嫁接是葡萄栽培中广泛应用的一种农艺措施,至今已有2 500多年的历史。葡萄砧木的研究与利用始于根瘤蚜传入欧洲并带来毁灭性灾害[8-9],因为原产于北美的葡萄种对葡萄根瘤蚜具有抗性[10]。此外,不同基因型的砧木对因土壤因素引起的其他生物和非生物胁迫也表现不同的耐性/抗性[11],因此,在葡萄栽培上,大量采用嫁接苗代替自根苗。不同砧木对接穗品种的生长发育、光合速率、果实和葡萄酒品质产生影响[12-18],研究发现,砧木通过影响接穗果实的可溶性固形物浓度(°Brix)、pH、多酚等成分含量,从而影响葡萄酒质量[19]。众多研究表明,砧木对接穗品种植物学性状和经济性状、生理代谢、基因表达均有不同程度的影响[20-26]。不同砧木由于自身遗传特性的不同,对接穗品种类黄酮物质的积累也产生不同的影响。Wang等[27]研究发现,砧木‘Ganzin 1’抑制‘赤霞珠’葡萄果皮黄烷-3-醇的积累;‘101-14’‘5A’‘5BB’‘Ganzin 1’‘Harmony’‘Riparia Gloire’和‘SO4’降低了‘赤霞珠’葡萄果实中表儿茶素的浓度和比例;‘5A’‘Harmony’和‘Riparia Gloire’提高了‘赤霞珠’葡萄果皮黄酮醇的浓度;‘SO4’降低了大部分单体花色苷的浓度。另有研究表明,嫁接到‘SO4’砧木上的‘美乐’葡萄与嫁接其他砧木的‘美乐’葡萄相比,其果皮和种子中的花色苷浓度较高,而嫁接到砧木‘Gravesac’上的‘美乐’葡萄果皮和种子中花色苷浓度显著偏低[28]。嫁接到‘Chasselas 41B’砧木上的‘Vranec’葡萄果实中花色苷含量较高,嫁接到‘Rupestris Du Lot’砧木的‘Vranec’葡萄果实中黄酮醇含量较高;嫁接到‘Fercal’砧木上的‘Vranec’葡萄果实中显示较高水平的黄烷醇[29]。但HARBERTSON等[30]研究了‘霞多丽’‘美乐’和‘西拉’分别嫁接到5种砧木(‘5C’‘140R’‘113P’‘3309C’和‘101CU’),并与各自的自根植株相比,发现各个砧穗组合中花色苷含量并没有显著性差异。由此可见,不同砧木对接穗品种果实类黄酮物质含量的影响不同。目前关于砧木对葡萄果实品质的研究多集中在糖、酸、pH等基本指标上,关于砧木对类黄酮物质的研究相对较少。【本研究切入点】‘丹娜’作为优良的酿酒品种,以拥有高品质及高含量的单宁而闻名,陈酿潜力大,广泛种植于法国、智利、阿根廷和乌拉圭等地,近年来在我国也开始推广种植。目前关于‘丹娜’葡萄酒类黄酮物质的报道较多,但是关于‘丹娜’葡萄果实类黄酮物质,尤其是不同砧木嫁接‘丹娜’葡萄果实中类黄酮物质的研究尚未有报道,不同砧穗组合之间的特征性类黄酮化合物也尚不明确。【拟解决的关键问题】以不同砧木嫁接‘丹娜’葡萄,在分析商业采收期葡萄果实基本理化指标的基础上,利用高效液相色谱-质谱联用技术,研究不同砧木对‘丹娜’类黄酮化合物积累的影响,以明确不同砧穗组合与自根苗之间的差异化合物,旨在为酿酒葡萄实际生产中砧木的选择应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料 试验地点位于中国农业大学上庄实验站,试验地为平地,土壤类型为砂质黏壤土。‘Tannat’所嫁接的砧木分别为‘1103P’‘101-14’ ‘SO4’和‘Beta’,以‘Tannat’自根苗作为对照;各砧木定植于2012年,于2013年夏季进行绿枝嫁接。2016、2017、2019三个年份测定不同砧穗组合中花色苷、黄酮醇、黄烷醇的含量(2018年由于试验地气候原因,病害严重,在采收期并未采收到健康成熟的果实,2019年采收期采到自根苗及‘1103P’‘101-14’‘Beta’嫁接的‘Tannat’果实,未采到Tanant/SO4组合果实)。于果实成熟期进行采样,2016年采样日期为9月23日,2017年采样日期为9月15日,2019年采样日期为9月17日。葡萄各砧穗组合种植均为南北行向,行距和株距分别为2.5 m和1.2 m,南北行向,篱架,树形为倾斜式单龙干,叶幕形为改良型VSP(M-VSP,即“厂”字形),采用短枝修剪,叶幕高度和宽度分别保持在约120 cm和70 cm,留梢量为12—15新梢/延长米,灌溉方式为滴灌,采用常规葡萄园管理,灌溉、施肥和病虫害控制等均按照相同的标准进行。
2016、2017、2019等3年的气象资料来源于中国气象数据网(http://data.cma.cn/),观测点(40°23 N,116°52′ E)与试验地直线距离约30 km。以“百粒果”的方法采收每个砧穗组合成熟期的葡萄果实样品,每种样品设3个生物学重复。样品采集后迅速用液氮速冻,液氮保护下转运至实验室后置于-40℃保存备用。
1.1.2 试剂 乙酸钠(分析纯)、甲醇(分析纯)、丙酮(分析纯),北京化工厂;乙腈(色谱纯)、甲酸(色谱纯)、甲醇(色谱纯),Fisher公司(Hampton,USA);类黄酮标准品,包括二甲花翠素-3--葡萄糖苷、儿茶素、表儿茶素、表棓儿茶素、表儿茶素没食子酸酯和槲皮素-3--葡萄糖苷,Sigma公司(St. Louis,MO,USA)。
1.2 仪器与设备
FD-1C-50冷冻干燥机,北京博医康实验仪器有限公司;Micro 17R离心机,赛默飞世尔公司;Agilent 1100系列配有二极管阵列检测器(DAD)的LC/MSD Trap-VL高效液相色谱-离子阱质谱联用仪,美国Agilent公司;Agilent 1200系列LC/MSD Trap-VL高效液相色谱-三重四级杆质谱联用仪,美国Agilent公司;Agilent 1200系列配有可变波长检测器(VWD)的高效液相色谱串联Bruker系列离子阱质谱联用仪,美国Agilent公司。
1.3 方法
1.3.1 果实理化指标的检测 电子天平(精度0.01 g)称量100粒果实重,共设3组平行。随机选取50粒无物理性损伤、无病虫害、发育正常的葡萄果实,充分挤压出汁后,利用手持糖度计测定葡萄汁的可溶性固形物含量,采用pH计测定葡萄汁的pH。可滴定酸的测定参照国标GB12293—1990进行测定。
1.3.2 葡萄果皮花色苷和黄酮醇的提取与测定 利用50%(v/v)甲醇水溶液对花色苷和黄酮醇进行低温避光提取,具体方法参考参照 Downey等[31]、胡丽等[32]。花色苷测定:使用Agilent 1100系列配有二极管阵列检测器(DAD)的LC/MSD Trap-VL液相色谱-离子阱质谱联用仪,色谱柱为Kromasil100-5-C18(250 mm×4.6 mm),柱温50℃,进样量30 μL,检测波长为525 nm,流速为1 mL∙min-1,离子阱质谱检测器的采集参数为电喷雾离子源,正离子模式,离子扫描范围为100—1 500 m/z,雾化器压力为30 psi,干燥器流速为10 L∙min-1,干燥气温度为325℃,具体测定检测条件参照胡丽等[32]。黄酮醇测定:使用Agilent 1200系列配有可变波长检测器(VWD)的LC-UV高效液相色谱串联Bruker系列的离子阱质谱联用仪,色谱柱为ZorbaxEclipseXDB-C18(250 mm×4.6 mm)。具体测定检测条件参照胡丽等[32]。
1.3.3 葡萄果皮和种子中黄烷醇的提取与测定 利用70%(v/v)丙酮水溶液提取游离黄烷醇,并进行氮吹浓缩,盐酸甲醇溶液复溶。用间苯三酚裂解果皮中黄烷醇,具体方法参照胡丽等[32]。黄烷醇测定:使用Agilent 1200系列HPLC-MS/MS高效液相色谱串联三重四级杆质谱仪,色谱柱为Poroshell 120 EC-C18 column(150 mm×2.1 mm,2.7 μm),具体测定方法和检测条件参照胡丽等[32]。
1.4 数据分析
标准曲线、平均值和标准偏差计算等均通过Microsoft Excel 2016软件进行分析;采用SPSS 22.0(IBM,USA)统计分析软件进行单因素方差分析和双因素方差分析,采用Orgin pro 2021进行气象图绘制,采用SMICA14.1进行正交偏最小二乘判别分析。
2 结果
2.1 葡萄园气象条件
如图1所示,通过对葡萄园所在地区2016、2017、2019年3年葡萄生长季气象数据的搜集、整理与分析,发现2017年总光照时数最大,2019年次之,2016年最小。且2016年降雨量最大,总有效积温较低,特别是2016年葡萄转色前降雨量较大。2017年降雨集中在7月初和8月初,葡萄收获前期降雨量较小。2019年总降雨量最小,生长前期(5—7月)降雨较小,采收前有少量降雨。

图1 气象数据
Fig. 1 Meteorological data
2.2 不同砧木对‘丹娜’葡萄果实基本理化指标的影响
在果实百粒重方面,2016年各砧穗组合及自根苗之间未发现显著性差异;2017年,Tannat/Beta组合的果实百粒重小于自根苗,其余砧穗组合与自根苗之间没有显著差异;2019年,Tannat/101-14与‘Tanant’自根苗无显著差异,两者显著高于Tannat/1103P和Tannat/Beta组合。在可溶性固形物方面,2016年的Tannat/101-14和Tannat/Beta与自根苗无显著性差异,Tannat/1103P和Tannat/SO4均低于自根苗;2017年Tannat/101-14显著高于自根苗及其他砧穗组合;2019年,Tannat/101-14和自根苗显著高于Tannat/ 1103P和Tannat/Beta组合。对于果汁pH,2016年所有砧穗组合与自根苗相比没有显著性差异;2017年,Tannat/101-14组合pH最高,Tannat/Beta最低;2019年,Tannat/1103P组合最高,同样以Tannat/Beta组合果汁pH最低。对于可滴定酸,2016年所有砧穗组合无显著差异;2017年自根苗可滴定酸显著低于Tannat/1103P、Tannat/101-14、Tannat/Beta;2019年,自根苗可滴定酸显著低于Tannat/101-14、Tannat/Beta组合(表1)。
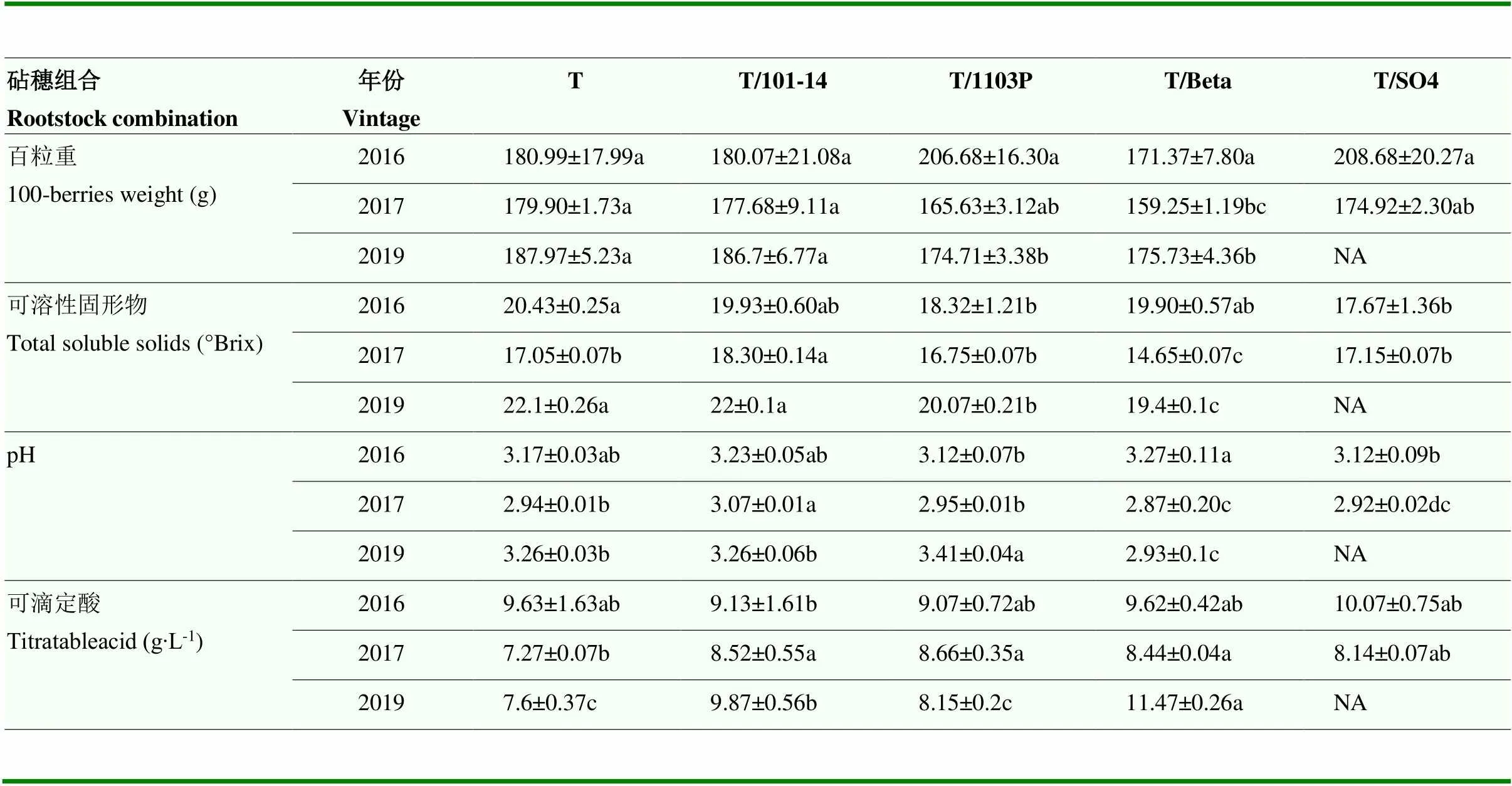
表1 不同砧穗组合‘丹娜’葡萄果实的基本理化指标
Tannat简写为T,不同小写字母表示同一年份不同处理间差异达到显著性水平(Duncan’s test,<0.05),NA表示缺失值。下同
Tannat is short for T, Different lowercase letters indicate significant differences between treatments in the same year (Duncan’s test,<0.05), NA represents the missing value. The same as blow
2.3 砧木对‘丹娜’葡萄花色苷含量的影响
在‘丹娜’葡萄果皮中共检测到16种单体花色苷,且各个砧穗组合中所含花色苷种类相同,主要包括5种非酰化花色苷,5种乙酰化花色苷,5种香豆酰化花色苷和1种咖啡酰化花色苷。由表2可知,3年的试验均表明,自根苗葡萄果皮中总花色苷含量最高,嫁接苗都有降低花色苷总含量的趋势,且2016—2017连续2年的试验表明,Tannat/SO4组合花色苷含量最低。对于不同种类的花色苷,2016年,自根苗和Tannat/Beta组合中甲基花青素和二甲花翠素类花色苷含量显著高于Tannat/SO4组合。2017年,自根苗和Tannat/101-14组合花青素、花翠素、甲基花青素和甲基花翠素类花色苷含量均显著高于其他组合(<0.05);而对于二甲花翠素类花色苷,自根苗和Tannat/101-14显著高于Tannat/1103P、Tannat/Beta和Tannat/SO4组合(<0.05)。‘Beta’‘SO4’ ‘1103P’等3种砧木嫁接的‘丹娜’葡萄果实各类花色苷含量较低。2019年,Tannat/101-14组合和自根苗中花翠素类花色苷含量显著高于Tannat/1103P和Tannat/Beta组合(<0.05),Tannat/101-14组合和自根苗中甲基花翠素和花青素含量显著高于Tannat/Beta组合(<0.05)。对于不同酰化类型的花色苷,2016年,各个砧穗组合非酰化花色苷和乙酰化花色苷仅在自根苗和Tannat/SO4组合中表现出差异,Tannat/ 1103P组合的香豆酰化和咖啡酰化花色苷含量显著高于自根苗、Tannat/101-14和Tannat/SO4组合(<0.05)。2017年,自根苗葡萄果实非酰化花色苷含量最高,自根苗和Tannat/101-14组合乙酰化花色苷、香豆酰化花色苷、咖啡酰化花色苷含量显著高于其他组合(<0.05)。2019年,Tannat/1103P组合和自根苗中香豆酰化花色苷含量显著高于Tannat/Beta和Tannat/101-14组合,Tannat/101-14组合和自根苗咖啡酰化和乙酰化类花色苷含量显著高于Tannat/Beta组合(<0.05)。
表2 不同砧穗组合‘丹娜’葡萄花色苷的组成和含量(mg∙kg-1FW)
Table 2 Anthocyanin compositions and contents (mg∙kg-1FW) in Tannat grape of different rootstock combinations
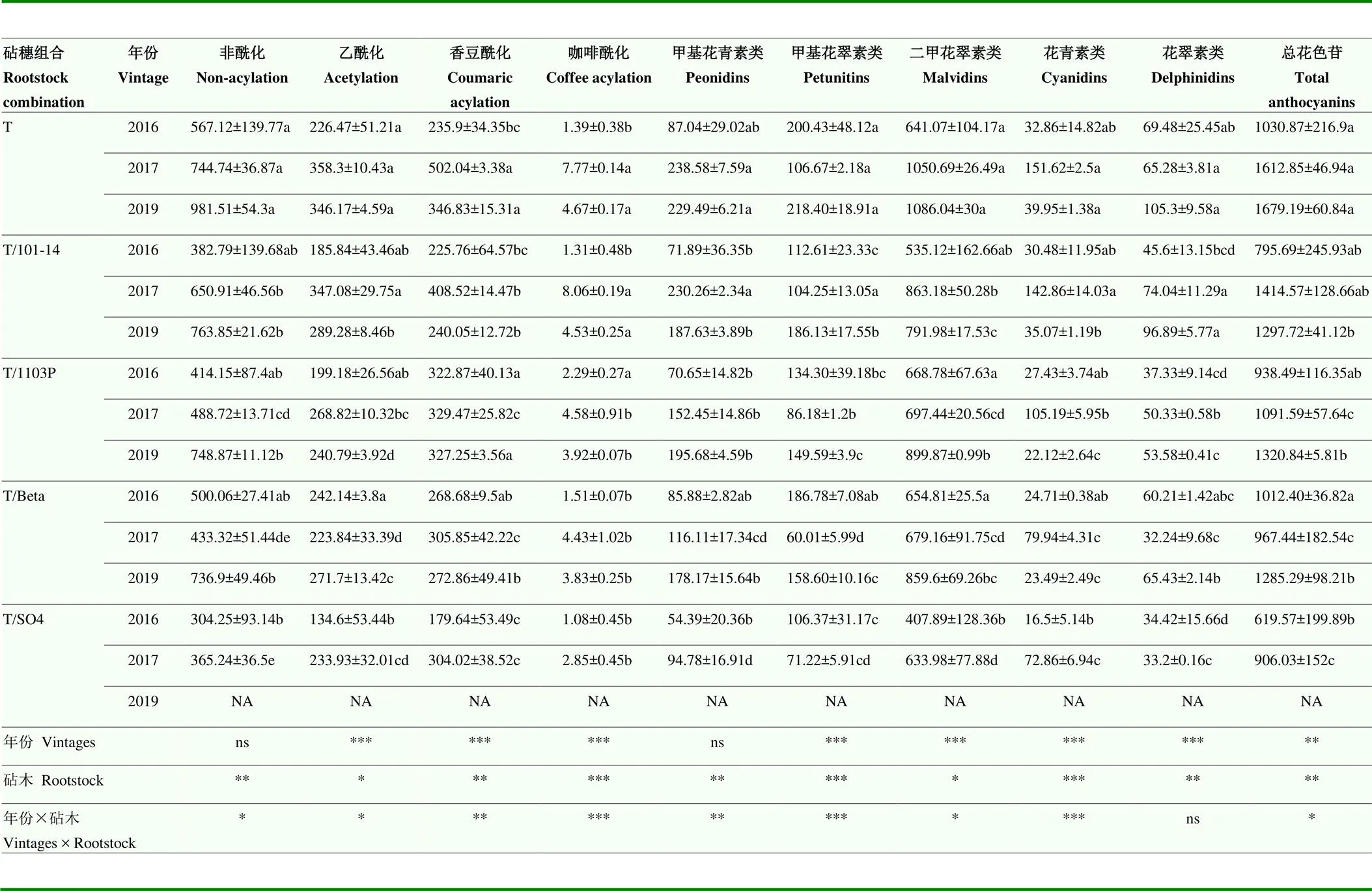
双因素方差分析检验年份、处理和年份×处理差异的显著性水平(ns:不显著;*:<0.05;**:<0.01;***:<0.001)。下同
Two-factor ANOVA was used to test the level of significance of differences in vintages, treatment, and vintages × treatment (ns: No significant; *:<0.05; **:<0.01; ***:<0.001). The same as below
年份和砧木的双因素方差分析结果表明,砧木对所有类型花色苷均具有显著影响,4种砧木都有降低甲基花青素类、甲基花翠素类、花青素类、非酰化类、乙酰化类、香豆酰化类花色苷的趋势。年份对花翠素类、花青素类、甲基花翠素类、甲基花青素类、二甲花翠素类、总花色苷类、乙酰化、香豆酰化、咖啡酰化类花色苷有显著影响。除花翠素类花色苷外,其他类型花色苷均受到砧木和年份的交互影响。
2.4 砧木对‘丹娜’葡萄黄酮醇含量的影响
‘丹娜’葡萄自根苗及其砧穗组合葡萄果实的果皮中共检测出11种黄酮醇类物质,且各样品中检测到的黄酮醇类别相同,‘丹娜’葡萄果皮中主要包括3种杨梅酮类、4种槲皮素类、1种西伯利亚落叶松黄酮类、2种山奈酚类、1种异鼠李亭类和1种丁香亭类黄酮醇。由表3可知,在成熟的果实中,槲皮素类黄酮醇物质是含量最高的黄酮醇,杨梅酮次之,丁香亭和西伯利亚落叶松黄酮类黄酮醇物质所占比例较小。2016年,Tannat/Beta组合果皮总黄酮醇与自根苗和其他砧穗组合无显著差异,但总含量显著高于Tannat/SO4组合(<0.05)。另外,Tannat/Beta组合槲皮素类和西伯利亚落叶松黄酮类黄酮醇物质含量也显著高于Tannat/SO4组合(<0.05)。Tannat/101-14组合的总黄酮醇含量也相对较高,各类型黄酮醇也均高于Tannat/1103P组合。而在2017年,‘丹娜’葡萄自根苗果皮总黄酮醇含量要高于的嫁接苗。对于不同类型的黄酮醇,同样以‘丹娜’葡萄自根苗和Tannat/101-14组合较高。Tannat/SO4组合杨梅酮、山奈酚、槲皮素、异鼠李素等含量均显著较低,丁香亭类和西伯利亚落叶松黄酮类黄酮醇类物质与其他砧穗组合差异较小。2019,Tannat/101-14总黄酮醇含量最高,与自根苗无显著差异,剩余3种砧穗组合黄酮醇含量较低。双因素方差分析结果表明,年份对山奈酚和异鼠李素类黄酮醇物质呈现出极显著差异(<0.01),对其他类型黄酮醇类物质的影响不显著。砧木对于杨梅酮类和西伯利亚落叶松黄酮类黄酮醇物质具有极显著影响,4种砧木都不同程度降低了‘丹娜’葡萄杨梅酮类和西伯利亚落叶松黄酮类黄酮醇物质的含量。年份和砧木对除山奈酚类和丁香亭类黄酮醇之外的其他类型黄酮醇具有共同影响。

表3 不同砧穗组合‘丹娜’葡萄黄酮醇的组成和含量(mg∙kg-1 FW)
2.5 砧木对‘丹娜’葡萄黄烷醇含量的影响
‘丹娜’葡萄果皮中的游离黄烷醇主要包括3种基本单元,分别为儿茶素(C)、表儿茶素(EC)和表棓儿茶素(EGC)。由表4可知,在果皮中,2016—2017年,以Tannat/101-14组合黄烷醇总含量最高;2019年Tannat/101-14组合与自根苗和其他组合果皮总黄烷醇含量无显著差异。对于游离单元%,2016年,不同砧穗组合无显著差异;2017年,自根苗游离单元%最高,Tannat/1103P最低;2019年,自根苗与Tannat/101-14和Tanant/Beta无显著差异,Tannat/1103P游离单元%最低。对于延伸单元,3年试验中,不同砧穗组合之间差异较小,以Tannat/101-14组合较高。对于末端单元%,2016—2017年,以Tannat/101-14组合最低;2019年各砧穗组合之间无显著差异。双因素方差分析结果表明,年份对果皮中的游离单元%有极显著影响(<0.01),对延伸单元%、末端单元%、总黄烷醇含量有显著影响(<0.05),而砧木仅对果皮中黄烷醇游离单元%有极显著影响。年份和砧木共同影响了果皮中游离单元%。

表4 不同砧穗组合‘丹娜’葡萄黄烷醇的组成和含量(mg∙kg-1 FW)
2.6 正交偏最小二乘回归分析
为了进一步探究不同砧木对‘丹娜’葡萄中次级代谢产物的影响,建立OPLS-DA模型进行差异分析。结果如图2所示,其中Tanant/SO4组合用2016—2017年数据进行拟合,剩余组合用2016、2017、2019年3年数据。结果显示,建立的OPLS-DA的模型第一主成分(竖轴方向上)可以很好地将不同砧穗组合与自根苗区分开来,且模型经过200次置换检验后,无过度拟合现象。一般而言,Q2Y值>0.5则表示模型有良好的预测能力,由表5可知,本试验构建的模型R2X、R2Y、Q2Y值均在0.656—0.999,说明模型可靠且筛选差异性化合物的能力良好。通过模型筛选VIP>1的化合物发现,与自根苗相比,Tannat/101-14组合差异化合物是香豆酰化二甲花翠素和乙酰化二甲花翠素;Tannat/Beta组合主要差异化合物香豆酰化二甲花翠素、乙酰化二甲花翠素、乙酰化甲基花青素、乙酰化甲基花翠素、香豆酰化甲基花翠素、槲皮素葡萄糖酸苷;而Tannat/SO4组合与自根苗差异化合物是香豆酰化二甲花翠素、乙酰化二甲花翠素、乙酰化甲基花青素、乙酰化甲基花翠素、香豆酰化甲基花翠素、槲皮素葡萄糖酸苷。Tannat/1103P组合差异化合物主要是乙酰化二甲花翠素、乙酰化甲基花青素、乙酰化甲基花翠素、槲皮素类、香豆酰化二甲花翠素。综上,在众多类黄酮物质中,嫁接苗和自根苗相比,花色苷是最主要的差异化合物,且花色苷以二甲花翠素类为主。

A—D分别表示T与101-14,T与1103P,T与Beta,T与SO4的OPLS-DA分布图

表5 基于类黄酮化合物构建的OPLS-DA模型参数
3 讨论
3.1 砧木影响‘丹娜’葡萄的理化指标
砧木对‘丹娜’葡萄的影响,首先体现在果实基本理化指标方面。从3年的结果看,砧木对‘丹娜’葡萄果实的百粒重影响并不是很大,但对于可溶性固形物,与其他砧木相比,砧木101-14嫁接的‘丹娜’葡萄含量较高,说明101-14可以促进‘丹娜’葡萄可溶性固形物的积累。同时,对于果汁可滴定酸,4种嫁接苗中,101-14同样有降低‘丹娜’葡萄中果汁可滴定酸的趋势。由此可知,砧木101-14一方面增加了可溶性固形物的积累;另一方面也加速了可滴定酸的分解,进而促进果实成熟。尽管与自根苗相比,差异较小,但对于嫁接苗,101-14显著加速果实成熟。李敏敏等[33]在‘赤霞珠’中也有类似的发现。
3.2 砧木影响‘丹娜’葡萄的类黄酮物质含量
酿酒葡萄果实中花色苷、黄酮醇、黄烷醇等类黄酮物质是酿酒品质的重要参考指标,一般而言,葡萄果实中类黄酮物质越丰富,酿出的葡萄酒酒体越饱满、骨架感越强。类黄酮化合物是苯丙烷代谢途径中代谢物种类最多的分支途径,基本结构为C6-C3-C6,即两个酚羟基的苯环(A环与B环)通过中央三碳原子(C环)相互连结而成的一系列化合物。根据C环的不同修饰,可将类黄酮化合物分为花色苷、黄酮醇、黄烷醇等[34-35]。葡萄果实类黄酮的生物合成又有2个分支:一个是类黄酮-3'-羟基化酶(F3'H)介导的花青素类花色苷的合成途径;另一个是类黄酮-3'5'-羟基化(F3'5'H)介导的花翠素类花色苷的合成途径[36]。本研究得出,二甲花翠素类花色苷是受砧木影响最大的类黄酮代谢物,而二甲花翠素类花色苷是类黄酮-3'5'-羟基化(F3'5'H)介导路径合成的,因此,推测砧木有可能是通过调节代谢流向使接穗果实中类黄酮物质的合成受到了影响。
本研究发现,相对于其他3种砧木,砧木‘101-14’有利于果皮中花色苷、黄酮醇、黄烷醇的积累,但与自根苗相比,并没有显著优势。与此相反,砧木‘SO4’不利于‘丹娜’葡萄中花色苷、黄酮醇、黄烷醇的积累。有文献报道,‘SO4’降低了‘赤霞珠’葡萄果实大部分单体花色苷的浓度,与本研究结果一致[27]。李敏敏等[33]以7种砧木嫁接‘赤霞珠’葡萄,发现‘101-14’显著提高了果实花色苷含量,与本研究结果一致。但也有文献报道‘140R’‘SO4’有利于‘美乐’葡萄果实花色苷的积累,‘101-14’和‘1103P’不利于接穗品种花色苷的积累[28],这种差异可能是由于不同的接穗品种和环境因素造成的,不同的砧穗组合之间的嫁接亲和性不同,不同的生长环境也会造成砧穗组合之间的生长产生差异,这种差异进而可能会影响果实中类黄酮物质的含量。此外,在‘黑格雷克’(Greco Nero)、‘丽晶’(Regent)葡萄的砧木嫁接试验中,砧木‘5BB’‘125AA’也在不同程度上提高了葡萄果实中花色苷的含量[37-38]。关于砧木对接穗黄酮醇含量影响的研究,目前报道较少。有研究发现‘5A’‘Harmony’和‘Riparia Gloire’有促进‘赤霞珠’黄酮醇合成的趋势[27],不同砧木嫁接的‘汤姆森无核’葡萄果实槲皮素含量无显著影响[39]。黄酮醇的积累与光照关系较为密切,结合本研究发现,2017和2019年光照较为充足的年份,黄酮醇含量普遍较高,说明充足的光照有利于黄酮醇的积累。同时发现在嫁接苗中,CS/101-14组合的花色苷和黄酮醇含量都较高,说明101-14对于花色苷和黄酮醇的积累有促进作用。对于果皮中的黄烷醇,‘5BB’嫁接的‘黑格雷克’果皮中EC和C含量较高[37]。WANG等[27]也发现砧木‘Ganzin 1’抑制‘赤霞珠’葡萄果皮黄烷-3-醇的积累。也有研究发现‘SO4’‘110R’促进了‘美乐’果皮中的黄烷醇含量积累。砧木‘Sori’与‘161-49’‘125AA’‘5BB’‘Borner’相比,显著增加了‘丽晶’葡萄的黄烷醇含量[38]。本研究发现各砧穗组合之间黄烷醇含量差异不大,说明砧木对黄烷醇含量影响较小。
综上,不同砧木对接穗果实中的花色苷、黄酮醇、黄烷醇均有显著影响。之所以会产生不同的影响,一方面是因为砧木对营养物质、水分等利用与同化能力不同,使接穗的营养生长和生殖生长发生了改变,进而影响了果实的表型以及类黄酮等次级代谢物的分泌。如‘101-14’由河岸葡萄和沙地葡萄杂交而来,树势中庸,有促进果实成熟的趋势。而‘1103P’由冬葡萄和沙地葡萄杂交而来,树势旺盛、根系发达。‘SO4’由冬葡萄和河岸葡萄杂交而来,树势中庸,根系较浅,丰产性强。‘贝达’由美洲葡萄和河岸葡萄杂而来,抗寒能力强。这些砧木独特的遗传特性赋予了接穗不同的性状表达。另外,砧木自身的根系分泌物、富集的微生物也各不相同[40],这也导致了接穗的生长发育发成了改变;砧木中遗传物质如miRNA可以在砧木和接穗中移动,也可能造成了接穗中调控类黄酮物质代谢的酶含量的变化,甚至引起关键酶相关基因的表达发生变化,从而调控了果实的发育,使果实中的类黄酮代谢产生差异。
基于此,初步推测在雨热同期的气候条件下,有促进成熟的趋势砧木,更利于果实类黄酮物质的积累;而树势旺盛,丰产能力强的砧木,不利于果实类黄酮物质的积累。关于砧木对果实表型的改变,导致类黄酮代谢物含量差异的机理,仍需进一步研究。
4 结论
在北京地区,‘101-14’有利于可溶性固形物的积累,而‘1103P’‘SO4’和‘贝达’等3种砧木不利于可溶性固形物的积累。‘101-14’嫁接的‘丹娜’葡萄花色苷、黄酮醇、黄烷醇等类黄酮物质积累较多,有利于酿酒品质的提升,推荐使用;而‘SO4’嫁接的‘丹娜’葡萄花色苷、黄酮醇、黄烷醇等类黄酮物质积累较少,不推荐作为砧木使用。
[1] BASHIR S, KAUR N, ARORA N K. Dynamics of partitioning of major sugars, total phenols and flavonoids in the juice of seven wine grape (spp.) cultivars during different stages of berry development. Plant Physiology Reports, 2019, 24(1): 112-118. doi: 10.1007/s40502-018-0409-1.
[2] GOUOT J C, SMITH J P, HOLZAPFEL B P, WALKER A R., CELIA B. Grape berry flavonoids: A review of their biochemical responses to high and extreme high temperatures. Journal of Experimental Botany, 2018, 70(2): 397-423.
[3] TANAKA T, IUCHI A, HARADA H, HASHIMOTO S. Potential beneficial effects of wine flavonoids on allergic diseases. Diseases, 2019, 7(1): 8-8. doi: 10.3390/diseases7010008.
[4] GEORGIEV V, ANANGA A, TSOLOVA V. Recent advances and uses of grape flavonoids as nutraceuticals. Nutrients, 2014, 6(1): 391-415. doi: 10.3390/nu6010391.
[5] 张欣珂, 赵旭, 成池芳, 齐梦瑶, 石英. 葡萄酒中的酚类物质I: 种类、结构及其检测方法研究进展. 食品科学, 2019, 40(15): 255-268. doi:10.7506/spkx1002-6630-20180916-159.
ZHANG X K, ZHAO X, CHENG C F, QI M Y, SHI Y. Phenolics in wines I: A review of categories, structures and detection methods. Food Science, 2019, 40(15): 255-268. doi: 10.7506/spkx1002-6630- 20180916-159. (in Chinese)
[6] SOMKUWAR R G, BHANGE M A, OULKAR D P, SHARMA A K, AHAMMED SHABEER T P. Estimation of polyphenols by using HPLC–DAD in red and white wine grape varieties grown under tropical conditions of India. Journal of Food Science and Technology, 2018, 55(12): 4994-5002. doi: 10.1007/s13197-018-3438-x.
[7] YUE Q Y, XU L L, XIANG G G, YU X,YAO Y X. Characterization of gene expression profile, phenolic composition, and antioxidant capacity in red-fleshed grape berries and their wines. Journal of Agricultural and Food Chemistry, 2018, 66(27): 7190-7199.
[8] MELNYK C W, MEYEROWITZ E M. Plant grafting. Current Biology, 2015, 25(5): 183-188.
[9] CARRASCO-QUIROZ M, MARTÍNEZ-GIL A M, GUTIÉRREZ- GAMBOA G, Y MORENO‐SIMUNOVIC. Effect of rootstocks on volatile composition of Merlot wines. Journal of the Science of Food and Agriculture, 2020, 100(8): 3517-3524. doi: 10.1002/jsfa.10395.
[10] SAVOI S, EITLE M W, BERGER H, CURTO M, MEIMBERG H, GRIESSER M, Forneck A. Comparative transcriptome analysis of two root-feeding grape Phylloxera () lineages feeding on a rootstock and. Insects, 2020, 11(10): 691.
[11] BLANCQUAERT E H, OBERHOLSTER A, RICARDO-DA-SILVA J M, DELOIRE A J. Effects of abiotic factors on phenolic compounds in the grape Nerry-A review. South African Journal of Enology and Viticulture, 2019, 40(1): 1-14.
[12] 綦伟, 厉恩茂, 翟衡, 王晓芳, 杜远鹏, 谭皓. 部分根区干旱对不同砧木嫁接玛瓦斯亚葡萄生长的影响. 中国农业科学, 2007, 40(4): 794-799. doi: 10.3321/j.issn: 0578-1752.2007.04.020.
QI W, LI E M, ZHAI H, WANG X F, DU Y P, TAN H. Effects of partial rootzone drying on the growth ofcv. malvasia grafted on varied rootstocks. Scientia Agricultura Sinica, 2007, 40(4): 794-799. doi: 10.3321/j.issn: 0578-1752.2007.04.020. (in Chinese)
[13] WALKER R R, BLACKMORE D H, CLINGELEFFER P R, HOLT H, PEARSON W, FRANCIS I L. Effect of rootstock on yield, grape composition and wine sensory attributes of Shiraz grown in a moderately saline environment. Australian Journal of Grape and Wine Research, 2019, 25(4): 414-429. doi: 10.1111/ajgw.12409.
[14] SUAREZ D L, CELIS N, ANDERSON R G, SANDHU D. Grape rootstock response to salinity, water and combined salinity and water stresses. Agronomy, 2019, 9(6): 321. doi: 10.3390/agronomy9060321.
[15] GUTIÉRREZ-GAMBOA G, CARRASCO-QUIROZ M, MARTÍNEZ- GIL A M, PÉREZ-ÁLVAREZ E P, GARDE-CERDÁN T, MORENO- SIMUNOVIC Y. Grape and wine amino acid composition from Carignan noir grapevines growing under rainfed conditions in the Maule Valley, Chile: Effects of location and rootstock. Food Research International, 2018, 105: 344-352. doi: 10.1016/j.foodres.2017.11.021.
[16] 崔鹏飞, 魏灵珠, 程建徽, 向江, 李明山, 吴江. 不同砧木对天工翠玉葡萄生长和果实品质的影响. 浙江农业学报, 2021, 33(1): 52-61. doi: 10.3969/j.issn.1004-1524.2021.01.07.
CUI P F, WEI L Z, CHENG J H, XIANG J, LI M S, WU J. Effects of different rootstocks on growth and fruit quality of Tiangong Cuiyu grape. Acta Agriculturae Zhejiangensis, 2021, 33(1): 52-61. doi: 10.3969/j.issn.1004-1524.2021.01.07. (in Chinese)
[17] 白世践, 户金鸽, 蔡军社, 赵荣华, 陈光. 砧木对极端干旱区马瑟兰葡萄光合及酿酒特性的影响. 西北农林科技大学学报(自然科学版), 2021, 49(3): 129-137. doi: 10.13207/j.cnki.jnwafu.2021.03.015.
BAI S J, HU J G, CAI J S, ZHAO R H, CHEN G. Effects of rootstocks on photosynthesis and vinification characteristics of Marselan grape in extreme arid region. Journal of Northwest A & F University (Natural Science Edition), 2021, 49(3): 129-137. doi: 10.13207/j.cnki.jnwafu. 2021.03.015. (in Chinese)
[18] 韩晓, 王海波, 王孝娣, 冀晓昊, 史祥宾, 王宝亮, 郑晓翠, 王志强, 刘凤之. 不同砧木对‘87-1’葡萄光合特性及荧光特性的影响. 中国农业科学, 2018, 51(10): 1972-1981. doi: 10.3864/j.issn.0578-1752. 2018.10.016.
HAN X, WANG H B, WANG X D, JI X H, SHI X B, WANG B L, ZHENG X C, WANG Z Q, LIU F Z. Effects of different rootstocks on ‘87-1’ grape photosynthetic and chlorophyll fluorescence characteristics. Scientia Agricultura Sinica, 2018, 51(10): 1972-1981. doi: 10.3864/j.issn.0578-1752.2018.10.016. (in Chinese)
[19] KOUNDOURAS S, HATZIDIMITRIOU E, KARAMOLEGKOU M, DIMOPOULOU E, KALLITHRAKA S, TSIALTAS J T. Irrigation and rootstock effects on the phenolic concentration and aroma potential ofL. cv. Cabernet Sauvignon grapes. Journal of Agricultural and Food Chemistry, 2009, 57: 7805-7813.
[20] JENSEN P J, MAKALOWSKA I, ALTMAN N, FAZIO G, PRAUL C, MAXIMOVA S N, CRASSWELLER R M, TRAVIS J W, MCNELLIS T W. Rootstock-regulated gene expression patterns in apple tree scions. Tree Genetics & Genomes, 2010, 6(1): 57-72. doi: 10.1007/s11295- 009-0228-7.
[21] HOOVER E E, HEMSTAD P, LARSON D, MACKENZIE J, PROPSOM F. Rootstock influence on scion vigor, hardiness, yield, and fruit composition of St. Pepin grape. Acta Horticulturae, 2004, 640: 201-206.
[22] SOMKUWAR R G, SATISHA J, RAMTEKE S D, SHARMA J. Effect of rootstocks and pre-harvest treatments on storage life of Thompson seedless grapes. Acta Horticulturae, 2008, 785(785): 441-446. doi: 10.17660/actahortic.2008.785.58.
[23] VRSIC S, PULKO B, KOCSIS L. Factors influencing grafting success and compatibility of grape rootstocks. Scientia Horticulturae, 2015, 181: 168-173.
[24] JIN Z X, SUN H, SUN T Y, WANG Q J, YAO Y X. Modifications of ‘Gold Finger’ grape berry quality as affected by the different rootstocks. Journal of Agricultural and Food Chemistry, 2016, 64(21): 4189-4197. doi: 10.1021/acs.jafc.6b00361.
[25] LI M M, GUO Z J, JIA N, YUAN J W, HAN B, YIN Y G, SUN Y, LIU C J, ZHAO S J. Evaluation of eight rootstocks on the growth and berry quality of ‘Marselan’ grapevines. Scientia Horticulturae, 2019, 248: 58-61. doi: 10.1016/j.scienta.2018.12.050.
[26] DE SOUZA LEÃO P C, DE MELO CHAVES A R. Training systems and rootstocks on yield and agronomic performance of ‘Syrah’ grapevine in the Brazilian semiarid. Ciência e Agrotecnologia, 2019, 43. doi: 10.1590/1413-7054201943005719.
[27] WANG Y, CHEN W K, GAO X T, HE L, YANG X H, HE F, DUAN C Q, WANG J. Rootstock-mediated effects on Cabernet Sauvignon performance: Vine growth, berry ripening, flavonoids, and aromatic profiles. International Journal of Molecular Sciences, 2019, 20(2): 401.
[28] GUTIÉRREZ-GAMBOA G, GÓMEZ-PLAZA E, BAUTISTA-ORTÍN A B, GARDE-CERDÁN T, MORENO-SIMUNOVIC Y, MARTÍNEZ- GIL A M. Rootstock effects on grape anthocyanins, skin and seed proanthocyanidins and wine color and phenolic compounds fromL. Merlot grapevines.Journal of the Science of Food and Agriculture, 2019, 99(6): 2846-2854.
[29] NEDELKOVSKI D, CVETKOVIĆ J, BELESKI K, POPOSKA H. Phenolic composition of Vranec grapevine cultivar (L.) grafted on different rootstock. Bulgarian Journal of Agricultural Science, 2017, 23(3): 389-395.
[30] HARBERTSON J F, KELLER M. Rootstock effects on deficit- irrigated wine grapes in a dry climate: grape and wine composition. American journal of enology and viticulture, 2012, 63(1): 40-48.
[31] DOWNEY M O, MARICA M, KRSTIC M P. Development of a stable extract for anthocyanins and flavonols from grape skin. American Journal of Enology and Viticulture, 2007, 58(3): 358-364.
[32] 胡丽, 彭文婷, 卢浩成, 王军. 不同酿酒葡萄果实类黄酮及香气物质差异分析. 食品科学, 2020, 41(14): 225-233. doi: 10.7506/ spkx1002-6630-20190625-310.
HU L, PENG W T, LU H C, WANG J. Analysis on differences in flavonoids and aroma compounds of different wine grape varieties. Food Science, 2020, 41(14): 225-233. doi: 10.7506/spkx1002-6630- 20190625-310. (in Chinese)
[33] 李敏敏, 袁军伟, 刘长江, 韩斌, 黄家珍, 郭紫娟, 赵胜建. 砧木对河北昌黎产区赤霞珠葡萄生长和果实品质的影响. 应用生态学报, 2016, 27(1): 59-63. doi: 10.13287/j.1001-9332.201601.003.
LI M M, YUAN J W, LIU C J, HAN B, HUANG J Z, GUO Z J, ZHAO S J. Effects of rootstocks on the growth and berry quality ofcv. Cabernet Sauvignon grapevine in Changli zone, Hebei Province, China. Chinese Journal of Applied Ecology, 2016, 27(1): 59-63. doi: 10.13287/j.1001-9332.201601.003. (in Chinese)
[34] 华晓雨, 陶爽, 孙盛楠, 郭娜, 阎秀峰, 蔺吉祥. 植物次生代谢产物-酚类化合物的研究进展. 生物技术通报, 2017, 33(12): 22-29. doi: 10.13560/j.cnki.biotech.bull.1985.2017-0546.
HUA X Y, TAO S, SUN S N, GUO N, YAN X F, LIN J X. Research progress on phenolic compounds of plant secondary metabolites. Biotechnology Bulletin, 2017, 33(12): 22-29. doi: 10.13560/j.cnki. biotech.bull.1985.2017-0546. (in Chinese)
[35] GRASSI D, AGGIO A, ONORI L, CROCE G, TIBERTI S, FERRI C, FERRI L, DESIDERI G. Tea, flavonoids, and nitric oxide-mediated vascular reactivity. The Journal of Nutrition, 2008, 138(8): 1554-1560. doi: 10.1093/jn/138.8.1554S.
[36] HE F, MU L, YAN G L, LIANG N N, PAN Q H, WANG J, REEVES M J, DUAN C Q. Biosynthesis of anthocyanins and their regulation in colored grapes. Molecules, 2010, 15(12): 9057. doi: 10.3390/ MOLECULES15129057.
[37] SURIANO S, ALBA V, DI GENNARO D, SURIANO M S, SAVINO M, TARRICONE L. Genotype/rootstocks effect on the expression of anthocyanins and flavans in grapes and wines of Greco Nero n.(L.). Scientia Horticulturae, 2016, 209: 309-315. Scientia Horticulturae, 2016, 209: 309-315.
[38] MIJOWSKA K, OCHMIAN I, OSZMIAŃSKI J. Rootstock effects on polyphenol content in grapes of ‘Regent’cultivated under cool climate condition.Journal of Applied Botany and Food Quality, 2017, 90: 159-164.
[39] JOGAIAH S, OULKAR D P, BANERJEE K, SHARMA J, PATIL A G, MASKE S R, SOMKUWAR R G. Biochemically induced variations during some phenological stages in Thompson seedless grapevines grafted on different rootstocks. South African Journal of Enology and Viticulture, 2016, 34(1): 36-45. doi: 10.21548/34-1-1079.
[40] MARASCO R, ROLLI E, FUSI M, MICHOUD G, DAFFONCHIO D. Grapevine rootstocks shape underground bacterial microbiome and networking but not potential functionality. Microbiome, 2018, 6(1): 3. doi: 10.1186/s40168-017-0391-2.
Effects of Different Rootstocks on Flavonoids ofL. cv. Tannat Grape Fruits

Center for Viticulture & Enology, College of Food Science and Nutritional Engineering, China Agricultural University/Key Laboratory of Viticulture and Enology, Ministry of Agriculture and Rural Affairs, Beijing 100083
【Objective】Flavonoids are important metabolites of wine grapes, which have important effects on the qualities of the grape fruits and their wines. In this study, the effects of different rootstocks on the physicochemical parameters and flavonoid substances of Tannat (L.) grapes were studied to provide the theoretical basis for the selection and utilization of rootstocks.【Method】In the present research, Tannat shoots were used as scions and were greenwood grafted on four different kinds of rootstocks, including 1103P, 101-14, SO4, and Beta. On the bases of the analysis of the basic physicochemical parameters (total soluble solid content, titratable acid, pH, and 100-berry weights) of the commercial mature grape berries of these grapevines grafted on different rootstocks, the compositions and contents of the flavonoids in the corresponding grape berries were detected by using high performance liquid chromatography-mass spectrometry (HPLC-MS), in the three vintages of 2016, 2017 and 2019.【Result】 The rootstocks had little effect on the 100-berry weights of the Tannat grapes; the contents of the total soluble solids were higher in the combination of Tannat/101-14, as well as the own-rooted Tannat; the titratable acids of the grape juice of the Tannat/101-14 and the Tannat/Beta combinations were higher than the own-rooted Tannat grapes. In the part of flavonoids, the contents of anthocyanins and flavonols in the Tannat/SO4 combination was the lowest in all of these combinations; the concentrations of anthocyanins and flavonols in the Tannat/101-14 combination and the own-rooted Tannat were higher than those of other combinations; the concentrations of flavanols in the skins of the Tannat/101-14 combination was higher. In addition, the concentrations of anthocyanins and flavonols in the Tannat/ 11103P combination was lower, but the content of flavanols in the skins of the Tannat/1103P combination was relatively high. Besides, the results of two-factor ANOVA of the year and the rootstock showed that the rootstocks had significant effects on all types of anthocyanins. All the four rootstocks showed a tendency of reducing the anthocyanins of peonidin, petunitin, malvidin, non-acylation, acetylation and coumaric acylation. In the mature fruits, the quercetins were the most abundant flavonols, followed by myricetins, while syringetins and laricitrins accounted for a smaller proportion. Rootstocks had a significant effect on the myricetins and laricitrins, which reduced the contents of myricetin and laricitrin to different degrees. Through the establishment of OPLS-DA (Orthogonal Partial Least Squares Discrimination Analysis) model, it was found that the Tannat/101-14 combination was mainly distinguished by the malvidin anthocyanin compared with the own-rooted grapes. The main difference compounds of Tannat/Beta combination were anthocyanins of malvidin, delphinidin and acetylation, the total flavanols and quercetin compounds. The difference compounds of the Tannat/SO4 combination were anthocyanins of malvidin, delphinidin, acetylation, and quercetins. The Tannat/1103P combination mainly consisted of acetylated anthocyanins and quercetins.【Conclusion】 In Beijing region, all the four rootstocks (1103P, SO4, Beta, and 101-14) showed a tendency of reducing the flavonoid concentrations, including anthocyanins of peonidin, petunitin, malvidin, non-acylation, acetylation, coumaric acylation quercetins, and laricitrins. The rootstock '101-14' was beneficial to the accumulation of anthocyanins, flavonols and flavanols in fruit skins, which was conducive to the improvement of the wine quality, so it was recommended to be used. However, Tannat grapes grafted with SO4 had less flavonoid accumulation, which was not recommended to be used.
wine grape; Tannat; rootstock; flavonoid; high-performance liquid chromatography-mass spectrometry (HPLC-MS)
2021-09-07;
2021-12-31
财政部和农业农村部:国家现代农业产业技术体系资助(CARS—29)
韩晓,Tel:18801311676;E-mail:hanxiaoke55@126.com。通信作者何非,Tel:13811574410;E-mail:wheyfey@cau.edu.cn
10.3864/j.issn.0578-1752.2022.10.011
(责任编辑 赵伶俐)
