基于广泛非靶向代谢组学解析富硒黄酒发酵过程的差异代谢产物
2022-06-28张标金昌晓宇刘清兰陆文英涂田华温国锦万伟杰张祥喜
张标金,昌晓宇,刘清兰,陆文英,涂田华,温国锦,万伟杰,严 寒,张祥喜
(1.江西省农业科学院 农产品质量安全与标准研究所,江西 南昌 330200;2.江西省石城县农业农村局,江西 石城 342700)
硒(Selenium, Se)具有抗衰老、抗癌和解毒等多种生理功能[1-2];食用富硒食品是提高人体硒摄入量的理想途径。黄酒富含低聚糖、酚类、活性肽、维生素、矿物质、有机酸、氨基酸等营养功能成分,具有抗氧化、增强免疫力、降血压、保护心血管、改善肠道菌群微生态环境等保健功能[3]。近年来,我国黄酒产量不断上升,据国家统计局调查,其年产量从2009年的10.63亿L增长至2020年的36.50亿L。江西是我国黄酒的重要产区之一,以甜黄酒为主,著名的九江封缸酒是人们重要的日常消费饮品。开发富硒黄酒产品,发挥硒元素和黄酒的双重营养保健功能,对增加富硒产品类型,丰富人们的补硒方式,促进黄酒产业的多元化发展等具有重要意义。本研究利用富硒糯米酿制富硒黄酒,分析了富硒黄酒的总硒和有机硒含量,并采用基于广泛非靶向代谢组技术解析了富硒黄酒发酵过程中的代谢物差异,以期为富硒黄酒的开发提供理论依据。
1 材料和方法
1.1 原料
菌种:采用江西本地传统发酵菌剂。
富硒糯米和普通糯米:供试水稻品种为赣糯8号,其种子由江西省农业科学院水稻研究所提供。在江西省农业科学院高安基地将赣糯8号作中稻种植,在抽穗期叶面喷施含亚硒酸钠的叶面肥(叶面肥硒含量为5 mg/L),每公顷喷施1500 L;在黄熟后收获稻谷,碾制成富硒糯米。以不喷施叶面肥的常规栽培收获的该品种稻米作为对照,制备成普通糯米。在种植前取田间土壤样品3个,按NY/T 1104─2006《土壤中全硒的测定》中的方法检测土壤总硒含量,检测结果为0.35 mg/kg。
1.2 主要仪器
氢化物发生-原子荧光光谱仪、超高效液相色谱仪、高分辨质谱仪、色谱柱。
1.3 试验方法
1.3.1 黄酒的制备 取富硒糯米和普通糯米各50 kg,按照浸米、蒸饭、加酒曲、落罐主发酵、后发酵、压榨等传统步骤酿制甜型黄酒,每个处理重复6次,取样分析黄酒的总硒和有机硒含量,并取样置于-80 ℃冰箱保存,用于代谢组学分析。
1.3.2 大米和黄酒总硒及有机硒含量的测定 采用GB 5009.93─2017《食品安全国家标准:食品中硒的测定》中的氢化物原子荧光光谱法测定糯米和黄酒的总硒含量;采用DB 36/T 1243─2020《稻米中有机硒和无机硒含量的测定:氢化物原子荧光光谱法》测定糯米有机硒含量;参考DBS 42010─2018《食品安全地方标准:富硒食品中无机硒的测定方法》中的固相萃取原子荧光光谱法检测黄酒的无机硒含量;有机硒含量由总硒含量减去无机硒含量得到。使用SPSS 22.0软件对测定数据进行统计分析。
1.3.3 代谢物的提取 称取100 μL样本,加入500 μL含有内标(1000∶2)的提取液(甲醇与乙腈的体积比=1∶1,内标浓度为2 mg/L),涡漩混匀30 s,超声10 min(冰水浴),在-20 ℃下静置1 h;将样本在4 ℃下以12000 r/min离心15 min;然后小心地取出500 μL上清于EP管中,在真空浓缩器中干燥提取物;向干燥后的代谢物加入160 μL提取液(乙腈与水的体积比为1∶1)复溶,涡漩30 s,冰水浴超声10 min;将样本在4 ℃下以12000 r/min离心15 min;小心地取出120 μL上清于2 mL进样瓶,每个样本各取10 μL,混合成QC样本,用于上机检测。
1.3.4 上机检测 用于代谢组学分析的液质联用系统由超高效液相串联高分辨质谱仪组成。
液相条件:色谱柱为1.8 μm×2.1 mm×100 mm;流动相A为超纯水溶液(加0.1%甲酸);流动相B为乙腈溶液(加0.1%甲酸)。洗脱梯度:在开始时B相比例为2%;在0~10.00 min期间,B相比例由2%线性增加到98%;在10.00~13.00 min期间,B相比例维持在98%;在13.00~13.10 min期间,B相比例降为2%;此后B相比例以2%平衡至15 min。柱温40 ℃;进样量1 μL;流速0.40 mL/min。
质谱条件:采用在高分辨质谱仪采集软件控制下的MSe模式进行一级、二级质谱数据采集。在每个数据采集循环中,同时对低碰撞能量及高碰撞能量进行双通道数据采集。低碰撞能量2 V,高碰撞能量区间为10~40 V,扫描频率为每0.2 s 1张质谱图。ESI离子源参数如下:毛细管电压2000 V(正离子模式)或-1500 V(负离子模式);锥孔电压30 V;离子源温度150 ℃;脱溶剂气温度500 ℃;反吹气流速50 L/h;脱溶剂气流速800 L/h。
1.3.5 数据处理 采用ProgenesisQI软件对Mass-LynxV 4.2采集的原始数据进行峰提取、峰对齐等处理;基于ProgenesisQI软件的在线METLIN数据库,以及北京百迈客生物科技有限公司的自建库进行鉴定,同时进行理论碎片识别,质量数偏差均在100 mg/kg以内。采用R软件对鉴定的代谢产物进行主成分分析(PCA)和正交偏最小二乘法判别分析(OPLS-DA)。根据OPLS-DA模型获得的变量重要性投影(VIP)评分,将VIP>1且P<0.05的代谢物定义为差异代谢物,同时将得到的相应差异代谢物通过KEGG代谢通路数据库进行解析。
2 结果与分析
2.1 理化性状分析
用于酿制黄酒的原料富硒糯米和普通糯米的硒含量分别为198.3、35.2 μg/kg,其中富硒糯米的硒含量满足国家标准GB/T 22499─2008《富硒稻谷》中40~300 μg/kg的要求。富硒黄酒和普通黄酒酒液中的硒含量分别为41.1、9.4 μg/L,前者是后者的4.37倍,用富硒糯米酿制的黄酒的富硒效果明显;富硒黄酒和普通黄酒的硒转化率[硒转化率(%)=黄酒总硒含量/大米总硒含量×100%]分别为20.73%、26.70%(表1),说明利用富硒糯米酿制富硒黄酒是可行的。
本试验制备的2种糯米的有机硒比例[有机硒比例(%)=有机硒含量/总硒含量×100%]都达到了83%以上,酿制的2种黄酒的有机硒比例均达到了85%以上(表1)。说明富硒糯米和富硒黄酒中的硒都以有机硒为主,在糯米发酵过程中,有机硒得到了良好的保留,并充分释放到了黄酒酒液中,因此富硒黄酒具有较高的补硒价值。

表1 富硒黄酒和普通黄酒的理化性状
2.2 多元统计分析
对样品进行主成分分析(PCA),结果显示:第一主成分(PC1)的贡献率为74.97%,第二主成分(PC2)的贡献率为13.05%,两组样本表现出明显的分离趋势;主成分的累计贡献率达88.02%(图1),因此,PCA的结果能够从总体上反映富硒黄酒和普通黄酒之间的代谢物差异,说明所建立的PCA模型是稳定的,可用于后续代谢产物差异的分析。

图1 富硒黄酒(T)和普通黄酒(CK)代谢物的主成分分析结果
为了更准确地显示富硒黄酒与普通黄酒之间的代谢物差异,使用有监督的正交最小偏二乘判别分析(OPLS-DA)模型进行进一步分析。结果表明:普通黄酒组样品主要分布在PC1的负半轴,富硒黄酒组样品主要分布在PC1的正半轴,说明该模型能够有效区分这两种处理的黄酒样品;该模型的评价参数R2Y=0.998,Q2Y=0.965,均接近于1(图2),表明该模型稳定可靠。对OPLS-DA模型进行置换检验,发现右侧初始OPLS-DA模型的Q2远大于左侧随机模型的Q2(图3),说明OPLS-DA模型不存在过拟合现象,具有良好的可靠性,可根据变量投影重要度(VIP)分析筛选差异代谢物。

图2 富硒黄酒(T)和普通黄酒(CK)代谢物的OPLS-DA分析结果

图3 OPLS-DA模型的置换检验结果
2.3 差异代谢物的鉴定与分析
利用代谢组学方法在富硒黄酒和普通黄酒中鉴定出1441种代谢物。基于OPLS-DA分析结果,以VIP>1且P<0.05作为差异代谢物的筛选标准,共检测到530种差异代谢物(图4),占所有检测代谢物的36.8%,说明富硒对黄酒代谢物质的生成具有明显的影响。在530种差异代谢成分中,富硒黄酒有402种成分呈上调表达,即相对含量显著高于普通黄酒,占比达75.85%;128种成分呈下调表达,即相对含量显著低于普通黄酒,占比为24.15%。上述结果说明,富硒黄酒中上调表达代谢物的数量远多于下调表达代谢物的数量(图5)。

图4 富硒黄酒(T)和普通黄酒(CK)差异代谢物的热图
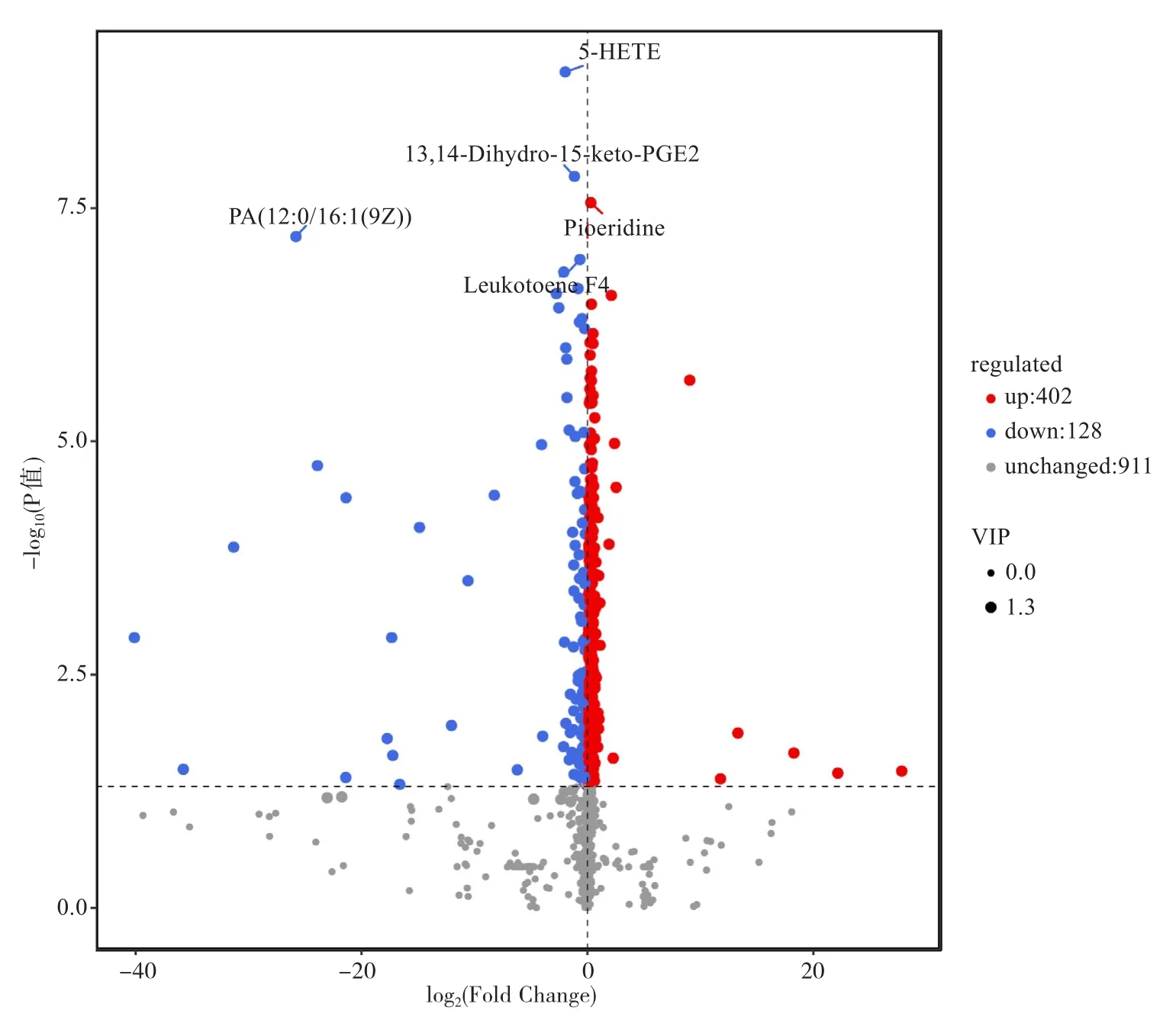
图5 富硒黄酒(T)和普通黄酒(CK)差异代谢物的火山图
根据人类代谢组数据库(HMDB)分类,差异代谢物较多的是羧酸及其衍生物、脂肪酰、有机氧化合物、甘油磷脂,占比分别为13.58%、6.98%、5.09%、3.58%(图6)。在明确分类的差异代谢物中,总体上有61种羧酸及其衍生物、22种脂肪酰、22种有机氧化合物在富硒黄酒中的相对含量更高,有15种脂肪酰、11种甘油磷脂、11种羧酸及其衍生物在普通黄酒中的相对含量更高。
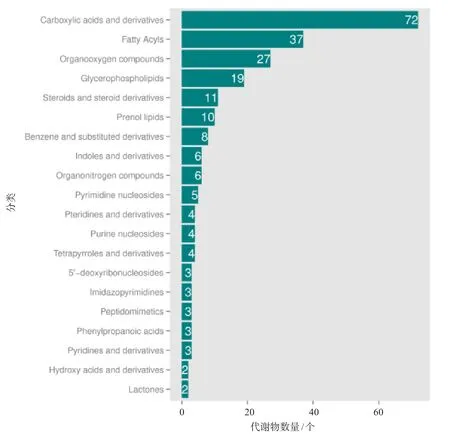
图6 差异代谢物的HMDB分类结果
2.4 主要差异代谢成分分析
将差异倍数(fold change, FC)作为重要的考察指标,以FC>5或FC<0.2,且VIP>1、P<0.05作为标准筛选差异倍数较大的代谢物,得到22种差异代谢物,其中富硒黄酒中有17种显著下调,5种显著上调。下调代谢物类别以甘油磷脂为主,共11种;上调代谢物包含2种有机氧化合物,以及甘油磷脂、蝶啶及其衍生物、脂肪酰各1种。
2.5 KEGG通路富集分析
通过KEGG数据库对差异代谢物进行通路富集分析,在鉴定出来的530种差异显著的代谢物中被KEGG注释到的代谢物数为177个,其中有128个差异代谢物显著上调,49个差异代谢物显著下调,主要分布在84条代谢途径中,其中富集程度居前5位的代谢通路为:花生四烯酸代谢,代谢物包括白三烯类、前列腺素类、磷脂酰胆碱类、血栓素B2、5-羟基二十碳四烯酸盐等14种化合物;异喹啉生物碱生物合成,代谢物包含4-羟基苯乙醛、酪胺、L-酪氨酸、4-羟基肉桂酸等5种化合物;苯丙氨酸代谢,代谢物包含反式肉桂酸、苯丙酮酸、D-苯丙氨酸、2-苯乙醇、N-乙酰-D-苯丙氨酸、L-酪氨酸、苯乙胺、麻黄碱等13种化合物;精氨酸生物合成,代谢物包含L-精氨酸、瓜氨酸、L-谷氨酰胺、N-乙酰鸟氨酸等8种化合物;乙醛酸和二羧酸代谢,代谢物包含柠檬酸、乙醛酸、甘油酸、L-苹果酸等6种化合物(图7)。
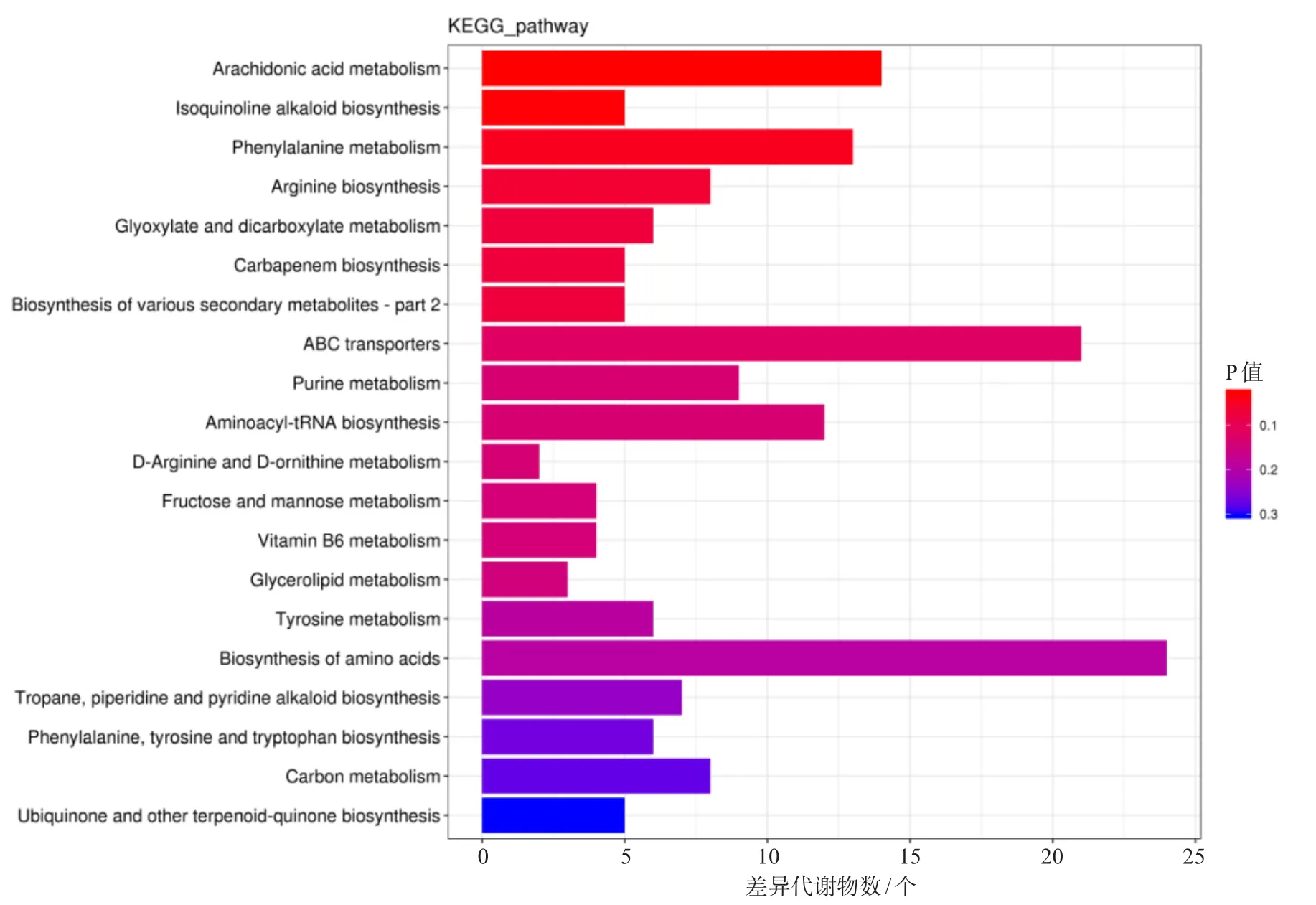
图7 差异代谢物的KEGG富集通路分析结果
3 讨论与结论
富硒大米是我国目前开发的主要富硒农产品类型,但富硒大米的深加工开发力度还远远不足。黄酒是大米的重要深加工方向之一,市场上还很少见富硒黄酒类产品的销售。陆步诗等[4]采用富有机硒酵母烹调黄酒,研制了有机硒含量高达16~17 μg/mL的黄酒;李海洲等[5]利用富硒蛹虫草和富硒大米,研制得到了硒含量为 0.10 mg/L的蛹虫草黄酒;张翼[6]对44个黄酒产品的硒含量进行了检测,结果发现黄酒中硒的含量范围为0.41~16.75 μg/kg。这些研究报道说明黄酒具有作为富硒产品开发的潜力。本研究以符合国家标准GB/T 22499─2008《富硒稻谷》的富硒糯米为硒源,制备了硒含量为41.1 μg/L的富硒黄酒,其硒含量适中。目前,我国还未制定富硒黄酒的国家或行业标准。根据本研究的黄酒酿制过程的硒转化率,结合国家富硒稻米标准硒含量0.04~0.30 mg/kg的规定,建议将富硒黄酒硒含量的标准设定为0.01~0.08 mg/L。
自然界中硒可分为无机硒和有机硒,无机硒包括Se(VI)、Se(IV)、Se(0)和Se(-II)等,大米中有机硒主要以硒代氨基酸的形态存在[7-8]。无机硒具有较大的毒性,不易被人体吸收,生物利用率低;而有机硒具有低毒高效的特点,其吸收利用效果和安全性均远高于无机硒[9]。本研究以富硒糯米为硒源,制备富硒黄酒,富硒黄酒中的硒以有机硒为主,占比达到了85%以上,其有机硒安全易吸收,可以作为人们补硒的良好来源。
代谢组学作为一门新兴的高通量鉴定技术,在小分子代谢成分的定性和定量分析方面具有独特的优势。目前将代谢组学应用于黄酒、葡萄酒等发酵过程的代谢产物的变化研究已有报道[10-12]。已有研究表明,硒对银杏[13]、西兰花[14]、雪樱子[15]、奶牛[16]等动植物代谢产物都具有明显的影响,但硒对酒类(特别是黄酒)发酵过程中代谢成分的影响还未见研究报道。本研究结果表明,富硒黄酒相对于普通黄酒的上调表达代谢产物数远多于下调数,其中羧酸及其衍生物是主要的上调代谢物类型之一,其主要来源于糯米淀粉类组分的发酵分解,这暗示硒促进了根霉等发酵菌剂的代谢分解速率。笔者进一步筛选差异倍数较大的主要差异代谢物,发现下调数量明显多于上调数量,并且以甘油磷脂为主,甘油磷脂主要是糯米磷脂类物质的代谢产物,这表明硒对磷脂类的代谢可能具有一定的抑制作用。KEGG代谢通路分析结果表明,花生四烯酸代谢、异喹啉生物碱生物合成、苯丙氨酸代谢、精氨酸生物合成、乙醛酸和二羧酸代谢等是富集程度居前5位的代谢途径,主要涉及多不饱和脂肪酸、氨基酸(以苯丙氨酸、络氨酸、精氨酸为前体)、小分子有机酸等的代谢合成,这些成分主要涉及到黄酒风味物质的形成。综合代谢组学的分析研究结果,富硒对黄酒发酵过程的代谢产物具有明显的调控作用,进而可能影响富硒黄酒产品的功能成分和营养品质。
