花木蓝种子生物学特性及不同处理对其种子萌发的影响
2022-06-27杨子墨
李 琪, 杨子墨, 孙 阎
(黑龙江大学现代农业与生态环境学院, 哈尔滨 150080)
道路绿化是城市景观的重要组成部分,筛选抗逆性强、姿态优美的绿化植物是城市建设的关键任务之一。东北地区气候相对寒冷,道路绿化的灌木品种较为单一,目前应用较多的是紫穗槐、胡枝子和沙棘等[1],这些植物的抗逆性较强,也易于养护,但观赏性相对较差,景观效益亟需提升。为增加道路绿化的景观多样性,需适当加强野生观赏灌木的引种驯化。然而,每种植物都有其自身的生长规律和生存环境,引种时首先要了解被引种植物的生物学特性[2],而种子萌发和幼苗的正常生长是植物适应新栖息地的前提条件[3],因此研究物种的种子生物学特性尤为重要。
木蓝属(IndigoferaL.)植物具有绿化优越性,该属的多花木蓝(IndigoferaamblyanthaCraib)是最常用的绿化灌木[4],但其难以在东北地区引进种植。而同属的花木蓝(I.kirilowiiMaxim. ex Palibin)自然分布于我国吉林、辽宁及河北等北方地区[5],具有较强的耐寒、抗旱、耐阴、耐瘠薄及抗二氧化硫等能力,野生资源也很丰富。花木蓝观赏性较强,特别是其花期长,花色艳丽,是北方稀有的夏花植物,可作为铁路、公路旁绿化树及花坛、花镜材料[6]。此外,花木蓝也具有广泛的经济价值,其根可作中药山豆根的代用品,是中国民间清热解毒、消肿止痛良药[7];而其茎皮纤维已成为造纸、纤维板及人造棉等行业不可或缺的原料来源[8]。
随着花木蓝的多重价值逐渐被发掘,其引种驯化工作[9-10]逐步开展,而种子繁殖是其最主要的繁殖方式。已有学者对花木蓝种子发芽特性进行相关研究,主要是种子萌发的处理方法,如不同温水浸种、浓H2SO4浸种以及机械破损种皮[11]等,进一步阐明花木蓝种子经50 ℃恒温水处理后的发芽率最高,并围绕种子硬实性进行了讨论,缺乏种子对环境变化的响应特征和萌发特性的相关研究。然而,受到种子自身理化性质和外部环境影响,同种植物的种子和幼苗生长状态在不同环境中会表现出一定差异性[12]。因此,本实验对花木蓝种子性状进行初步观察,并通过不同贮藏条件、光照、温度、盐胁迫、干旱胁迫以及酸碱胁迫等6个因素,研究不同处理下花木蓝种子萌发特性和3种环境胁迫中的幼苗生长状态,以期为这一种质资源的播种育苗和引种驯化提供理论支持。
1 材料与方法
1.1 试验材料
种子材料分别采自哈尔滨师范大学生命科学与技术学院试验园(HSD)、黑龙江大学现代农业与生态环境学院试验田(HD)和黑龙江省森林植物园(ZWY)共3个地点,经哈尔滨师范大学王臣教授鉴定为豆科植物花木蓝。
1.2 种子性状观察
随机挑选饱满的花木蓝种子,在解剖镜下观察其种子形状、颜色及表面纹理等特征,并用精度为0.01 mm的测量尺测量3个采集地点的花木蓝种子长度和宽度,每组测量100粒,每个采集地点重复3次,计算平均值及标准差。
采用百粒重法测定种子千粒重,每个采集地点随机选取100粒饱满种子用精度为万分之一的AL 204电子分析天平称重,重复8次,取平均重量乘以10,即为种子千粒重。
1.3 试验方法
将种子用75%酒精消毒10 min,蒸馏水冲洗5~6次,暂置于阴凉干燥处备用。采用培养皿纸上发芽方式进行发芽试验,每个培养皿(直径为90 mm)随机且间隔基本相同地放置30粒饱满种子,每个处理3次重复。各处理的培养皿均加入适量对应溶液并每天及时补加,胚根突出种皮的长度为种子长度的一半视为萌发,连续5 d无萌发种子视作发芽结束,每天定时观察并记录种子萌发情况。
1.3.1不同贮藏条件处理
分别于2020年、2018年、2015年和2013年的10月采收花木蓝成熟种子,将种子装入信封后放置在阴凉干燥的房间内贮藏(2020年、2018年、2015年)和-20 ℃冰箱冷藏(2013年)。于2020年10月取出当年采收(0年)和贮藏2年、5年的花木蓝种子,2021年10月取出冷冻贮藏8年的种子,消毒处理后,置于培养温度(25±1)℃,光照强度2 000 lx,光照周期12 h/d的LRH-400-G光照培养箱中进行纸上发芽试验。
1.3.2不同温度和光照处理
将当年采收的种子充分混合,随机挑选相对饱满的种子作为试验材料。设定10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃共6个温度梯度,光照时间为12 h/d,光照强度2 000 lx。同时设定2种光照处理:12 h光照/12 h黑暗和24 h黑暗,并置于(25±1)℃、光照强度2 000 lx的光照培养箱中进行萌发,培养过程中保持滤纸湿润。
1.3.3不同胁迫处理
PEG胁迫试验设定5%、10%、15%、20%、25%共5个浓度梯度,每天定时观察。NaCl胁迫试验设定25、50、100、150、200 mmol/L共5个梯度,培养过程中保持滤纸湿润;酸碱胁迫设定9个处理,pH值分别为2、3、4、5、6、7、8、9、10,用0.5 mol/L的HCl和0.5 mol/L的NaOH溶液对蒸馏水进行滴定。
除贮藏实验外,其余供试种子均为当年新种子,不同胁迫处理设置1组空白对照(ck),并置于25 ℃、光周期12 h/d、光照强度2 000 lx光照培养箱中进行培养,每2 d更换一次滤纸,其余条件一致。在种子萌发结束后1 d,分别随机选取30株在不同处理中生长的花木蓝幼苗,测量其胚根及下胚轴的长度(不足30株则全部测量),计算平均值和标准差;称量30株幼苗的地上部分和地下部分干重,计算根冠比。
1.4 数据统计分析
根据每天的记录统计花木蓝种子发芽率、发芽势、发芽指数以及幼苗下胚轴长度、胚根长度、根冠比,对种子和幼苗活力进行评价。利用Microsoft Excel 2010软件进行数据整理,SPSS 25.0统计软件对数据进行多因素方差分析和显著性分析,Origin 2021作图软件对已分析数据进行图像化处理。
发芽率(%)=(种子萌发总数/供试种子数)×100%;
发芽势(%)=(在发芽高峰期发芽种子数/供试种子数)×100%;
发芽指数=∑Gt/Dt,Gt为处理后t日的发芽种子数;Dt为相应发芽日数;
根冠比=地下部分干重/地上部分干重。
2 结果与分析
2.1 花木蓝种子形态特征
花木蓝果实为荚果,内含种子多粒,最多可达10余粒,种子近圆柱形或长圆形(图1 A)。其成熟种子胚发育程度较高,可见子叶、下胚轴和胚根的分化(图1 B)。种子为无胚乳种子类型,营养物质贮存在两片肥厚的子叶中(图1 C)。花木蓝种子的种皮较薄,分为内外种皮,外种皮光滑,呈黄褐色或红褐色,附棕褐色纹路(图1 C)。种脐略向内凹陷,呈长椭圆形,棕褐色,位于种子一端(图1 A)。

注:A为种子外观; B为种子纵切; C为种子横切。图1 花木蓝种子形态结构Fig.1 Seed morphological structure of I. kirilowii
受光照和土壤肥力影响,3个采集地点的花木蓝果实和种子形态存在一定的差异。在HSD采收的花木蓝果实品质性状相对优良,其果实长度和宽度分别为51.39 mm和5.62 mm,产出的种子较为饱满(表1)。而于ZWY采收的果实和种子性状相对较差,其种子长度为3.64 mm,宽度为2.52 mm,千粒重仅23.78 g(表1)。可见,花木蓝果实和种子的品质优劣与其所处自然环境的光照条件和土壤肥力有关。
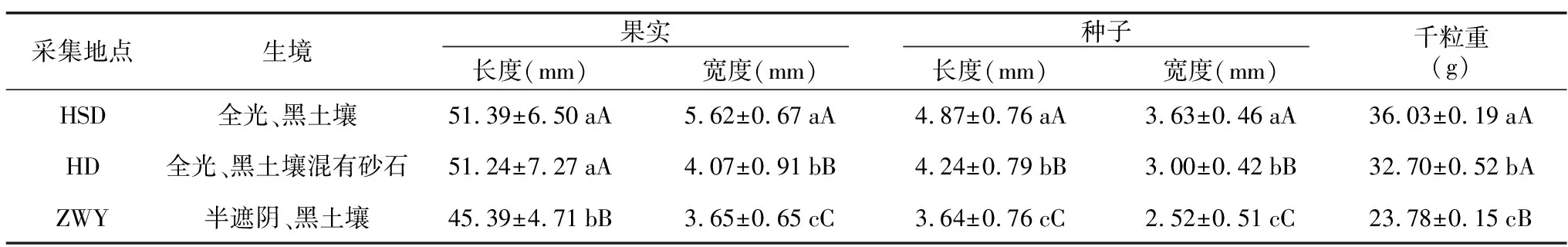
表1 不同采集地点花木蓝果实和种子的长度与宽度Table 1 Length and width of I. kirilowii fruits and seeds at different collection sites
2.2 不同贮藏条件对花木蓝种子萌发的影响
-20 ℃冷冻贮藏8年的花木蓝种子与当年采收的种子萌发启动时间相同(4 d),其次为贮藏2年的种子(5 d);贮藏5年的种子最晚萌发(8 d)(表2)。常温贮藏2 年和冷冻贮藏8年的种子发芽率与当年采收的种子差异不显著,但贮藏2年的种子发芽势和发芽指数显著降低(表2)。种子常温贮藏5年后,其各项发芽指标显著下降(表2)。可见,冷冻贮藏可以显著延长种子寿命,常温贮藏5年的花木蓝种子已基本失去利用价值。
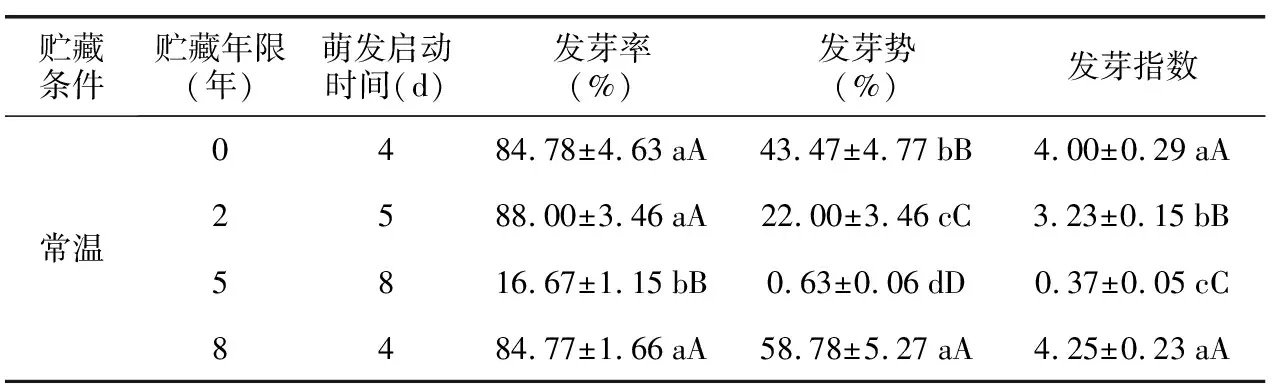
表2 不同贮藏条件对花木蓝种子萌发的影响Table 2 Effects of different storage years and storage conditions on seed germination of I. kirilowii
2.3 不同温度对花木蓝种子萌发的影响
花木蓝种子的萌发启动时间随温度升高而缩短,30 ℃和35 ℃下种子萌发启动时间(3 d)最短,10 ℃下推迟至13 d(表3)。花木蓝种子在10~35 ℃温度范围内均可萌发,其各项发芽指标呈先升后降的趋势,25 ℃下各指标达到峰值,发芽率、发芽势及发芽指数分别为84%、41.33%和3.84,与其他温度相比差异显著;此后随着温度升高或降低,种子各项指标显著降低(表3)。可见,花木蓝种子具有较宽的萌发温幅,其最适萌发温度为25 ℃。
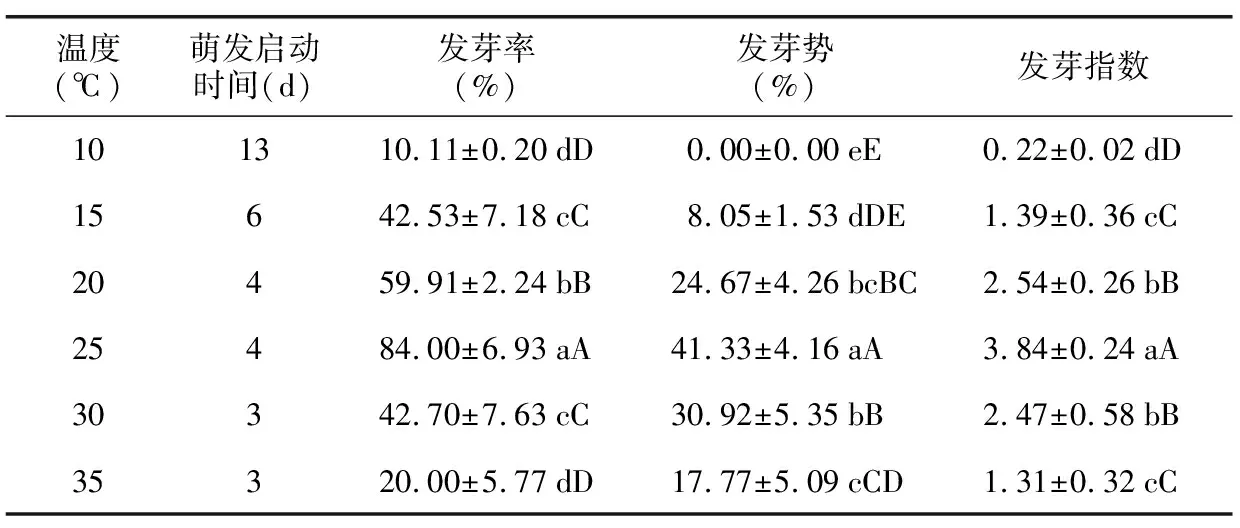
表3 不同温度处理对花木蓝种子萌发的影响Table 3 Effects of different temperature treatments on seed germination of I. kirilowii
2.4 不同光照对花木蓝种子萌发的影响
充足的光照能够使花木蓝种子的萌发启动时间提前,光照条件下其种子于第4天开始萌发,第5天达到发芽高峰期;黑暗条件下其首次萌发时间为5 d,较光照处理延迟1 d(表4)。光照条件的改变对种子发芽率影响不显著,却能够显著影响发芽势与发芽指数(表4),说明光照处理能够加快种子发芽速度,提高种子活力。
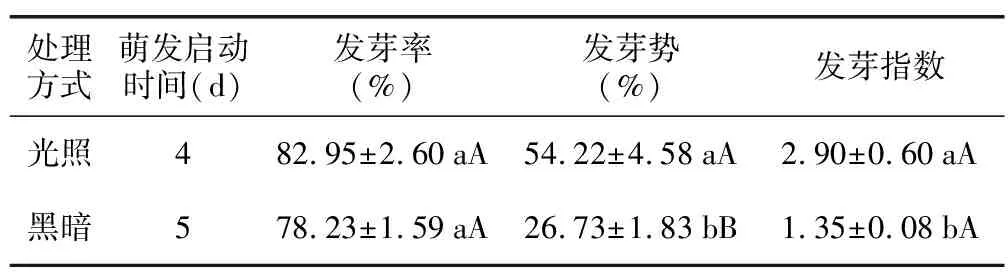
表4 不同光照处理对花木蓝种子萌发的影响Table 4 Effects of different light treatments on seed germination of I. kirilowii
2.5 不同浓度PEG对花木蓝种子萌发的影响
5%和10%的PEG胁迫对花木蓝种子活力的影响较小,其种子各项指标与ck相比差异不显著,萌发启动时间均为4 d(表5)。15%的PEG浓度下其种子发芽率、发芽势及发芽指数显著降低,分别为39.79%、8.45%、1.48;PEG浓度达到20%时,种子不能萌发(表5)。可见,花木蓝种子具有一定的耐旱能力,但高浓度干旱胁迫下种子难以萌发。
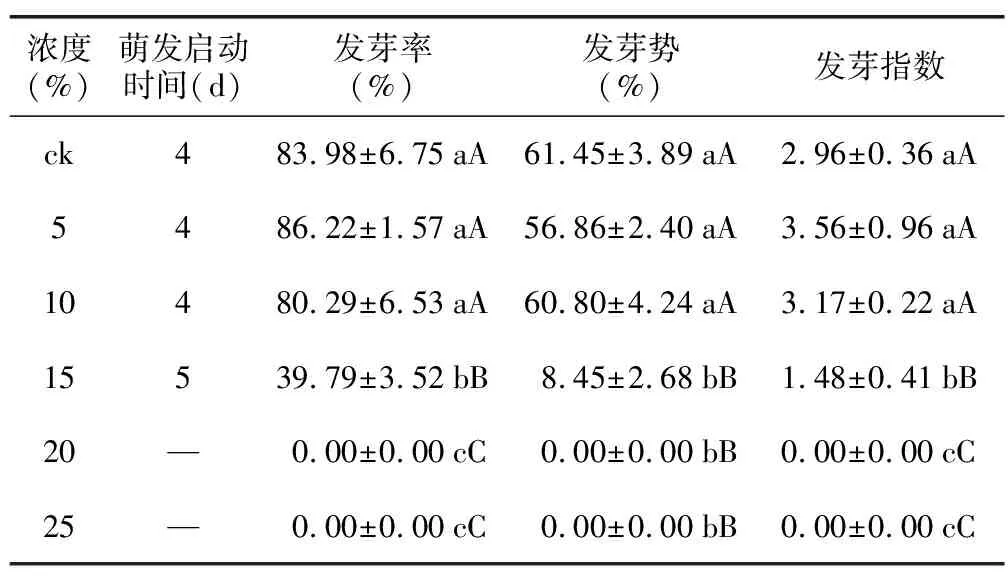
表5 不同浓度PEG对花木蓝种子萌发的影响Table 5 Effects of different concentrations of PEG on seed germination of I. kirilowii
5%和10%的PEG浓度下幼苗各项指标较ck略有提高,说明低浓度干旱胁迫对其幼苗生长具有一定促进作用;15%浓度中其幼苗生长受到显著抑制,下胚轴长度、胚根长度及根冠比仅为22.78 mm、29.09 mm及0.99(图2)。可见,低浓度干旱胁迫下其幼苗可以维持良好的生长状态,高浓度干旱环境中生长欠佳,不宜置于高浓度干旱环境中进行培养。
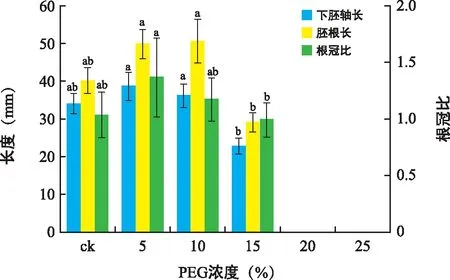
图2 不同浓度PEG对花木蓝幼苗下胚轴长度、胚根长度及根冠比的影响Fig.2 Hypocotyl length,radicle length and root shoot ratio of I. kirilowii seeds under different PEG concentrations
2.6 不同浓度NaCl对花木蓝种子萌发的影响
随NaCl溶液浓度增加,花木蓝种子各项指标逐渐降低。25 mmol/L的盐浓度下其种子萌发受到显著抑制;NaCl浓度为50 mmol/L时,萌发启动时间(5 d)延长,种子活力显著降低;但200 mmol/L胁迫处理的种子仍可萌发,其发芽率、发芽势、发芽指数分别为19.11%、4.67%及0.55(表6)。可见,花木蓝种子具有较广的耐盐范围。
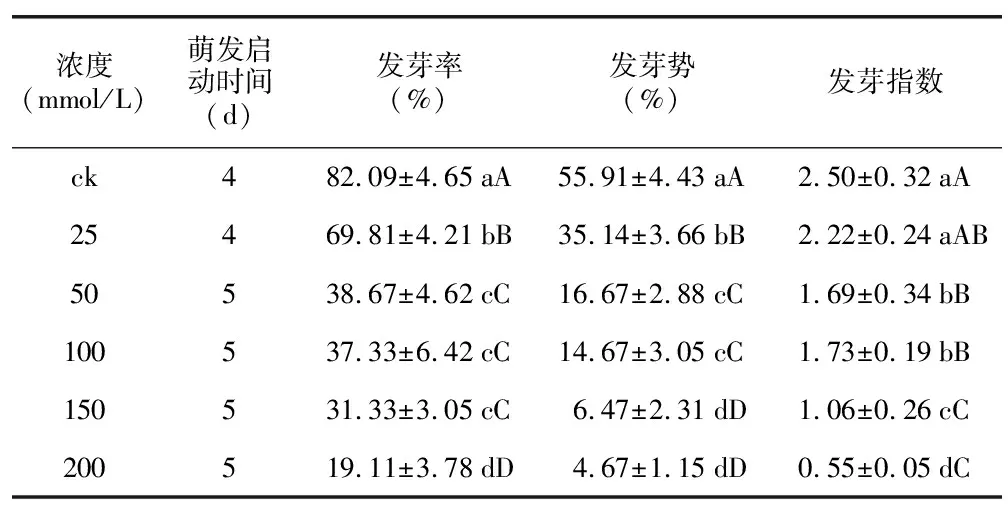
表6 不同浓度NaCl对花木蓝种子萌发的影响Table 6 Effects of different concentrations of NaCl on seed germination of I. kirilowii
ck组的花木蓝幼苗下胚轴(34.06 mm)显著长于其他处理,25 mmol/L时其幼苗下胚轴缩短至24.22 mm,根冠比差异不显著,而胚根则较ck有所增长,说明低盐胁迫对其干物质积累并未产生显著影响,但能够显著抑制其下胚轴增长,对胚根生长则表现为一定的促进作用(图3)。高盐胁迫下,其幼苗生长状态较差,子叶的长出时间大幅推迟(图3)。可见,花木蓝幼苗对低盐胁迫具有一定适应能力,同时该条件下其幼苗具有相对发达的根系。
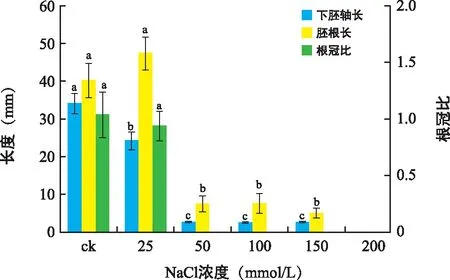
图3 不同浓度NaCl对花木蓝幼苗下胚轴长度、胚根长度及根冠比的影响Fig.3 Hypocotyl length,radicle length and root shoot ratio of I. kirilowii seeds under different NaCl concentrations
2.7 不同pH值对花木蓝种子萌发的影响
酸性环境可使花木蓝种子萌发启动时间提前,pH值为2~4时(3 d)较其他处理提前1 d(表7)。其种子在pH值为2~10范围内均可萌发,多数情况下各个指标差异不显著,说明花木蓝种子的酸碱适应范围较广(表7)。pH值处于4~7之间时其发芽率和发芽势相对较高;而pH值为2与pH值大于7时,其种子发芽率与发芽势显著降低(表7)。可见,花木蓝种子在中性偏酸的土壤环境中更易于萌发。
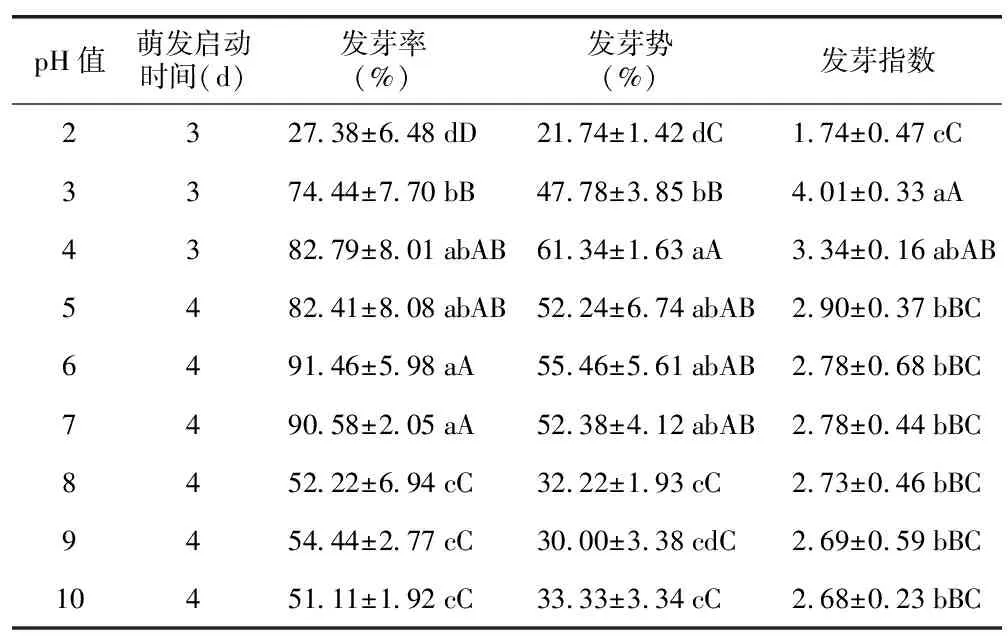
表7 不同pH值对花木蓝种子萌发的影响Table 7 Effects of different pH on seed germination of I. kirilowii
pH值为2时,花木蓝幼苗难以适应该酸性环境而大量霉烂死亡;pH值大于4后,不同酸碱处理中的幼苗均保持良好生长状态。pH值在4~7之间时其胚根较长,且胚根干物质积累能力较为优越;而碱性环境(pH值大于7)中其下胚轴显著缩短,但胚根长度差异不显著,说明其胚根对碱性环境的耐受性强于下胚轴(图4)。可见,花木蓝幼苗具有较广的酸碱适应范围。

图4 不同pH值对花木蓝幼苗下胚轴长度、胚根长度及根冠比的影响Fig.4 Hypocotyl length,radicle length and root shoot ratio of I. kirilowii seeds under different pH treatments
3 讨论与结论
幼苗成活率通常与种子大小有关,花木蓝种子相对较大,其长度和宽度分别为4 mm和3 mm左右,较大的种子贮存有充足的能量,发育而成的幼苗对光照、养分资源和胁迫耐受性的竞争能力更高[16]。光照和土壤肥力直接影响植物果实发育[13],哈尔滨师范大学生命科学与技术学院试验园光照十分充足且土壤肥沃,该处采收的花木蓝果实和种子与土壤肥力匮乏的黑龙江大学现代农业与生态环境学院试验田和光照不足的黑龙江省森林植物园相比较为饱满,而黑龙江省森林植物园生长状态最差,可能光照对其果实和种子的影响大于土壤肥力。赵堂君等[11]研究指出,花木蓝种子长度和宽度与本研究结果接近,但其千粒重仅为15.744 g,这也可能是由于光照或土壤肥力不同导致种子性状上的差异,具有相似变异特性的还有马棘(I.pseudotinctoria)[14]。因此,为保证引种栽培后花木蓝的果实(种子)品质,其栽培地应具备充足的光照及较为肥沃的土壤条件。
豆科植物的种子大多具有硬实性,这是由于种皮透水性差而形成的一种物理休眠[15]。赵堂君等[11]的研究中,花木蓝种子硬实率为56%,室温浸种的种子发芽率仅40%,而本研究中其种子自然萌发率至少高达82%,说明硬实率较低。种子发芽率可能与种子重量有关[16],恶劣的环境会使种子千粒重减少,增加种子硬实,间接造成发芽率的降低,不同居群的次序木蓝(I.sylvestrii)种子硬实率亦不同[4],也进一步说明了这一点。此外,冷冻贮藏显著延长了花木蓝种子寿命,这与低温抑制种子新陈代谢有关[17];而常温贮藏2年的种子发芽率与当年采收的种子相比提升了4%左右,这是因为适当贮藏能够解除部分硬实种子的物理休眠[18];室温贮藏5年的种子萌发率仅为14%,基本失去种用价值,室温贮藏3年和贮藏4年的种子的萌发率还需要后续试验进一步来验证。
温度和光照是种子萌发的关键因素,也是酶促反映正常进行的重要条件[19]。花木蓝种子最佳发芽温度为25 ℃,萌发启动时间为4 d,且有无光照都可以正常萌发,属于中温型[20]光不敏感[21]种子,与赵堂君等[11]研究结果一致。光照虽然未显著改变花木蓝种子发芽率,但其种子活力和发芽速度显著提高,可能是光照条件下种子呼吸作用增强,细胞代谢速度加快所致,与温度升高所产生的现象类似,这也可能是30 ℃和35 ℃下种子提前萌发的原因,然而高温也会使蛋白质变性[22],导致种子大量霉烂死亡。本试验中,花木蓝种子在10 ℃下仍可萌发,且幼苗长势良好,说明其种子和幼苗均具备一定的抗寒能力。
在目前全球气候变化和人为干扰加剧的背景下,干旱、盐胁迫和酸碱胁迫成为影响植物种子萌发和幼苗生长的主要因素[23]。5%和10%的干旱胁迫能够恢复花木蓝种子理化性质,促进幼苗下胚轴和胚根伸长,生物量优先向根系分配,说明花木蓝幼苗能够很好地适应干旱逆境,并做出相应的响应。盐胁迫与干旱胁迫相似,主要影响细胞内离子和水分平衡[24]。试验表明,花木蓝种子对盐分胁迫的耐受范围较广,与同属的多花木蓝耐盐特性相似[25]。轻度盐胁迫可促使花木蓝幼苗胚根增长,形成发达的根系,从而提高幼苗稳固性。碱胁迫通常伴随盐胁迫出现,但碱胁迫对植物的危害更甚[26]。本研究表明,碱胁迫虽可抑制花木蓝种子萌发,但由该环境中的种子发育而成的幼苗根系较为发达,说明其幼苗也有一定的耐碱能力。与碱胁迫不同的是,弱酸胁迫通常以酸沉降(pH值小于5.6)的形式体现,其可能对种子内部蛋白质和淀粉水解具有积极作用[27],从而缩短花木蓝种子萌发启动时间;并且其幼苗在中性偏酸环境中根系干物质积累效率最高,幼苗稳固性亦可得到增强。可见,花木蓝种子和幼苗的环境适生范围较宽,证明其具有作为干旱、盐碱地区绿化树种的发展潜力。同时,在对花木蓝进行引种驯化时,可以利用低旱、低盐及弱酸处理增加其幼苗根系稳固力,提高幼苗定植成活率。
