沉默FOXC2基因对乳腺癌耐阿霉素MCF-7/ADR细胞耐药性的逆转作用及机制
2022-06-26邓军吉王先明易石坚屈洪波
董 云,邓军吉,王先明,易石坚,屈洪波*
(1 潍坊市中医院放疗科,潍坊 261000;2 深圳大学附属华南医院甲乳外科;*通讯作者,E-mail:156786587@qq.com)
目前,乳腺癌已经超过肺癌成为女性发病率第一位的恶性肿瘤。尽管通过手术、放化疗、内分泌及靶向治疗等综合手段使得90%以上早期乳腺癌获得长期生存,但仍有一部分晚期乳腺癌在多线化疗后获得耐药性,严重威胁患者生命。如何逆转乳腺癌多药耐药性(multidrug resistance,MDR)成为当前研究热点。研究表明,肿瘤细胞在经历上皮间质转化(epithelial-mesenchymal transition,EMT)后可获得耐药性,表现对放化疗抵抗,而EMT化的乳腺癌MDR细胞侵袭潜能明显增强[1,2]。叉头框蛋白C2(forkheadbox C2,FOXC2)是叉头框基因家族的重要成员之一,其在转录水平参与对肿瘤EMT调控,与多条信号通路存在交叉对话[3,4]。本课题组前期研究证实了沉默FOXC2对TGF-β1诱导MCF-7细胞EMT具有逆转作用[5];同时下调FOXC2表达可增强乳腺癌MDA-MB-231细胞对多西紫杉醇化疗敏感性[6]。本研究拟探讨沉默FOXC2基因是否能增强乳腺癌MCF-7/ADR细胞对吡喃阿霉素(THP-ADM)化疗的敏感性,为逆转乳腺癌耐药寻找新的治疗靶点。
1 材料与方法
1.1 材料与试剂
人乳腺癌耐阿霉素MCF-7/ADR细胞(中科院上海细胞库),质粒载体pSilencer3.1-H1(美国Ambion公司),大量质粒DNA提取试剂盒(德国Qiagen公司),Lipofectamine2000(美国Invitrogen公司),总RNA提取试剂盒、逆转录试剂盒(大连宝生物公司),DNA Marker(上海碧云天生物研究所);引物设计及合成(上海生工公司);单克隆兔抗人FOXC2、鼠抗人BCRP、E-cadherin及Vimentin,鼠抗人β-actin、HRP标记羊抗鼠二抗及鼠抗兔二抗(武汉三鹰公司);Annexin Ⅴ-FITC/PI凋亡试剂盒(南京凯基公司),胎牛血清及RPMI 1640培养基(美国Gibco公司);吡喃阿霉素(THP-ADM)(深圳万乐公司)。
1.2 方法
1.2.1 重组FOXC2-siRNA表达质粒的构建及鉴定 设计及合成FOXC2基因siRNA寡核苷酸序列,构建干扰序列表达质粒,转染至293T细胞。根据FOXC2抑制率,确定最终有效靶序列为5′-CTACCTGAGCGAGCAGAAT-3′,由上海吉凯基因公司合成。寡核苷酸经退火形成双链DNA,经T4连接酶与BamHⅠ和HindⅢ双酶切后的pSilencer3.1-H1线性化载体连接,形成siRNA质粒载体,经酶切鉴定。转化至DH5a大肠杆菌,挑取重组阳性克隆行PCR鉴定。
1.2.2 人乳腺癌耐阿霉素MCF-7/ADR细胞培养及转染 为了获得稳定转染的耐阿霉素MCF-7/ADR细胞,实验分为未转染组、control-shRNA组和FOXC2-shRNA组。取对数生长期MCF-7/ADR细胞消化后重悬,以2×105个/孔密度接种于6孔板,待其生长至底板60%~80%时,每组设置3个复孔。按照Lipofectamine2000转染试剂说明进行转染实验,质粒-脂质体复合物转染至细胞中,4 h后换成完全培养基继续培养,转染48 h后收集细胞,提取RNA和蛋白,检测FOXC2 mRNA和蛋白的表达。
1.2.3 采用逆转录-聚合酶链反应(RT-PCR)和Western blot检测FOXC2 mRNA和蛋白表达 实验分为未转染组、control-shRNA组及FOXC2-shRNA组。收集转染后的耐阿霉素MCF-7/ADR细胞,采用Trizol抽提总RNA,逆转录反应得到cDNA。以β-actin为内参,引物设计:β-actin F:5′-AGCGAGCATCCCCCAAAGTT-3′,R:5′-GGGCACGAAGGCTCATCATT-3′,FOXC2 F:5′-CTCAACGAGTGCTTCGTCAA-3′,R:5′-GCTCCTCCTTCTCCTTGGAC-3′。反应条件:95 ℃预变性15 s,95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸1 min,共循环35次,重复3次,取平均值。收集细胞,加入RIPA裂解液及PMSF,冰上静置30 min;12 000 r/min离心10 min,BCA法测定蛋白浓度。取等量蛋白进行电泳和电转,5%脱脂牛奶TBST室温封闭2 h,加一抗4 ℃孵育过夜。HRP标记的抗兔或鼠二抗37 ℃孵育1.5 h,TBST洗膜后用ECL发光试剂盒显色、曝光、显影及定影。实验重复3次,取平均值。
1.2.4 MTT检测耐阿霉素MCF-7/ADR细胞增殖抑制率 实验分为未转染组、空脂质体组、control-shRNA组及FOXC2-shRNA组。将细胞以5×103/孔密度接种于96孔板继续培养,16 h后FOXC2-shRNA组加入FOXC2-shRNA和Lipofectamine2000,未转染组以等体积PBS代替,6 h后换成200 μl完全培养基。FOXC2-shRNA组再加入吡喃阿霉素(pirarubicin,THP-ADM)建立浓度梯度(浓度分别为0.2,0.4,0.8,1.6,3.2,5.0,10.0 μg/ml),以不加细胞孔作为调零孔。在培养24,48,72 h后,加入20 μl MTT培养4 h后弃上清,加入150 μl DMSO,酶标仪570 nm测OD值,计算5个复孔平均值。细胞增殖抑制率(%)=(对照孔OD值-实验孔OD值)/对照孔OD值×100%。
1.2.5 流式细胞术检测耐阿霉素MCF-7/ADR细胞凋亡率及细胞周期 实验分为未转染组、空脂质体组、control-shRNA组及FOXC2-shRNA组。细胞培养16 h后加入THP-ADM至后三组中,使其终浓度为1 μg/ml,72 h后收集细胞,1 000 r/min离心3 min,重悬于200 μl结合缓冲液中,加入10 μl Annexin Ⅴ-FITC及5 μl PI,室温避光孵育15 min,1 h内上机检测。细胞周期检测在细胞收集后,用70%预冷乙醇固定4 h以上,1 000 r/min离心5 min,弃固定液,加入10 mg/L RNaseA,室温孵育1 h,加入400 μl PI染色液(50 mg/L),室温避光孵育15 min上机检测,每个样本至少采集1万个细胞,每组实验重复3次。
1.2.6 Western blot检测耐阿霉素MCF-7/ADR细胞FOXC2、BCRP及EMT相关标志物蛋白表达 将耐阿霉素MCF-7/ADR细胞分为未转染组、control-shRNA组及FOXC2-shRNA组。收集转染72 h后细胞,加入RIPA裂解液及蛋白酶抑制剂PMSF,冰上静置30 min。4 ℃,12 000 r/min离心10 min,将上清移至一新的EP管中,BCA法测定蛋白浓度,沸水煮5 min,采用8%SDS-PAGE电泳,先用40 V电泳30 min左右至溴酚蓝跑至底部。电泳完毕后转膜,做好“三明治”夹板,250 mA恒流转膜1.5 h,20 ml封闭液37 ℃孵育2 h,弃去封闭液,加入单克隆兔抗人FOXC2、鼠抗人BCRP、E-cadherin及Vimentin抗体(1 ∶200稀释)或β-actin鼠抗人单抗(1 ∶1 000稀释),4 ℃孵育过夜。次日TBST洗膜3次,加入HRP标记的抗山羊或鼠二抗37 ℃孵育1.5 h,TBS洗膜3次,每次5 min。膜印干后加入ECL化学发光试剂孵育1 min,置于暗盒内曝光拍照。图像分析系统测定条带的光密度值,每组实验重复3次。
1.3 统计学分析
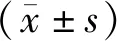
2 结果
2.1 重组质粒载体的构建和鉴定
根据pSilencer3.1-H1载体要求设计3个shRNA与载体连接构建质粒:FOXC2-shRNA1、FOXC2-shRNA2及FOXC2-shRNA3;经BamHⅠ和HindⅢ双酶切应产生54 bp和4.5 kb两个片段(见图1),电泳鉴定结果显示筛选克隆与理论值相符,证实克隆为阳性克隆,筛选的阳性克隆经测序,结果与初始设计序列一致。
1.Marker;2.FOXC2-shRNA1;3.FOXC2-shRNA2;4.FOXC2-shRNA3图1 重组载体pSiRNA-FOXC2质粒双酶切鉴定Figure 1 Identification of recombinant pSiRNA-FOXC2 plasmid by double enzyme digestion
2.2 耐阿霉素MCF-7/ADR细胞FOXC2 mRNA和蛋白表达
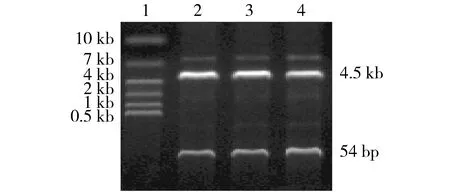
凝胶成像条带结果显示:未转染组、control-shRNA组及FOXC2-shRNA组细胞FOXC2mRNA表达量分别为0.65 ±0.02,0.61 ±0.02及0.28 ±0.01(见图2);以上三组FOXC2蛋白表达量分别为0.98 ±0.04,0.92 ±0.03及0.18 ±0.02(见图2)。与未转染组及control-shRNA组相比,FOXC2-shRNA组FOXC2 mRNA及蛋白表达明显降低(P<0.05)。表明沉默FOXC2基因表达能有效下调FOXC2 mRNA及其蛋白表达。
1.FOXC2-shRNA组;2.control-shRNA组;3.未转染组;4.Marker图2 RT-PCR和Western blot检测MCF-7/ADR细胞FOXC2 mRNA及蛋白表达Figure 2 The mRNA and protein expression of FOXC2 in MCF-7/ADR cells detected by RT-PCR and Western blot
2.3 沉默FOXC2基因抑制耐阿霉素MCF-7/ADR细胞增殖和增加对THP-ADM化疗敏感性
MTT检测结果显示,转染24 h,4组细胞半数抑制浓度未见明显差异(P>0.05);转染48 h及72 h,FOXC2-shRNA组细胞半数抑制浓度明显降低(P<0.05,见表1),表明沉默FOXC2表达能够抑制MCF-7/ADR细胞增殖。经0.5 μg/ml THP-ADM处理FOXC2-shRNA组细胞24,48,72 h,体外细胞生长抑制率结果显示:FOXC2-shRNA组细胞增殖抑制率明显高于未转染组、空脂质体组和control-shRNA组(P<0.05)。
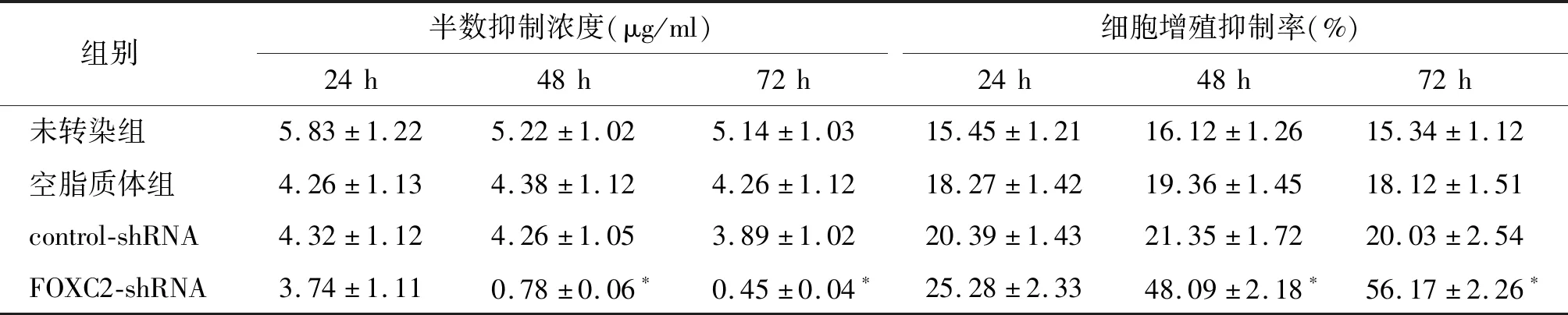
表1 吡喃阿霉素(THP-ADM)作用于各组细胞的半数抑制浓度和增殖抑制率Table 1 IC50 and inhibitory rate of MCF-7/ADR cells after THP-ADM treatment in different groups
2.4 沉默FOXC2基因联合THP-ADM对MCF-7/ADR细胞凋亡的影响
流式细胞术结果显示,FOXC2-shRNA组细胞无论早期凋亡率,还是晚期凋亡率均明显高于未转染组、空脂质体组及control-shRNA组,差异有统计学意义(P<0.05),而空脂质体组与control-shRNA组之间比较,差异无统计学意义(P>0.05,见表2及图3)。

图3 流式细胞术检测各组耐阿霉素MCF-7/ADR细胞凋亡率Figure 3 Apoptosis rate of MCF-7/ADR cells in different groups by flow cytometry

表2 各组MCF-7/ADR细胞凋亡率Table 2 Apoptosis rate of MCF-7/ADR cells in each group
2.5 沉默FOXC2基因联合THP-ADM对MCF-7/ADR细胞周期的影响
流式细胞术结果显示,FOXC2-shRNA组细胞周期G2/M期细胞比例明显高于未转染组、空脂质体组及control-shRNA,差异均有统计学意义(P<0.05)。而S期和G0/G1期细胞比例明显低于未转染组、空脂质体组及control-shRNA组,差异有统计学意义(P<0.05,见图4和表3)。

图4 流式细胞术检测各组耐阿霉素MCF-7/ADR细胞周期分布Figure 4 Cell cycle distribution of MCF-7/ADR cells in different groups detected by flow cytometry

表3 各组MCF-7/ADR细胞周期分布Table 3 Cell cycle distribution of MCF-7/ADR cells in each
2.6 沉默FOXC2基因联合THP-ADM对MCF-7/ADR细胞FOXC2、BCRP及EMT标志物影响
Western blotting结果显示,与未转染组及control-shRNA组比较,FOXC2-shRNA组乳腺癌FOXC2蛋白、乳腺癌耐药蛋白BCRP及间质性标志物Vimentin表达明显下降,上皮性标志物E-cadherin表达明显增强,差异有统计学意义(P<0.05,见图5)。
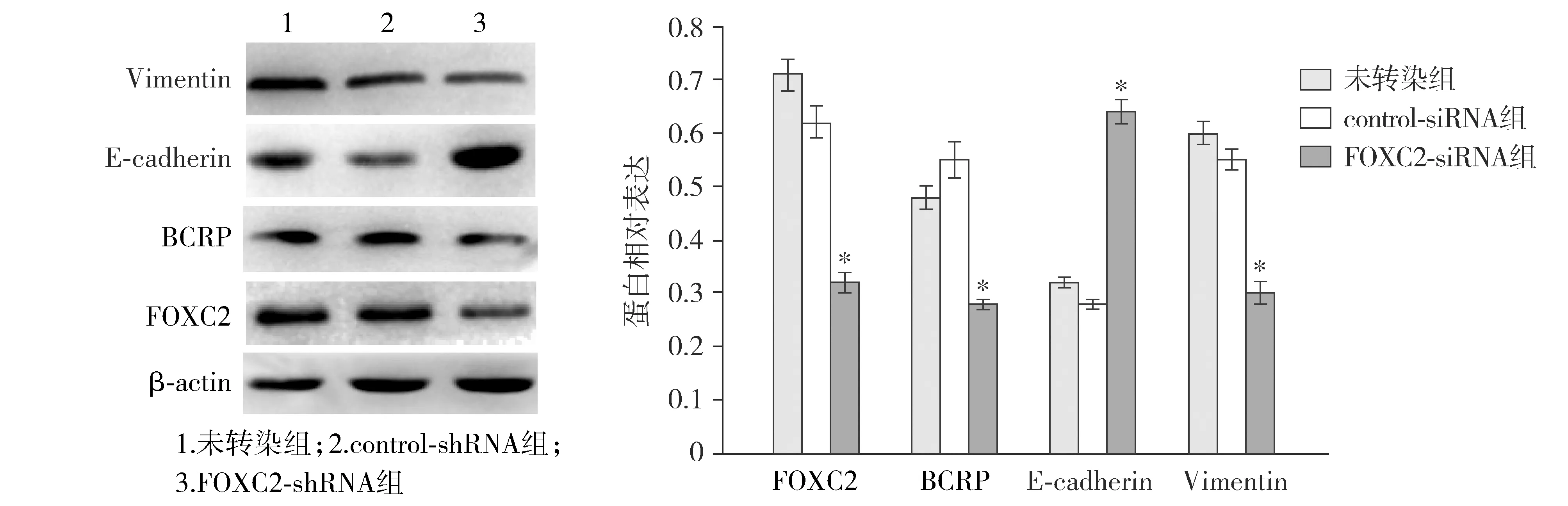
与未转染组及control-shRNA组比较,* P <0.05图5 Western blotting检测MCF-7/ADR细胞FOXC2、BCRP及EMT标志物的表达Figure 5 The expression of FOXC2, BCRP, E-cadherin, Vimentin protein in MCF-7/ADR cells detected by Western bloting
3 讨论
晚期乳腺癌多线化疗后多药耐药是导致临床治疗失败的主要原因。研究表明,化疗一方面促进肿瘤细胞凋亡发生,另一方面诱导肿瘤细胞向恶性表型转换,如上皮间质转化(EMT)和肿瘤干细胞(cancer stem cells,CSCs)生成等。乳腺癌细胞在经历EMT后,能够生成癌干细胞特征,从而赋予其增强的侵袭能力及多药耐药性[7]。Li等[8]发现阿霉素及紫杉醇诱导肿瘤细胞发生凋亡及EMT,而只有发生EMT化的乳腺癌细胞才具有更强的侵袭转移能力和高表达乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)。因此,从EMT途径探讨如何逆转乳腺癌多药耐药具有重要意义。
上皮间质转化(EMT)是上皮细胞失去极性转变成具有迁移能力的间充质表型细胞过程,如E-cadherin蛋白表达缺失,而N-cadherin蛋白及Vimentin蛋白表达的增强。FOXC2作为一种重要的EMT转录调控因子在多种肿瘤中被证实[9]。He等[10]研究发现,FOXC2通过激活AKT/GSK3β/Snail/EMT信号通路促进非小细胞肺癌对顺铂的耐药性。2007年,Mani等[11]证实,FOXC2通过调控EMT参与乳腺癌侵袭转移,是基底型乳腺癌的一种重要分子特征。此外,国内学者Cai等[12]发现,FOXF2通过负调节FOXC2转录从而逆转基底样乳腺癌细胞EMT发生和多药耐药性。本课题组前期研究[13]也证实,FOXC2通过介导Hedgehog/Gli信号通路从而调控EMT促进乳腺癌侵袭及迁移。为了证明下调FOXC2表达能够逆转乳腺癌EMT从而克服其多药耐药性,本研究构建FOXC2基因RNA干扰慢病毒表达载体并稳定转染至MCF-7/ADR细胞为后续试验奠定基础。
为进一步探讨沉默FOXC2对MCF-7/ADR细胞增殖及凋亡的影响,本研究首先采用MTT试验检测MCF-7/ADR细胞半数抑制浓度和细胞增殖抑制率,结果显示下调FOXC2表达能够明显抑制MCF-7/ADR细胞增殖活性,促进凋亡发生。FOXC2调控凋亡的具体机制可能是其作为原癌基因,当表达被抑制后从而减少对肿瘤细胞凋亡的异常调控;本研究中细胞凋亡及细胞周期实验结果均提示,下调FOXC2表达能够增强MCF-7/ADR细胞对THP-ADM敏感性,诱导MCF-7/ADR细胞早期凋亡发生,并使得细胞周期出现G2/M阻滞,S期细胞数量减少,DNA复制减速,最终导致肿瘤细胞有丝分裂和增殖速度减慢。
为进一步探讨FOXC2诱导多药耐药是否与上皮间质转化(EMT)存在相关性,本研究采用Western blot实验,结果显示下调FOXC2蛋白表达能够诱导乳腺癌耐药蛋白(BCRP)及间质性EMT标志物波形蛋白(Vimentin)表达降低,而上皮性EMT标志物E-钙黏蛋白(E-cadherin)蛋白表达明显增强,提示下调FOXC2表达能够使得MCF-7/ADR细胞对阿霉素耐药性发生逆转,而耐药性逆转机制可能与EMT被逆转相关。故可推测通过靶向FOXC2介导的EMT机制能够克服乳腺癌的多药耐药性,FOXC2有望成为乳腺癌新的治疗靶点。
