蓝莓品种布里吉塔的组培无菌体系建立
2022-06-24张孟琪秦公伟曹小勇胡选萍黄大涛席进成
张孟琪,秦公伟, 2, 3, 4*,曹小勇, 2, 3,胡选萍, 2,黄大涛,席进成
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723000;2.秦巴生物资源与生态环境省部共建国家重点实验室(培育),陕西 汉中 723000;3.陕西省资源生物重点实验室,陕西 汉中 723000;4.陕南秦巴山区生物资源综合开发协同创新中心,陕西 汉中 723000)
0 引言
【研究意义】蓝莓学名越橘,属杜鹃花科(Ericaceae)越橘属(Vaccinium)植物[1],果实为小浆果,多为蓝色,俗称蓝莓。蓝莓果肉香甜,具独特风味,富含多种氨基酸、矿物质和维生素,尤其含有大量的花青素和黄酮,具有保护视力、增强人体免疫力等保健作用[2-3]。在水果市场中,蓝莓广受消费者的欢迎,也受到生产者、农业科学家和政府的关注,蓝莓产业发展前景广阔。我国于2000年开始蓝莓产业化生产[4],截至2020年底,全国蓝莓栽培面积6.64万hm2,总产量34.72万t,主要分布在贵州、辽宁、山东、四川、安徽、云南等省,经济效益显著[5],对增加农民收入有重要意义。【前人研究进展】组织培养技术是蓝莓生产育苗的主要方式,现已开展了大量蓝莓组培方面的研究[6-18],但研究深度和系统性有望得到进一步完善,可以通过改进培养技术降低污染率、提升增殖倍数[11],有助于提高苗木生产效益。陕西蓝莓产业起步较晚,从2012年开始规模化种植[6],主要栽培高丛蓝莓和兔眼蓝莓两大类型系列品种[7]。布里吉塔为北高丛蓝莓晚熟品种,果实大、风味佳,一直是澳大利亚和智利的主栽品种;在国内引种栽培后发现,该品种在不同的栽培地区,表现存在差异性。在北方产区多存在花芽分化不良、产量低等问题[8],但在陕西栽种长势好、果实大、丰产稳产,综合表现良好。【研究切入点】布里吉塔作为区域性适生品种,目前未得到国内苗木生产企业的重视,其组培苗一直处于缺乏状态。【拟解决的关键问题】以陕西蓝莓适生品种布里吉塔为试验材料,研究外植体采集时间、不同外植体、玉米素核苷(ZT)浓度、细胞分裂素种类对组培苗无菌体系建立的影响,旨在为陕西蓝莓适生品种苗木生产提供技术支持,同时为蓝莓组培无菌体系建立提供参考。
1 材料与方法
1.1 材料
北高丛蓝莓品种布里吉塔(Brigita Blue)春梢,2021年4月6日至5月24日采自勉县陕西理工大学秦巴蓝莓研究所校企合作共建蓝莓试验示范基地。
1.2 方法
1.2.1 取材 从2021年4月6日开始,隔15 d取材1次,共4个取材时期,分别为4月6日、4月18日、5月5日和5月24日。选择栽种5年以上、生长健壮且无病害植株,采集当年春梢,装入洁净保鲜袋,带回实验室处理。
1.2.2 材料预处理 春梢去除下部木质化过高部分,留取上部幼嫩枝条,长度≤15 cm,剪去叶片(注意保留叶柄),装入干净的广口瓶;1 L带刻度烧杯挤入洗洁精(约1 mL),加入纯净水搅拌均匀。将洗洁精溶液倒入广口瓶振荡清洗材料,再用纯净水冲洗5次,每日早晚再用纯净水各冲洗1次,2 d后接种。
1.2.3 材料接种 超净台通风和紫外灭菌后,依次将材料用75%酒精消毒30 s,0.1%升汞消毒8 min,无菌水冲洗4~5遍,放入垫有滤纸的无菌培养皿。接种时将消毒的枝条按照生长成熟度切分为茎上段、茎中上段、茎中下段和茎下段4个部分,但由于4月上旬的枝条较短且未完全成熟,只能切分为茎上段、茎中上段和茎中下段3个部分。将4部分茎段剪为长约2 cm的外植体,接种到培养基中,每瓶接种3个外植体,每个处理接种4瓶,重复3次。接种后,置于(25±2)℃培养室,光照强度2 500~3 000 lx,光照时间12 h/d。
当腋芽萌发的新梢生长缓慢时,剪为长约1.5 cm茎段,接种到继代培养基中。接种数量、培养条件同初代培养。
1.2.4 培养基 初代培养选用1/2 MS + 1/2 WPM营养组分的培养基作为基础培养基,添加蔗糖30 g/L、琼脂粉7 g/L、调pH值5.8,ZT浓度设置1 mg/L、1.25 mg/L、1.5 mg/L 3个水平。继代培养基中分别添加1.5 mg/L ZT和1.5 mg/L tZR,其他成分同初代培养基。
1.3 数据统计
外植体接种后第2天开始观察统计组培苗生长情况,隔日统计污染率1次;连续5 d未观察到有新的腋芽萌发时统计萌芽率;约60 d组培苗进入直线生长末期后统计增殖倍数。
污染率=(污染外植体数/接种外植体数)×100%
总成活外植体数=接种外植体数-污染外植体数-褐化死亡外植体数
萌芽率=(萌芽的外植体个数/总成活外植体数)×100%
增殖倍数=可以继代接种的茎段数/总成活外植体数
其中,可以继代接种的茎段数为初代培养外植体腋芽萌发生长获得的新梢,继代培养超净工作台内无菌操作过程中,在培养皿中切分获得长度≥1.5 cm的茎段总数。
1.4 数据分析
利用Excel 2016和GraphPad Prism 5软件统计与分析试验数据,采用Turkey检验法进行组间显著性差异检验。
2 结果与分析
2.1 不同ZT浓度处理外植体的萌发率及增殖倍数
5月5日第3批次采集的外植体,接种在不同ZT浓度(1 mg/L、1.25 mg/L、1.5 mg/L)的初代培养基上,腋芽约7 d开始膨大。由表1可知,ZT对蓝莓布里吉塔茎段的腋芽萌发诱导和生长有良好作用,当ZT浓度为1 mg/L时,萌芽率最高,为77.78%;其次为ZT 1.5 mg/L,为73.33%;ZT为1.25 mg/L时,萌芽率相对较低,仅61.67%。外植体的增殖倍数以ZT 1.25 mg/L最高,为3.75倍;其次为ZT 1 mg/L,为2.94倍;ZT 1.5 mg/L最低,仅2.40倍,但不同浓度间增殖倍数未达到显著水平。3种ZT浓度的培养基均可作为蓝莓品种布里吉塔的初代培养基(图1),其中以ZT浓度为1.25 mg/L时效果最佳。

表1 不同ZT浓度处理外植体的萌发率及增殖倍数

注:A,培养基中ZT浓度1.0 mg/L;B,1.25 mg/L;C,1.5 mg/L。
2.2 不同外植体处理初代培养的差异
从图2可知,5月5日第3批次采集的外植体4 d后开始出现污染,第10天污染率达到峰值。其中,茎上段的污染率最高,为34.78%;茎中上段(8.33%)和茎中下段(4.76%)次之;茎下段污染率最低,仅4.35%,不同茎段的污染率有明显区别。仅从污染率看,茎中上段、茎中下段和茎下段作为外植体建立无菌体系效果较佳。茎上段污染率高的原因可能是在去除叶片时产生较多切面,且残留的叶柄不脱落,容易导致污染;茎下段污染率低的原因可能是叶柄部分在预处理和消毒的冲洗过程中部分自行脱落,污染率降低。
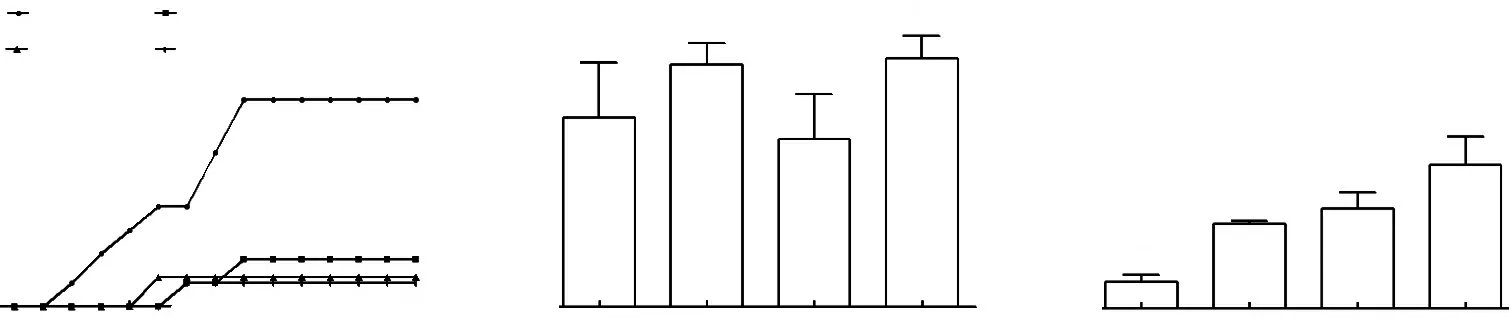
注:不同小写字母表示处理间差异显著(P< 0.05)。
茎下段萌芽率最高,为83.33%;茎中上段(81.25%)和茎上段(63.33%)其次;茎中下段最低,仅56.25%,但不同外植体之间萌芽率差异不显著。不同茎段的增殖倍数与萌芽率呈现的规律不同,茎下段的增殖倍数最高,为4.81倍;茎中下段(3.35倍)和茎中上段(2.83倍)其次;茎上段最低,仅0.90倍,不同外植体之间的增殖倍数差异达到显著水平。不同外植体在培养基中的生长状况不同(图3),以茎上段作为外植体的组培苗,植株矮小,生长缓慢;以茎中上段、茎中段和茎中下段作为外植体的组培苗生长健壮。综合污染率、萌芽率、增殖倍数和组培苗的生长状况4个试验评价指标认为,以茎中下段和茎下段作为外植体,建立无菌体系效果较好。

注:A,茎上段;B,茎中上段;C,茎中下段;D,茎下段。
2.3 不同采集时间外植体的污染率、萌发率及增殖倍数
由表2可知,4—5月采集外植体的污染率在13.06%~37.68%,萌芽率为68.18%~74.00%,增殖倍数为1.22~3.07倍。不同批次采集对外植体萌芽率的影响差异不显著,而增殖倍数达到显著水平。第2批次采集的外植体污染率较高,应是由于4月中下旬气温开始升高,材料带回实验室进行预处理冲洗后,未考虑温度影响放置冰箱低温贮藏,外植体残留的菌体不断繁殖、侵入伤口,导致接种后出现较多污染。综合上述,外植体采样时间对蓝莓初代培养的增殖倍数有重要影响。在无菌体系建立中,4—5月均可进行外植体采集,最佳采集时间为5月份。
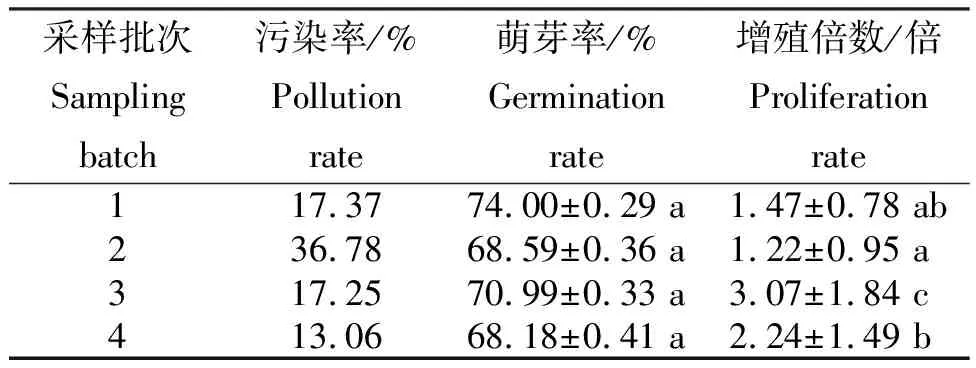
表2 不同采集时间处理外植体的污染率、萌发率及增殖倍数
2.4 不同细胞分裂素处理组培苗的继代增殖状况
将初代培养获得的新梢切分后转接到继代培养基中,约7 d发现腋芽开始膨大,叶片展开。从表3可知,在组培苗的继代培养过程中,2种细胞分裂素之间萌芽率和增殖倍数的差异未达显著水平。从图4看出,组培苗在添加tZR的培养基上生长更旺盛,叶色浓绿。从组培苗的生长状况看,tZR更有利于蓝莓组培苗的增殖培养。

表3 不同细胞分裂素处理组培苗的继代增殖状况

注:A,培养基中添加ZT;B添加tZR。
3 讨论
蓝莓组织培养中,外植体的选择在一定程度上影响快繁体系的建立。研究发现,布里吉塔春梢上部幼嫩枝条切分获得的茎中下段和茎下段作为外植体的效果更佳,春梢上部幼嫩枝条最成熟的部分,组培增殖效果最佳,与王大平[13]对兔眼蓝莓的研究结果一致。
采样时间也是成功建立无菌体系的重要因素。通过试验得出,4—5月均可进行蓝莓外植体采集,5月最佳,与周闰等[14-16]的研究结果一致。原因应是5月采集的春梢木质化程度更高,同时枝条贮藏的营养更多,从而表现出作为外植体时增殖倍数显著高于4月。
培养基是外植体诱导生长的重要营养来源,在组织培养过程中起着不可替代的作用。培养基中添加3种ZT浓度(1 mg/L、1.25 mg/L、1.5 mg/L)均可在初代培养中诱导腋芽萌发,与李森等[12]的研究结果相同。从节约生产成本角度出发,建议使用低浓度ZT(1.0 mg/L)进行初代培养。
在植物组培无菌体系建立过程中,添加细胞分裂素可促进茎段腋芽萌发。在蓝莓组培苗的第1次继代时,培养基内添加tZR更有利于增殖培养,与尹利方等[17]的研究结果一致,与张力思等[18]认为添加ZT对蓝莓茎段增殖效果最佳的结论不同,可能是由于蓝莓不同品种在增殖阶段对细胞分裂素的需求不同。
试验建立了蓝莓品种布里吉塔的无菌培养体系,下一步将对该品种的继代培养、生根和驯化进行系统研究,为蓝莓其他品种组培的系统研究提供思路及数据支持。
4 结论
通过组培快繁技术建立蓝莓品种布里吉塔的组培无菌体系时,应在5月进行外植体采集,并使用幼嫩春梢的中下部分作为外植体,最佳初代培养基为1/2 MS+1/2 WPM+ZT 1.0 mg/L,初代培养诱导新梢在继代培养基为1/2 MS + 1/2 WPM+1.5 mg/L tZR中成功继代,且生长状态良好。
