追氮时期对强筋小麦根际土壤微生物群落结构的影响
2022-06-23付博阳张钧浩杨明晓许华森彭正萍
付博阳,张钧浩,杨明晓,许华森,彭正萍,薛 澄
(河北农业大学 华北作物改良与调控国家重点实验室/资源与环境科学学院/河北省农田生态环境重点实验室,河北 保定 071000)
小麦是我国重要的粮食作物,近年来,我国小麦年产量稳定在1.3 亿t 左右,约占粮食总产量的20%[1]。氮肥施用是影响小麦产量和品质的重要因素之一[2],合理的氮肥调控为小麦高产优质生产提供了保障。除氮肥施用量以外,氮肥供应时期对小麦产量和品质也具有较大的影响。前人研究表明,在小麦生育后期追施氮肥可在保障小麦高产的前提下显著提高氮肥利用率和小麦籽粒蛋白质含量、优化蛋白质组成,进而提高其加工品质[3-4]。
土壤氮素供应水平显著影响土壤微生物多样性及其群落结构与功能[5-6]。熊艺等[7]研究表明,在小麦根际微生物群落多样性和群落结构变化中起主导作用的是土壤中可溶性无机氮含量,且土壤微生物群落在氮素供应不足的情况下具有更高的α-多样性。随施氮水平提高,小麦根际微生物总量和细菌、放线菌、真菌数量均呈单峰曲线[8],微生物多样性随施氮量增加呈下降趋势[5,9]。Zhou 等[10]通过对不同生态区454 个氮肥试验进行meta 分析发现,提高氮肥施用量降低了土壤微生物量碳/氮比以及真菌/细菌比,但氮素输入量每年小于100 kg /hm2时,对土壤微生物并不会产生负面效果。长期定位试验结果也表明,长期施氮会降低细菌群落的α-多样性及微生物数量[6]。
土壤微生物群落结构不仅与施氮量有关,还受氮肥施用方式的影响。王淑贞[11]研究表明,在施氮量相同条件下,分次施氮(基施氮+拔节期追氮、基施氮+灌浆期追氮、基施氮+拔节期追氮+灌浆期追氮)相较于播前一次性施氮显著提高了冬小麦的产量和土壤微生物多样性。现有研究主要关注中筋小麦土壤微生物对氮肥调控的响应特征,很少涉及强筋小麦,而不同基因型小麦的土壤微生物结构与功能存在明显的差异[12]。本课题组前期研究发现[4],施氮量相同时,孕穗期追氮能够实现强筋小麦产量和品质的协同提高,但土壤微生物群落结构的变化仍未可知。基于此,本试验以优质强筋小麦品种‘藁优2018’为供试材料,研究不同追氮时期对小麦根际土壤微生物群落结构的影响,以期为小麦高产优质生产中科学施肥提供依据。
1 材料与方法
1.1 试验地概况
试验于2017 年10 月—2020 年6 月在河北省邢台市凤凰镇孟村(37°36′N, 114°54′E)进行,该地属大陆性季风气候,年均气温12.8 ℃,年均降水量449.1 mm,无霜期198 d,年均日照时长2 629.5 h。供试土壤类型为壤质潮褐土,其0 ~20 cm 土层基本理化性状为:有机质含量17.2 g/kg,全氮含量1.0 g/kg,硝态氮含量8.7 mg/kg,铵态氮含量5.8 mg/kg,有效磷含量19.2 mg/kg,速效钾含量132.7 mg/kg,pH(水土比2.5 ∶1)值8.34。
1.2 试验设计
试验共设置5 个处理:N0,不施氮肥;NE,基施氮96 kg /hm2,拔节期追氮144 kg /hm2,后期不追氮;NB、NH、NF为后期追氮处理,即将NE处理拔节期追氮的50%分别于孕穗期、抽穗期、开花期追施,各施氮处理总施氮量均为240 kg /hm2。播前各处理均同时施入 135 kg /hm2P2O5和105 kg /hm2K2O,基肥为掺混肥,追肥为尿素(N ≥46%),追施方式为撒施。各处理均设置4 次重复,采用随机区组设计,小区面积25 m2(4 m×6.45 m)。供试小麦品种为优质强筋冬小麦‘藁优2018’,小麦播种量为262.5 kg/hm2,行距0.15 m,其他田间管理均按当地常规管理进行。
1.3 样品采集与测定方法
1.3.1 样品采集 经过3 年的定位试验后,于2020年6 月4 日采集小麦成熟期根际土壤样品,取样工具事先经过消毒灭菌处理,采用抖根法进行根际土的采集。每小区随机采集20 ~30 株生长均匀并具有代表性的小麦,将这些小麦根部(0 ~20 cm 土层)挖出,抖掉小麦根部周围土壤,用毛刷刷取根际土,将其进行混合放置于密封袋中作为1 个分析样品。将所取样品放置于低温保藏箱(-20 ℃),带回实验室后保存在-80 ℃超低温冰箱中。于2020 年6 月4 日采集小麦成熟期0 ~20 cm 土层的土壤样品,每小区随机取2 点,2 个采样点的土壤混合作为1个分析样品,用于测定土壤含水量、硝态氮含量、铵态氮含量和pH 值[13]。
1.3.2 根际土壤DNA 提取与PCR 扩增 DNA 提取:称取-80 ℃保存的根际土壤0.5 g,采用试剂盒提取土壤微生物群落DNA(Fast DNA® Spin Kit for Soil,MP Biomedicals,USA),用1%琼脂糖凝胶电泳检测DNA 质量[14]。PCR 扩增:细菌以引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′) 和806R(5′-GGACTACHVGGGTWTCTAAT-3′)进行细菌16sRNA 的V3-V4 高变区域扩增,真菌以引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)进行真菌ITS1 区域扩增。PCR 反应条件为95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存(PCR 仪:ABI GeneAmp®9700 型)。
1.3.3 高通量测序 使用2% 琼脂糖凝胶回收PCR 产 物, 利 用AxyPrepDNA Gel Extraction Kit(Axygen Biosciences,Union City,CAM,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer(Promega,USA)对回收产物进行检测定量,使用NRXTFLEX Rapid DNASeq Kit 进行建库。利用I11umina 公司的Miseq PE300/NovaSeq PE250 平台进行测序。
1.4 测序数据处理和分析
测序数据的处理参考Wang 等人[15]的方法。使用SPSS 软件进行统计分析,微生物群落的α-多样性采用一般线性模型-单因素进行方差分析,LSD 法进行多重比较(P< 0.05),微生物差异检验采用Kruskal-Wallis 秩和检验。
2 结果与分析
2.1 追氮时期对土壤微生物群落α-多样性的影响
对不同追氮时期小麦根际土壤微生物群落α-多样性指数进行分析(表1),结果表明细菌16S-rRNA 测序文库覆盖度均超过97%,真菌ITS测序文库覆盖度均超过99%,表明各处理测序数据达到饱和,其结果能反应真实样本条件。

表1 根际土壤微生物群落的α-多样性指数Table 1 Alpha diversity index of rhizosphere soil microbial community
Sobs 值代表可观测到的微生物物种数变化情况,数值越大说明优势菌群地位越突出。与N0相比,NE、NB、NH处理的细菌Sobs 值有降低的趋势,NF处理细菌Sobs 值显著降低10.5%(表1),表明基施氮+拔节期追氮+开花期追氮(NF)较不施氮相比降低了土壤中细菌OTU 数。与N0处理相比,NE、NB、NF处理Shannon 指数显著降低,而NH处理无显著差异,表明拔节期追氮、孕穗期追氮和开花期追氮降低了土壤中细菌的多样性。NE和NF处理Simpson 指数显著高于不施氮处理(N0),而不同追氮时期处理间无显著差异。细菌各处理间ACE指数亦无显著差异,表明施用氮肥和不同追氮时期对细菌群落丰富度无明显影响。细菌Chao 1 指数各处理间表现出与Sobs 值相同的规律。真菌Sobs 值、Shannon 指数、Simpson 指数、ACE 指数、Chao 1指数各处理间无显著差异。
2.2 不同追氮时期根际土壤微生物共有菌群分析
按照97%的相似性非重复序列(不含单序列)进行聚类后,共得到细菌OTU 总数量为6 741,真菌OTU 总数量为1 550(图1)。通过Venn 图可以直观体现不同处理间OTU 组成的差异性和重叠情况,由图1a 可以看出,各处理共有细菌OTU 数量为3 181,占各处理细菌总OTU 数量的47.19%,N0、NE、NB、NH和NF各 处 理 特 有 细 菌OTU 数量 分 别 为305、197、166、206、152,施 氮 处 理特异性细菌OTU 数量较不施氮处理(N0)下降了32.5%~50.2%,表明施用氮肥会降低土壤中特异性细菌OTU 数;不考虑N0处理,各施氮处理共有细 菌OTU 数 量 为3 355,NE、NB、NH和NF各 处理间特有细菌OTU 数量分别为318、271、310、230,NB处理和NF较NE处理特异性细菌OTU 数分别下降了14.8% 和27.7%,表明在孕穗期追氮和开花期追氮降低了土壤特异性细菌OTU 数。同样,由图1b 可以看出,各处理共有真菌OTU 数量为503,N0、NE、NB、NH和NF各处理特有真菌OTU 数量分别为104、79、74、102、73,与N0处理相比,NE、NB、NF处理特异性真菌OTU 数分别下降24.0%、28.8%、29.8%。施氮处理中,NE、NB、NH和NF各处理特有真菌OTU 数分别为107、92、144、86,与NE处理相比,NH处理特异性真菌增加了34.6%,NB和NF处理则降低了14.0%和19.6%。
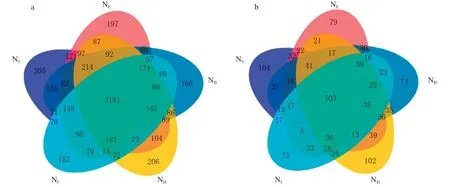
图1 不同追氮时期根际土壤细菌(a)和真菌(b)OTUs 的Venn 图Fig.1 Veen diagram of soil bacteria(a)and fungi(b)OTUs under different split N application timing
2.3 追氮时期对土壤微生物群落结构组成的影响
2.3.1 土壤微生物群落结构组成分析 各处理土壤细菌在门水平下的群落构成基本一致(图2a),检测出的优势菌门(平均相对丰度>1%)为放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidota)、Myxococcota、厚壁菌门(Firmicutes)、髌骨细菌门(Patescibacteria)、芽 单 胞 菌 门(Gemmatimonadota)、 浮 霉 菌 门(Planctomycetota)和疣微菌门(Verrucomicrobiota)共11 个门类。其中,各处理细菌优势菌门的相对丰度占细菌总丰度的比例分别为89.2%、92.2%、93.3%、92.6% 和93.8%。 对 各 处 理 土壤真菌群落在门水平上的分类进行分析,结果如图2b 所示,子囊菌门(Ascomycota)、未分类的真菌门类(unclassified_k__Fungi)、被孢霉门(Mortierellomycota)、担子菌门(Basidiomycota)为优势菌门,各处理真菌优势菌门的相对丰度占真菌总丰度的比例分别为95.1%、92.0%、95.1%、94.2%和85.4%。

图2 不同追氮时期土壤细菌(a)和真菌(b)门水平下的相对丰度变化Fig.2 Changes of relative abundance of soil bacteria (a) and fungi (b) at the phylum level under different split N application timing
各处理根际土壤微生物在属水平群落构成基本一致(图3)。对不同追氮时期小麦根际土壤细菌群落进行分析,共鉴定出978 个属。对其中优势细菌群落(平均相对丰度>1%)在属水平上进行分类,相对丰度如图3a 所示,norank_f__norank_o__Vicinamibacterales、norank_f__Vicinamibacteraceae、类诺卡氏菌属(Nocardioides)、链霉菌属(Streptomyces)、节杆菌属(Arthrobacter)、norank_f__JG30-KF-CM45、芽孢杆菌属(Bacillus)、德沃斯氏菌属(Devosia)8 个属为优势细菌属,各处理中8 个优势菌属平均占总细菌属丰度的19.8%。不同追氮时期小麦根际土壤真菌群落共鉴定出403 个属,对优势真菌群落(平均相对丰度>2%)在属水平上进行分类,相对丰度如图3b 所示,其优势菌属为枝顶孢属(Acremonium)、赤霉菌属(Gibberella)、unclassified_k__Fungi、被孢霉属(Mortierella)和枝孢属(Cladosporium)5 个菌属,平均占总真菌属丰度的42.9%。
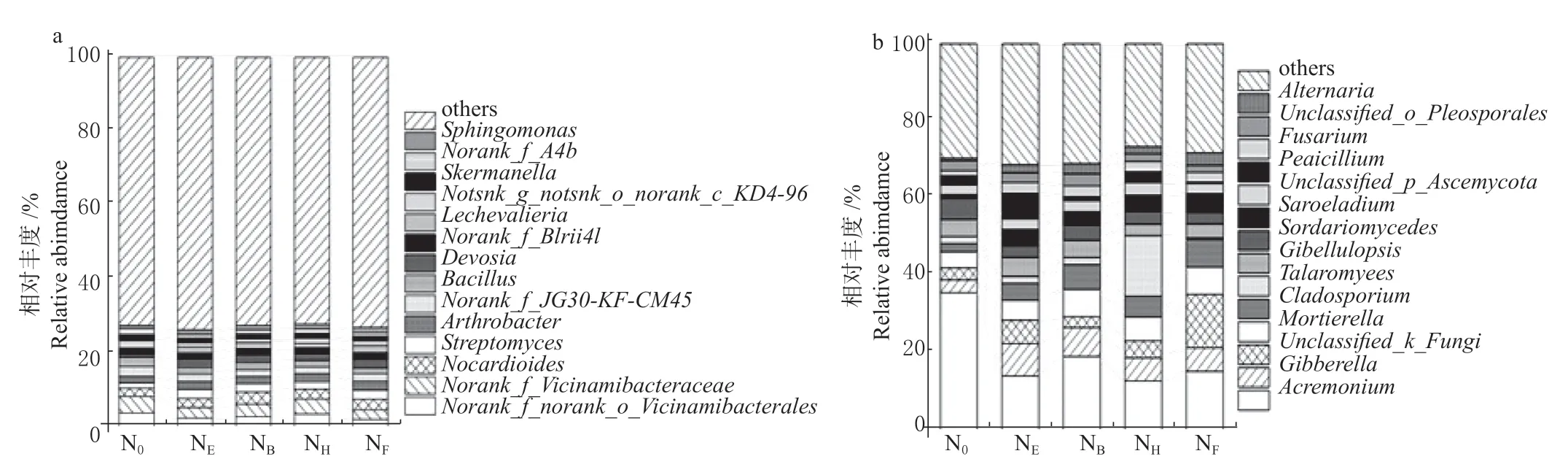
图3 不同追氮时期土壤细菌(a)和真菌(b)属水平下的相对丰度Fig.3 Changes of relative abundance of soil bacteria(a) and fungi(b)at the genus level under different split N application timing
2.3.2 土壤微生物群落组成差异性比较 对细菌在门水平和属水平优势菌群的相对丰度进行差异检验,发现仅有绿弯菌门、疣微菌门的相对丰度处理间表现出显著差异(图4a),与不施氮处理N0相比,NE、NB、NF处理绿弯菌门相对丰度分别显著下降了26.5%、31.8%、27.4%,不同追氮时期处理间无显著差异,但NH处理较其他追氮处理表现出提高绿弯菌门相对丰度的趋势。疣微菌门的相对丰度处理间表现为N0>NE>NH>NB>NF,与不施氮处理N0相比,NE处理疣微菌门的相对丰度无明显差异,NB、NH处理有降低的趋势,NF处理则显著下降57.7%。与NE处理相比,随着施氮时期的后移,疣微菌门的相对丰度有下降趋势,其中开花期追氮时显著下降56.9%。
对真菌在门水平和属水平优势菌群的相对丰度进行差异检验,发现氮肥施用及不同追氮时期对赤霉菌属、帚枝霉属、链格孢属的相对丰度影响显著。与不施氮处理N0相比,NE处理显著提高赤霉菌属相对丰度,NF处理显著提高帚枝霉属和链格孢属相对丰度,增幅分别为394.5%、390.9%。不同追氮时期处理间,赤霉菌属、帚枝霉属和链格孢属的相对丰度无显著差异(图4b)。

图4 不同追氮时期土壤微生物组成差异检验Fig.4 Soil microbial composition difference test under different split N application timing
2.4 追氮时期土壤环境因子与微生物群落结构的冗余分析
各处理下土壤细菌门水平群落组成与环境因子的RDA 分析结果(图5)表明,2 个排序轴共解释了26.41%的细菌群落变化,其中第一个轴解释了25.70%,第二个轴解释了0.71%。在所分析的4 个指标中,土壤环境因子中的含水量与N0处理呈正相关分布关系,绿弯菌门、疣微菌门、髌骨细菌门也和N0处理呈显著呈正相关分布关系,说明氮肥施用后,土壤含水量的变化定向改变了土壤中细菌多样性和群落结构,但氮肥处理间土壤细菌多样性和群落结构无差异。
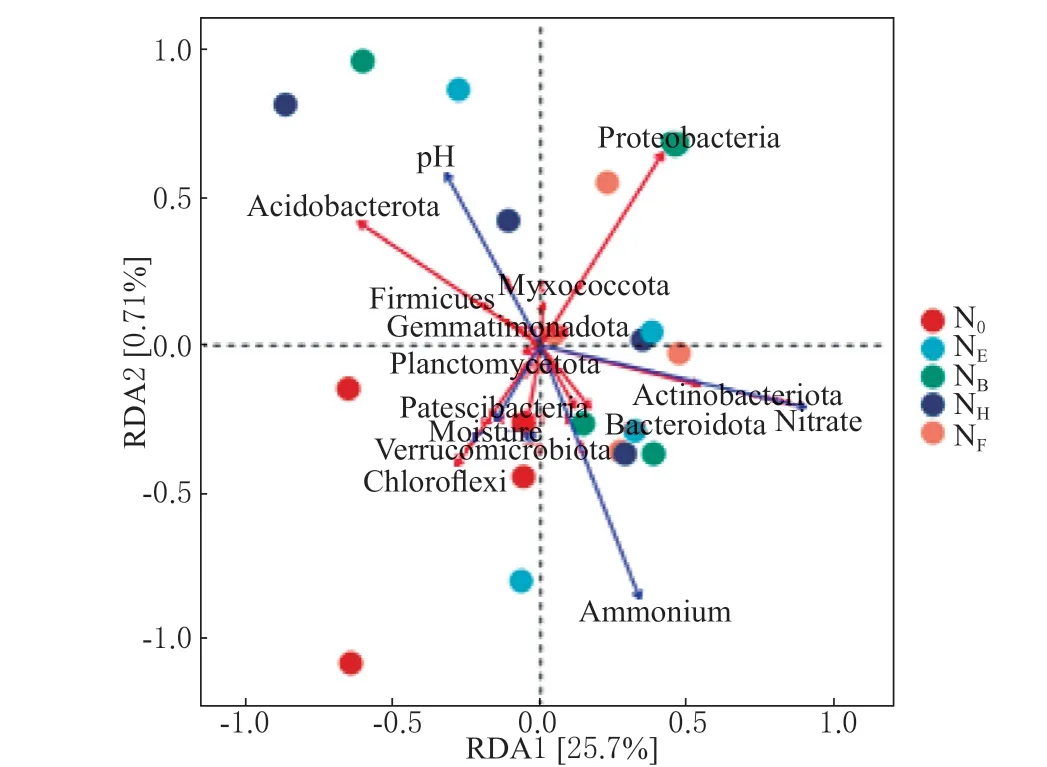
图5 不同处理下土壤环境因子与土壤细菌门水平群落组成的冗余分析Fig.5 Redundancy analysis of soil environmental factors and soil bacterial phylum level community composition under different treatments
在属水平上对土壤真菌群落进行冗余分析(RDA),如图6 所示。RDA 分析的前两个轴共解释了29.15%的真菌群落变化,第一个轴解释了19.42%,第二个轴解释了9.73%。土壤pH 值、硝态氮含量、铵态氮含量和含水量与各处理无明显相关关系,但枝顶孢属与硝态氮含量、铵态氮含量和含水量呈显著负相关系,而unclassified_k__Fungi、被孢霉属、枝孢属等菌属和硝态氮含量、铵态氮含量和含水量呈正相关关系。

图6 不同处理下土壤环境因子与土壤真菌属水平群落组成的冗余分析Fig.6 Redundancy analysis of soil environmental factors and soil fungi genus level community composition under different treatments
3 讨论
土壤中氮素状况是土壤微生物多样性和群落结构变化的主要驱动力之一[5-6]。许多研究表明,施用无机氮会降低土壤微生物多样性[5,16],其原因是氮素供应促进了土壤中微生物DNA/RNA 的复制,提高了一些蛋白代谢相关基因的丰度,有利于富营养微生物的生长和繁殖,导致多样性降低[17]。本研究发现,与不施氮处理相比,施用氮肥降低了细菌Sobs 值、Shannon 指数和Chao 1 指数,与前人研究结果基本一致[5,16]。王淑贞[11]研究表明,分次施氮(基施氮+拔节期追氮+灌浆期追氮)提高了土壤真菌的多样性,而本试验未发现类似现象,其原因可能是本试验后期施氮处理第3 次追氮的时期与之不同造成的。Chen 等[9]研究表明,根际微生物群落结构在分蘖期因施氮水平不同而出现显著差异,但在拔节期和成熟期又趋于相似,说明氮素的输入确实会影响微生物群落结构,但是随着小麦生育期推进,土壤中氮素减少,微生物群落多样性趋于稳定。本试验在总施氮量一致的基础上,分别于孕穗期、抽穗期和开花期追施氮肥,随小麦生育期推进,微生物群落结构趋于稳定,这可能是本试验至小麦成熟期各施氮处理间根际微生物多样性无显著差异的原因之一。
研究表明[15],小麦根际土壤细菌在门水平的优势菌门为放线菌门、变形菌门、酸杆菌门和绿弯菌门等,在属水平的优势菌属为norank_f__norank_o__Vicinamibacterales、norank_f__Vicinamibacteraceae、norank_f__norank_o__norank_c_KD4-96和norank_f__JG30-KF-CM45等,与本研究结果在门水平基本一致,而在属水平存在差异。本研究表明,在门水平,绿弯菌门和疣微菌门的丰度在处理间表现出显著差异。氮肥施用显著影响了绿弯菌门的生长,绿弯菌门的营养方式极为多样,其中化能自养是其主要的营养方式,而在氮循环中,绿弯菌门参与了硝化作用,它可以促进的氧化,加快了的形成[18]。在本试验中,不施氮处理的土壤有效态氮素含量较低,绿弯菌门可以促进硝化过程的进行,产生更多利于小麦吸收的硝态氮。疣微菌门在土壤中普遍存在,但其丰度和功能可能被低估了[19],有研究表明,疣微菌门中存在多种多样、连接稀疏的非核糖体肽合成酶系统,其基因簇中有合成抗生素的潜能[20]。本研究发现,与基施氮+拔节期追氮(NE)处理相比,随着施氮时期后移,疣微菌门的相对丰度有下降趋势,在开花期时达显著水平,说明在开花期追施氮肥,可能会导致土壤中抗生素的合成减少,不利于小麦抗病。本研究还表明,真菌在门水平上的优势菌门为子囊菌门,其相对丰度平均占总真菌群落的80%以上,与肖苗苗等人[15]的研究一致。此外,施用氮肥会使土壤中赤霉菌属、帚枝霉属和链格孢属的相对丰度增加,尤其是在无后期施氮(NE)和开花期追氮(NF)处理,而链格孢属丰度的提高可能会使小麦更易发生病害。
土壤环境因子(如pH 值、含水量和养分状况)对土壤微生物生长具有重要作用,这也是导致微生物群落结构发生变化的主要原因之一[21-22]。Zhao等人[23]研究表明,在中国北方石灰性土壤中,土壤硝态氮含量是驱动土壤细菌群落变化的最重要的因素之一。本研究RDA 分析表明,土壤含水量是影响土壤细菌群落组成的关键因素,而土壤硝态氮含量、铵态氮含量和pH 值与细菌群落无显著相关性。其中,绿弯菌门、疣微菌门、髌骨细菌门均与土壤含水量呈显著正相关,与马大龙[24]等研究结果类似。
4 结论
氮肥的施用降低了土壤细菌群落α-多样性,而对真菌群落α-多样性无明显影响,不同追氮时期对小麦根际土壤微生物群落α-多样性无显著影响。施用氮肥能够降低小麦根际土壤细菌多样性以及绿弯菌门和疣微菌门的相对丰度。施氮量相同时,追氮时期对小麦根际细菌多样性无显著影响,但基施氮+拔节期追氮+开花期追氮的氮肥运筹方式显著降低了疣微菌门的相对丰度。施氮对小麦根际真菌多样性无明显影响,但增加了赤霉菌属、帚枝霉属、链格孢属的相对丰度,追氮时期对小麦根际真菌群落和结构无明显影响。综上所述,追氮时期对强筋小麦根际土壤微生物多样性没有显著影响,但开花期追氮较无后期追氮处理降低了抗生素合成相关的疣微菌门相对丰度。
