褐藻寡糖对卵形鲳鲹幼鱼生长性能、抗氧化能力和免疫功能的影响
2022-06-22黄健彬周传朋黄小林荀鹏伟林黑着
黄健彬,迟 艳,周传朋,黄小林,黄 忠,虞 为,荀鹏伟,吴 杨,张 宇,林黑着,
1. 上海海洋大学 水产与生命学院,上海 201306
2. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室,广东 广州 510300
3. 五洲丰农业科技有限公司,山东 烟台 264000
4. 中国水产科学研究院南海水产研究所 深圳试验基地,广东 深圳 518121
卵形鲳鲹 (Trachinotus ovatus) 俗称金鲳,隶属于鲈形目、鲹科,广泛分布于印度洋、地中海以及中国南海等热带亚热带海域。其具有肉质鲜美、生长快、优质苗种易获得、养殖过程中可全程投喂配合饲料等良好的生产性能,现已成为广东、广西和海南等沿海地区海水养殖的重要经济鱼类。近年来,卵形鲳鲹集约化养殖模式快速壮大,加重了养殖水体负荷,这不仅对鱼类生长产生了有害影响,还导致传染性鱼类疾病频发,严重阻碍了卵形鲳鲹养殖业的可持续性发展。
研究证实,饲料中补充益生元,可以增强水生动物免疫能力,促进其生长[1-3]。寡糖可被鱼类肠道内有益微生物所发酵,产生的短链脂肪酸可以改善鱼类肠道健康、促进鱼类生长和调节免疫功能,是水产养殖业中应用较为广泛的重要益生元[4-6]。有研究表明,壳寡糖可以调节鱼类肠道益生菌丰度并改善肠道结构,促进鱼类生长[4];此外,壳寡糖还可促进白细胞吞噬功能和淋巴细胞转化[1],抑制促炎细胞因子mRNA和细胞凋亡相关基因的表达[5],提高鱼类免疫功能。果寡糖可以改善斜带石斑鱼 (Epinephelus coioides) 肠道形态,并提高肠道胰蛋白酶和淀粉酶的活性[2,7]。赵峰等[8]报道,饲料中添加果寡糖可增加奥尼罗罗非鱼 (Oreochromis niloticus×O. aureus) 肠道内双歧杆菌 (Bacillus bifida)和乳酸杆菌(Lactobacillus) 的数量。饲料中添加低聚木糖可以增大奥尼罗罗非鱼肠皱襞面积,提高其血清超氧化物歧化酶 (SOD)、碱性磷酸酶 (AKP)和过氧化氢酶 (CAT) 活力,并增强抗嗜水单胞菌(Aeromonas hydrophila) 感染的能力[9-10]。胡晓伟等[6]研究发现低聚木糖可增加花鲈 (Lateolabrax japonicus) 肠道中双歧杆菌的数量,并降低沙门氏菌(Salmonella) 和大肠杆菌 (Escherichia coli) 数量。对不同鱼类物种的研究表明,甘露寡糖具有改善鱼类肠道结构功能[3,11]、调节菌群结构[12]、促进营养素消化[3]、增强非特异性免疫力[3,11]和抗致病菌感染能力[13]等作用。
褐藻寡糖是由褐藻胶降解而成的功能性寡糖。作为新一代益生元,褐藻寡糖具有比褐藻胶更优良的性质,如较低的分子量、更高的溶解度等[14],因此易被鱼类肠道益生菌利用,可更好地促进肠道益生菌生长[15-16]。有研究表明,褐藻寡糖可以改善肠道结构,促进鱼类生长,并提高其非特异性免疫和抗致病菌能力[16-18]。然而,褐藻寡糖在水产动物健康养殖方面的应用尚处于起步阶段,饲料中添加褐藻寡糖对卵形鲳鲹生长和免疫功能的调节作用尚未见报道。结合本项目组对褐藻寡糖的前期研究结果,本研究以卵形鲳鲹为研究对象,通过添加0.7和 6.0 g·kg−1的褐藻寡糖,从生长性能、血浆生化与免疫指标、肝脏抗氧化能力、肠道形态和肠道Nf-κb信号通路相关基因表达等方面研究褐藻寡糖对其生长和免疫的调节作用,为褐藻寡糖应用于卵形鲳鲹配合饲料的有效性和安全性评估提供科学依据。
1 材料与方法
1.1 实验饲料
褐藻寡糖由山东省五洲丰农业科技有限公司生产,是通过褐藻胶裂解酶对褐藻酸钠进行酶解制得,纯度约90%。本实验饲料共分3组,对照组为TC,其余2组依次编号为A1和A2,其原料组成见表1。由于A1和A2组饲料中褐藻寡糖添加剂量很少,本实验使用等量的小麦面粉替代褐藻寡糖。实验用鱼粉、猪肉粉、矿物质预混料等含有丰富的磷 (P) 元素,额外添加0.50%磷酸二氢钙[Ca(H2PO4)2]以满足卵形鲳鲹幼鱼生长发育对P的正常需求。所有原料粉碎后,过40目筛网。准确称量原料后,按组分比例由小到大逐级混匀。按配方比例加入大豆卵磷脂、鱼油和适量水,充分混匀。使用F-26双螺杆挤条机将混匀的原料挤压成2.0和2.5 mm径长的2种柱形长条。使用G-500造粒机将柱形原料切成2.0和2.5 mm粒径的饲料。风干后放入装有相应标签的真空密封袋中,于−20 ℃下保存备用。

表1 卵形鲳鲹幼鱼实验饲料组成与近似成分Table 1 Ingredients and proximate composition of experimental diets of juvenile T. ovatus g·(100 g)−1
1.2 养殖管理与样品采集
本实验的卵形鲳鲹鱼苗购自深圳市龙岐庄实业发展有限公司,驯养和养殖实验在中国水产科学研究院南海水产研究所深圳试验基地的露天池塘内进行。驯养期间,使用商品饲料 (质量分数:粗蛋白≥43.0%、粗脂肪≥8.0%,广东越群海洋生物研究开发有限公司) 饲养鱼苗。1周后选取225尾状态良好、规格相近的卵形鲳鲹 [平均初始体质量为(6.06±0.03) g],随机分配到9个网箱中。整个实验随机分3组,每组3个重复,每个重复25尾鱼。每组网箱分别投喂对应的实验饲料。每天06:30和17:30各投喂一次。饲养期间,采取自然光周期,水温28.3~33.3 ℃,盐度14~18,溶解氧质量浓度维持 5.0 mg·L−1以上,氨氮质量浓度不超过0.05 mg·L−1,亚硝酸盐质量浓度低于0.01 mg·L−1。实验周期为 58 d。
采样前,对实验鱼进行24 h停食处理。采样时,对每个网箱的实验鱼进行计数,并称量总质量;每个网箱随机选取3尾实验鱼用于体成分分析;参照水产动物营养研究的常规方法[19],每个网箱随机选取5尾鱼,测量并记录体质量和体长,用于计算肝体指数、脏体指数和肥满度;使用质量分数为1%的肝素钠润洗1 mL医用注射器后,抽取鱼静脉血,于 4 ℃ 条件下 3 000×g离心 10 min,吸取上清液,用于血液指标的测定;称量并记录内脏团和肝脏质量,供肝体指数、脏体指数的计算备用;剪取约1.0 g肝组织保存于−20 ℃,供肝酶活性、总抗氧化能力 (T-AOC) 和丙二醛 (MDA) 浓度的测定备用;分离出完整肠道后,于肠道中央位置剪取约绿豆粒大小的肠道组织,装入冷冻管中,短时间液氮保存后,转置−80 ℃下保存,用于分子分析;剪取约2 mm肠组织,并用多聚甲醛溶液进行固定,用于制作组织切片。
1.3 生长性能与饲料利用率
增重率 (Weight gain rate, WGR, %)、特定生长率 (Specific growth rate, SGR, %∙d−1)、饲料系数(Feed coefficient, FC)、肝体指数 (Viscerosomatic index, HSI)、脏体指数 (Hepatosomatic index, VSI)、肥满度 (Condition factor, CF, g∙cm−3)、成活率 (Sur-vival rate, SR, %) 等指标的计算公式为:
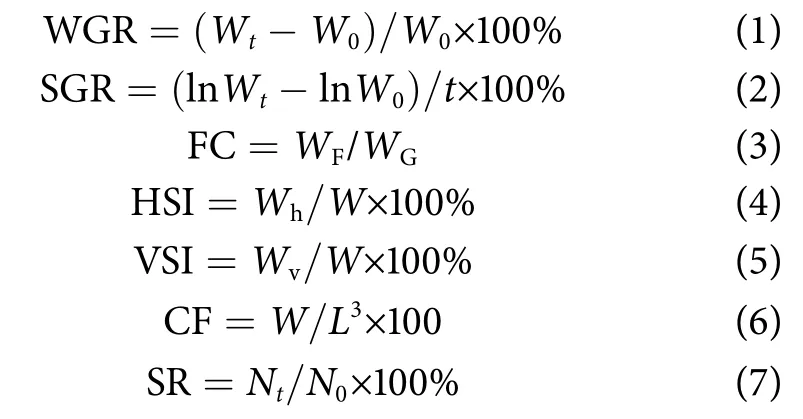
式中:W0为初始体质量 (g);Wt为终末体质量(g);t为实验时长 (d);WF为摄食饲料干质量(g);WG为增质量 (g);Wh为肝脏质量 (g);W为体质量 (g);Wv为内脏团质量 (g);L为体长(cm);Nt为终末鱼数量 (尾);N0为初始鱼数量 (尾)。
1.4 营养成分分析
饲料、全鱼以及肌肉样品的水分含量使用(103±2) ℃ 烘箱干燥后测定 (GB/T 6435—2014);粗蛋白使用FOSS 2300全自动凯氏定氮仪 (Hoganas,瑞典) 测定 (GB/T 6432—2018);粗脂肪使用索氏抽提装置测定 (GB/T 6433—2006);粗灰分使用FO610C马弗炉 (Yamato Scientific Co. Ltd.,日本) 550 ℃ 煅烧后测定 (GB/T 6438—2007)。
1.5 血浆生化及免疫指标
使用ROCHE p800全自动生化分析仪 (德国)检测血浆生化指标,检测指标包括总蛋白、血糖、甘油三酯浓度和AKP活性。参照对应试剂盒 (南京建成生物工程研究所) 说明书测定血浆补体C3和C4的质量浓度。
1.6 肝脏抗氧化能力
实验所用抗氧化酶检测试剂盒购自南京建成生物工程研究所。参照说明书测定肝脏SOD、CAT、过氧化物酶 (POD) 和谷胱甘肽还原酶 (GR) 活性,并测定肝脏T-AOC及MDA浓度。
1.7 肠道组织形态学分析
委托武汉塞维尔生物科技有限公司对样品进行石蜡包埋、苏木精-伊红 (HE) 染色,制成组织切片。使用PANNORAMIC DESK全景切片扫描仪(3DHISTECH,匈牙利) 扫描成像后,使用Case-Viewer 2.4软件测量肠道绒毛高度、隐窝深度和肌层厚度。
1.8 实时荧光定量 PCR
使用 Hipure Universal RNA Mini Kit试剂盒(Magen) 提取肠道组织总RNA。用1%琼脂糖凝胶电泳检测RNA质量,并使用超微量分光光度计(NanoDrop 2000, Thermo Fisher Scientific) 检测RNA 浓度。使用Evo M-MLVRT Kit with gDNA Clean for qPCRⅡ试剂盒 (Accurate Biotechnology)将RNA反转录成cDNA,于−20 ℃保存。目的基因以及内参基因β-Actin的实时荧光定量PCR引物序列见表2。实时荧光定量PCR扩增体系 (12.5 μL):2×SYBR GreenProTaqHS Premix 6.25 μL,cDNA 模板 1 μL,上下游引物各 0.5 μL,RNase free water 4.25 μL。实时荧光定量 PCR 仪 (LightCycler®480 II, Roche) 运行程序设置:95 ℃ 预变性 30 s;95 ℃ 变性 5 s,60℃ 退火 45 s,共 40 个循环。PCR扩增结束后,在50~95 ℃范围内分析溶解曲线。基因的相对表达量计算方法参照Livak和Schmittgen[22]描述的 2−ΔΔCt法。

表2 实时荧光定量PCR引物序列Table 2 Sequences of primers used for real-time PCR
1.9 数据分析
先用Excel 2019软件对成活率、肝体指数和脏体指数等百分比数据进行反正弦函数转化,再用SPSS 25.0软件对实验数据进行单因素方差分析(One-way ANOVA)。实验数据通过方差同质性(Levene's test) 检验后,进一步采用 Duncan's检验进行多重比较。所有数据以“平均值±标准误均值 (±SEM)”表示,显著水平为0.05。
2 结果
2.1 卵形鲳鲹幼鱼的生长性能与饲料利用率
摄食不同饲料的卵形鲳鲹幼鱼的生长性能与饲料利用率见表3。结果显示,不同饲料组实验鱼的成活率之间无显著差异 (P>0.05)。与TC组相比,A1和A2组幼鱼的增重率和特定生长率显著升高(P<0.05);且A1和A2组的增重率和特定生长率无显著差异 (P>0.05)。与TC组相比,A1组饲料系数显著下降 (P<0.05)。与TC组相比,A2组幼鱼的肥满度显著增加 (P<0.05),不同饲料组的脏体指数和肝体指数无显著差异 (P>0.05)。
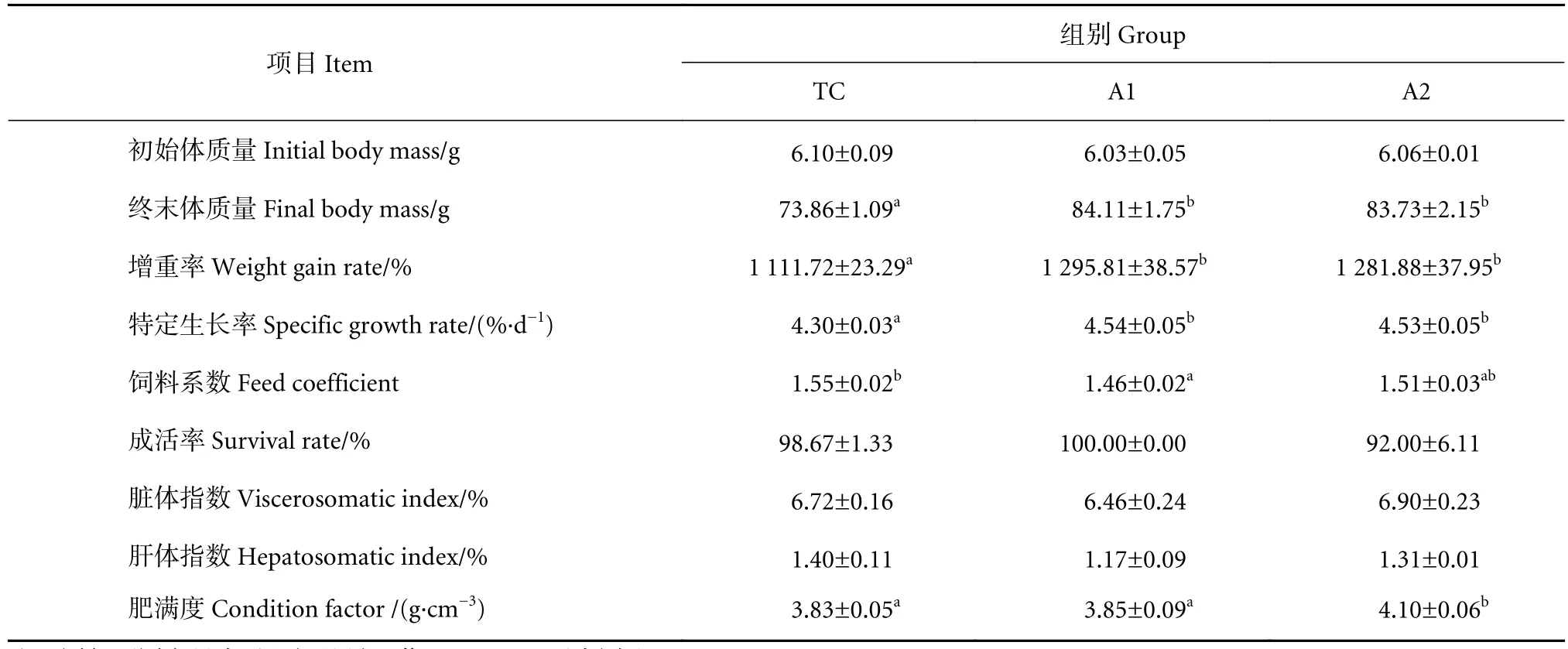
表3 饲料中添加褐藻寡糖对卵形鲳鲹幼鱼生长性能和饲料利用率的影响Table 3 Effects of dietary AO on growth performance and feed utilization of juvenile T. ovatus
由表4可知,摄食不同饲料的卵形鲳鲹幼鱼的体成分之间无显著差异 (P>0.05),但比较肌肉成分发现,A2组的肌肉粗脂肪含量显著高于TC和A1 组 (P<0.05)。
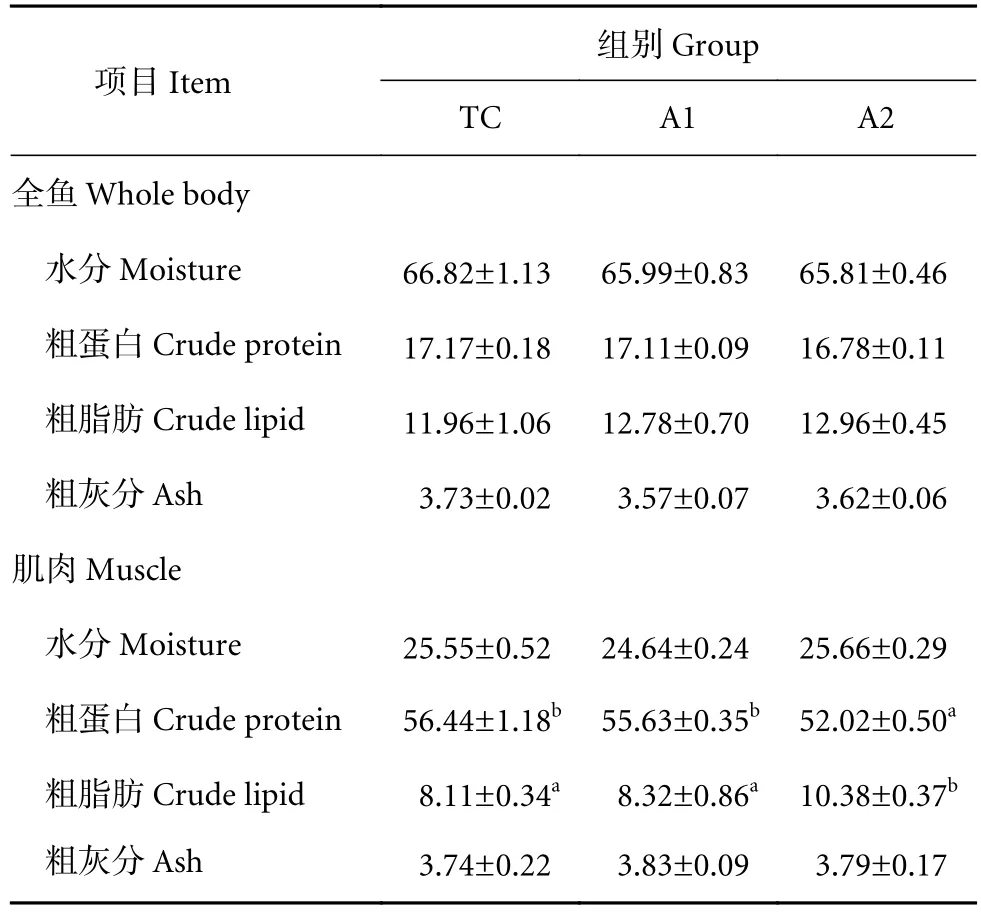
表4 饲料中添加褐藻寡糖对卵形鲳鲹幼鱼全鱼成分和肌肉成分的影响Table 4 Effects of dietary AO on proximate composition of whole body and muscle of juvenile T. ovatus %
2.2 卵形鲳鲹幼鱼血浆生化与免疫指标
摄食不同饲料的卵形鲳鲹幼鱼血浆生化与免疫参数见表5。A1组卵形鲳鲹幼鱼的血糖浓度显著低于TC组 (P<0.05)。与TC组相比,饲料中添加褐藻寡糖在不同程度上降低了实验鱼血浆中甘油三酯浓度,其中A1组甘油三酯浓度显著低于TC组(P<0.05)。免疫指标结果显示,A1和A2组卵形鲳鲹幼鱼血浆中补体C3质量浓度显著高于TC组(P<0.05)。且饲料中添加褐藻寡糖在不同程度上提高了实验鱼血浆中AKP活性,其中A2组的AKP活性显著高于TC组 (P<0.05)。
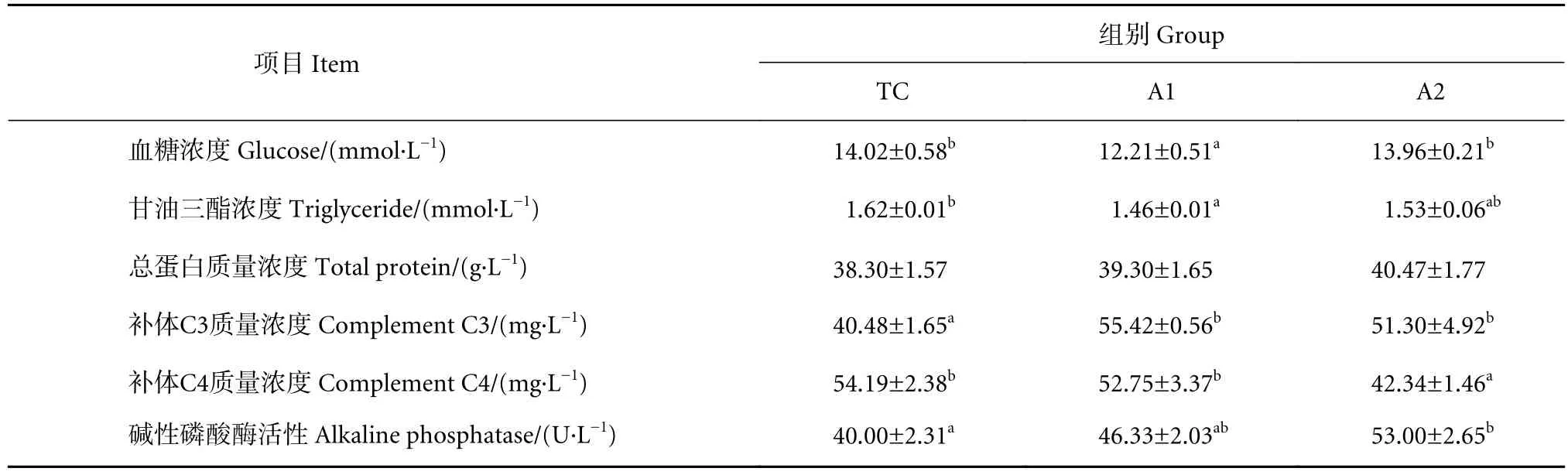
表5 饲料中添加褐藻寡糖对卵形鲳鲹血浆生化及免疫指标的影响Table 5 Effects of dietary AO on plasma biochemical and immune parameters of juvenile T. ovatus
2.3 卵形鲳鲹幼鱼肝脏抗氧化能力
不同饲料组卵形鲳鲹幼鱼的肝脏T-AOC和MDA浓度见表6。饲料中添加褐藻寡糖可以显著提高卵形鲳鲹幼鱼肝脏抗氧化能力。与TC组相比,A1和A2组SOD、CAT、POD和GR活性均显著升高 (P<0.05);A1和A2组T-AOC显著高于TC组 (P<0.05),MDA质量摩尔浓度显著低于TC 组 (P<0.05)。
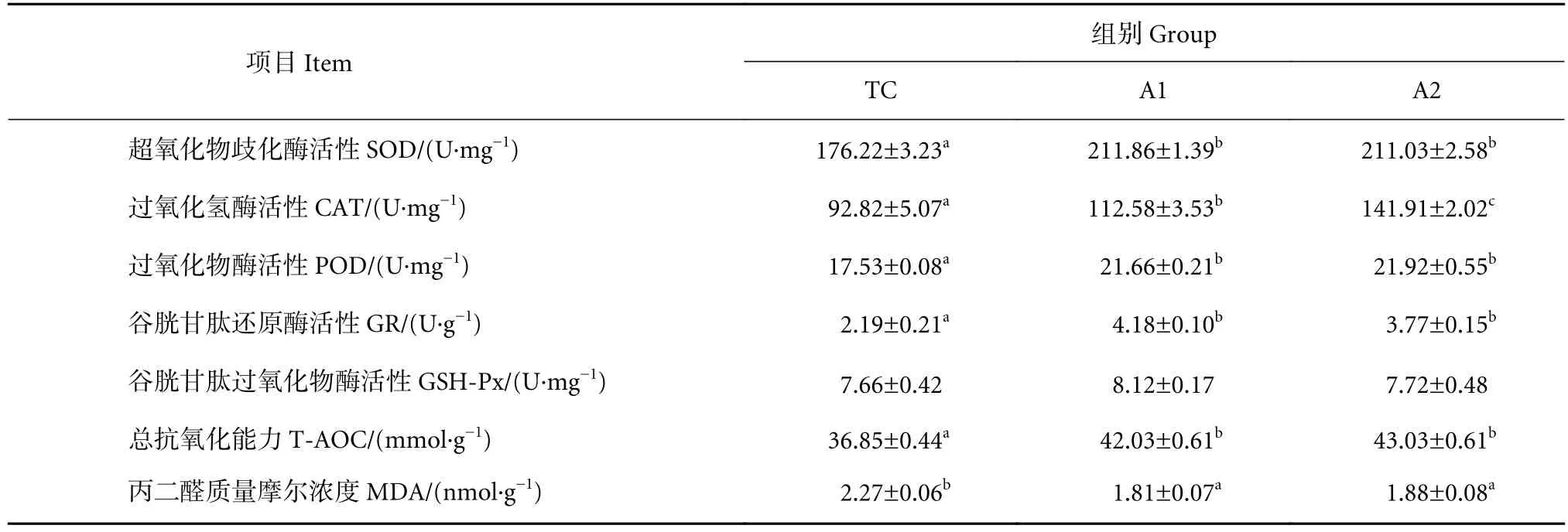
表6 饲料中添加褐藻寡糖对卵形鲳鲹幼鱼肝脏抗氧化能力的影响Table 6 Effects of dietary AO on hepatic antioxidative capacity of juvenile T. ovatus
2.4 卵形鲳鲹幼鱼肠道形态
不同饲料组卵形鲳鲹幼鱼的肠道组织形态学指标见表7。结果显示,饲料中添加褐藻寡糖能够显著提高实验鱼肠绒毛高度 (P<0.05),但对实验鱼的隐窝深度和肌层厚度无显著影响 (P>0.05)。此外,肠道组织切片 (图1) 显示,摄食不同浓度褐藻寡糖饲料的卵形鲳鲹的肠道组织均未发生明显的形态学病变。
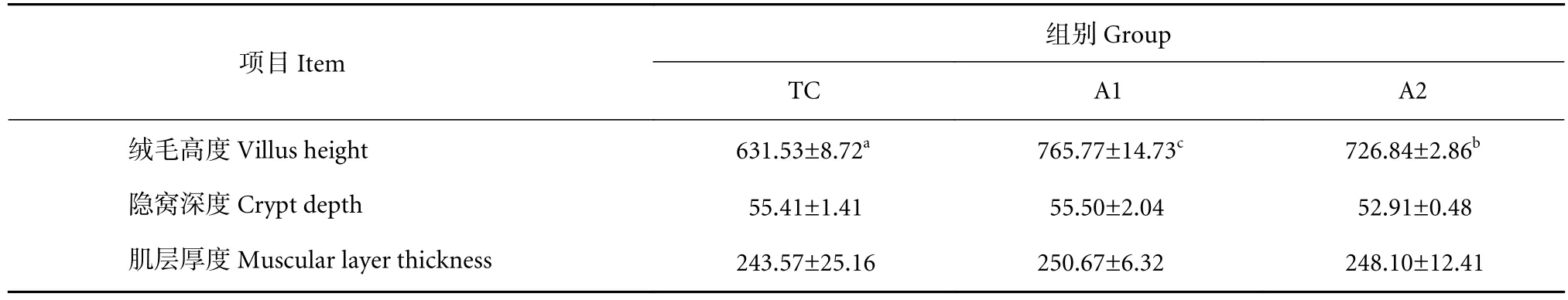
表7 饲料中添加褐藻寡糖对卵形鲳鲹幼鱼肠道组织形态学指标的影响Table 7 Effects of dietary AO on intestine morphological parameters of juvenile T. ovatus μm

图1 摄食不同浓度褐藻寡糖饲料的卵形鲳鲹幼鱼的肠道形态 (HE 染色)Fig. 1 Intestine morphology of T. ovatus fed with different levels of dietary AO (HE staining)
2.5 卵形鲳鲹幼鱼肠道 Nf-κb 信号通路相关基因的相对表达量
与 TC 组相比,A1 和 A2 组的nf-κb、iκb、ikk、tnf-α和il-8的相对表达量显著降低 (P<0.05),tgfβ的相对表达量显著升高 (P<0.05)。此外,A2组实验鱼肠道iκb、nf-κb、tnf-α和il-8的相对表达量显著低于 A1 组 (P<0.05,图2)。
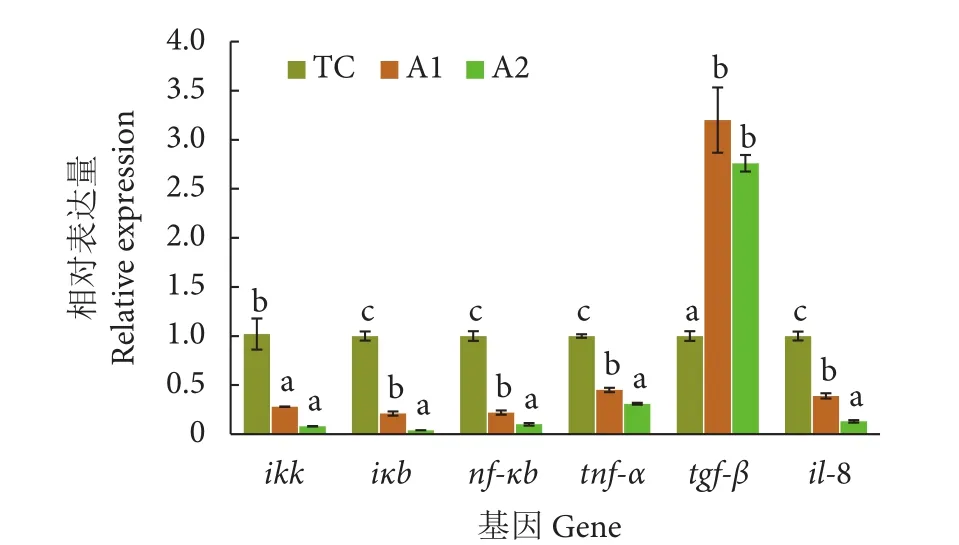
图2 卵形鲳鲹幼鱼肠道Nf-κb信号通路相关基因的相对表达量Fig. 2 Relative expression of genes involved in Nf-κb signaling pathway in gut of T. ovatus
3 讨论
3.1 褐藻寡糖对卵形鲳鲹生长与饲料利用率的影响
褐藻寡糖可有效促进水产动物生长,在水产养殖业中具有良好的应用潜力[16-18]。Hu等[17]报道,饲料中添加褐藻寡糖能明显提高草鱼 (Ctenopharyngodon idella) 的增重率和特定生长率,并降低饲料系数。van Doan等[23]研究发现,饲料中添加褐藻寡糖能显著提高尼罗罗非鱼(O. niloticus) 的增重率和特定生长率,并降低饲料系数。本研究中,饲料中添加 0.7 和 6.0 g·kg−1褐藻寡糖均显著提高了卵形鲳鲹幼鱼的增重率和特定生长率,且添加0.7 g·kg−1的褐藻寡糖显著降低了饲料系数,与上述研究结果相似。褐藻寡糖在鱼类肠道发酵产生的短链脂肪酸可为肠上皮细胞的修复和再生提供能量[24],改善肠道结构功能,促进肠道对营养物质的吸收与利用[25],有利于鱼类生长。此外,褐藻寡糖可提高鱼类肠道消化酶活性[18],增强其对营养素的消化率。
肥满度是评价鱼类营养状况的重要指标[26]。一般情况下,个体肥满度越高,其体内储存的能量物质越多[27]。本研究中,A2组实验鱼的肥满度显著高于TC和A1组,这主要与A2组肌肉脂肪积累显著增加有关。与TC和A1组相比,A2组肌肉脂肪含量显著升高,原因是褐藻寡糖通过增加肠道益生菌丰度促进了肠道脂肪酶合成和分泌[18,28],促进了对脂类的吸收,进而提高血液甘油三酯的合成[29],血液甘油三酯在脂蛋白脂肪酶(LPL) 催化下发生水解,为肌肉组织合成甘油三酯提供甘油和脂肪酸[30],有助于肌肉组织沉积脂肪。此外,低浓度的褐藻寡糖诱导实验鱼肠道内嗜黏蛋白阿克曼菌 (Akkermansia muciniphila)的丰度增加[31],进而降低了实验鱼血液甘油三酯浓度[32-33],从而减少脂肪沉积。类似的结果同样见于尖吻鲈 (Lates calcarifer)[18],饲料中添加较高浓度褐藻寡糖明显提高了尖吻鲈肠道脂肪酶的活性,导致其肥满度增加,但添加低浓度褐藻寡糖对肥满度无明显影响。
3.2 褐藻寡糖对卵形鲳鲹血浆生化及免疫功能的影响
短链脂肪酸在生物体内葡萄糖代谢活动中发挥重要作用,可与肠上皮细胞G蛋白偶联受体 (Gpcrs) 结合,诱导多肽 YY (Pyy) 和胰高糖素样肽-1(Glp-1) 的释放,促进肌肉和脂肪组织储存葡萄糖,从而降低血液中葡萄糖浓度[34]。本研究中,添加0.7 g·kg−1褐藻寡糖显著降低了卵形鲳鲹血糖浓度,其原因可能是提高了实验鱼肠道短链脂肪酸水平[31],促使血液中葡萄糖向肌肉和脂肪组织转移。添加 0.7 g·kg−1褐藻寡糖显著降低实验鱼血浆的甘油三酯浓度,在挪威舌齿鲈 (Dicentrarchus labrax)[25]的研究中也观察到类似结果,其主要原因是低浓度的褐藻寡糖诱导鱼类肠道内嗜黏蛋白阿克曼菌增殖[32]。
研究表明,低分子量的褐藻寡糖能够调节并增强养殖动物的免疫功能[23,35]。江晓路等[36]报道,褐藻寡糖可以提高刺参 (Apostichopus japonicus) 体腔液酸性磷酸酶、AKP和溶菌酶的活性;王鹏等[37]研究发现褐藻寡糖提高了大菱鲆 (Scophthalmus maximus) 的体液免疫以及细胞免疫水平。本研究中,与 TC 组相比,添加 6.0 g·kg−1褐藻寡糖显著提高了卵形鲳鲹AKP活性,与刺参[36]和挪威舌齿鲈[38]的结果相似。AKP活性升高可能与肠道微生物发酵产生的丁酸有关。褐藻寡糖在鱼类后肠内被微生物发酵产生了丁酸[15,31],丁酸上调了碱性磷酸酶基因的表达[39],进而提高AKP活性。另一方面,饲料中添加 0.7 和 6.0 g·kg−1褐藻寡糖均显著提高了卵形鲳鲹幼鱼血浆中补体C3浓度,这与草鱼[17]的研究结果相似,其原因可能是褐藻寡糖激活了鱼类体内的巨噬细胞[40-41],促进补体合成。本研究中,饲料中添加6.0 g·kg−1褐藻寡糖显著降低了实验鱼血浆补体C4浓度,这与有些研究结果[17,23]相反。因此,今后需进一步探讨褐藻寡糖对卵形鲳鲹补体C4浓度是否会产生负面影响。
3.3 褐藻寡糖对卵形鲳鲹肝脏抗氧化状态的影响
活性氧 (ROS) 是动物体内正常代谢产生的物质,如超氧阴离子 (O2−)、过氧化氢 (H2O2) 和羟基自由基 (∙OH)等[42]。ROS 参与细胞内信号传导级联反应,在细胞凋亡过程中发挥重要作用[43]。然而,机体内产生的多余ROS会导致氧化应激反应,诱导构成细胞的蛋白质、脂质和DNA等氧化损伤[44],最终导致细胞凋亡[45]。鱼类抗氧化系统包含酶抗氧化系统和非酶抗氧化系统,其功能是清除机体代谢异常产生的多余ROS,维持机体内氧化和抗氧化稳态,防止氧化应激诱导的细胞坏死[46]。SOD是抗氧化系统的第一道防线,可将机体产生的多余 O−2转化为 H2O2[47]。CAT 是组成鱼类抗氧化系统的重要抗氧化酶之一,可催化H2O2分解成H2O和O2,并抑制H2O2转化成∙OH[48]。POD和GSH-Px在鱼类抗氧化系统中同样发挥着重要作用,可清除体内产生的H2O2和有机过氧化物[46]。本研究中,添加褐藻寡糖显著提高了卵形鲳鲹幼鱼肝脏SOD、CAT和POD活性,与草鱼[17]和尖吻鲈[20]的研究结果相似,表明褐藻寡糖可以提高鱼类体内抗氧化酶活性。谷胱甘肽 (GSH) 是鱼类体内重要的非酶抗氧化剂,可作为GSH-Px的底物清除体内多余的ROS,而自身氧化成氧化型谷胱甘肽 (GSSG)[49]。GR是催化GSH氧化还原循环的关键酶,可催化GSSG还原成GSH。与TC组相比,添加褐藻寡糖显著提高了实验鱼GR活性,与草鱼[17]的研究结果相似,表明褐藻寡糖可能通过提高鱼类GR活性,进而促进GSSG转化成GSH,间接增强GSH-Px活性。T-AOC能够反映机体清除ROS的总能力[50]。本研究中,A1和A2组T-AOC显著高于TC组,表明添加褐藻寡糖可以提高卵形鲳鲹幼鱼肝脏的抗氧化能力。MDA是脂质过氧化的主要产物,其含量升高与ROS产生过多密切相关[51]。与TC组相比,饲料中添加褐藻寡糖显著降低了实验鱼肝脏MDA浓度,原因是饲料中添加褐藻寡糖提高了实验鱼肝脏抗氧化酶活性,增强了其清除ROS的能力,从而减少了脂质过氧化物积累。综上,饲料中添加褐藻寡糖可以通过提高卵形鲳鲹SOD、CAT、POD和GSH-Px等抗氧化酶活性增强其抗氧化能力,有助于清除多余ROS,减缓脂质过氧化反应,减少组织损伤。
3.4 褐藻寡糖对卵形鲳鲹肠道形态的影响
肠道是鱼类消化食物和吸收营养物质的主要器官,其形态结构对鱼类吸收营养物质和生长至关重要[52-53]。肠绒毛由肠上皮细胞特化形成,是肠道吸收营养物质的重要结构,其形态关乎鱼类肠道吸收能力强弱[54]。本研究中,饲料中添加褐藻寡糖显著提高了实验鱼的肠绒毛高度,与尖吻鲈[18]相似。表明褐藻寡糖可以改善卵形鲳鲹幼鱼肠道组织形态,原因可能是:1) 褐藻寡糖诱导益生菌产生的短链脂肪酸为肠上皮细胞提供了能量,促进了肠绒毛增殖和修复[55];2) 产生的短链脂肪酸降低肠道环境pH,抑制有害微生物生长,利于肠绒毛发育。
3.5 褐藻寡糖对卵形鲳鲹肠道 Nf-κb mRNA 表达的影响
Nf-κb信号通路可以调控多种细胞因子mRNA的转录,进而影响机体内炎症反应[56]。在静息细胞中,位于胞质的Nf-κb与Iκb结合形成稳定的二聚体[57]。当脂多糖 (LPS)[14]与膜上受体结合,活化Ikk,活化的Ikk诱导Iκb磷酸化,从而激活Nf-κb[58]。激活的Nf-κb转移至细胞核内与DNA结合,并转录相应的促炎细胞因子mRNA。这提示抑制Nfκb活性可以减少促炎细胞因子的产生,减轻炎症反应[59]。本研究中,饲料中添加 0.7 和 6.0 g·kg−1褐藻寡糖均显著降低了实验鱼肠道nf-κb、tnf-α和il-8的相对表达量,表明褐藻寡糖通过降低nfκb的表达量,进而抑制促炎细胞因子基因tnf-α和il-8 表达。与 0.7 g·kg−1组相比,6.0 g·kg−1组显著下调肠道nf-κb、tnf-α和il-8 的表达,这表明 6.0 g·kg−1褐藻寡糖对促炎细胞因子基因表达的抑制作用更明显。另一方面,Tgf-β是鱼类体内重要的抗炎细胞因子,可以抑制炎症反应[60]。本研究中,饲料中添加 0.7 和 6.0 g·kg−1褐藻寡糖显著提高了实验鱼肠道tgf-β的相对表达量,表明褐藻寡糖可以促进tgfβ表达,从而提高肠道抗炎能力。饲料中添加褐藻寡糖能显著下调草鱼促炎细胞因子基因表达,并上调抗炎细胞因子基因表达[17],这与本研究结果相似。造成鱼类肠道组织nf-κb表达下调的原因之一是褐藻寡糖发酵产生的短链脂肪酸与致病菌竞争性结合肠上皮细胞上的受体[61],抑制病原菌附植,减轻LPS对肠道细胞的刺激[62]。另外,产生的短链脂肪酸降低肠道环境pH,抑制病原菌生长。
4 结论
饲料中添加褐藻寡糖可以改善卵形鲳鲹幼鱼肠道形态和生长,提高血浆免疫指标和肝脏抗氧化能力,抑制肠道Nf-κb和促炎细胞因子mRNA的转录,并促进抗炎细胞因子mRNA转录。基于饲料成本和养殖效果考虑,建议卵形鲳鲹幼鱼饲料中褐藻寡糖的添加量为 0.7 g·kg−1。
