低氧环境下热休克蛋白90对人肝细胞脂质代谢通路的影响*
2022-06-22邓子豪黄雅玲刘利霞陈雪梅
邓子豪,黄雅玲,刘利霞,陈雪梅
(南方医科大学公共卫生学院职业卫生与职业医学系,广州 510515)
低氧可导致脂质代谢异常,使组织中脂质蓄积,并影响身体机能[1-4]。肝脏内氧分压明显低于标准大气压且呈梯度代谢现象,肝脏对此反应敏感[5,6]。研究表明高原人群脂肪肝发病率和患病率远高于非暴露区普通人群[7,8],提示低氧在脂肪肝发生、发展中起着重要作用。
低氧应激可损伤线粒体功能,使ROS大量生成,引起蛋白质的错误折叠甚至失活[9]。而分子伴侣热休克蛋白90(HSP90)是蛋白质质量控制系统的重要一员,通过调控多种蛋白质的活化,在细胞信号转导、增殖和存活中发挥重要作用[10-12]。本研究通过干扰或敲除HSP90,探讨低氧环境下HSP90对人肝细胞脂质代谢通路的影响。
1 材料与方法
本研究经南方医科大学公共卫生学院伦理审查委员会审查批准。
1.1 材料
人肝细胞株L02、HepG2、Huh7购自中国科学院上海典型培养物保藏中心。用于HSP90α敲除的CRISPR-Cas9质粒购自iGeneBio公司(广州)。
1.2 方法
1.2.1 细胞培养
用含有10%胎牛血清(Gibco)的DMEM基础培养基(Thermo Scientific Forma)培养细胞。低氧组是将细胞置于低氧孵箱(94%N2,5%CO2)中,常氧组是将细胞置于常氧孵箱(21%O2,5%CO2)中培养。低氧组细胞培养液需事先于低氧培养箱内平衡30 min,处理时迅速置换培养液。
1.2.2 胞内HSP90敲低
运用siRNA技术敲低胞内HSP90。HSP90的干扰序列由上海吉玛制药技术有限公司合成(siHSP90α:5′-CCCAGUUGAUGUCAUUGAUTT-3′;siHSP90β:5′-GCGGUAAGGAUAAGAAGAATT-3′ )。
使用Lipofectamine 3000(Invitrogen)试剂进行转染。
1.2.3 胞内脂质蓄积检测
1.2.3.1 用PBS洗涤共聚焦培养皿中的细胞,在室温下用1.5%戊二醛(Sigma-Aldrich)避光固定15 min,固定完毕后先用PBS洗涤,再用0.1%曲拉通作用于细胞(通透)10 min,经PBS洗涤后用尼罗红染液染色(10μg/mL,37℃,避光)10 min。用预冷PBS洗涤并经甘油封片后,通过Olympus FV1000共聚焦激光扫描显微镜(日本东京)捕获图像,导出图像使用ImageJ 1.50i软件分析。
1.2.3.2 细胞在60 mm培养皿中培养、处理后,用胰酶消化并离心收集至1.5 mL离心管,经PBS洗涤后再用尼罗红染色(10μg/mL,37℃,避光)20 min。细胞经PBS洗涤后吹打混匀,上样至96孔板,并使用GUAVA easyCyte HT流式细胞仪检测。
1.2.4 甘油三酯含量检测
通过甘油三酯(Triglyceride,TG)测定试剂盒(南京建成)测量细胞内TG,以评估脂质积累的程度。通过BCA蛋白质测定试剂盒(Biotechnology)测量蛋白质浓度,以标准化测定结果。
1.2.5 mRNA相对表达量检测
使用实时荧光定量PCR法检测。用Trizol(Takara)提取总RNA。用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(Takara)逆转录:37 ℃,15 min;85 ℃,5 s;4 ℃,5 min。参照Hieff®qPCR SYBR®Green Master Mix(No Rox)说明书进行qRT-PCR反应,反应条件:95 ℃下预变性5 min;95 ℃下变性10 s,60 ℃下退火20 s,72 ℃下延伸30 s,共40个循环。引物序列如下:
FASN引物:上游5′-GAGGTGTCAGAGAACGGCAA-3′,下游5′-GTGTCCATGAAGCTCACCCA-3′;
β-actin引物:上游5′-CATGTACGTTGCTATCCAGGC-3′,下游5′-CTCCTTAATGTCACGCACGAT-3′。
1.2.6 统计学分析
采用SPSS 16.0软件进行统计学分析。计量资料数据用均数±标准差表示,两独立样本均数比较采用t检验,三组及以上样本均数比较采用单因素方差分析,两两比较采用LSD法,视P<0.05为差异有统计学意义。
2 结果
2.1 低氧应激导致人肝细胞株脂质蓄积增多
实验结果提示,低氧应激促进人肝细胞株L02和人肝癌细胞株HepG2、Huh7内脂质蓄积。通过流式细胞术检测经尼罗红染色后的细胞,与常氧组相比,低氧24 h组和低氧48 h组的L02、HepG2、Huh7细胞内的脂质含量随低氧处理时程增加,差异有统计学意义(P<0.05)。(表1,图1)在激光共聚焦显微镜下可见相似结果(P<0.05)。(表2,图2)与用TG测试盒检测得到的细胞内TG含量结果一致(P<0.05)。(表3)
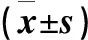
表1 低氧时程对三种细胞脂质蓄积的影响(流式细胞术检测)Table 1 Effects of hypoxia duration on lipid accumulation of three kinds of cells detected by flow
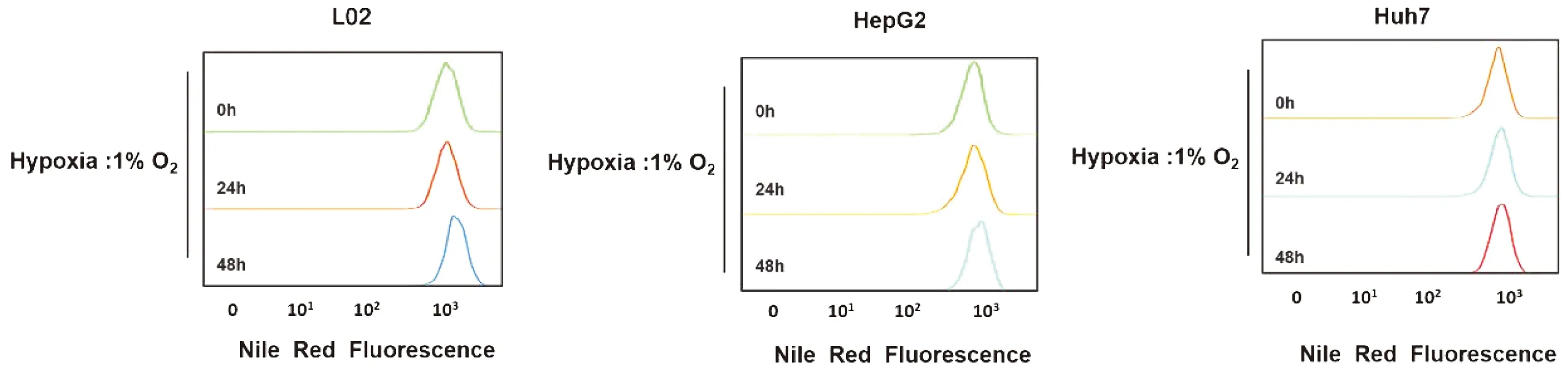
图1 低氧时程对三种细胞脂质蓄积的影响图

表2 低氧时程对三种细胞脂质蓄积的影响(共聚焦显微镜检测)Table 2 Effects of hypoxia duration on lipid accumulation of three kinds of cells detected
2.2 HSP90抑制剂导致低氧下HepG2细胞脂质蓄积减少,并影响低氧下脂质代谢途径
N端抑制剂STA9090、C端抑制剂Novobiocin可导致低氧24 h的HepG2细胞内脂滴减少(P<0.05)(表4~5,图3~4)、甘油三酯水平下降(P<0.05)(表6);下调脂质代谢通路中脂质合成相关FASN基因的mRNA水平(P<0.05)(表7)。
图2 低氧时程对三种细胞脂质蓄积的影响
表3 低氧时程对三种细胞脂质蓄积的影响(TG试剂盒检测)Table 3 Effects of hypoxia duration on lipid accumulation of three kinds of cells detected

表4 低氧联合抑制剂对HepG2细胞脂质蓄积的影响(流式细胞术检测)Table 4 Effects of hypoxia combined with HSP90 inhibitors on lipid accumulation ofHepG2 detected by flow

表5 低氧联合抑制剂对HepG2细胞脂质蓄积的影响(共聚焦显微镜检测)Table 5 Effects of hypoxia combined with HSP90 inhibitors on lipid accumulation ofHepG2 detected by confocal

图3 低氧联合抑制剂对HepG2细胞脂质蓄积的影响
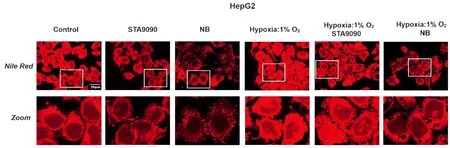
图4 低氧联合抑制剂对HepG2细胞脂质蓄积的影响
表6 低氧联合抑制剂对HepG2细胞脂质蓄积的影响(TG试剂盒检测)Table 6 Effects of hypoxia combined with HSP90 inhibitors on lipid accumulation ofHepG2 detected by TG test

表7 低氧联合抑制剂对HepG2细胞FASN表达的影响(qPCR检测)Table 7 Effects of hypoxia combined with HSP90 inhibitors on expression ofFASN of HepG2 detected by
2.3 敲低HSP90导致低氧下HepG2细胞脂质蓄积减少
为了研究HSP90在低氧环境下对肝癌细胞脂质代谢的影响,本研究对在敲低HSP90α或HSP90β的基础上经过低氧24 h处理的HepG2细胞用尼罗红染色,并通过激光共聚焦显微镜观察,可见2种HSP90亚型的敲低均可导致低氧下HepG2细胞的脂质蓄积减少(P<0.05)(表8,图5);另一方面,通过构建敲除HSP90α的HepG2细胞也可发现低氧下该细胞的脂质蓄积较野生型HepG2细胞明显减少(P<0.05)(表9,图6)。
表8 低氧联合敲低HSP90α/β对HepG2细胞脂质蓄积的影响(共聚焦显微镜检测)Table 8 Effects of hypoxia combined with HSP90α/β knocked down on lipid accumulation ofHepG2 detected by confocal
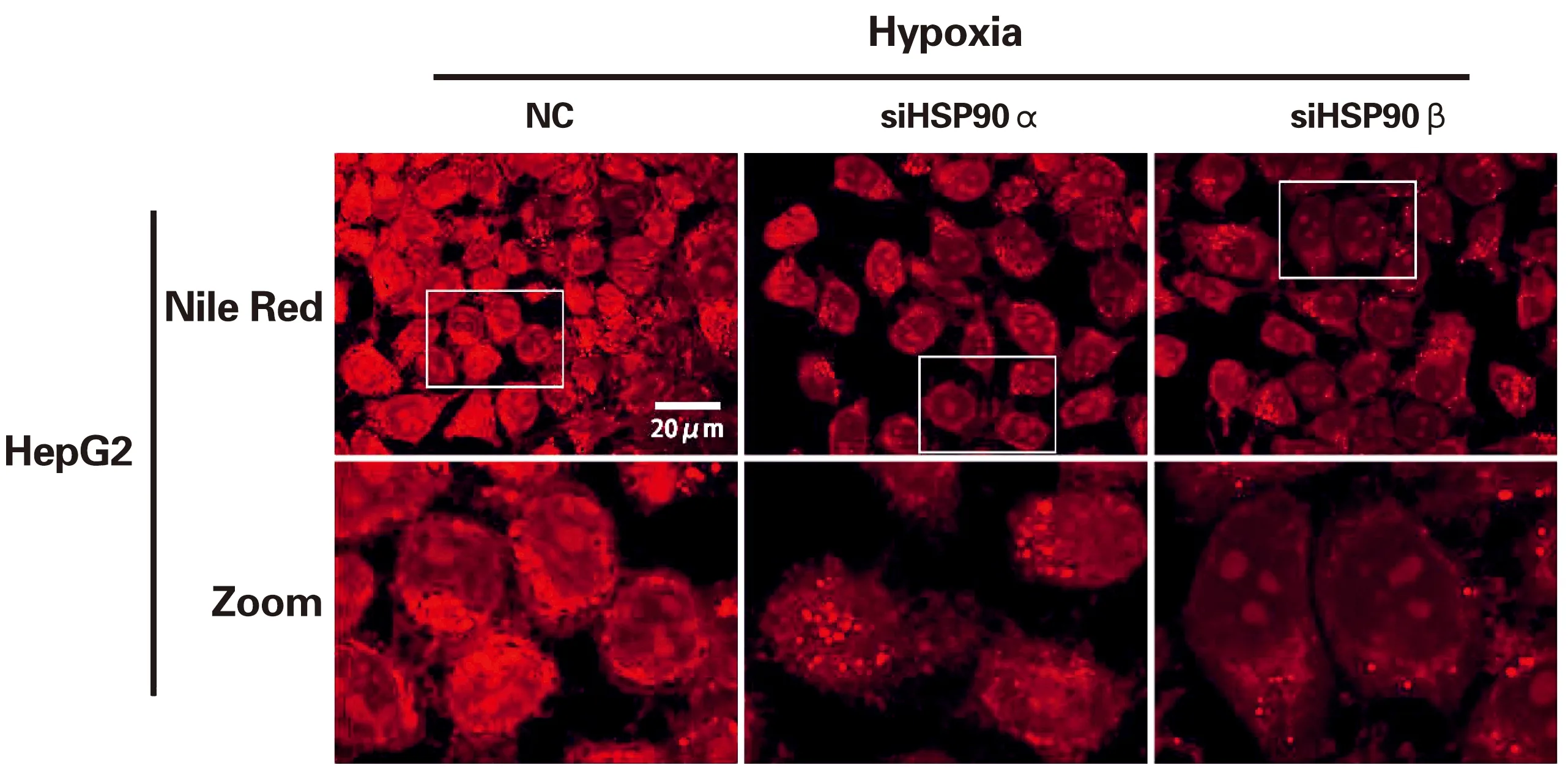
图5 低氧联合敲低HSP90α/β对HepG2细胞脂质蓄积的影响

表9 低氧联合敲除HSP90α对HepG2细胞脂质蓄积的影响Table 9 Effects of hypoxia combined with HSP90α knocked out on lipid accumulation of
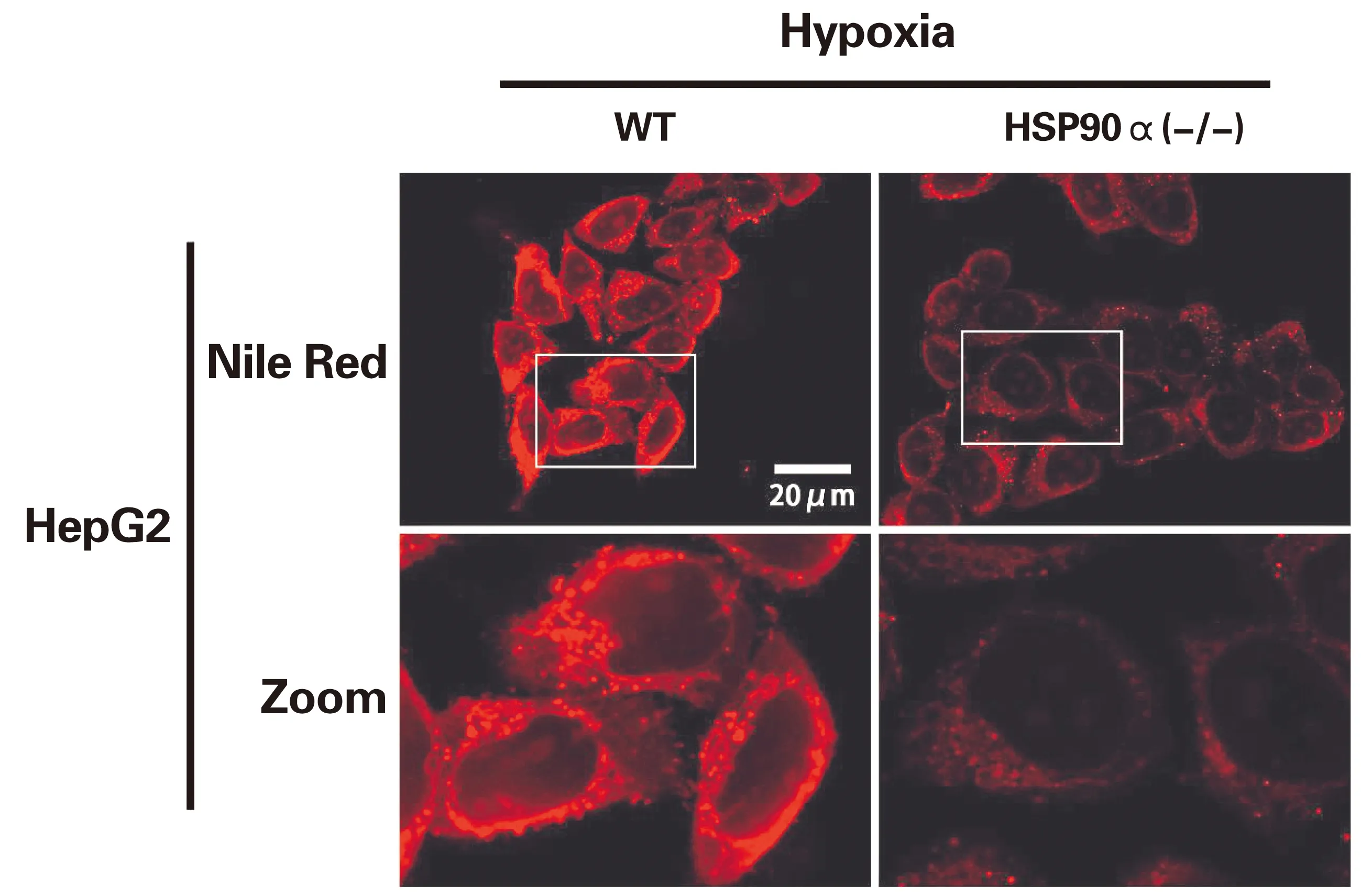
图6 低氧联合敲除HSP90α对HepG2细胞脂质蓄积的影响图
3 讨论
在高等真核生物中,按是否富含谷氨酰胺片段将HSP90分为α、β亚型,属不同基因编码,但其同源性达86%。HSP90单体由25 kDa的N端和55 kDa的C端通过一个连接区相连而成。HSP90的N端含有高度保守ATPase结构域,在该位点可发生ATP的结合和水解,从而使HSP90具有分子伴侣活性,并通过与共伴侣分子如CDC37、P23、AHA1、CHIP等的结合,帮助底物蛋白折叠和降解;C端是二聚体相互作用以及HSP90与免疫亲和素和p60Hop相结合的主要区域[13]。中间连接区是核定位信号和底物蛋白结合位点。N端与ATP结合后,HSP90便发生构象改变,影响HSP90与底物蛋白及辅分子伴侣之间的相互作用。
Hartl F U等[14]发现,在发生低氧应激时,机体可诱发热休克反应(Heat shock response,HSR),通过上调热休克因子1(Heat shock factor protein 1,HSF1)来激活HSP90、HSP70的分子伴侣功能,清除细胞内非正常结构蛋白质,抵抗细胞氧化损伤,从而增强细胞对低氧损伤的耐受性并提高存活率[15]。另外,低氧应激可诱导HSP90α的胞外分泌,并促进创伤的愈合[16]。多种HSP90的底物蛋白HIF-1α、HIF-2α、HIF-3α、PPARα、PPARβ、PPARγ、AMPKα、AMPKγ均为脂质代谢途径的中心调控分子[17-19]。
本研究的实验证据亦证实HSP90参与低氧诱导脂质蓄积,并对脂质代谢的重要酶类FASN存在调控作用。FASN被认为是正常生理条件下肝脏中的管家蛋白,调控肝脏甘油三酯合成。当碳水化合物丰富时,葡萄糖会在FASN的帮助下转化为脂肪酸,然后将多余的脂肪酸组装成甘油三酯并以脂滴的形式储存或以极低密度脂蛋白的形式分泌[20,21]。细胞脂质代谢和体内平衡由甾醇调节元件结合蛋白 (SREBPs) 控制,FASN为其下游转录激活靶标[22,23]。已知HSP90通过维持SREBP(Sterol Regulatory Element-binding Protein)及SCAP(SREBP Cleavage-activating Protein)蛋白稳定性而调控脂质代谢途径,HSP90抑制剂可通过上述途径抑制小鼠肝脏的脂质蓄积[24,25],低氧下是否存在类似机制有待进一步探索。
