自然光照下补光策略对Chlamydomonas sp.JSC4生物膜除污固碳的影响
2022-06-22程海翔
王 莎,张 华,程海翔
(1.常州工程职业技术学院 智能制造学院,江苏 常州 213164;2.福州大学机械工程及自动化学院,福建福州 350108;3.衢州职业技术学院 机电工程学院,浙江 衢州 324000;4.衢州学院 化学与材料工程学院,浙江 衢州 324000)
0 引言
能源短缺和环境污染长期制约着生态健康和经济社会发展。藻类作为自然界光合作用的主体,能合成油脂和碳水化合物,可吸收畜禽养殖废水等水体中的COD、氮、磷、重金属成分,在太阳能固定以及碳循环中起到非常重要的作用,是实现碳达峰碳中和目标的重要的生物质资源[1]。
相较于悬浮培养,生物膜方式的藻类养殖能提升微藻的去污能力、固碳力和光利用效率,同时也能节约能耗和水资源。但现有生物膜系统存在室外培养不可控因素多、适应性差的问题。首先,生物膜光传递效率容易受限,导致底层生物膜接收光照和养分不足,不利于生物量积累[2]。Xu研发的毛细管驱动光生物反应器,生物膜和培养基相对分离,超细涤纶纤维载体结构改善了营养物质的运输方式,降低了能耗。该系统采用人工照明和smBG11培养基,额外增加了能耗和成本,总光合效率也仅为3.3%~4.8%[3]。Ye的异养辅助光自养生物膜培养系统提升了营养物质的传输效率,透光能力比普通光生物反应器提高64%,但平板式系统占地面积大,额外添加碳、氮源增加了成本[4]。以上两项报道均是基于实验室环境,对自然光照下生物膜生长和代谢,光照、营养物质传输利用机制研究还未深入开展。此外,从环保和经济的角度看,利用自然光作为直接光源可降低培养成本,对系统的产业化应用具有重要的意义。但由于昼夜交替,以及纬度、季节、天气等原因,光能供给具有不确定性和不可连续性。以处于低纬度(30°N~30°S)的福建省为例,2010-2018年平均日照时数为1 625.4 h,冬季平均有效光照时数仅301.2 h,属于光辐射可利用但较贫乏区[5]。对大多数微藻而言,最佳光暗周期在12∶12~16∶8[6]。因此,依赖自然光可能会受到光能强度或光照时数不足的影响。
为探索室外自然光照时数不足条件下微藻生物膜的生长情况,改善生物膜光和营养物质传输效率,设计封闭式旋转盘生物膜系统,研究不同培养体积和补光时间对生物膜积累、代谢产物、营养物去除以及固碳率的影响。试图通过优化策略提高生物膜产率、生物燃料生产和废水净化效果,降低能耗和成本,探讨室外环境中大规模获取微藻生物质的可行性。
1 材料与方法
1.1 藻种与培养基
藻种:衣藻(Chlamydomonas sp.JSC4),来自于中国台湾中山大学海洋生物研究所藻种库。育种方法及初始培养条件同文献[7]。
培养基:试验采用预处理过的厌氧出水的养殖废水作为培养基。养殖废水由福州市上街镇溪源宫养猪场提供,经浸泡、纱布过滤(主要是去除固体悬浮物)并用蒸馏水稀释后备用。由于初始pH值较低,试验前采用1 mol/L NaOH溶液将pH调至7.5。为了保证废水成分一致,同一批次试验用水样在-20℃速冻保存。预处理后污水的基本理化性质如表1所示。

表1 预处理后的养猪场废水理化性质Table 1 Compositions of swine wastewater
1.2 试剂与仪器
试剂:所用试剂均为分析纯,西陇化工股份有限公司生产。
仪器设备:UVmini-1240紫外可见分光光度计(岛津制作所);5B-3B(A)型多参数水质分析仪(连华科技);FD-1000型冷冻干燥机(上海爱朗);Li-190SA型日射强度计 (美国Li-COR);MOT500-CO2-IR型二氧化碳检测器(美国德康);Minibeadbeater-16破碎仪(美国Biospec);Vario EL III型元素分析仪(德国ELEMENTAR);TGL-16gR高速冷冻离心机(上海安亭);6890N-5975B气相色谱-质谱仪(美国Agilent)等。
1.3 生物膜系统
微藻生物膜系统的架构如图1所示。该系统由6组培养单元、CO2反应器、驱动模块、光源等组成。每个培养单元包括储液槽、旋转盘及复合载体等。储液槽(0.5 m×0.05 m×0.5 m)选用透光性好的亚克力板材料(PMMA),内部储存培养液。旋转盘(半径0.25 m)垂直放置,转盘骨架镂空设计,重量轻。复合载体上接种浓藻液,载体为廉价的、亲水性好的棉麻帆布,布置在转盘骨架外。旋转盘下部浸入培养液中,空间向上延伸,提高了生物膜实际生长面积,旋转过程中微藻均匀地接受光照。CO2(5%,10 mL/min)从储液槽顶部通入,为增加CO2吸收,保持载体湿润,系统要保证密封性。驱动模块由电机、减速和传动机构等构成。光源有自然光源和可调节的LED光源。生物膜平面和光源平面垂直布置,可提高自然光受光率,且对高光强有较好的稀释作用,控制培养单元温度上升过快。系统运行时,驱动模块带动旋转盘以15 r/min匀速转动。由于液体表面张力,营养液沿帆布经纬线被源源不断输送到载体上,旋转至一定的高度后,载体上的营养液在重力作用下逐渐扩散到未被浸润的区域,微藻逐渐吸附在载体表面形成生物膜。
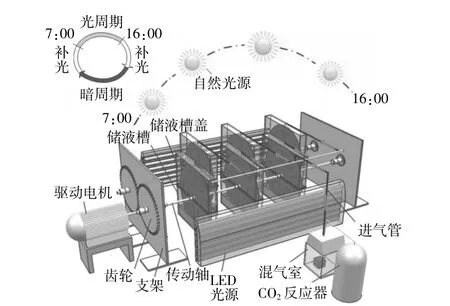
图1 封闭式旋转盘生物膜反应器架构示意图Fig.1 Schematic diagram of microalgae biofilm reactor
转盘浸没比μ和光稀释率Rl可分别按下面的公式计算。
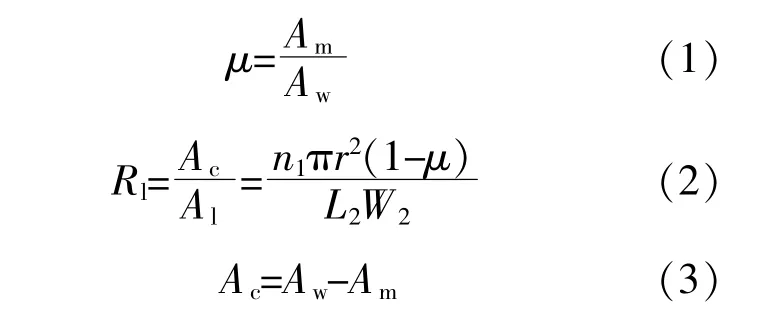
式中:Am为浸没于液体中的载体面积;Aw为转盘面积;Ac为旋转盘曝光面积;Al为储液槽占地面积;n1为每个培养单元载体个数;r为旋转盘半径;L2为储液槽占地面长度;W2为储液槽占地面宽度。
1.4 试验方案
试验基地位于福建省福州地区大学城(119.28°E,26.08°N),时间为2020年12月。试验分两步开展。
步骤一:生物膜系统的基础参数优化(A组),确定最佳培养液体积。为了减少不必要因素的影响,试验在室内进行。试验基础条件:光照为LED光,有效光照为100~150μmol/(m2·s),光暗周期为16∶8,温度为(26±2)℃,初始培养液pH为7.5±0.5,接种量为15 g/m2(干重),培养时间8 d。每隔12 h(8:00与20:00)加入40~80 mL的蒸馏水至对应的刻度线处,以补偿试验过程中培养液损耗。
步骤二:自然光照条件下的补光策略研究(B组)。首先,连续监测每天(6:00-17:00)室外自然
图2为不同培养体积时微藻生物膜的生长及氮磷吸收情况。光照强度,评价有效光照强度及光强分布。然后,根据A组试验得到的最佳培养体积1.5 L,设计3种补光策略(补光时间0,7 h和12 h)的对比试验,补光方式设计见图1。由于冬季环境气温较低,试验在专门的透光性好的阳光房内进行,以保证温度环境为26~30℃。初始培养液pH、接种量、培养天数、培养液补偿等基础条件与A组试验相同。每天监测TN浓度的变化,在TN消耗近90%时收获微藻。试验设计见表2,各组试验中每个参数做两个平行样。

图2 不同培养体积时微藻生物膜的生长及氮磷吸收Fig.2 Biofilm productivity and adhesion、TN/TP removal under different volumes

表2 培养液体积与补光时间试验设计Table 2 Medium volume and illumination time experiment
1.5 测量与计算方法
1.5.1 微藻生物质量、产油量
微藻的收获方法及生物质干重、产油量的测量参照文献[7]的方法进行。
1.5.2 藻体中蛋白质、碳水化合物含量和固碳率
测定微藻蛋白质、碳水化合物、固碳率时,先将微藻生物质冷冻干燥,获得藻粉。藻粉蛋白质、碳水化合物含量采用文献[7]的方法测定。藻粉碳含量采用元素分析仪测量。固碳率的计算式为

式中:CFR为固碳率;Cc为干细胞碳含量;MCO2为CO2的分子质量;MC为碳的分子质量;ABP为微藻生物质产率。
1.5.3废水培养基中TN,TP的测定
TN,TP的测定分别按照《水质总氮的测定-碱性过硫酸钾消解紫外分光光度法》(GB 11894-1989)、《水质总磷的测定-钼酸铵分光光度法》(GB 11893-1989)进行。
1.5.4 有效光照强度、光强分布与光合效率
有效光照强度是指到达生物膜表面附近的光照强度,测量时用光强计在生物膜表面上2 cm处沿旋转盘一周4个位置分别读取数据,取平均值。为表征光强的波动变化情况,用变异系数Cv衡量,其计算式为

式中:Eb为生物膜热量;Ec为培养基有机碳量;Es为培养单元接受太阳光总能量;Ea为接受LED光源总能量;Is,Ia分别为波长介于400~700 nm的太阳光强辐照度、LED光源光强辐照度;Esl,Eal分别为太阳光与LED光单位辐照度所含的能量;Asl,Aal分别为两种光照下的生物膜受光面积;t1,t2为光照时间;ηv为400~700 nm波长的光占总太阳光的比例;κ为COD热值;NCOD为废水COD浓度;V为培养基体积;Wnet为生物质总干重;LC为生物膜油脂含量;为简化起见,假设生物质只有油脂和碳水化合物两部分组成,则Elipid为油脂热值;Ecarbon为碳水化合物热值。
2 结果与分析
2.1 不同培养液体积下微藻生物膜的生长及废水氮磷去除

由图2(a)可知,当培养液体积从1 L增加至2.5 L时,生物膜产率先上升后下降,培养液为1.5 L时获得最大的生物膜产率为(50.48±0.28)g/(m2·d)。生物膜固定率从(89.65±1.77)%降至(79.38±1.66)%。图2(b)显示TN,TP的去除率均先增加和减少,培养体积为1.5 L时达到最大的TN和TP去除率/量,分别为(93.01±0.57)%,(7.71±0.03)g/(m2·d)和(98.56±0.29)%,(1.52±0.01)g/(m2·d)。
2.2 不同培养液体积下微藻生物膜组分合成及固碳率
图3为不同培养体积时微藻生物膜各组分含量及CO2固定率。

图3 不同培养体积微藻生物膜组分含量及CO2固定率Fig.3 Biomass composition content and CO2 fixation under different volumes
从图3(a)可知,随着培养液体积的增加,蛋白质含量从(29.8±2.0)%增加到(42.63±2.0)%,碳水化合物和油脂分别从(51.68±4.60)%,(8.78±0.03)%减少到(38±5.09)%,(5.09±0.86)%,且相同培养体积下碳水化合物含量均要高于油脂含量。在培养液体积为1.5 L时达到各组成成分的最大产率,分别为(16.41±0.09),(23.38±1.83),(4.27±0.08)g/(m2·d)。图3(b)显示,CO2固定率随培养液体积增加呈现先上升后下降的趋势,1.5 L时达到了最大的固定率91.31 g/(m2·d)。
2.3 不同补光时间条件下微藻生物膜生长及废水氮磷去除
图4为不同补光时长下微藻生物膜生长、氮磷吸收及pH变化。
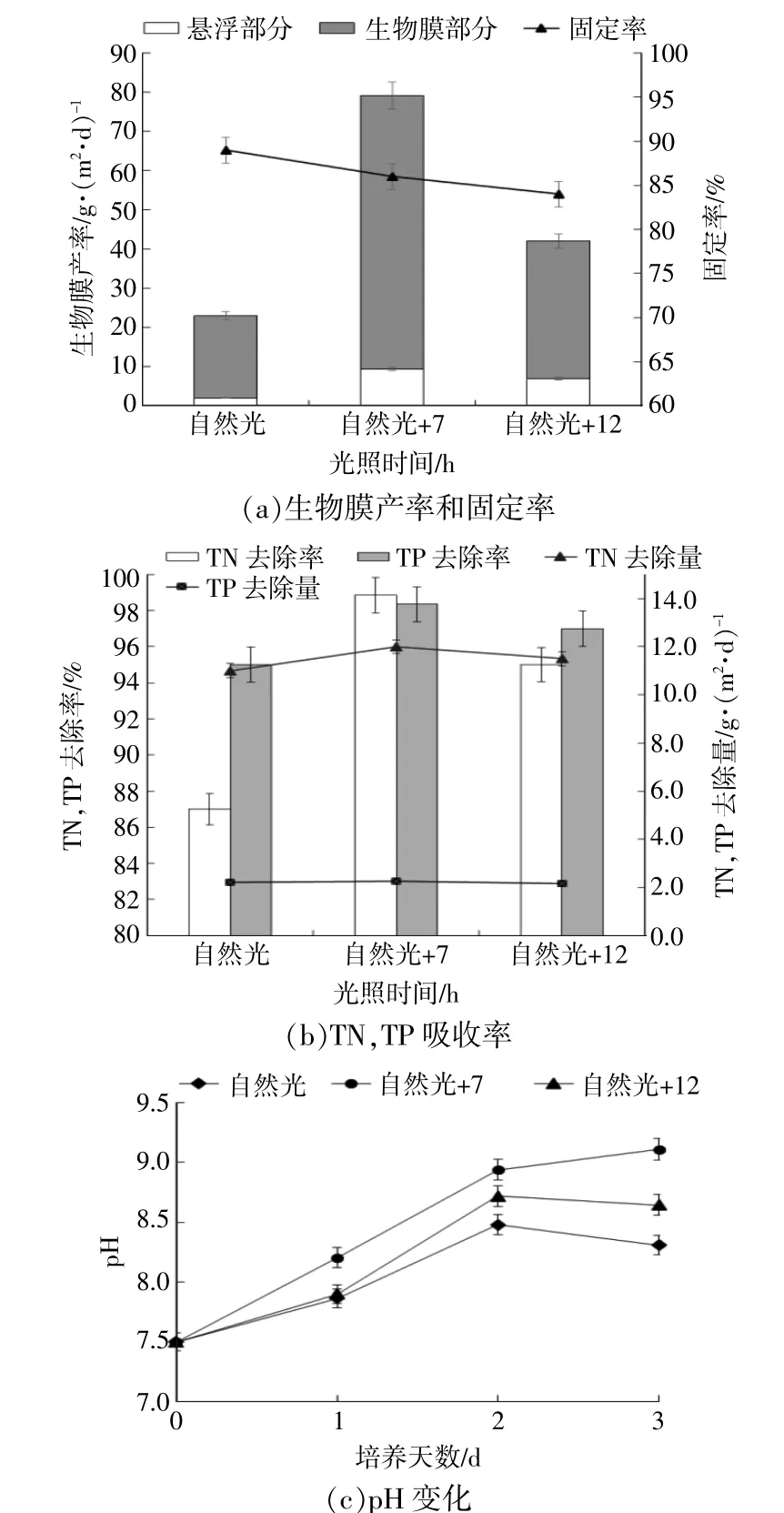
图4 不同补光时长微藻生物膜生长、氮磷吸收及pH变化Fig.4 Biofilm productivity and adhesion、TN/TP removal and pH tendency under different illumination
由图4(b)可知,步骤二培养到第3天时,不同补光时间组废水TN,TP去除率均已超过90%,此时采收生物膜。生物膜生长情况如图4(a),随着补光时间的增加,悬浮部分和生物膜部分的生物质产率均呈现先增大后减小的趋势。在补光时长为7 h(光暗周期为16∶8)时,生物膜部分和悬浮部分的生物质产率均达到最大值,分别为(69.77±1.17),(9.4±0.20)g/(m2·d)。随着补光时间的延长,TN,TP去除率/量也呈现先增大后减少的趋势,且补光7 h达到最大的去除率/量,分别为(98.85±0.80)%,(11.86±0.10)g/(m2·d)和(98.35±0.14)%,(2.17±0.01)g/(m2·d)。由图4(c)可以看出,随培养天数增加,不同补光策略的培养液pH上升速率不同,即补光7 h>补光12 h>补光0 h。补光0,12 h在第3天pH开始下降。
2.4 不同补光时间条件下微藻生物膜组分合成及固碳率
图5为不同补光时长下微藻生物膜各组分含量及CO2固定率。

图5 不同补光时长微藻生物膜组分含量及CO2固定率Fig.5 Biomass composition content and CO2 fixation under different illumination
由图5(a)可知,蛋白含量在补光7 h时达到最高,为(42.81±2)%;碳水化合物含量随补光时间的增加,从(34.43±0.95)%增加到(46.3±3.68)%,且在同一补光时间下,碳水化合物的含量都要高于油脂;脂质的含量在补光为0 h的条件下达到最大值,为(15.17±0.60)%。且蛋白质产率、碳水化合物产率及油脂产率均在补光7 h时达到最大,分别为(29.87±0.50),(27.48±1.24),(3.46±0.14)g/(m2·d)。由图5(b)可知,随着补光时间的增加,CO2的固定率先增大后减小,在补光7 h时CO2固定率均达到最大值(130.12±2.19)g/(m2·d)。
2.5 自然光强分布、有效光照时数及补光策略下的光合效率
图6为自然光强分布情况、补光策略下的光合效率。

图6 自然光强分布情况、补光策略下的光合效率Fig.6 Distribution of sunlight and biofilm photosynthetic efficiency under different illumination
图6(a)的阴影部分表示福州地区冬季12月白天(7:00-16:00)任意时刻光照强度波动范围。可以看出,7:00以前及16:00之后,光照强度极低,且变异系数较大[式(5)],说明光强极不稳定。最高光强主要集中在11:00-13:00,最高值可达1 098.2μmol/(m2·s),最低值为883.5μmol/(m2·s)。综合来看,有效光照在7:00-16:00。图6(b)显示补光试验对生物膜光合效率的影响,由式(6)~(8)计算得,补光0 h时光合效率最低,补光12 h次之,补光7 h最高,可达11.8%。
3 讨论
3.1 培养体积对生物膜的生长、氮磷吸收、组分合成及固碳的影响
生物膜细胞密度高,光和营养物质能够更有效地穿透生物膜,因此参与光合作用的细胞个数多。Huang发现在一定光照下微藻生物膜内能接受有效光照的细胞占比超过40%,而对应悬浮培养仅为2.5%[9]。氮和磷作为生物膜生长重要的营养素,其吸收速率受到细胞机能、TN和TP的影响[10]。本研究中,总体上看,废水TN,TP的去除率与微藻生物质的产率呈正相关。3种培养液中氮含量是不断增加的。由式(1)可知,培养液为1 L时旋转盘浸没面积比最小,营养物质传递速率较慢,所以生物膜产率最低,但生物膜固定率最高。由于流体粘性,粘附在旋转盘上的生物膜会受到一个沿旋转方向相反的粘附力,即剪切作用,其强弱与旋转盘的浸没比成正比,随着培养体积增加,生物膜固定率持续减小,这是因为载体浸没比越大,转盘与培养基之间的剪切作用也越大,使藻体落入培养基,这也是2.0 L时比1.5 L时生物膜产率低、悬浮部分产率高的主要原因。
合成产物方面,氮与蛋白质合成紧密相关[11]。本研究中,随着培养液体积的增加,蛋白质含量呈现上升的趋势。微藻光合碳的流向随环境以及培养条件的变化而改变,其细胞组成往往有所不同[12]。在氮消耗殆尽的条件下,细胞调整碳、能量和还原剂的代谢途径,转移到合成不含氮的大分子(如脂质、碳水化合物)上。培养体积越少,含氮量越少,油脂和碳水化合物含量越高。但是碳水化合物和油脂的合成之间存在着竞争。在环境压力条件下,首先合成淀粉作为能量存储形式,然后建立长期存储机制,即合成油脂。由式(4)可知,固碳率与微藻细胞碳含量、生物膜产率成正比,培养液为1.5 L时达到了最高的生物膜产率、油脂产率和碳水化合物产率,即该培养体积下固碳率最高。由此可以得出,高的生物质产率有利于CO2固定和生物能源生产。
3.2 补光时间对生物膜的生长、氮磷吸收、组分合成及固碳的影响
在微藻废水处理中,光周期是重要的可控参数,对生物膜产率等有显著影响[12]。若光照时长不足,光合作用将无法有效地进行,出现微藻黄化现象,影响初始生长速率[6]。补光0 h(光周期为9∶15),生物质产率最低。较短的光照时长相当于一个压力信号,会促使细胞停止分裂去转换过量的葡萄糖来储存脂质[4]。这是因为在环境压力(如氮抑制或光限制)下,微藻中的碳将会被分配到能量丰富的化合物中,因此引起蛋白含量的降低和能量丰富产物含量的提高。继续增加补光时间(补光7 h,光周期为16∶8)时,生物膜生长及代谢明显改善,这也印证了文献中关于理想光周期的报道[6]。当光周期达到21∶3(补光12 h)时,生物质产率出现了下降,这是因为过多的光照会产生活性氧基并引起光抑制现象[13]。
微藻生物膜对氮和磷的吸收也受到光强、pH等环境因素的影响。Sukacova发现,随着光照周期增加,磷去除率和生物膜产量持续增加。24 h自然光照下(光周期为12∶12)生物膜对磷的去除率为36%~41%,而连续人工光照下(24∶0)磷的去除率高达(97±1)%[14]。另外,pH的变化一方面能反映生物膜生长快慢,也能间接表明生物膜对废水成分的吸收情况。以磷的去除为例,研究发现,废水环境中磷通常以沉淀和细胞吸附等方式被吸收,磷与Ca,Mg等金属阳离子形成难溶的磷酸盐而沉淀,这需在较高pH(8.5~9.5)条件下进行。同时光周期内磷的去除率高于暗周期,因为在暗周期时仅有41%的磷酸盐会被细胞吸收,约58%的磷酸盐会再次溶解。本研究中补光7 h时生物膜生长率最高,pH上升较快,且所用废水Ca,Mg含量较高,有利于污水中磷的沉淀和吸收。相应的,补光12 h的磷吸收率次之,补光0 h时最低。总的来说,磷的去除率/量与pH升高速率正相关,合适的光周期能促进生物膜的生长和代谢。
3.3 自然光照下微藻光合效率的提高及运用生物膜系统除污固碳的可行性
研究者在培养耐高温富油绿藻Desmodesmus sp.F51生物膜时发现,随着生物膜厚度增加,须提高光照才能满足生物膜的生长,且生物膜透光性越好,微藻生长越快,自养能力越强,脂质等积聚越多[7]。Liu研究发现,在700μmol/(m2·s)高光强度且光稀释率为10时,栅藻生物膜产率可提高至120 g/(m2·d),光合效率高达18%,室外培养时光合效率在10.8%~17.3%[12]。这表明生物膜具有较高的光耐受性和利用效率。本研究显示,在最佳光暗周期比为16∶8和培养液体积为1.5 L时,自然光加LED补光7 h比纯LED光照的生物膜产率、生物质各组分总产率、固碳率分别提高38.2%,38.1%,44.7%。补光策略论证了理想光周期条件下生物膜对室外高光强的适应性,一定程度的高光强能促进微藻光合作用和生物能源生产。
封闭式旋转盘生物膜系统在垂直空间上扩大了微藻生物膜生长面积,一定程度上稀释了太阳光照(光稀释率Rl高达13.5)。尽管中午太阳光强值超过藻的光饱和点,但经稀释后到达生物膜表面的光强在211.06~262.35μmol/(m2·s),适合微藻生长,这也间接地提高了生物膜的光饱和点和光利用效率。CO2等碳源能促进微藻生物量增加,且微藻对CO2的固定效果更好[15]。由式(1)~(3)可得该生物膜系统载体获得较大曝光面积,CO2流通空间与生物膜接触区域也越大,固碳量、光合效率较高。同时该系统充分利用自然光照和废水资源,选用廉价的生物膜载体,降低了培养成本和能耗。
室外环境不稳定因素多,例如光照时长、光照强度和温度等难以控制。完全依靠自然光照实现12∶12~16∶8的理想光周期不太现实,尤其在年光辐射量不足的地区。人工补光又增加了额外的能耗投入。因此,产业应用时要具备系统思维,加大资源融合和技术集成力度。可以预见,碳达峰、碳中和背景下微藻培养与减排降耗、太阳能、风能等资源和学科交叉技术耦合发展是未来努力的方向。
4 结论
①室外环境下微藻生物膜系统可能会受到光照强度或时长不足的影响。本文设计了一款改进的封闭式旋转盘光生物反应器,可有效提高营养物质传输效率和对自然光环境的适应性。
②在培养液体积为1.5 L,自然光照加补光7 h情况下,可获得最大的生物膜产率、固碳率和碳水化合物产率,TN,TP去除率达到98%,光合作用效率高达11.80%。
③补光策略能初步改善室外环境光照不足,促进生物膜生长、氮磷成分吸收、生物燃料生产以及CO2固定,达到绿色培养微藻和除污固碳的目的。
