高强度间歇训练和中等强度持续训练对高脂膳食雌性小鼠肝脏巨噬细胞浸润的影响
2022-06-22王蕊何玉秀
王蕊,何玉秀
(1.河南师范大学 体育学院,河南 新乡 453007;2.河北师范大学 体育学院,石家庄 050024)
肥胖是一个重要的公共卫生问题,与人们饮食类型的改变和缺乏体育锻炼有关[1].2006至2015年4次《中国健康与营养调查》结果显示,成人总体上超重率男性高于女性,肥胖率则是女性高于男性[2].女性作为母亲的社会角色,其健康状况关系到家庭和谐幸福及社会整体的健康水平[3].从中国居民健康代际传递作用的程度看,女性也高于男性[4].母体高脂膳食可通过改变代谢表型影响子代[5],也可通过子宫内炎症影响子代肝脏脂肪代谢[6],增加子代脂肪肝病的患病风险,因此解决女性健康问题有利于提高我国的全民健康水平.
能量过剩会使过量脂肪异位沉积于肝脏等非脂肪组织,从而导致肝脏脂肪变性.脂肪肝通常被认为是一种良性病变,但可发展为脂肪性肝炎.这是肝硬化等严重肝脏疾病的先兆[7].肝脏内除肝细胞外还含有大量的巨噬细胞,据估计健康的啮齿小鼠体内每100个肝细胞中就有20~40个巨噬细胞[8],因此,巨噬细胞在肝脏炎症转变的过程中发挥着关键作用[9].
体育锻炼能有效改善肝脏脂肪变性,从而预防和改善脂肪肝的发展[10-11],但家庭照料会明显影响女性参与运动的行为[12].高强度间歇训练(high intensity interval training,HIIT)指在“短时间高强度训练之间穿插低强度训练或休息”,能提高机体心血管适能、增加胰岛素敏感性和降体脂[13-15],且在节省时间和某些效果方面优于传统的中等强度持续训练(moderate intensity continuous training,MICT)[16-18].因此,本文观测小鼠肝脏组织形态学和炎症状态的变化,比较HIIT和MICT两种运动方式对肝脏巨噬细胞影响的差异,为脂肪肝患者运动处方的制订提供可参考的依据.
1 材料与方法
1.1 动物与分组
采用3周龄雌性C57BL/6J小鼠,体质量(9.62±1.04)g,购自北京维通利华公司.自然光照,自由饮水,饲养温度(26±2)℃,湿度45%~55%.根据饮食方式随机分为高脂膳食组(90只)和普通膳食组(CON,10只),膳食饲料脂肪供能比,普通饲料约14%,高脂饲料约38%.
15周后,从高脂膳食组筛选出体质量超过CON组均值10%的小鼠30只,随机分为高脂对照组(HFD),中等强度持续训练组(MICT)和高强度间歇训练组(HIIT),每组10只,继续高脂喂养.但MICT和HIIT组小鼠进行运动干预,5次/周,共12周.
1.2 运动干预方案
运动干预前,每只小鼠均进行3 d适应性运动.随后每2周进行一次跑台速度测试,确定跑速后推测最大摄氧量(VO2peak)[19].初始速度为7 m/min,上坡25°,每2 min为一级,以每级2 m的速度递增,直到小鼠在驱赶下不能完成测试为止.以测试速度的前一级速度作为HIIT组高强度运动速度(约90%~100%VO2peak),以此速度对应的60%VO2peak计算中等强度运动速度,详见表1.HFD:无运动干预,安静对照,自由活动.MICT:运动强度约60%VO2peak,每次持续45 min,5次/周.HIIT:1 min高强(90%~100%VO2peak)+2 min低强度(60%VO2peak),每次运动距离与MICT相同,5次/周.

表1 小鼠12周内HIIT和MICT组小鼠运动速度
1.3 样本采集及测试指标
MICT和HIIT组小鼠最后一次运动48 h后,与HFD和CON组一起取材.取材前禁食12 h,称体质量、麻醉、测体长,内眦取血.用DEPC处理水注入左心室进行灌流,待肝脏变苍白后,取肝脏尾状叶做形态学检测,其他部位液氮冷冻后-80 ℃保存待用.
1)形态学观察:肝脏尾状叶部分用石蜡包埋做HE染色,部分冰冻切片做油红O染色.
2)生化指标测定:称取适量肝组织匀浆后,按照试剂盒说明书(南京建成)进行甘油三酯(triglyceride,TG),总胆固醇(total cholesterol,TC),谷丙转氨酶(alanine aminotransferase,ALT),谷草转氨酶(aspartate aminotransferase,AST)活力检测,采用BCA蛋白质量浓度测试小鼠肝脏蛋白质量浓度.
3)实时荧光定量PCR和蛋白表达:在NCBI数据库进行目的基因全序列查找目的基因序列或基因ID,通过Primer Bank查找相应引物序列,引物信息如下表2.Trizol提取肝组织总RNA,按照TaKaRa-RNA定量和反转录试剂盒说明书进行操作,在LightCycler®96实时荧光定量PCR仪上,按程序进行扩增和荧光定量检测.数据处理以β-actin为内参,采用2-ΔΔCT方法分析目的基因的相对表达量.
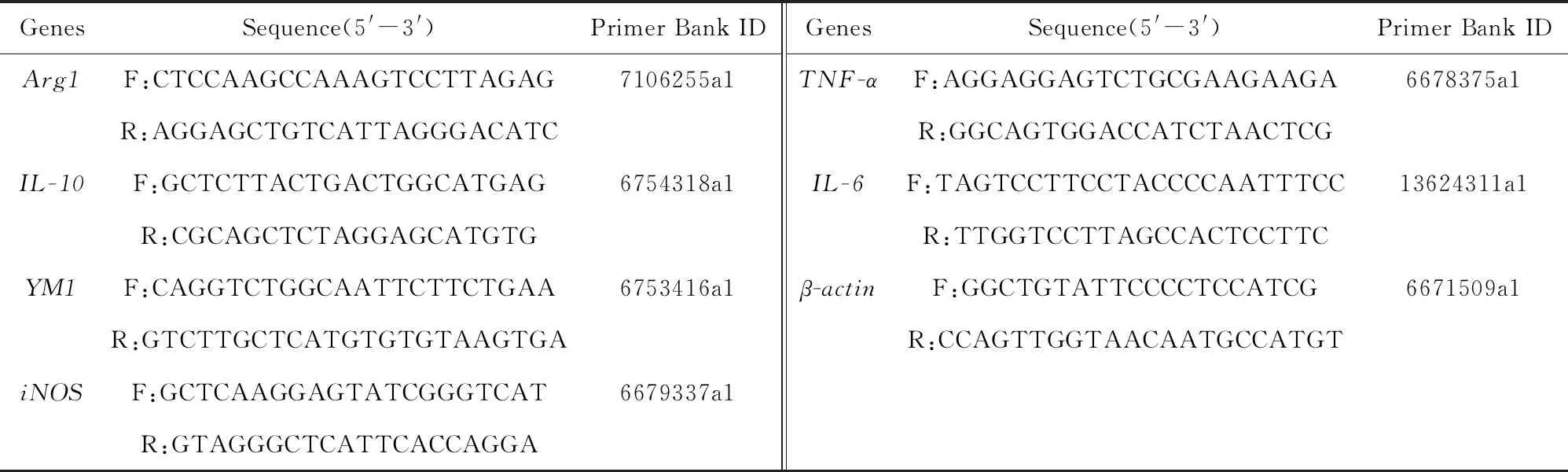
表2 基因引物序列
取肝组织约50 mg,液氮研磨,放入预先加好RIPA裂解液和蛋白酶抑制剂的EP管中,4 ℃冰箱静置120 min,4 ℃低温离心机12 000 r/min 10 min取上清.用BCA试剂盒测定样品蛋白浓度,并根据每样1.5 g/L稀释分装,加上样缓冲液制成样品,放沸水煮5 min后-20 ℃保存.SDS-PAGE凝胶电泳(先80 V,40 min,再120 V,1 h),采用PVDF转膜(300 mA,1.5 h),封闭(5%脱脂奶粉液,1 h),一抗孵育(摇床20 min后4 ℃冰箱过夜).次日,洗膜,二抗孵育(室温2 h),再次洗膜,显影(ECL化学发光工作液),成像(FUSION FX系统),用Image-J软件进行分析,计算目的蛋白相对表达量.
实验用到的一抗抗体为TNF-α(tumor necrosis factor-α)(Abcam ab6671,25~35 ku,1∶2 000),IL-10(Affinity DF6894,20~35 ku,1∶2 000),β-actin(Bioworld bs6007m,40~45 ku,1∶5 000).
1.4 统计学分析
采用SPSS统计软件进行分析.实验数据用均值±标准差表示,普通膳食组(CON)和高脂膳食组(HFD)采用独立样本T检验;高脂膳食组(HFD),MICT,HIIT采用单因素方差分析后进行组间比较.
2 结 果
2.1 体质量变化
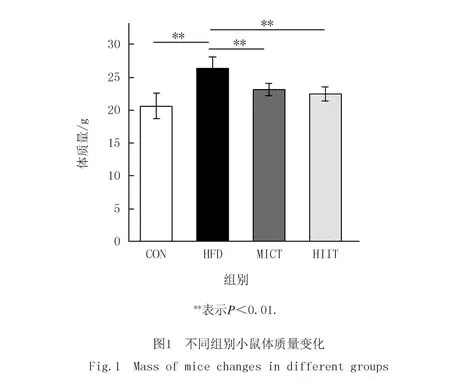
经过15周膳食和12周运动干预后,HFD组小鼠体质量明显高于CON组,MICT和HIIT运动干预均降低小鼠体质量,但两组间无显著性差异,见图1.
2.2 肝脏内脂质含量变化
肝组织内脂质含量指单位质量蛋白质含有脂质的物质的量(表3).与CON组相比,HFD组小鼠肝脏TG含量明显增加(P<0.01).与HFD组相比,MICT和HIIT运动干预均降低小鼠肝组织TG含量,但只有HIIT组有统计学意义(P<0.05).肝组织TC含量在各组间无显著性差异.
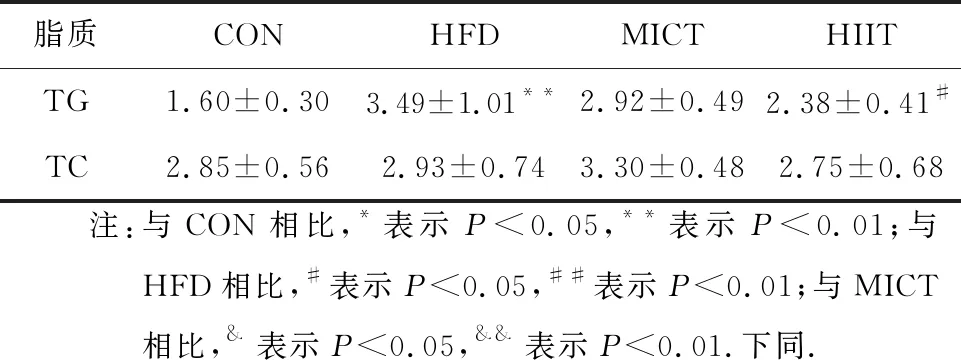
表3 肝脏组织脂质含量(n=8)
肝组织形态学(20×10)观察,HE染色显示:CON组肝细胞核呈蓝色,大而圆,肝小叶形态完整;HFD组肝组织内有空泡,细胞呈气球样变,提示肝细胞脂肪变性;两个运动组肝组织内空泡减少,HIIT组比MICT组明显.油红O染色显示:肝组织内红色脂滴,HFD组明显多于CON组,MICT和HIIT运动均能减少肝内脂滴,HIIT组优于MICT组.
2.3 肝损伤指标
肝脏内ALT与AST含量丰富,是参与糖和蛋白质代谢的必需酶,可作为诊断肝组织损伤及程度的重要指标.与CON组相比,HFD组小鼠肝脏组织ALT,AST活力明显增加(P<0.01),提示肝组织有损伤.与HFD组相比,MICT组和HIIT组小鼠因运动干预肝组织内ALT,AST活力降低,且HIIT优于MICT,见表4.

表4 肝脏组织酶活力(n=8)
2.4 肝组织巨噬细胞表型变化
肝脏巨噬细胞通常认为有M1和M2表型,M1型发挥促炎作用,M2型具有抗炎修复作用,两者在功能、基因表达谱和代谢方面有区别.M1常用的标记物为TNF-α,iNOS(inducible nitric oxide synthase)和IL-6(interleukin-6),M2的标记物为Ym1(chitinase 3-like 3),Arg1(Arginase1)和IL-10(Interleukin-10).由表5可知,与CON组相比,HFD组小鼠肝组织内M1巨噬细胞相关基因(IL-6,INOS,TNF-α)相对表达量非常显著增加(P<0.01),M2巨噬细胞相关基因(Arg1,YM1,IL-10)相对表达量下降非常显著(P<0.01).高脂膳食小鼠结合HIIT和MICT运动干预后,肝组织M1巨噬细胞相关基因(IL-6,INOS,TNF-α)相对表达量显著下降,但只有TNF-α表达量在两组间有显著性差异(P<0.05);M2巨噬细胞相关基因(Arg1,YM1,IL-10)表达明显增高,HIIT组优于MICT组.以上结果提示:HIIT和MICT使高脂膳食小鼠肝组织巨噬细胞M1表型减少,M2表型增加,HIIT效果更好.
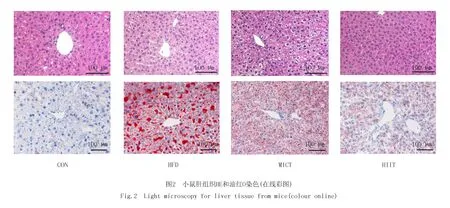
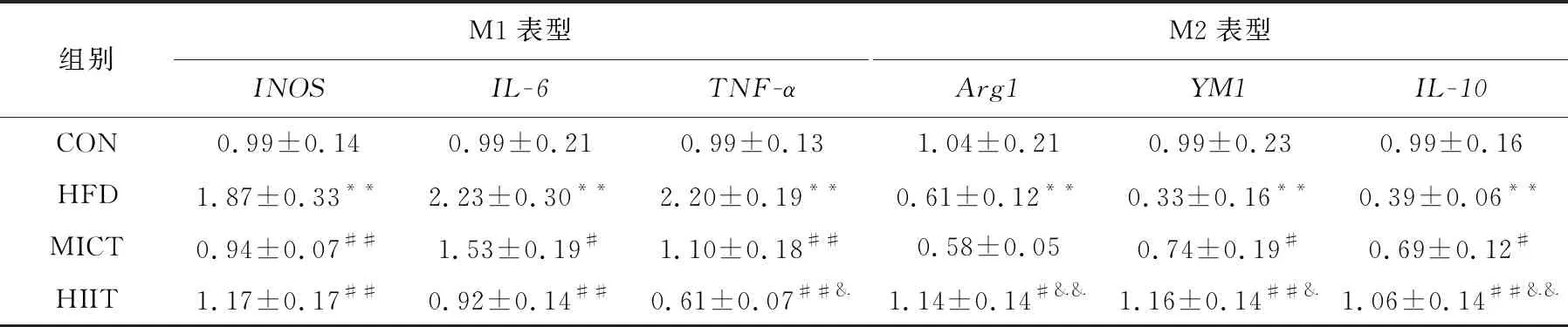
表5 巨噬细胞不同表型基因表达变化
2.5 肝组织炎症TNF-α和IL-10蛋白表达的变化
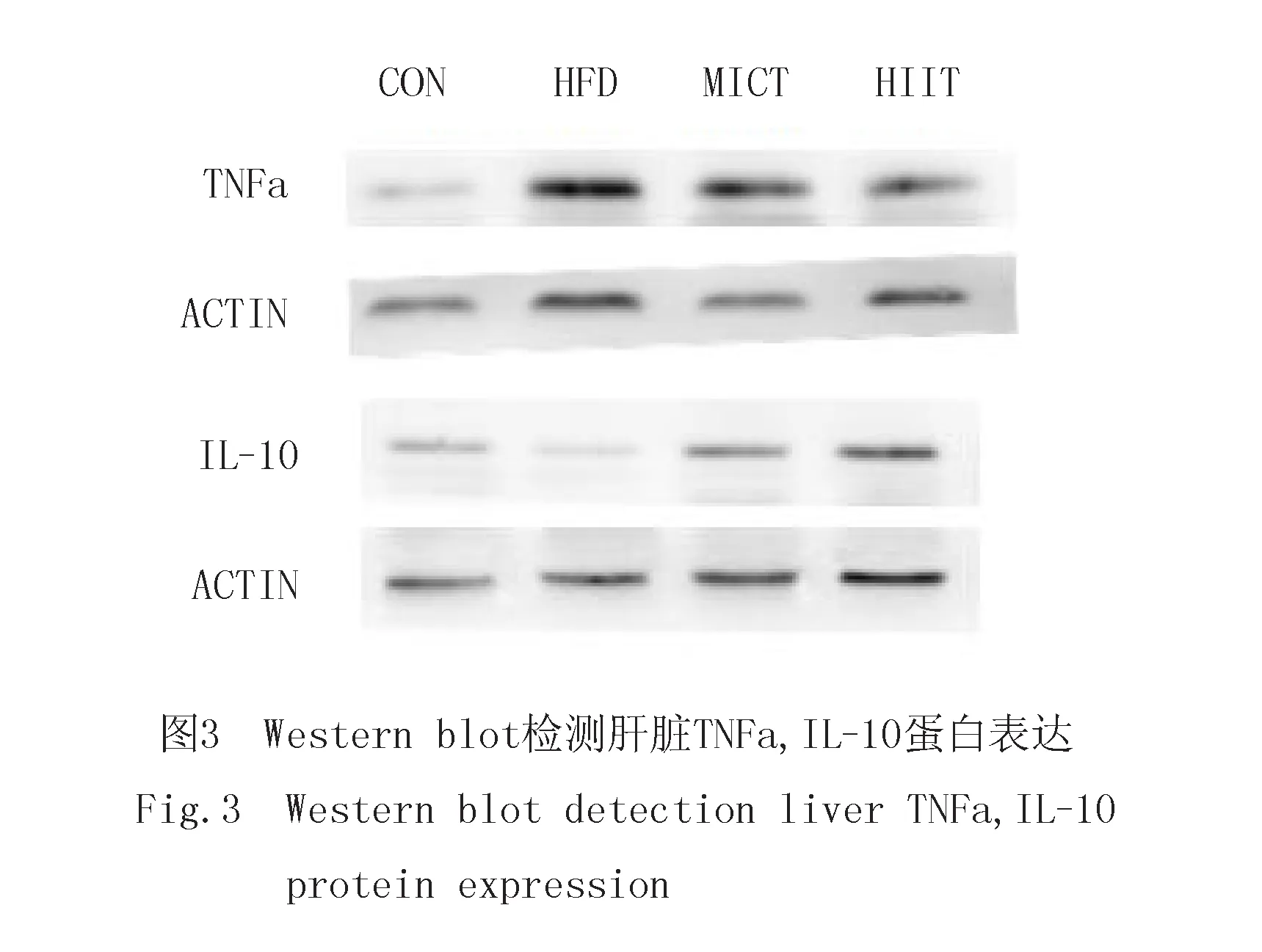
与CON组相比,HFD组小鼠肝组织内TNF-α蛋白表达水平显著增高(P<0.01),IL-10蛋白相对表达水平显著下降(P<0.01).与HFD组相比,高脂膳食小鼠结合HIIT和MICT运动干预后肝组织TNF-α蛋白表达水平显著下降,HIIT组优于MICT组(P<0.05);肝组织IL-10蛋白表达水平在MICT组具有显著上升(P<0.05),在HIIT组具有非常显著水平(P<0.01),但MICT和HIIT组无显著性差异,见表6和图3.

表6 肝脏TNF-α,IL-10蛋白表达变化
3 讨 论
长期高脂膳食促使体内脂肪含量增加,其不仅储存在脂肪细胞内[20],也可沉积于非脂肪细胞.肝脏是脂质代谢的重要脏器,肝细胞内过量脂肪堆积会导致脂肪变性和肝组织炎症状态.钟立等[21]认为C57BL/6J小鼠在42%的高脂膳食喂养下,4月后开始出现肝细胞气球样变和肝小叶内炎症状态,8月后进入明确的非酒精脂肪肝炎阶段.本研究对照组雌性小鼠为单纯高脂膳食喂养,27周后体质量增加,肝内TG聚积,肝组织切面脂滴量增加,肝细胞发生脂肪变性,同时肝组织损伤标志物ALT与AST上升.
有氧运动即使在未改变体质量的情况下也能减少肝内脂质含量[22],但运动量和强度对肝脏脂质的最佳益处缺乏共识.KEATING等[23]将超重/肥胖成年人随机分为3组进行运动干预8周,即中低强度高运动量组(50%VO2peak,60 min,4 d/周)、高强度低运动量组(70%VO2peak,45 min,3 d/周)、中低强度低运动量组(50%VO2peak,45 min,3 d/周),结果显示3组运动均减少肝脏脂肪,但有氧运动的量和强度对肝内脂肪减少的效果没有差异.而NATH[24]认为6个月的中等强度(3.6METs)比低强度(2.1METs)运动,更能改善非酒精性脂肪肝病(Non-alcohol Fatty Liver Disease,NAFLD)患者肝脏脂肪变性.WINN等[25]将18名肥胖成年人随机分为HIIT组(4 min,80 %VO2peak+3 min,50%VO2peak)和MICT组(50%VO2peak,60 min),两组运动中能量消耗相同,4周干预后HIIT和MICT均减少肝内脂质,两者无显著性差异.CHO[26]用高脂饲料喂养C57BL/6小鼠8周后,再结合8周的MICT(45 min,10 m/min)或HIIT(12组(1 min,17 m/min)+(2 min,10 m/min)).两组小鼠每次运动距离相同.结果显示HIIT在减轻肝脏脂肪变性方面优于MICT.本研究雌性小鼠在高脂喂养15周后,膳食不变情况下进行12周的MICT或HIIT运动,小鼠体质量和肝组织TG含量下降明显,与MICT相比,HIIT能明显降低肝组织TG含量、改善肝损伤,并且HIIT组每次运动时间减少为MICT组的20%(36 min v.s. 45 min),HIIT量效关系更优.综上推测,对于长期高脂膳食的人群或NAFLD患者进行个体化运动处方制定时,运动强度可作为考虑的重要因素.
在NAFLD的发展过程中,巨噬细胞起核心作用[27],肝细胞内过多的脂肪堆积导致细胞死亡,释放损伤相关分子模式(DAMPS),触发巨噬细胞活化,促使组织产生炎症[28].HUANG[29]在高脂饮食的C57BL/6J小鼠肝脏内检测到T辅助细胞1和M1巨噬细胞增加,如果用氯膦酸脂质体去除巨噬细胞可保护小鼠免于脂肪变性的发生.本研究雌性小鼠高脂膳食喂养后,肝组织巨噬细胞相关基因的表达结果显示M1表型增加,M2表型降低.其机制可能是巨噬细胞p38丝裂原活化蛋白诱导M1巨噬细胞极化和促炎因子分泌[30],也可能是过载脂肪的肝细胞或巨噬细胞释放超微小泡可活化NLRP3炎症小体造成肝组织炎症的发生[31].
运动能减少机体组织的巨噬细胞浸润状态.就脂肪组织而言,KAWANISH在2010-2015年间发现运动可以减少高脂膳食的雄性C57BL/6J小鼠附睾周围脂肪组织内M1巨噬细胞浸润[32-34].贺强等[35]发现db/db小鼠4周游泳训练(60 min/d,5 d/周)后附睾周围脂肪组织内M1巨噬细胞数量下降,M2巨噬细胞数量上升.关于持续运动和间歇运动对巨噬细胞的影响差异,KOLAHDOUZI等[36]将高脂膳食的雄性Wistar大鼠,分为持续运动组和有氧间歇组,间歇运动组的高强度≥85%VO2peak,两组每次运动距离相等,5次/周,10周干预后,有氧间歇运动减少腹膜内脂肪组织炎性M1巨噬细胞和增加M2巨噬细胞的效果更明显.运动对肝脏组织内巨噬细胞的影响,AI[37]采用8周的下坡跑离心运动(-5°,1 h/d,6 d/周)与限制热量饮食相结合,可以明显抑制高脂膳食小鼠肝脏M1巨噬细胞生成并促进M2巨噬细胞表型形成,从而改善NAFLD.因此,本研究HIIT与MICT相比,能明显减低肝组织TG含量和改善肝损伤,可能与HIIT运动时高强度达到90%~100%VO2peak,小鼠肝脏巨噬细胞的表型变化有关,即M1表型明显减少,M2表型明显增加.
巨噬细胞通常分为MI和M2两种表型,M1表型产生TNF-α,iNOS和IL-6等细胞因子[38],能引起组织胰岛素抵抗和炎症;M2表型产生Arg1,IL-10等细胞因子[39],可发挥清除炎症和组织修复功能.M1型巨噬细胞产生的炎症因子TNF-α等在促进肝脏炎症和纤维化过程中发挥重要作用,TNF-α水平与脂肪变性程度、肝硬化和NAFLD肝纤维化评分显著相关[40],肥胖诱导产生的TNF可导致肝脏炎症和致癌转录因子STAT3的激活[41].POTOUPNI等[42]用Meta分析纳入56篇文献,共有1 634名对照组和4 214名NAFLD患者,发现NAFLD患者血清TNF-α水平高于对照组,且水平高低与病情严重程度正相关.TNF-α介导的肝损伤主要通过TNF-受体-1(TNFR1)信号发生,WANDRER等[43]用HFD喂养TNFR1基因敲入小鼠32周,然后进行8周的抗TNFR1抗体和对照抗体治疗,结果表明抑制TNFR1后能明显改善肝脏脂肪变性、降低TG含量和ALT水平.在NAFLD发病前期,促炎M1型巨噬细胞发挥主要作用,随着时间的延长,抗炎M2型巨噬细胞在促进肝脏组织修复中起主要作用[44],主要产生Arg1,IL-10等细胞因子.WAN等[45]表明IL-10表达增加对高脂膳食诱导的小鼠肝损伤和脂肪变性起到保护作用,AMORAS等[46]认为肝组织IL-10mRNA表达增加,有助于降低组织内炎症浸润,限制丙型肝炎病毒患者肝脏纤维化反应.艾磊等[47]对C57BL/6N雄性小鼠喂养高脂膳食12周,复制伴有NAFLD的胰岛素抵抗模型小鼠,随后进行中等强度下坡跑运动(-5°,45%的最大运动强度,6 d/周),8周后小鼠肝脏内巨噬细胞M2表型相关IL-10,Arg-1的蛋白表达显著增加,改善NAFLD的发生发展.
综上,本研究认为,与MICT相比,HIIT能明显改善高脂膳食对雌性小鼠肝脏组织的影响,原因可能与高强度运动明显增加肝脏组织内IL-10蛋白表达,降低TNF-α蛋白表达有关.有资料显示4周有氧运动结合饮食控制可以降低肥胖青年的体脂和血脂,且男性优于女性[48],确切机制不详,HIIT是否通过巨噬细胞极化改善高脂膳食对雄性小鼠肝脏的影响,有待后续进一步证实.
4 结 论
同等运动距离情况下,高强度间歇训练比中等强度持续训练更能改善高脂膳食雌性小鼠肝细胞脂肪变性,降低肝组织炎症状态,这可能与肝内巨噬细胞从M1极化为M2表型有关.
