安罗替尼联合PD-1/PD-L1抑制剂后线治疗晚期转移性结直肠癌的临床观察
2022-06-21李娜杨芳王大庆曹双清
李娜 杨芳 王大庆 曹双清
目前,结直肠癌是世界上最常见的癌症之一。在我国,结直肠癌在肿瘤发病率中居第三位,结直肠癌在死亡率中位居第五位[1]。结直肠癌严重危害人们的身心健康。目前治疗结直肠癌的标准方案是以氟尿嘧啶联合伊立替康或奥沙利铂为基础的化疗。贝伐单抗和西妥昔单抗虽然可以提高化疗对转移性结直肠癌(Metastatic Colo-Rectal Carcinoma,mCRC)的临床疗效,并已广泛应用于一线和二线治疗。然而,目前仍有不少mCRC 患者身体素质尚可,他们经历了三线治疗后进展,缺乏有效合理的治疗方法。安罗替尼是我国自主研发的技术创新型多靶点酪氨酸激酶阻滞剂,可抑制毛细血管内皮细胞生长因子蛋白激酶、成纤维细胞生长因子蛋白激酶等靶点,抑制肿瘤向毛细血管的转化,从而达到抑制肿瘤细胞增殖的目的[2]。目前,程序性细胞死亡蛋白激酶-1(programmed cell death protein kinase-1,PD-1)和程序性细胞死亡配体-1(programmed cell death-Ligand,PD-L1)阻滞剂是mCRC免疫治疗药物的关键。由于PD-1/PD-L1 阻滞剂在错配修复缺陷(mismatch repair deficiency,dMMR)/高度微卫星不稳定性(microsatellite instability-high,MSI-H)mCRC 患者中显示出优异的临床医学疗效,因此它们作为免疫检查点阻滞剂受到越来越多的关注[3-4]。治疗方案也逐渐从后线治疗转向一线治疗或新辅助治疗并取得成功。一方面,抗血管生成药物不仅可以使肿瘤的毛细血管正常化,还可以通过多种方式阻断自身免疫抑制信号的传递[5-6]。另一方面,PD-1/PD-L1 阻滞剂在增强免疫功能的同时,也可以促进毛细血管的正常化[7-8],因此两者密切相关。本研究分析安罗替尼联合PD-1/PD-L1 阻滞剂治疗dMMR/MSI-H mCRC 的临床疗效和安全性因素,探索三线后mCRC 的治疗途径,现将结果报告如下。
1 材料与方法
1.1 一般资料
收集2020年2月至2020年10月于衡水市人民医院接受安罗替尼联合PD-1/PD-L1 阻滞剂治疗的晚期dMMR/MSI-H mCRC 患者病历资料。共纳入17 例患者,其中男性11 例,女性6 例,年龄31~78 岁,中位年龄62 岁;原发灶部位:左半乙状结肠10 例,右半乙状结肠7 例;RAS基因突变4 例,见表1。纳入标准:①病理诊断为dMMR/MSI-H mCRC;②既往使用过三线及以上标准治疗方案;③体力状态ECOG 评分[9]≤2 分,无骨髓抑制及心肺功能,肝肾功能均正常;④能准确测量病变大小;⑤预计生存时间>3 个月。排除标准:①同时患有其他类型的继发性恶性肿瘤;②有出血风险;③有颅内转移致精神、神经系统异常的患者;④身体患有间质性肺病、甲状腺素异常、弥漫性慢性乙型肝炎、HIV 等。⑤过去使用过免疫药物治疗。所有研究对象均签署知情同意书,研究经院伦理委员会批准同意。
1.2 治疗
17 例患者均口服安罗替尼(正大天晴)12 mg/d,3 周为1 个治疗周期(服药2 周,停药1周),每2 个周期评价疗效。所有患者如果出现3 级及以上的副作用会减少安罗替尼的使用或停药。6 名患者接受信迪利单抗注射液治疗,每3 周200 mg;5 名患者接受注射用卡瑞珠单抗治疗,每3周200 mg;4 名患者接受治疗帕博利珠单抗注射液,每3 周200 mg;2 名患者接受特瑞普利单抗注射液,每3 周240 mg 治疗,17 例晚期结直肠癌患者临床特征见表1。

表1 17 例晚期结直肠癌患者的临床特征(n,%)Table 1 Clinical features of 17 patients with advanced colorectal cancer(n,%)
1.3 结果评价
根据RECIST 1.1 版规范[10]进行疗效评价,疗效评价包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)和疾病进展(progressive disease,PD)。客观缓解率(objective response rate,ORR)和疾病有效率(response rate,RR)由CR、PR 衡量。CR、PR 及SD 衡量疾病控制率(disease control rate,DCR)。根据NCI CTC 4.0 版本[11]对副作用进行评估,分为0 到4 个等级。
1.4 随诊
随诊按照查病史资料和电话的方式进行。17例患者均获得随访,末次随访时间为2021年5月20日。无进展生存期(progression-free survival,PFS)定义为口服安罗替尼联合静脉内PD-1/PD-L1阻滞剂开始时间至末次随访日期,包括病情进展、死亡或病情未进展者。
1.5 统计学分析
采用SPSS 22.0 版统计软件进行数据统计分析;计数资料以n(%)表示;生存分析采用Kaplan-Meier 法并行处理Log-rank 检验;P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效
17 名患者中有1 名死亡,其余16 名患者未获得CR。PR 2 例、SD 6 例、PD 9 例(1 例死亡),RR和DCR 分别为11.76%和47.06%。中位PFS 为2.1 个月。见表2、图1。

图1 PFS 曲线Figure 1 PFS curve
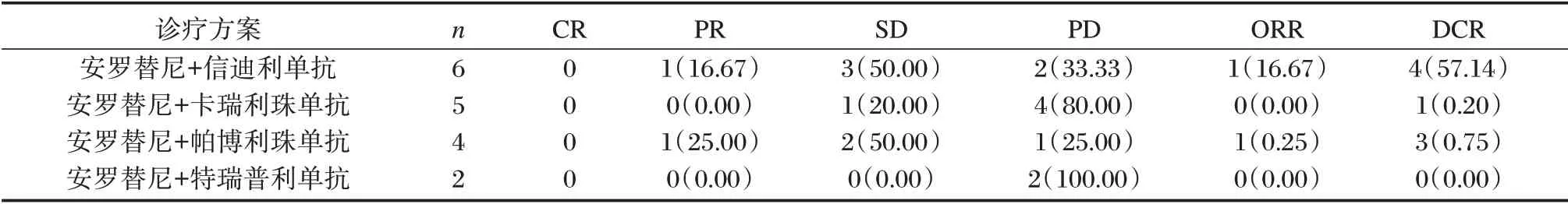
表2 不同治疗方案晚期结直肠癌的近期疗效[n(%)]Table 2 Short-term efficacy of different treatment regimens for advanced colorectal cancer[n(%)]
2.2 副作用
最常见的副作用是高血压、疲劳和腹泻。发生率35.30%(6/17)、35.30%(6/17)、29.41%(5/17)。大多数副作用为1 至2 级,未出现4 级不良反应。出现3 级不良反应5 例,其中乏力2 例,高血压1例,腹泻1 例,甲状腺生长激素升高1 例。见表3。

表3 17 例晚期结直肠癌患者不良反应发生情况Table 3 Incidence of adverse reactions in 17 patients with advanced colorectal cancer
3 讨论
结直肠癌的发病率逐渐升高,是我国最常见的恶性肿瘤之一。对于mCRC 患者,氟尿嘧啶联合伊立替康或奥沙利铂,或进一步联合贝伐单抗或西妥昔单抗是一线和二线治疗的标准方案。目前的三线治疗虽然包括呋喹替尼[12]、瑞戈非尼[13-14]和免疫检查点阻滞剂,但方法非常有限,有效率低。仍有非常多的患者一般情况良好,但缺乏有效的治疗方案。因此,对mCRC 患者的后线治疗进行科学研究在临床医学中具有关键的现实意义。
安罗替尼作为我国自主研发的多靶点色氨酸蛋白激酶阻滞剂,现阶段已获批用于三线非小细胞肺癌、小细胞肺癌和部分软组织肉瘤。目前,安罗替尼已用于晚期肝癌、软组织肉瘤、肾肿瘤、甲状腺髓样囊肿等。并且已经在多种癌症中进行了临床研究。例如,一项安罗替尼治疗终末期甲状腺髓样囊肿的单臂研究收集了58 例患者,48 周无进展生存率为85.5%。与基线相比,45 例患者血清蛋白甲状腺生长激素浓度下降≥50%,表明安罗替尼具有治疗终末期甲状腺髓样囊肿的潜力[15]。安罗替尼在mCRC 的治疗中显示出一定的疗效[16]。但是,目前关于安罗替尼治疗mCRC 的临床研究仍然很少。
免疫治疗已在非小细胞肺癌、黑色素瘤、前列腺癌等各种肿瘤中全面展开。Le 等[17]2015年首次发现存在dMMR 或MSI-H 分子结构基因型mCRC患者可从免疫检查点抑制剂单抗帕博利珠中显著获益。错配修复(mismatch repair,MMR)基因编译的MMR 蛋白可以修复DNA 的碱基失衡,保持DNA 复制的高保真度[18]。当MMR 基因出现缺陷和蛋白质功能异常时,会造成微卫星高度变异,最终在DNA 产生的全过程中引发无数新的基因突变。这种新基因突变引起的新抗原增强了MSI-H结直肠癌患者肿瘤微环境中肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)的 水 平。在dMMR/MSI-H mCRC 中TIL 水平相对密度远高于错配修复完整(proficient mismatch repair,pMMR)/微卫星稳定(Microsatellite Stable,MSS)型mCRC。MSI-H 恶性肿瘤恢复良好,这也与恶性肿瘤较高的TILs 有关[19-21]。与微卫星稳定型(MSS)相比,MSI-H 直肠癌具有更高的PD-L1 表达水平,这也表明此类患者很可能受益于PD-1/PD-L1 治疗[22]。在MSI-H 肿瘤免疫治疗的重要科学研究KEYNOTE-016 中,dMMR 的多种恶性肿瘤均可受益于PD-1 抑制剂帕博利珠单抗的免疫治疗[17]。KEYNOTE-164这项大中型临床试验分析了帕博利珠单抗在dMMR/MSI-H mCRC 患者中的临床疗效,1年总生存率和无进展生存率分别为41%和76%。由于免疫治疗的显著疗效,人们开始探索免疫治疗作为mCRC 一线治疗的疗效[23]。在近期的KEYNOTE177 大型临床研究中,共纳入307 例MSI-H/dMMR mCRC 患者,其中153 例纳入帕博利珠单抗组,154例纳入标准治疗组(FOLFOX 或FOLFIRI±贝伐单抗或西妥昔单抗)。关键终点是PFS 和OS。主要和次要终点包括ORR 和安全性(RECIST 评估)。数据显示,免疫治疗组和化疗组的中位随访时间分别为28.4 和27.2 个月。化疗组的PFS 劣于帕博利珠单抗组。在安全性层面,帕博利珠单抗组不良反应发生率显着降低,不良反应的发生率分别为22%和66%。化疗组有1 例治疗相关死亡。无论是疗效还是副作用,帕博利珠单抗都优于化疗[24]。
本研究分析17 例晚期结直肠癌患者三线及以上使用安罗替尼联合PD-1/PD-L1 阻滞剂的临床疗效,组内所有患者均可对疗效进行评价。安罗替尼联合PD-1/PD-L1 阻滞剂治疗4 个周期。RR 和DCR 分别为11.76%和47.06%。中位PFS 为2.1个月。不良反应主要有高血压、疲劳、腹泻及甲状腺功能减退、毛细血管征等,3 级以上不良反应均经药物治疗和延迟给药控制,无4 级不良反应发生。本研究出现1 名患者死亡,该患者于治疗的第1 个周期末因突发心肌梗死而死亡,该患者的死因考虑与疾病进展及药物毒副反应无关。关于PD-1/PD-L1 抑制剂联合抗血管生成药物治疗恶性肿瘤临床方面的研究尚有很多,涉及的瘤种非常广泛,研究结果大部分是安全有效的,而且逐步向一线治疗迈进,目前在肝癌、肾癌、肺癌等实体瘤方面的结果甚是令人期待。然而目前的联合治疗方案多数属于Ⅰ~Ⅱ期研究,Ⅲ期研究却凤毛麟角,因此需要有更加有效、更加深入的临床研究加以证实。此外,亦有研究显示,联合疗法在大多数与免疫相关的不良事件中均未显示出明显的安全性,因此需要在具体临床实践活动中权衡利弊,从而选择最佳的抗肿瘤治疗模式[25]。一系列临床前和临床研究表明,PD-1/PD-L1 阻滞剂与抗血管生成治疗相辅相成。一方面,抗血管生成能够增加免疫细胞的比例,并且下调多个免疫检查点的表达来阻断抑制性免疫信号的传导。另一方面,PD-1/PD-L1 阻滞剂治疗可以恢复免疫微环境,促进恶性肿瘤血管的正常化,从而有利于药物的传递,减少PD-1/PD-L1 阻滞剂的用药剂量,降低不良事件的发生风险。
综上所述,安罗替尼联合PD-1/PD-L1 抑制剂后线治疗晚期结直肠癌的临床效果尚可,安全性可、耐受性良好。
