微流控芯片技术在布鲁氏菌检测中的应用
2022-06-21李翔董占柱陈昊孙欣包春喜李英智牛艺卿郝明媛赵志军杜彦丹
李翔 董占柱 陈昊 孙欣 包春喜 李英智 牛艺卿 郝明媛 赵志军 杜彦丹★
布鲁氏菌病(Brucellosis)是由布鲁氏菌属的细菌(Brucella)侵入机体,引起传染-变态反应性的人兽共患的传染病。临床上以长期发热、多汗、乏力、关节疼痛、肝脾及淋巴结肿大为特点[1]。人群易感,多因病致贫。布病的诊断以实验室检查为主,结合流行病史、临床表现、影像学手段等综合判断[2]。目前,检测布氏菌的常用技术均存在一定局限性,如血培养技术耗时长、检出率低;虎红平板凝集试验、试管凝集特异性不高;补体结合试验敏感性低;传统聚合酶链式反应(Polymerase Chain Reaction,PCR)操作繁琐涉及生物安全等。微流控芯片-PCR(Microfluidic Chip PCR,MCPCR)技术可将样品制备、反应、分离、检测等集成到一块芯片上并自动完成,具有快速、高通量、低消耗,灵敏、特异等特点[3-4]。其技术已经成功应用于HPV[5]、结核[6]、肿瘤[7]等疾病的检测。近年来布病的国内外的发病率出现逐年上升的势头[8-9],探究MC-PCR 技术与布氏菌检测相结合,提高布氏菌检测、诊断能力十分必要。
1 材料与方法
1.1 样本来源
收集2021年呼伦贝尔市传染病医院80 例布氏菌试管凝集实验阳性患者血液样本,3 000 r/min转速处理5 min,离心半径15 cm,分离血清,布氏菌悬液及阴性血清样本由内蒙古林业总医院提供。阳性样本及布氏菌悬液均采用56℃30 min 进行灭活,-80℃冷藏。布氏菌质粒为北京睿博兴科生物技术有限公司。
1.2 实验方法
研发适合MC 技术的布氏菌核酸提取试剂、PCR 扩增条件、反向斑点杂交试剂;设计MC-PCR与基因测序符合性测试、比较MC-PCR 法与硕世生物科技qPCR 法、上海之江生物科技TaqMan 探针法、临床诊断结果;评估MC-PCR 重复性、准确性、特异性、最低检出限。
1.2.1 DNA 提取
采用5×105CFU/mL 浓度胎牛血清加布氏菌悬液作为样本。MC 布氏菌提取试剂50 μL 血清+50 μL ddH2O+100 μL 裂解液+5 μLPK+10 μL 磁珠+100 μL 异丙醇,6M 裂解液,裂解2 min 在全自动核酸芯片检测仪(北京博晖创新生物技术股份有限公司,型号:BHF-VI)上进行核酸提取、产物PCR 检测结果设为研究组;AXYGEN 柱式核酸检提取剂盒、天净沙柱式血液核酸提取试剂盒、全式金(离心柱)核酸提取试剂盒、天根血液基因组DNA 提取试剂盒、德诺杰亿核酸提取试剂、济凡生物科技济凡快速磁珠法血液基因组提取试剂盒及研发的手工提取试剂共7 种试剂提取产物分别PCR 检测结果设为对照组。
1.2.2 PCR 扩增
采用美国ABI 7500 实时荧光定量PCR 仪对提取的产物检测。根据布氏菌BCSP31 蛋白编码的基因,使用Oligo7 和Allele ID6 软件设计出适合微流控芯片检测的引物(5′-ACCTTGCCCTTGCCATCAT-3′)(5′-AGTCCGGCTTTACGCAGTCA-3′)以及探针(TGCCGTTATAGGCCCAATA GGCAAC G)。采用15 μL PCR 反应体系,主要包括:诺唯赞通用型高灵敏度染料法定量PCR 检测酶7.5 μL,正、反向引物各1.5 μL(0.5 μmoL/μL)ddH2O:1.5 μL 核酸模板3 μL。MC-PCR 用诺唯赞高纯度耐热DNA 聚合酶,检测使用BHF-VI,其它与实时荧光定量实验扩增体系参数一致。
1.2.3 反向斑点杂交
MC 技术反向斑点杂交试剂使用微量点样技术,在BHF-VI 上进行自动提取反向斑点杂交、显示和结果分析。见图1。

图1 微流控探针排布Figure 1 Microfluidic probe arrangement
1.2.4 微流控芯片结果判定
实验过程中设立的阴阳性对照必须BS、GB 和SP 位置处均出现阳性斑点,否则提示核酸提取、PCR 扩增或杂交失败。试剂盒内的阴性对照必须在GB 和SP 位置出现阳性斑点,其他位置均不能出现阳性斑点,否则有可能发生污染。
1.2.5 符合性测试
采用80 例试管凝集试验阳性血清为样本,使用MC-PCR 试剂在BHF-VI 上检测,与MC-PCR 提取的产物在华大基因北京公司的基因测序结果进行符合性比较;与硕世生物科技(qPCR)、上海之江生物科技的布菌核酸检测试剂盒(TaqMan 探针)在ABI 7500 PCR 仪上检测结果进行比较;与临床诊断结果比较。
1.3 MC-PCR 性能评估
使用MC-PCR 重复性:检测浓度1 000 copies/mL 布氏菌质粒参考品22 次;精密度:检测100 CFU/mL 布氏菌悬液10 次;准确性:检测浓度1 000 copies/mL 布氏菌质粒参考品及浓度1.0×105copies/mL 人胚胎肾HEK293 细胞阴性参考品;特异性:检测浓度2.5 ×105copies/mL EB 病毒、2.1×105copies/mL 人巨细胞病毒、3.0×106copies/mL 金黄色葡萄球菌、1.8×106copies/mL 肺炎链球菌14 型、1.0×105copies/mL 人胚胎肾HEK293 细胞。检出限:检测梯度浓度布氏菌质粒。
1.4 统计学分析
采用SPSS 26 统计软件进行数据分析;计量资料采用(±s)描述,多组间比较采用方差分析;计数资料采用(%)表示,组间比较采用χ2检验;不同检验方法之间的一致性采用kappa 检验分析;以P<0.05 差异有统计学意义。
2 结果
2.1 研究组与对照组提取布氏菌核酸实验结果比较
研究组与对照组核酸溶解曲线图纵坐标峰值所对应的横坐标一致,呈现单一的溶解峰,温度相同,表示为相同的扩增产物。见图2;研究组布氏菌核酸最早在27 个循环就达到设定的阈值,核酸不同提取方法之间Ct 值差异有统计学意义(P<0.05)。NaI(机提)的Ct 值低于AXYGEN、天净沙、济凡、NaI(手提),差异有统计学意义(P<0.05);NaI(机提)的Ct 值与全式金、天根、德诺杰亿差异无统计学意义(P>0.05)。见表1、图3。
表1 不同提取方法之间CT 值比较(±s)Table 1 Comparison of the CT values between the different extraction methods(±s)

表1 不同提取方法之间CT 值比较(±s)Table 1 Comparison of the CT values between the different extraction methods(±s)
提取方法AXYGEN天净沙全式金天根德诺杰亿济凡NaI(手提)NaI(机提)CT 值29.95±0.29 32.94±0.19 28.07±0.08 27.81±0.29 27.26±0.86 31.85±0.55 29.24±0.30 27.68±0.26 F 值P 值14.935<0.001

图2 布氏菌核酸QPCR 溶解曲线Figure 2 QPCR dissolution curve of Brucellosis nucleic acid

图3 布氏菌核酸QPCR 扩增曲线Figure 3 QPCR amplification curve of Brucella nucleic aci
2.2 符合性测试结果
基因测序的Kappa 值为0.659,与MC-PCR 具有高度的一致性,MC-PCR 与基因测序阳性结果符合率100%,总符合率82.5%。见表2。
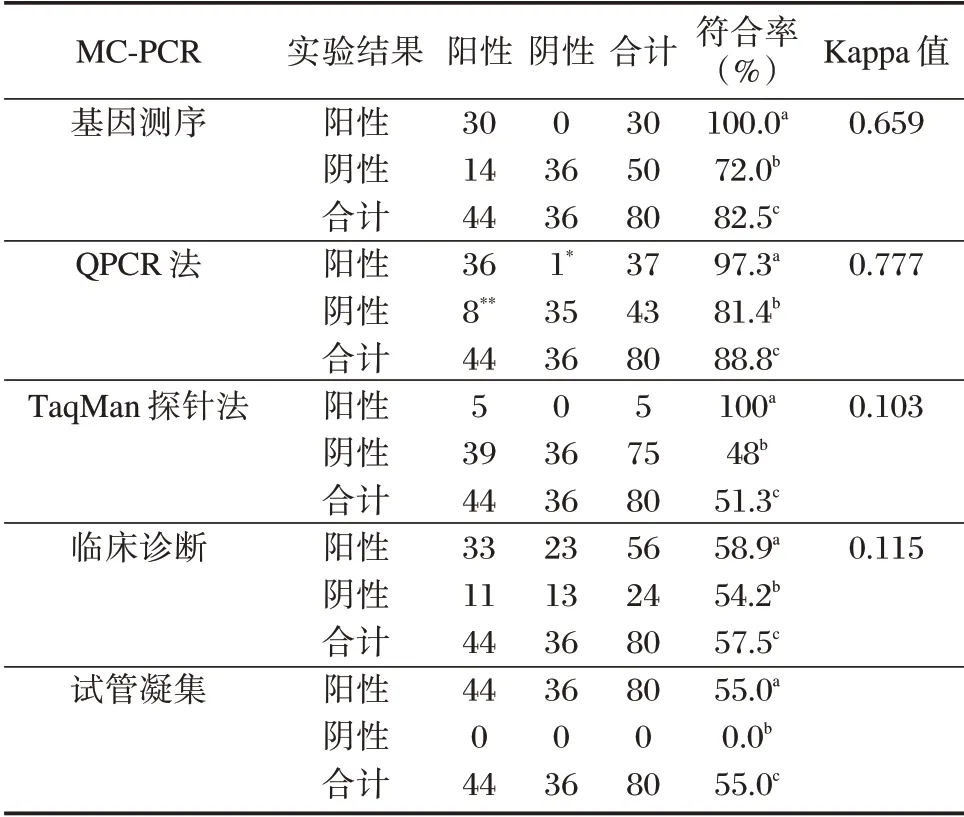
表2 不同方法的符合性测试结果Table 2 Compliance test results of different methods
2.3 MC-PCR 性能评估结果
准确性:结果符合率为100%;特异性:结果阴性率100%;重复性:结果均可以检出布氏菌;检出限:浓度为825 copies/mL时,MC-PCR与qPCR、TaqMan探针法检出率差异有统计学意义(χ2=24.699,P<0.05),经两两比较,MC-PCR 检出率高于qPCR和TaqMan 探针法,差异有统计学意义(P<0.05)。精密度:结果均可以检出布氏菌。见表3、图4。

表3 MC-PCR 与qPCR、TaMan 探针法检出限比较实验Table 3 Comparison of detection limits of MC-PCR,qPCR and Taman methods

图4 精密度参考品微流全流程检测结果Figure 4 Results of microflow of precision reference
3 讨论
布病是一种易被忽视的人畜共患病,不仅严重危害人民身体健康,而且影响畜牧业、旅游业、国际贸易的发展,还会带来食品安全隐患[10],其已经成为我国法定的乙类传染病之一。内蒙古畜牧业发达,畜牧业交易、运输的活跃,致使布病疫情从牧区向半牧区、农区以及城市蔓延。虽然检测出布氏菌是诊断布病的金标准[11-12]。但由于布氏菌培养营养要求高,生长缓慢,往往会延误诊断及早期治疗,故不能成为诊断布病的主要方法。血清学诊断缺乏国际化的参考标准,具有诊断学意义的血清布氏菌抗体滴度尚未确定。传统的布氏菌核酸检测试剂盒多数是以手工提取核酸为主要方法,提取过程繁琐,提取效率不高,稳定性不好,此外,多数检测机构环境难以达到《病原微生物实验室生物安全环境管理办法》中布鲁氏菌活菌检测要求[13]。虽然布氏菌的检测技术已经有了很大的发展,但是,仍然没有一种单一的方法能在任何情况下进行安全、快速、准确的检测。因此,找到快速、准确、安全的诊断布病的检测方法至关重要。
MC 的适时出现为分子诊断研究开启了新的大门,MC 是指在微米级别流道上对微流体或微反应体系进行精准操控与分析检测的科学技术,具有自动、高效、快速、集成、低消耗且灵敏、特异等优点[14]。用MC 技术将PCR 核酸提取、PCR 扩增、RDB 集合到一个芯片上建立起微型化的MC-PCR检测布氏菌DNA 反应体系,其能克服PCR 需要较多的试剂、加热时间长、冷却时间长等缺点,消除了因离心、混合和冻融步骤所导致的场地问题,从而解决PCR 扩增的标准化问题。此外,该技术还可以避免样品在多步处理过程中出现内源性核糖核酸酶激活、不适pH 值和温度导致的样品降解[15]等。研究表明这种能快速分离出细菌及病毒的DNA,并在最小化人为干预的情况下将其传送到检测装置传感器的封闭集成单元内的微流控系统是目前传染病检测的最佳选择。且仪器操作稳定性高,可以实现布氏菌检测的误差最小化,自动化操作极大减少了实验人员感染风险,这将是现阶段最好的布氏菌核酸提取和检测方法。
MC-PCR 与基因测序、TaqMan 探针法、qPCR检测阳性结果符合率为100%、100%和97.3%,1 例QPCR 阳性、MC-PCR 阴性样本基因测序为阴性结果,8 例QPCR 阴性、MC-PCR 阳性样本测序后为阳性结果,MC-PCR 与基因测序结果更符合,说明MC-PCR 检出研究组的结果更准确。因为MCPCR 在PCR 扩增后又进行了RDB。RDB 是将针对BCSP31 基因组设计的引物的探针包被在芯片检测区的杂交膜上,若扩增产物中含有目的基因,则可被芯片上的探针捕获,与膜上探针相结合,结合形成复合物,特异性强,经酶和显色反复润洗,形成可见的斑点,就可判断感染了布氏菌,这可显著降低假阳性率和假阴性率[16]。通过RDB 技术不仅可以提高布氏菌核酸的检测效率,还增加了实验的特异性和准确性。MC-PCR 阳性率高是MC-PCR 的检出限最低,对布氏菌检测最敏感,这对布病的早期诊断以及鉴别布病慢性期与急性期都有帮助。与临床诊断较低的一致性,分析是临床医生常根据布病血清免疫学试管凝集实验和临床症状对布病进行诊断,但对一些试管凝集实验阳性且与布氏菌感染症状相似的患者无法准确诊断是否是布病感染,导致会出现一部分假阳性的病例。试管凝集实验是对血清中总抗体(包括IgM和IgG)进行检测,可能会与其它细菌存在着一定量交叉反应,导致假阳性率偏高,特异性不强,同时血清抗体在体内可以长时间存在,即使一些患者痊愈且没有症状,但对其血清进行检测仍然会出现一些较高滴度抗体的情况[17]。由于布病国家诊断标准的局限性,误诊漏诊不可避免[11-12]。
综上所述MC-PCR 技术检测布氏菌重复性、准确性、特异性、检出限的性能均优于一般布氏菌核酸检测试剂盒,且检测方法安全、快捷、及时、精准。该技术的应用将提高布病诊断率和诊断准确率,有效地减少误诊、漏诊,对布鲁氏菌病的防治起到重要作用。
