茶树上拟茎点霉病害的鉴定及其生物防治
2022-06-20文小龙
文小龙


摘要:拟茎点霉属(Phomopsis)是腔孢纲球壳孢科真菌中的一个属,是一类重要的植物致病菌,可寄生多种不同科属的植物。该属病原菌分布廣种类多,可引起多种植物病害,如植物的枝枯、叶枯、烂茎、溃疡及果腐等严重病害。本研究主要对从茶树上分离出来的拟茎点霉属病原菌进行形态学结合DNA序列分析的方法来进行鉴定,生物防治方面的研究在本文中也进行了探讨,为后续茶叶病害生物防治的应用提供一定的参考依据。
关键词:拟茎点霉属;茶树病害;生物防治
1 前言
拟茎点霉属(Phomopsis)属于腔孢纲球壳孢科真菌中的一个属,是一种重要的植物致病菌,据调查显示近年来该病原菌在全世界范围内的很多植物上都常有发生,且发现的种类也很多,拟茎点霉引起的病害主要表现在叶片枯黄、枝干部位枯萎腐烂、果实溃疡腐烂等严重病害,对于植物来说拟茎点霉的危害是致命的。
2 材料与方法
2.1 试验材料
2.1.1 试剂
无菌水、酒精、DNA试剂盒、无水乙醇、100 mg·ml-1 硫酸链霉素等。
2.1.2 材料
生防菌、封口膜、茶叶病害标本、超净操作台、解剖针、接种针、酒精灯、手术刀、剪刀、打孔器、标签、体式镜、生物显微镜、Bio-Rad梯度PCR仪等。以上材料试剂均由贵州大学植物病理实验室提供;其中茶叶病害标本采摘于松桃苗族自治县普觉现代循环农业示范园区。
2.2 病原菌的分离及纯化
2.2.1 标本采集及处理
(1)标本采集:2019年8月在松桃苗族自治县普觉现代循环农业示范园区采集病害茶叶标本。
(2)标本处理:用70%酒精浸泡20s,然后用棉花轻轻擦拭标本叶表面,在用无菌水清洗擦干备用。
2.2.2 PDA固体培养基的制作
(1)取200g去皮马铃薯切块水煮沸至软化。
(2)过滤取滤液,加20g葡萄糖、15~20g琼脂混合均匀,溶解加水定容至1L。
(3)冷却转移至500ml锥形瓶中,120℃灭菌20~30min,常温保存备用。
2.2.3 单孢分离
在无菌操作台中把将PDA培养基转入培养皿中加适量100 mg·ml-1 硫酸链霉素。然后通过体式显微镜观察已清洁过的标本,找到病斑部位,挑取病斑孢子,置于培养基中用封口膜密封,28℃培养一周。
2.2.4 病原菌的纯化
培养基中长出可见菌落后观察记录菌丝形态特征,用菌丝顶端纯化法挑取菌丝纯化培养,重复该步骤直至所培养出来的病原菌只有一种为止。
2.3 病原菌DNA的提取
(1)准备工作:准备无菌冻存管、无菌离心管、无菌移液枪,DNA试剂盒。
(2)保存菌丝:取冻存管加2ml左右灭菌水,将长满菌丝的培养基切成合适小块放入冻存管。每种菌保存三管,4℃下保存备用。
(3)提取菌丝:取培养皿中的菌丝置于离心管,加600μl BufferFG1和少量石英砂研磨至研磨棒上不沾菌丝为止。
(4)65℃水浴加热30~40min,7min摇晃一次。
(5)加140μl Buffer FG2,冰水浴5min,以10000rpm/min离心6min。
(6)取400μl上清液于新离心管中,加400μl无水乙醇和200μl Buffer FG3混合摇匀。
(7)转移到2ml的柱子离心管中,以12000rpm/min离心2min,静置取上清液。
(8)取上清液加650μlDNA washing buffer,以10000rpm/min离心2min。
(9)转柱子滤管于新的1.5ml离心管中加入Elution Buffer 5μl以12000rpm/min离心2min,取下清液,取下清液于-20℃冰箱保存备用。
2.4 PCR扩增及DNA-ITS序列测定
本试验采用引物为ITS1(5'–TCCTCCGC TTATTGATATGC-3')和ITS4(5'-GGAAGTAAAAGTCGTAACAAGG-3')。将9.5μLddH2O,12.5μL 2×Tap Master Mix,正反引物各1μl,加入1μl目的DNA中。反应程序为94℃预变性5min,94℃变性30s,53℃退火30s,72℃延伸90s,35次循环;最后72℃充分延伸7min,4℃保存。
2.5 凝胶电泳检测DNA质量
(1)20ml五倍的TBE缓冲液定容到200ml,制作成0.5倍缓冲液。加0.4g琼脂糖,放入锥形瓶中并加入50ml 0.5倍的缓冲液加热至琼脂糖完全溶解。
(2)加入5μl goldview摇匀倒入电泳胶槽,待其完全凝固后加入缓冲液至电泳槽水平面。
(3)用移液枪逐个点样,每点一个样换一个胶头。
(4)接通电源,电压控制在60~80V,当彩带跑过胶板1/2后停止电泳。
(5)采用Bio–Rad凝胶成像系统观察,观察条带的长度及亮度,确定DNA质量。
2.6 序列同源性比较及鉴定
得到的DNA产物送至北京诺赛基因组研究中心有限公司进行测序,序列经Blast并与NCBI数据库中的已知序列进行同源性比较得出结果。
2.7 回接确定其在茶树上的致病性
(1)供试菌株:于贵州大学教学茶园采摘新鲜健康的茶叶若干编号,用于回接试验。
(2)用无菌水清洗茶叶标本灭菌。
(3)病原菌接种体的制备:将已确定为拟茎点霉真菌属所对应的保存菌重新放入PDA固体培养基活化培养,28℃条件培养7d。0C4DB567-1758-4DB7-AE07-51627FF0E814
(4)接种病原菌:用解剖针破坏茶叶的皮外组织,直径5mm无菌打孔器取菌饼置于茶叶表面伤口处。
(5)用湿润棉花包裹茶葉标本叶柄,加少许无菌水保湿,28℃培养箱培养。待茶叶上长出病斑后观察记录病斑形态。
(6)再次从标本提存病原菌,与原病原菌比较。
2.8 生物防治
本试验采用平板对峙法进行试验,生防菌来自于实验室,编号Hg1、Hg6、Hg7。
(1)生防菌的活化:将三种生防菌接入PDA培养基中培养备用。
(2)5mm直径打孔器截取病原菌菌饼置于PDA培养基中央。
(3)5mm直径打孔器截取两块生防菌菌块分别置于病原菌两侧,病原菌与生防菌间隔35mm。
(4)空白对照:以直接病原菌的处理作为对照组,每个处理重复三次记做处理A、处理B、处理C,置于28℃恒温培养箱培养一周。
(5)待对照组病原菌长满整个培养基以后开始测量实验组病原菌菌落的直径。
(6)计算:
3 试验结果分析
3.1 病原菌的分离纯化分析
病害标本经纯化处理以后从中分离出拟茎点霉病原菌。见下图(图1)
茶叶病斑为黄褐色,水渍状,圆形或不规则形病斑。在PDA培养基中菌落初为白色,渐变为黄白色,菌落整体平整,中间浓密边缘较为稀疏,生长速度极其快,培养一周左右长满整个培养基。
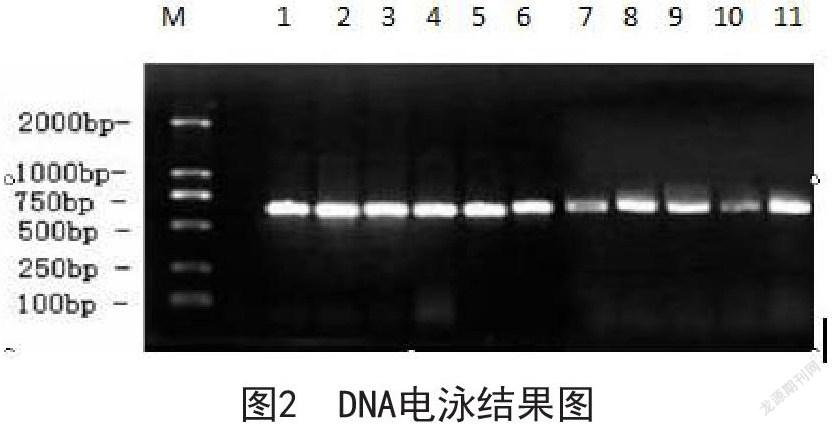
3.2 凝胶电泳结果分析
经过采用Bio–Rad凝胶成像系统对凝胶电泳观察到主带清晰,拖尾现象不明显质量较好的DNA。见下图(图2)
3.3 序列同源性比较结果分析
以ITS1(5-TCCGTAGGTGAACCTGCGG-3)和ITS4ITS4(5-TCCTCCGCTTATTGATATGC-3)(由上海捷瑞生物工程有限公司合成)引物进行PCR扩增,得到的DNA产物送至北京诺赛基因组研究中心有限公司进行测序,得到以下ITS序列:
ACCCTTTGTGAACTTATACCTTACTGTTGCCTCGGCGCATGCCGGCCCCCCTGGGGGCCCCTCCTTCTGGAGGAGCAGGCACGCCGGCGGCCAACCTAACTCTTGTTTTTACACTGAAACTCTGAGAATAAAACATAAATGAATCAAAACTTTCAACAACGGATCTCTTGGTTCTGGCATCGATGAAGAACGCAGCGAAATGCGATAAGTAATGTGAATTGCAGAATTCAGTGAATCATCGAATCTTTGAACGCACATTGCGCCCTCTGGTATTCCGGAGGGCATGCCTGTTCGAGCGTCATTTCAACCCTCAAGCCTGGCTTGGTGATGGGGCACTGCCTGTAAAAGGGCAGGCCCTGAAATTCAGTGGCGAGCTCGCCAGGACCCCGAGCGCAGTAGTTAAACCCTCGCTCTGGAAGGCCCTGGCGGTGCCCTGCCGTTAAACCCCCAACTTCTGAAAATTTGACCTCGGATCAGGTAGGAATACCCGCTGAACTTAAGCATATCAAT
上述序列经Blast并与NCBI数据库中的已知序列进行同源性比较,鉴定结果为Phomopsis sp.同源性为100%的登录号为KJ463526.1。
3.4 回接试验分析
将所得病原菌进行回接试验,试验结果表明茶叶表现出了病斑,出现病斑与分离出病原菌的标本上的病斑基本吻合,且发病后再次从叶片上分离所得的病原菌与初次鉴定所得病原菌为同一种病原菌,进一步确定该病原菌能使茶树发病,通过试验可以看出(图3),在相同环境下经过病原菌侵染后的茶叶标本产生了病斑,而空白对照组则无此症状。
3.5 生防菌拮抗试验结果分析
由下表(表1)试验所用三种生防菌对拟茎点霉菌的生长都有一定的抑制效果,表明了这三种生防菌本身,或者是他们的代谢产物对拟茎点霉菌的生长具有抑制作用。其中接种了Hg1的病原菌平均直径为60.57mm,接种了Hg6的病原菌平均直径为38.14mm,接种了Hg7的病原菌平均直径为44.15mm,平均抑菌率分别为31.9%,57.2%,50.75%,抑制效果越好平均直径就越小,反之抑制效果越差平均直径就越大,平均直径跟平均抑制率成负相关。
4 结论
(1)致病性分析:通过试验证明,从所采摘的茶叶标本上分离出了拟茎点霉病原菌,通过回接试验发现接种了拟茎点霉病原菌的茶叶标本表现出病态,而在相同环境下,空白对照组则无此现象,说明了拟茎点霉确实能够浸染茶树并使茶树致病。
(2)本试验采用了平板对峙法进行试验,试验结果表明了在一定的生长环境下,所选取实验室的三种生防菌对拟茎点霉的生长都产生了一定的抑制作用。但这仅仅只是在实验室里得到的结果,本研究并不能确定其在复杂的自然环境下,试验所用生物生防菌是否对拟茎点霉属具有相同的抑制效果,有待做进一步的研究。
参考文献
[1] 王海斌,洪斌毅,陈荣山,等.世界茶叶产销状况及我国茶叶现状[J].福建茶叶,2014,36(4):5-6.
[2] 王雪萍,谭荣荣,曹丹,等.茶树内生真菌研究进展[J].湖北农业科学,2015,54(23):5808-5812.
[3] 李雪光,潘凤娟,宋洁,等.拟茎点霉属及其病害研究进展[J].大豆科技,2012(6):32-37.
[4] 龙珑.叶点霉和茎点霉两属真菌的分子系统分类学研究[D].江西农业大学,2013.0C4DB567-1758-4DB7-AE07-51627FF0E814
