采用HS-SPME-GC-MS分析蜂蜜中的5-羟甲基糠醛衍生物
2022-06-19陈路芳李丹丹杨远帆
陈路芳,李丹丹,倪 辉,杨远帆
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.厦门市食品生物工程技术研究中心,福建 厦门 361021)
0 引言
随着科学技术的进步,今天的人类社会对健康提出了更高的要求。在预防和治疗疾病方面,相对于传统药物,人们更倾向于食疗的方式,中华食疗科学已成为华夏饮食文化的重要内容之一[1]。蜂蜜是蜜蜂利用自身分泌液将采集到的花蜜反复酿造而成的甜味物质[2]。蜂蜜性味甘平,具有抗菌、抗氧化、补中益气、养肺止咳、降低血脂水平等功效,对多种疾病起到调理、治疗的作用,深受广大消费者的喜爱[3]。我国蜂蜜生产量和出口量都稳居世界第一,2018年蜂蜜产量为54.25万t,出口量国际占比维持在19%以上[4]。
蜂蜜的主要成分是糖类,约占蜂蜜总质量的75%,主要以葡萄糖、蔗糖及果糖为主[5]。研究表明,含糖食品在加工及储藏过程中易发生焦糖化和美拉德反应,产生5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)[6],进而分解成3-甲基-2-戊酮、糠醛等衍生物[7]。新鲜无添加的蜂蜜不含5-HMF,但随着贮藏时间的延长,蜂蜜中部分葡萄糖和果糖在酸性条件下脱水生成5-HMF,若往蜂蜜中加入转化糖等物质,更容易产生5-HMF[2]。目前,人们通过测定蜂蜜中5-HMF含量来表征蜂蜜质量,5-HMF成分高,表明蜂蜜纯度不高,或者贮藏过久,或者贮藏环境不合理[8]。我国国家标准规定,蜂蜜中5-HMF含量要求不高于40 mg/kg[9]。目前,测定5-HMF含量的方法主要有紫外-可见分光光度法(spectrophotometry,SP)[10]、高效液相色谱法(high performance liquid chromatography,HPLC)[11]、气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)[12]和液相色谱-质谱法(liquid chromatograph-mass spectrometer,LC-MS)[13]等。其中,GC-MS既有色谱较强的分离能力,同时具有质谱灵敏的鉴别功能,具有高效率、灵敏准确等特点。近几年来,顶空固相微萃取联动气质色谱(head space solid phase micro-extraction gas chromatography-mass spectrometry,HS-SPME-GC-MS)分析技术在食品领域的应用越来越广泛,它可以实现对样品的采集、定量和定性分析等一系列研究,萃取过程不需要加入有机溶剂,抗干扰能力强,可更加准确地分析样品中的5-HMF等挥发性成分[14]。
由于蜂蜜中的5-HMF可以通过活性炭吸附等方法去除,因此,仅以5-HMF为指标难以判别经过活性炭处理的加热浓缩蜂蜜的质量,也不能很好地将新鲜纯天然的原蜜与市场上其他浓缩蜜等加工蜂蜜区分开来。针对该问题,本文采用HS-SPME-GC-MS鉴定蜂蜜中5-HMF衍生物,建立定量检测方法,对比分析原蜜和加热浓缩蜂蜜样品中5-HMF衍生物含量差异,为评价蜂蜜的质量提供参考指标。
1 材料与方法
1.1 材料与试剂
枇杷、洋槐和龙眼原蜜均购于福建厦门本地商场。浓缩处理枇杷、洋槐、龙眼蜂蜜由本实验室在60~65 ℃温度下加热原蜜30 min得到[15]。
5-HMF、盐酸,国药集团上海化学试剂有限公司;3-甲基-2-戊酮、糠醛、2-乙基-1-己醇、正构烷烃、环己酮,美国Sigma-Aldrich公司。
1.2 仪器与设备
QP-2010型Plus GC-MS仪、Rtx-5MS型毛细管色谱柱 (60 μm×0.32 mm,0.25 μm)色谱柱,日本岛津公司;HH-157330-U型手动SPME进样器、30 μm PDMS、50/30 μm DVB/CAR/PDMS、65 μm DVB/PDMS、75 μm CAR/PDMS萃取头,美国Supelco公司。
1.3 实验方法
1.3.1 样品前处理
量取5 mL样品于SPME采集瓶中,加入25 mL水和10 μL内标物环己酮,立即密封混匀。于恒温水浴锅里60 ℃预热保温5 min,将老化后的固相微萃取头萃取探针插入样品瓶,顶空吸附20 min。随后插入GC进样口解吸附3 min,然后进行数据采集。
1.3.2 5-HMF衍生物的制备
取适量5-HMF,按料液比(g∶mL)=1∶200的比例加入1.5 mol/L的盐酸于90 ℃水浴锅中催化90 min,然后立即冰浴冷却,用氢氧化钠溶液中和至pH=7,低温避光保存。
1.3.3 5-HMF衍生物顶空固相微萃取条件的优化
为提高HS-SPME提取5-HMF衍生物的萃取效率,在盐酸模拟体系下对样品pH值、萃取头、萃取温度及时间进行优化实验。通过不同萃取头实验确定合适的pH值后,再考察萃取头、萃取温度及时间对峰面积的影响,确定最优的萃取条件。
1)pH值的选择。量取5份100 mL 5-HMF衍生物,用氢氧化钠溶液进行中和,得到pH=4,5,6,7,8的5种样品,低温避光保存。分别量取5 mL上述5种样品于采集瓶中,加入25 mL水,60 ℃预热保温5 min,插入75 μm CAR/PDMS萃取头吸附20 min后进行解析,测定各总峰面积。
2)萃取头的选型。分别量取5 mL 5-HMF衍生物(pH=7)加入采集瓶中,加入25 mL水,60 ℃预热保温5 min,插入4种萃取头吸附20 min后进行解析,测定各总峰面积。
3)温度的选择。量取5 mL 5-HMF衍生物(pH=7)加入采集瓶中,加入25 mL水,预热保温5 min,插入75 μm CAR/PDMS萃取头分别在30,45,60,75 ℃吸附20 min后进行解析,测定各总峰面积。
4)时间的优化。量取5 mL 5-HMF衍生物(pH=7)加入采集瓶中,加入25 mL水,60 ℃预热保温5 min,插入75 μm CAR/PDMS萃取头在60 ℃下分别吸附10,20,30,40 min后进行解析,测定各总峰面积。
1.3.4 5-HMF衍生物的分析条件
根据SCAN模式为扫描方式进行定性分析,GC-MS条件参照本实验室前期的实验[16]。
1)GC条件。色谱柱为Rtx-5MS(60 m×0.32 mm,0.25 μm),载气为高纯度氦气,柱流量为3 mL/min,不分流进样;进样口温度为250 ℃。柱升温程序:初始温度为40 ℃,保持5 min,以5 ℃/min速率升温至220 ℃,保持1 min。
2)MS条件。离子源温度为200 ℃,电离方式为EI(electron ionization),电离能量为0.80 kV,质谱接口部分温度为250 ℃,离子碎片扫描范围将质荷比设定为35~450,定量分析时质谱扫描方式设为SIM(selected ion monitoring)模式。
3)定性分析。将正构烷烃和样品进行GC-MS测定,采用仪器配置的质谱数据库(NIST08、NIST08s、FFNSC1.3)进行检索,检测出挥发性成分匹配度较高(>80%)的化合物,结合基峰、特征峰、保留指数与文献报道的保留指数进行比对定性。根据式(1)计算待测物质的保留指数:
RIx=100n+100×(RTx-RTn)/(RTn+1-RTn)
(1)
其中:RIx为待测物质的保留指数;n为正构烷烃的碳原子数;RTx为待测物质的保留时间;RTn为正构烷烃Cn的保留时间。
1.3.5 5-HMF衍生物标准线性曲线的建立
3种5-HMF衍生物的标准品采用已知浓度的内标物溶液(环己酮)进行梯度稀释,配制一系列浓度的标准品溶液。
1.3.6 5-HMF衍生物的检出限和定量限
将低浓度的混合标准品溶液稀释得到一系列更低浓度的混合标准品溶液,按照3倍信噪比(signal-noise ratio,S/N)即S/N=3的浓度作为方法检出限,10倍信噪比即S/N=10的浓度作为方法定量限[17]。量取5 mL空白样品,加入1 μL混合标准溶液(3种5-HMF混合标准品溶液,10 mg/L)和10 μL内标物(1 mg/L),再逐倍稀释至S/N=10,3。
1.3.7 5-HMF衍生物的回收率
分别向洋槐原蜜中添加已知浓度的混合标准品溶液,混匀后进行HS-SPME-GC-MS处理分析,以蜂蜜初始浓度为空白对照,各浓度平行测定3次,根据式(2)计算回收率:
回收率/%=[加标样测量值/(试样测量值+加标量)]×100。
(2)
1.3.8 5-HMF衍生物的准确度和精密度
计算相对标准偏差(relative standard deviation,RSD)来表示精密度,相对误差(relative error,RE)反映准确度[19],根据式(3)计算:
准确度/%=[(1-测量值的平均值/理论真实值)]×100。
(3)
1.3.9 加热浓缩对5-HMF衍生物的影响
对6种蜂蜜样品中5-HMF衍生物进行HS-SPME/GC-MS检测分析,每个样品平行测定3次。蜂蜜样品放在4 ℃冰箱中冷藏。
1.3.10 数据统计分析
采用Excel 2016和SPSS 24.0软件进行数据统计分析。
2 结果与分析
2.1 5-HMF衍生物顶空固相微萃取条件的优化
由图1a可知,当pH=7时,分析得到的物质峰面积最大,是萃取5-HMF衍生物的最佳pH值。由图1b可知,比较4种萃取头萃取效果,发现75 μm CAR/PDMS萃取头可以更好吸附挥发性成分,因此选用75 μm CAR/PDMS的萃取头进行实验。由图1c可知,萃取温度从30 ℃到75 ℃,总峰面积随温度的增加呈现出先上升后略减少的趋势。可能是因为低温未达到5-HMF衍生物中部分挥发性成分的沸点,温度升高,挥发性物质挥发性增强,有利于萃取头对待测物质的吸附[19]。60 ℃时,总峰面积达到最大,萃取效率最高[20],因此,采用60 ℃为萃取温度。由图1d可知,总峰面积随萃取时间增加呈现先增加后减小的趋势,20 min的萃取时间得到的总峰面积最大,因此选择20 min为最佳萃取时间。
本文考察了萃取条件对挥发性成分提取效果的影响,确定HS-SPME萃取条件为:样品的pH=7,75 μm CAR/PDMS的萃取头,萃取温度为60 ℃,萃取时间为20 min。

2.2 蜂蜜样品中5-HMF衍生物的鉴定及标准曲线制定
本文以洋槐原蜜为原料,经HS-SPME-GC-MS分析后,得到蜂蜜中挥发性物质的总离子流图(见图2),从蜂蜜样品中鉴定出3种5-HMF衍生物(见表1)。任佳淼等[21]、王方莉[22]、Rering等[23]分别在不同蜂蜜样品中检测到糠醛、3-甲基-2-戊酮与2-乙基-1-己醇,这说明本研究结果与相关蜂蜜研究具有一致性。
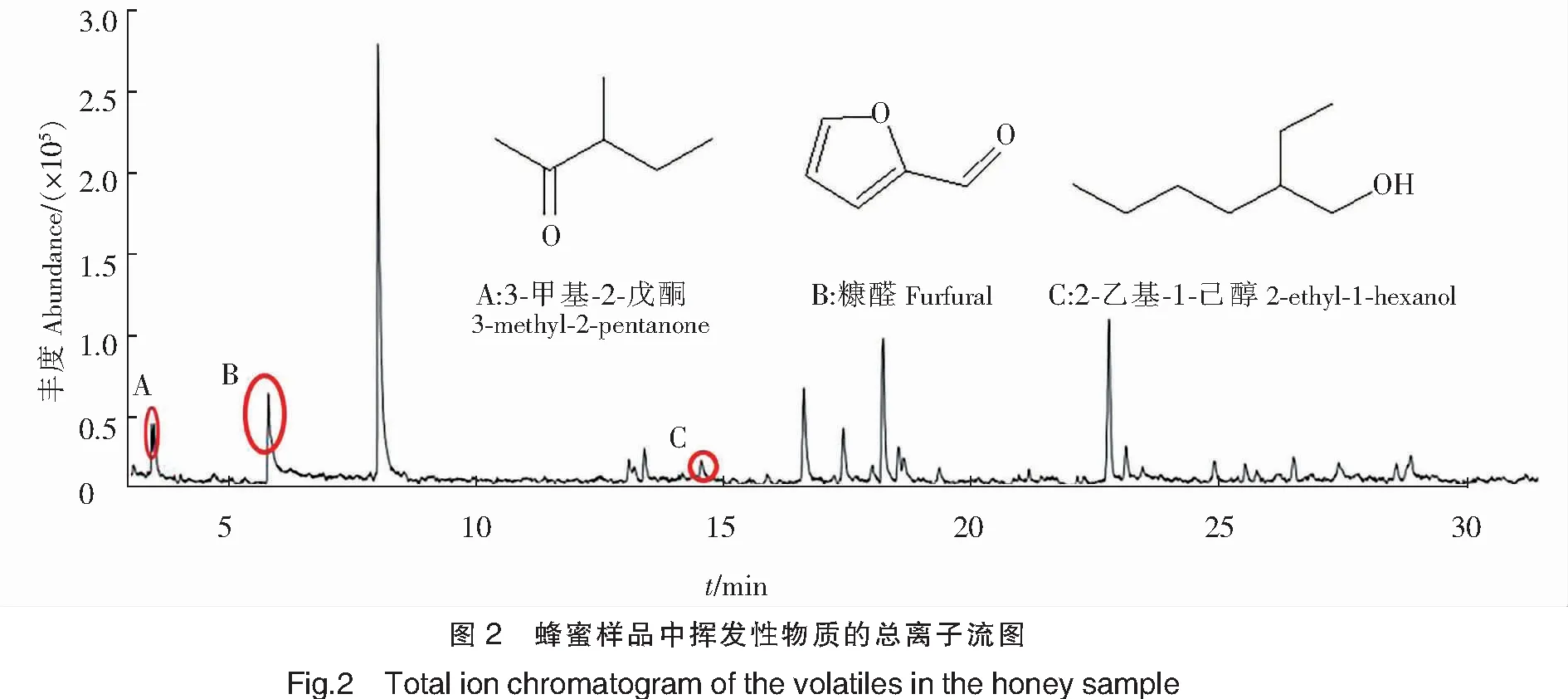
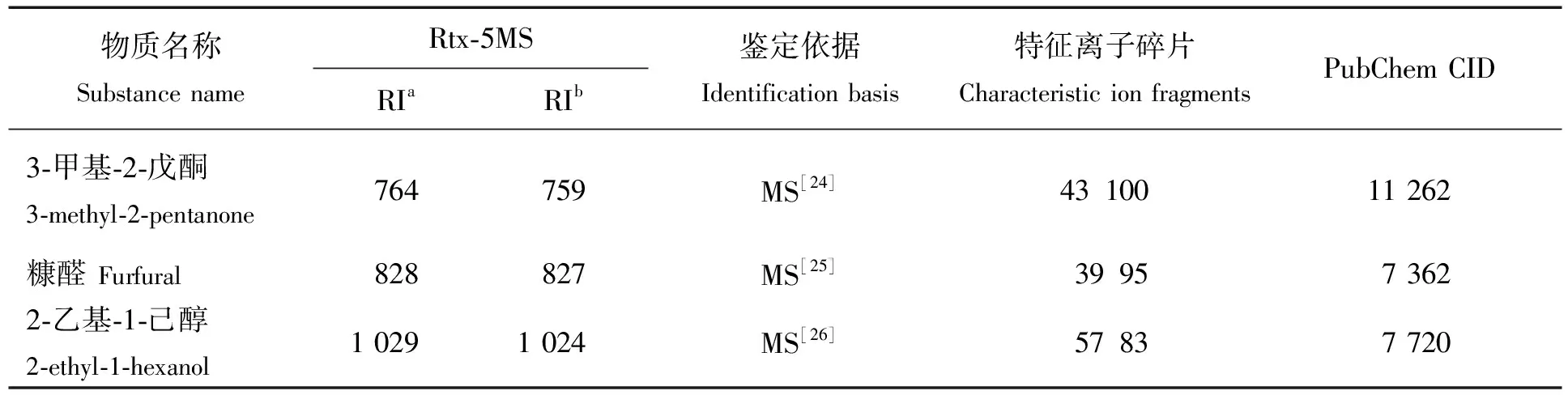
表1 6种蜂蜜样品挥发性成分的鉴定结果
如表2所示,3-甲基-2-戊酮、糠醛和2-乙基-1-己醇的标准曲线方程分别为Y=0.124X-5.820、
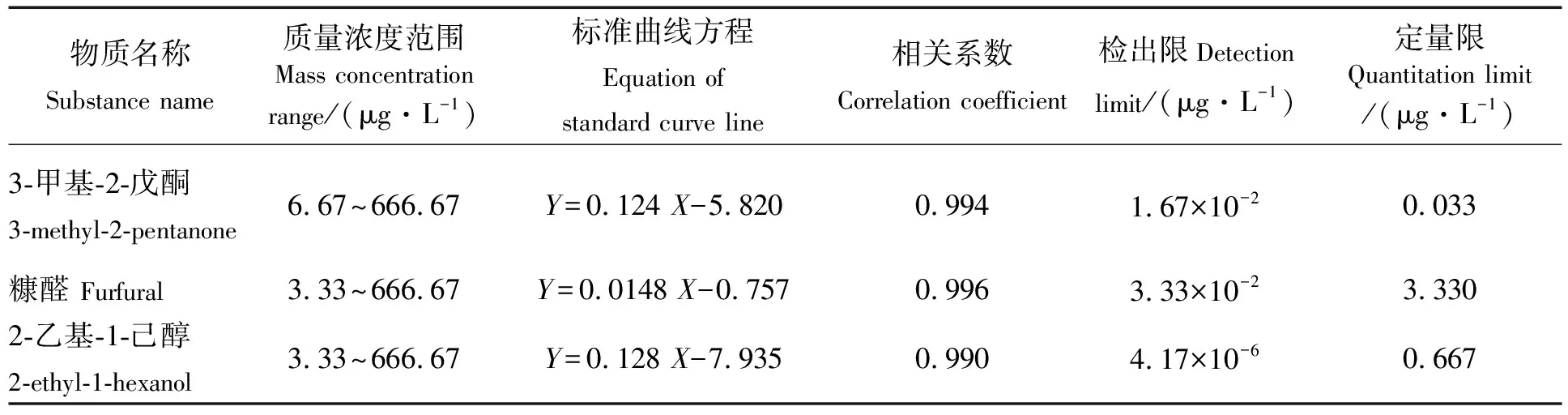
表2 5-HMF衍生物的标准曲线、检出限和定量限
Y=0.014 8X-0.757、Y=0.128X-7.935,相关系数均高于0.990,表明这3种5-HMF衍生物在质量浓度范围内呈良好的线性关系。这3种5-HMF衍生物的检出限和定量限结果见表2。李燕等[24]利用气相色谱-串联质谱法测定8种食品中的5-HMF,其方法的检出限为50 μg/kg,说明本方法灵敏度符合检测要求。
2.3 方法回收率
分别往样品中加入混合标准品溶液25,50,100 mg/L,采用相同的方法处理。崔钰莹等[27]利用气相色谱-三重四级杆串联质谱法测定发酵乳中4种糠醛类物质,平均回收率范围为82.2%~118%。本文中3-甲基-2-戊酮、糠醛和2-乙基-1-己醇的平均回收率范围是80.76%~115.5%(见表3),表明检测方法重现性好,数据较可靠。

表3 蜂蜜中5-HMF衍生物的回收率
2.4 方法准确度和精密度
分别以相对误差、相对标准偏差考察方法的准确度和精密度,测定结果见表4。由表4可知,蜂蜜中检测到的3种5-HMF衍生物的准确度均接近100%,且平行性良好,相对标准偏差为2.86%~8.02%。周斌等[28]利用GC-MS测定酱油中的糠醛类物质,RSD为2.1%~8.3%。由此可见,本方法重复性良好,测定准确可靠,可用于实际样品的测定。
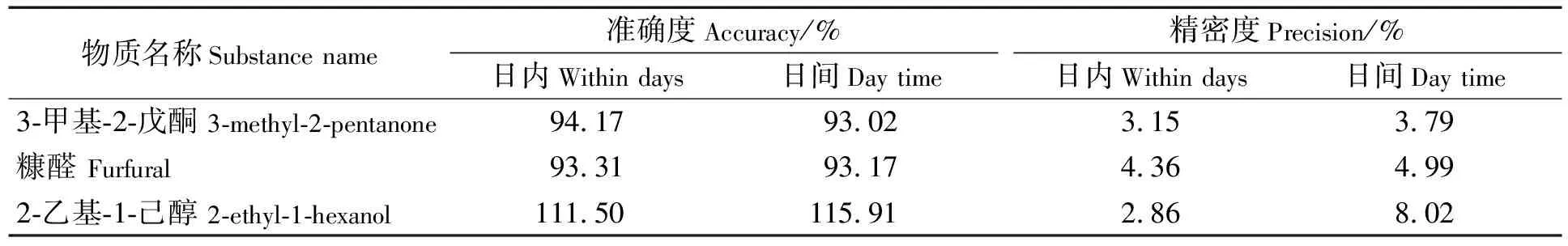
表4 方法准确度和精密度
2.5 实际样品的测定
浓缩蜂蜜加工需要经过融蜜、浓缩、灭菌等步骤[29],这些步骤中温度升高使果糖和葡萄糖脱水生成5-HMF,进而转换成5-HMF衍生物。随着储藏温度的升高和时间的增加[30],蜂蜜中5-HMF含量会增加,且温度越高,增加速度越快[31]。对6种蜂蜜样品中5-HMF衍生物进行定量分析(见表5)可知,3-甲基-2-戊酮在龙眼原蜜中含量最高(55.11 μg/L),在浓缩龙眼蜂蜜中含量最低(23.55 μg/L);糠醛在浓缩枇杷蜂蜜中含量最高(563.4 μg/L),在枇杷原蜜中最低(51.15 μg/L);2-乙基-1-己醇在洋槐原蜜中含量最高(67.97 μg/L),在枇杷原蜜中最低(63.55 μg/L)。通过比较可知,糠醛在3种原蜜中含量较低,但在对应的浓缩蜂蜜中含量明显升高;而3-甲基-2-戊酮和2-乙基-1-己醇含量在3种原蜜及对应的浓缩蜜之间无显著差异。结果表明,蜂蜜经过加热后,5-HMF及其衍生物含量会显著增高。同时说明,在蜂蜜加热过滤浓缩过程中产生的糠醛较稳定,其在浓缩蜂蜜中的含量显著高于原蜜的。因此,糠醛可作为区分加热与非加热蜂蜜的指标物质,为鉴别加热蜂蜜与原蜜提供了新的参考指标。
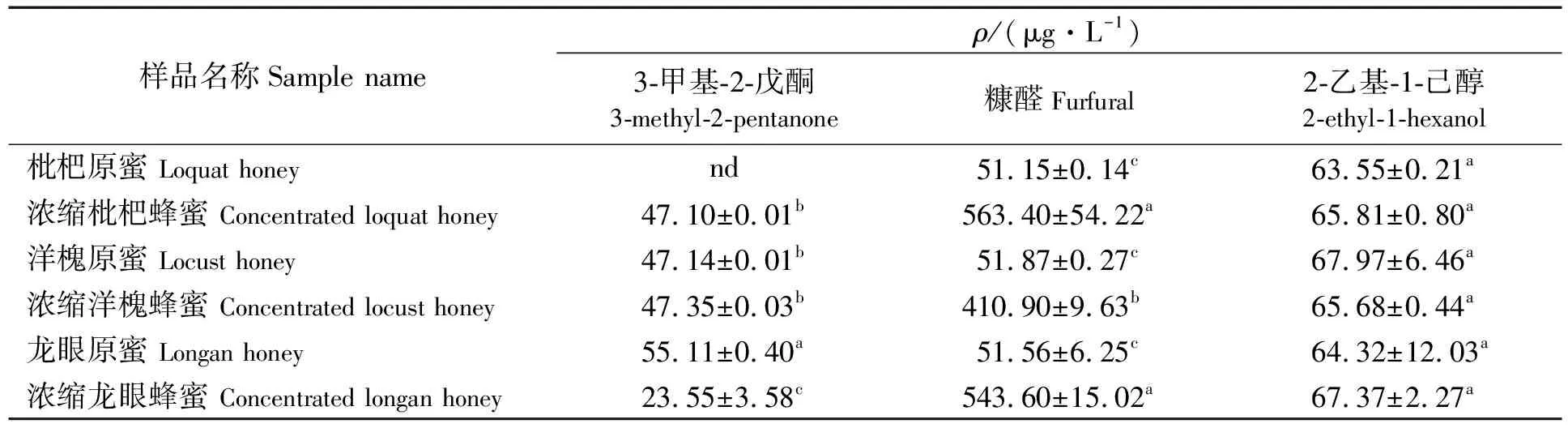
表5 6种市售样品中5-HMF衍生物的测定结果
3 结论
本研究采用HS-SPME-GC-MS分析蜂蜜中5-HMF衍生物,从市售原蜜及加热浓缩处理之后的蜂蜜中鉴定出3-甲基-2-戊酮、糠醛和2-乙基-1-己醇3种5-HMF衍生物成分,其中,糠醛在3种加热浓缩蜂蜜中的含量显著高于对应的3种原蜜,而3-甲基-2-戊酮及2-乙基-1-己醇含量在3种加热浓缩蜂蜜与对应原蜜之间没有显著差异。因此,蜂蜜中的糠醛含量可作为新鲜纯天然的原蜜与市场上其他蜂蜜区分的参考指标。
