氧化银微纳米粉体的制备研究
2022-06-18陈昆昆张卜升
陈昆昆,郑 晶,党 蕊,张卜升,杨 阳
(西北有色金属研究院,西安 710016)
氧化银(Ag2O)是一种具有简单立方结构的棕黑色粉体,其禁带宽度为1.46 eV,电化当量为0.231 Ah/g,主要用作有机合成催化剂、电池正极活性物质和电子浆料等,其中电子行业所消耗的氧化银占比为90%[1-4]。
目前,氧化银粉体的制备方法主要有电化学法、热分解法和化学合成法[5-7]。Murray 等[8]报道了采用电化学法合成氧化银微纳米颗粒,在碱性Na2SO4溶液体系中,以银线为阳极,通过改变阳极电位,制得漏斗形和花形的氧化银颗粒,并通过电解时间来调控颗粒尺寸,但是氧化银产率低,限制其实际应用。Mashkani 等[9]采用400℃热分解水杨酸银新型前驱体,在空气气氛中制得粒径40~50 nm 的六边形氧化银,但水杨酸银前驱体合成操作繁杂。
化学合成法制备氧化银是研究最广泛的,也是国内氧化银生产的主要方法。Wang 等[10]直接将硝酸银水溶液和氢氧化钠溶液混合,搅拌反应生成氧化银。Lyu 等[11]采用混合AgNO3、NH4NO3和NaOH溶液制得不同形状的氧化银纳米晶体,并通过三者摩尔比来调控氧化银晶体的生长。武慧芳[12]报道了在硝酸银溶液中加入氨水,配成银氨溶液,然后加入氢氧化钠溶液,充分搅拌反应,制得不同形貌的氧化银粉体,同时考察了有机聚合物对氧化银颗粒的影响。但是,该方法存在氧化银颗粒粒径分布不均匀、形貌不规则等问题。
本文分别采用常规方法、铵盐络合法和氨水络合法3 种化学合成法,以硝酸银作为初始原料开展一系列制备氧化银粉体的试验研究,并制备不同形貌和粒径的氧化银微纳米粉体,为实现氧化银粉体形貌和粒径的可控制备提供技术支撑。
1 实验
1.1 试剂及器材
实验原料及试剂:硝酸银,氢氧化钠,氨水,硝酸铵,无水乙醇,聚乙烯吡咯烷酮(PVP,相对平均分子质量为40000),试剂均为市售分析纯试剂,实验用水为去离子水。
仪器及设备:恒温加热磁力搅拌器,电子天平,电炉,真空干燥箱,离心机等常规实验设施。
1.2 实验方法
由于OH-与Ag+反应速度很快,过程难以控制。而利用NH3与Ag+络合成Ag(NH3)+离子,能有效减缓OH-与Ag+的反应速度,使得氧化银晶体生长过程得到有效控制。本研究采用化学合成法制备氧化银粉体,分别采用氨水或铵盐+氢氧化钠作为络合剂,硝酸银溶液与络合剂形成银氨溶液,以聚乙烯吡咯烷酮(PVP)作为分散剂,再用氢氧化钠溶液沉淀制得不同形貌的氧化银粉体;另外直接将硝酸银溶液与氢氧化钠溶液混合制得氧化银粉体。样品制备步骤如下:
1) 常规方法。将AgNO3溶液倒入250mL烧杯,并放置于磁力搅拌器中,启动搅拌,再将NaOH 溶液缓慢加入到AgNO3溶液,室温(25℃)下搅拌反应2h 后,离心过滤,并用去离子水洗涤至中性后再用无水乙醇洗涤一次,在80℃下真空干燥得到氧化银粉体。
2) 铵盐络合法。将AgNO3溶液和NH4NO3溶液依次倒入250mL 烧杯中,添加少量NaOH 溶液后超声处理1 min,放入磁力搅拌器中,在35℃下静置30 min 后,启动搅拌,再添加NaOH 溶液,室温(25℃)下搅拌反应5 min 后,离心过滤,并用去离子水洗涤至中性后再用无水乙醇洗涤一次,在80℃下真空干燥得到氧化银粉体。
3) 氨水络合法。将AgNO3溶液倒入250mL 烧杯,并放置于磁力搅拌器中,启动搅拌,缓慢添加NH3·H2O 溶液并搅拌5 min 后形成银氨溶液,再添加NaOH 溶液,室温(25℃)下继续搅拌反应5 min后,静置24h,离心过滤,并用去离子水洗涤至中性,再用无水乙醇洗涤一次,在80℃下真空干燥得到氧化银粉体。
上述步骤涉及如下化学反应:
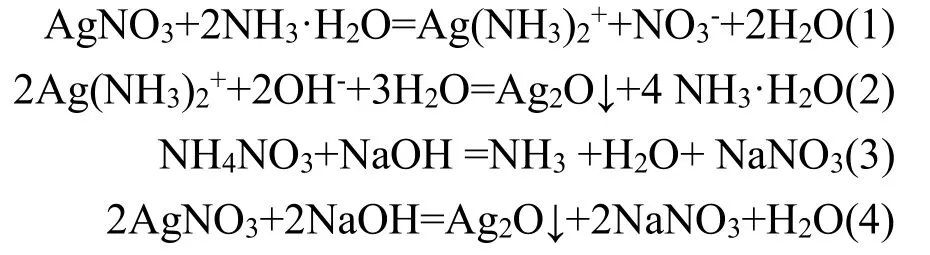
1.3 测定和表征
采用Bruker D8 Advance型X射线衍射仪(XRD)分析所得样品物相;JSM-6700F 型场发射扫描电镜(SEM)观察所得样品微观形貌,统计分析粒径;采用电子天平对所得样品进行称重。氧化银产率(X)的计算公式如下:
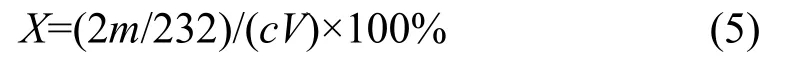
式中,m代表氧化银实际质量,g;c代表硝酸银溶液浓度,mol/L;V代表硝酸银溶液体积,L。
2 结果与讨论
2.1 常规方法制备氧化银粉体
配制2 份20mL 2mol/LNaOH 溶液,其中1 份不添加聚乙烯吡咯烷酮(PVP),另1 份添加0.1g PVP,再分别缓慢倒入100 mL 0.2mol/L AgNO3溶液中,在室温下搅拌反应2 h 后过滤,用去离子水洗涤至中性后再用无水乙醇洗涤一次,在80℃下真空干燥得到氧化银粉体,考察聚乙烯吡咯烷酮(PVP)对氧化银粉体形貌的影响,结果如图1 所示。
由图1可知,当AgNO3:NaOH摩尔比为1:2时,添加PVP 情况下制得的氧化银颗粒粒径更小,这是由于PVP 作为分散剂可增大颗粒的比表面积并降低粒子团聚[13]。PVP 中的羰基氧原子有孤对电子与Ag+形成共价键,从而形成保护作用,使得用于晶核成长的物种浓度降低,得到细微粒子,从而增大颗粒比表面积。但是,PVP 对氧化银粉体形貌无影响,不添加PVP 和添加PVP 两种情况下制得的氧化银粉体形貌均为类球形,粒径不均匀,平均粒径为0.1~0.5μm;氧化银产率均为100%。

图1 常规法制备氧化银粉体的SEM 图像Fig. 1 SEMimagesof Ag2O powder prepared by conventional method
2.2 铵盐络合法制备氧化银粉体
取50mL AgNO3溶液和50mL NH4NO3溶液,AgNO3浓度分别为 0.1 和 0.01mol/L,对应的NH4NO3浓度分别为0.2 和0.02mol/L,先添加5 或0.5mL2mol/LNaOH 溶液后超声处理1 min,并放入35℃水浴锅中静置30 min 后,再添加25mL 或10mL 2mol/LNaOH 溶液,控制AgNO3:NH4NO3:NaOH 摩尔比为1:2:12 或1:2:42,制得如图2 所示的氧化银粉体。
由图2 可知,采用铵盐络合法,NH4NO3先与NaOH 反应形成NH3,NH3再与AgNO3络合形成银氨溶液,可制备出正八面体或削角八面体的氧化银粉体。这是由于在较高的反应物浓度下,氧化银晶体沿[100]方向的生长速率大于沿[111]方向生长速率,从而形成正八面体;而在较低的反应物浓度下,氧化银晶体沿[100]和[111]方向的生长速率相当,从而形成削角八面体[11]。另外所得氧化银粉体粒径均匀,其平均粒径为1~2 μm,氧化银产率均为100%。

图2 不同AgNO3:NH4NO3:NaOH 摩尔比制备得到的氧化银粉体的SEM 图像Fig. 2 SEM images of Ag2O powder preparedat different AgNO3:NH4NO3:NaOH molar ratios
2.3 氨水络合法制备氧化银粉体
取50mL AgNO3溶液,当AgNO3浓度分别为0.1、0.05 和0.01 mol/L 时,在搅拌条件下分别对应加入50mL 0.2、0.1 和0.02 mol/L NH3·H2O 或0.4、0.2 和0.04 mol/L NH3·H2O 络合形成银氨溶液,搅拌5 min 后分别添加5mL 2mol/LNaOH,在室温下搅拌反应5 min 后,静置24h,离心过滤,并用去离子水洗涤至中性再用无水乙醇洗涤一次,在80℃下真空干燥得到氧化银粉体,考察AgNO3:NaOH 和AgNO3:NH3·H2O 摩尔比对氧化银粉体形貌和粒径的影响,结果如图3 和图4 所示。
由图3 可知,采用氨水络合Ag+时,当AgNO3:NH3·H2O 摩尔比为1:2,NaOH 浓度为2 mol/L 时,随着AgNO3:NaOH 摩尔比增大,由于氧化银在碱性溶液中具有较大的溶解度[14],NaOH 溶液侵蚀氧化银颗粒的棱角和棱边,使氧化银颗粒球形化,从而依次制得八面体、削角八面体、类球形氧化银粉体,平均粒径分别为0.4~0.8、0.3~0.6、0.2~0.4 μm,氧化银产率分别为53.45%、58.62%、100%。

图3 不同AgNO3:NH3·H2O:NaOH 摩尔比制备得到的氧化银粉体的SEM 图像Fig. 3 SEM images of Ag2O powder prepared at different AgNO3:NH3·H2O:NaOH molar ratios
由图4 可知,采用氨水络合Ag+时,其他条件不变,控制AgNO3:NH3·H2O 摩尔比为1:4,NaOH浓度为2mol/L 时,可分别制得六足体、六足体(花状)、正方体形氧化银粉体,平均粒径分别为3~4、4~5 和0.5~1μm,氧化银产率分别为5.17%、31.03%、51.72%。由于氨水络合作用,Ag+被氨分子包围,阻碍Ag+与OH-反应[12],导致氧化银的产率降低。

图4 不同AgNO3:NH3·H2O:NaOH 摩尔比摩尔比制备得到的氧化银粉体的SEM 图像Fig. 4 SEM images of Ag2O powder prepared at different AgNO3:NH3·H2O:NaOH molar ratios
因此,增大AgNO3:NH3·H2O 摩尔比有利于制得较大粒径的氧化银粉体。由于氨水络合作用增强,更有利于形成带菱角的氧化银粉体,但产率会降低。
2.4 三种制备方法的综合对比
将常规法、铵盐络合法和氨水络合法制备氧化银粉体时对应的氧化银产率作对比,如表1 所列。

表1 不同制备方法对氧化银产率的影响Tab. 1 Effect of different preparation methods on Ag2O yield
由表1 可知,采用常规法和铵盐络合法时氧化银产率均为100%,但铵盐络合法操作工序较多,不利于工业应用;而采用氨水络合法时氧化银产率较低,且随着NH3·H2O 摩尔占比增加,氧化银产率继续减小。因此采用氨水络合法时,为获得较高氧化银产率,应增大NaOH 摩尔占比。
对氨水络合法所得氧化银粉体进行XRD 物相表征,结果如图5 所示。
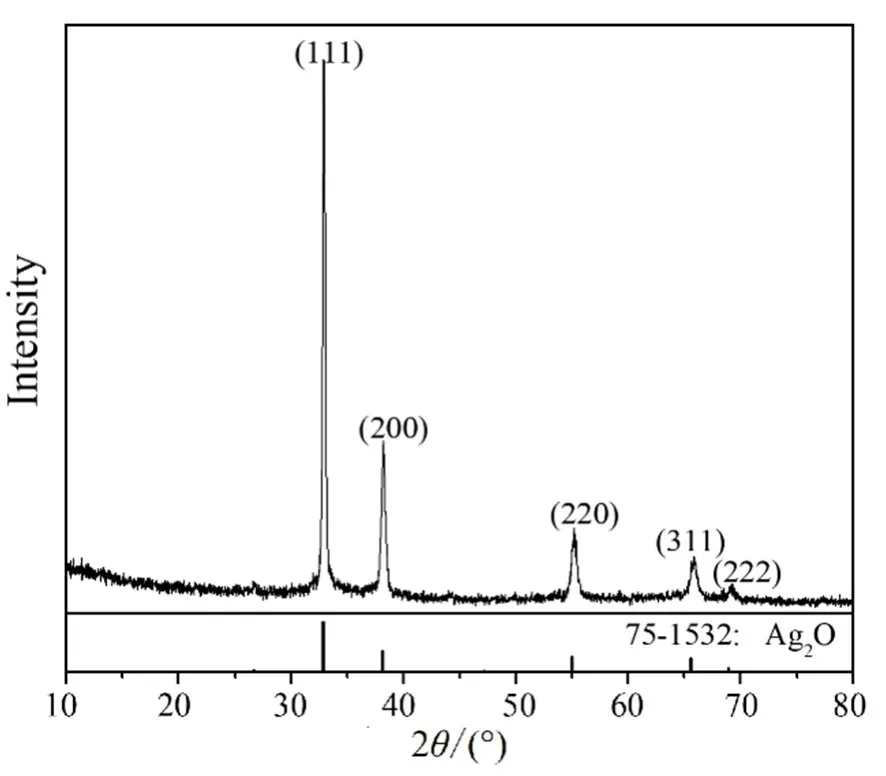
图5 Ag2O 粉体的XRD 图谱Fig. 5 XRD pattern of Ag2O powder
图5 中在2θ为32.853°、38.116°、55.004°、65.570°和68.883°处有明显的衍射峰,与PDF#75-1532 的数据基本吻合,分别与立方晶系氧化银的(111)、(200)、(220)、(311)和(222)晶面对应,且衍射峰非常尖锐,无其他杂峰。
3 结论
1) 采用常规方法制备氧化银时,添加PVP 可减小氧化银粉体粒径,但对其形貌无影响,所得氧化银粉体形貌为类球形,粒径不均匀。
2) 采用铵盐络合法可制备出正八面体和削角八面体的氧化银粉体,且粒径均匀,其平均粒径为1~2 μm,氧化银产率为100%。
3) 采用氨水络合法可制备出八面体、削角八面体、类球形、六足体、正方体的氧化银粉体,随AgNO3:NH3·H2O 摩尔比增大,氧化银粉体粒径增大,氧化银产率降低,所得氧化银粉体无杂质相。
