谷子SHR 基因的全基因组鉴定与表达分析
2022-06-16李露露李艳芬尹美强原向阳温银元
李露露,李艳芬,尹美强,赵 娟,原向阳,温银元
(山西农业大学 农学院,山西 太谷 030801)
谷子(Setaria italic)因其根系发达、次生根生长数量多、密集、庞大,且具有耐瘠薄、耐干旱,适应性强等特点[1-2],深入开展对谷子根系的研究对提高谷子的抗倒伏能力以及抗旱保苗能力至关重要,同时对于谷子的高产栽培也具有重要意义。
研究发现,GRAS 家族蛋白是植物特有的一类转录因子,分为8 个亚家族:SCL、LISCL、SHR、PAT1、DELLA、SCR、LS、HAM,参与植物的信号转导、根和腋芽的发育、根瘤和菌根的形成、生长发育、信号转导、解毒作用、胁迫相关的应答过程[3]。其中,SHORT-ROOT基因(SHR)对根的辐射模式和根顶端分生组织的形成至关重要[4-5]。BENFEY等[6]于1993 年首次发现SHR基因,它与拟南芥根的伸长生长和辐射形态形成有关。2000 年,拟南芥的SHORT-ROOT基因(AtSHR)被成功克隆,其编码区全长1 593 bp,在根和茎中都有转录产物[7]。shr突变体的凯氏带结构消失[8],内皮层缺失,只保留有皮层,表现出短根、不定根增多的表型[9-10]。THOMAS 等[11]研究表明,SHR基因可作为细胞增殖的调节因子,影响玉米叶片维管组织和花环结构的形成而调控叶片的发育。此外,SHR基因还介导植物生长发育过程中许多重要的信号途径[12-13],参与生长素的极性运输(PIN3、PIN7、CYP79B2和SPS等12 个基因)[14-15]、侧根和不定根的发生[16]、根尖分生组织干细胞的维持[17]、GA 信号转导途径(GA3、SNE、RGL1 和RGL2基因)[18]和油菜素内酯的生物合成、信号转导和感应(BIN3、BRL3、Br6ox2和CYP90D1基因)[19-20]等多种代谢过程。
目前,已在多种植物如水稻[21]、甘蓝型油菜[22]、白杨[23]和蒺藜苜蓿[24]等植物中发现了SHR基因,但在谷子中关于SHR基因的特征与表达模式的研究尚未见报道。
本研究参照AtSHR基因,在NCBI和Phytozome数据库中筛选谷子的SHR基因,对其加以鉴定和生物信息学分析,并对SHR基因在谷子不同生育时期各组织中的表达模式进行分析,旨在为进一步研究谷子SHR 蛋白的功能、作用途径和谷子根的生长发育及其辐射形态的形成提供参考依据。
1 材料和方法
1.1 谷子SHR 基因的鉴定和基因信息挖掘
以AtSHR基因(AT4G37650)的cDNA 序列为基础,在NCBI、Phytozome 上对谷子全基因组进行BLASTn 比对,获得SiSHR基因,下载拟南芥、水稻和谷子SHR基因的全基因序列、CDS 序列和蛋白序列用于后续生物信息学分析。利用已获得的SHR基因的全基因序列和CDS 序列在GSDS 在线工具中绘制谷子SHR基因、拟南芥和水稻SHR基因的基因结构图[25];用MEME 4.10.2(http://memesuite.org/tools/meme)在线软件进行motif 分析[26]。并用MEGA 7.0 软件构建SHR基因的系统发育树,分析其进化关系。用SHR基因转录起始位置(ATG)上游2 000 bp 的序列,利用PlantCARE 在线数据库进行启动子顺式作用元件分析。
1.2 SiSHR 蛋白的理化性质分析和空间结构预测
用ProtParam(http://web.expasy.org/protparam/)[27]分析谷子SHR 蛋白的理化性质和氨基酸组成,并用ProtScale 分析其疏水性。采用在线工具PRABI(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=/NPSA/npsa_sopma.html)对其二级结构进行预测;谷子和拟南芥SHR 蛋白的三级结构利用在线软件SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测。
1.3 SiSHR 基因在谷子中的组织特异性表达分析
以晋谷42 号为材料,分别在苗期和灌浆期取谷子根、茎、叶、叶鞘、穗颈、穗共6 个组织,液氮速冻,保存于-80 ℃超低温冰箱中。
使用Primer Premier 5.0 设计引物(表1),以谷子Actin基因作为内参基因,引物由上海生工生物有限公司合成。采用改良RNSiso Plus 法[28]提取总RNA 并反转录为cDNA,稀释3 倍于-20 ℃保存。qRT-PCR使用SYBR®PremixExTaqⅡ(TliRNaseH Plus)试剂盒(TaKaRa)完成。采用2-ΔΔCt计算相对表达量,每个样品3 个重复。

表1 SHR 蛋白引物序列Tab.1 Primer sequence of SHR proteins
2 结果与分析
2.1 SiSHR 基因的鉴定和生物信息学分析
以AtSHR的cDNA 序列为模板,在NCBI、Phytozome 上对谷子全基因组进行BLASTn 比对,获得了2 个SiSHR基因,分别命名为SiSHR1(Seita.9G355300)、SiSHR2(Seita.2G372300),其中SiSHR1基因的CDS 长度为1 908 bp,编码635 个氨基酸,位于谷子的9 号染色体上;SiSHR2基因的CDS 长度为1 785 bp,编码594 个氨基酸,位于谷子的2 号染色体上。
用GSDS 绘制SHR基因的基因结构图如图1所示,与水稻和拟南芥相比,SiSHR基因在结构上基本一致,SiSHR基因与水稻和拟南芥的SHR基因都只有1 个外显子,没有内含子。SHR基因的基因结构物种间差异不大。
系统进化分析结果表明,SiSHR基因与OsSHR基因在进化上同源性较高(图2-A)。SiSHR1基因与OsSHR1基因聚为一类,SiSHR2基因与OsSHR2基因聚为一类,拟南芥、烟草(A0A1S4A5 E5 TOBAC)、辣 椒(A0A2G3AB65 CAPAN)的SHR基因聚为一类。motif 分析发现了10 个保守基序,依次命名为motif 1~motif 10(图2-B)。其中,motif 6 位于氨基酸序列中部,为VHIID 保守基序,motif 9 为PFYRE 保守基 序,motif 10 为SAW保守基序(图2-C)。SHR 蛋白在结构上总体保守。

图2 SHR 蛋白的系统进化分析与motif 分析Fig.2 Phylogenetic analysis and motif analysis of SHR proteins
2.2 SiSHR 基因的启动子区顺式作用元件分析
为认识SiSHR基因应答各种反应的潜在机制,分析了其启动子区顺式作用元件,结果如图3所示,2 个SiSHR基因的启动子区均含有光信号、激素(ABA、生长素、MeJA)、胁迫(低温)、分生组织表达、醇溶蛋白代谢调控相关元件和MYBHv1 转录因子结合位点。除此之外,SiSHR1特有昼夜节律控制响应元件和GA 代谢响应元件,SiSHR2特有细胞周期调控元件和水杨酸响应元件。存在的这些调控元件说明SiSHR基因家族成员不仅能够响应光、胁迫等外界环境信号,而且还能应答多种激素信号,调控谷子的生长发育。

图3 SiSHR 基因启动子区域顺式作用元件分析Fig.3 Cis-acting elements analysis in SiSHR gene promoter region
2.3 SiSHR 蛋白的理化性质和二、三级结构分析
谷子SHR 蛋白的理化性质分析结果表明(表2),SiSHR1 蛋白的分子式为C2933H4485N877O943S15,分子质量为67 601.09 u,其中丝氨酸(Ser,14.0%)含量最高;SiSHR2 蛋白的分子式为C2784H4299N817O899S16,分子质量为64 111.65 u,其中丝氨酸(Ser,13.3%)与丙氨酸(Ala,13.3%)含量最高;SiSHR1 蛋白和SiSHR2 蛋白的等电点均小于7,不稳定系数均大于40,平均亲水性指数均小于0,说明SiSHR1 和SiSHR2 均为酸性不稳定的亲水蛋白。ProtScale 疏水性分析结果也表明,SiSHR 是亲水蛋白(图4)。

表2 谷子SHR 蛋白的理化性质Tab.2 Physical and chemical properties of SiSHR protein in Setaria italica
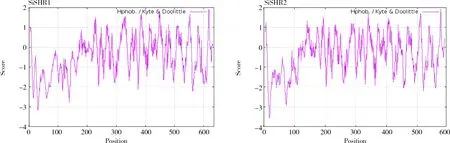
图4 SiSHR 蛋白的疏水性预测Fig.4 Hydrophobicity prediction of SiSHR proteins
PRABI 对SiSHR 蛋白的二级结构预测结果如图5 所示,主要由α-螺旋和无规则卷曲组成,约占85%。对SiSHR 蛋白进行三级结构的建模发现(图6),谷子SHR 蛋白空间构象(包括二级结构的走向和空间折叠方向)与拟南芥的十分相似,二者均模拟到5b3g.1 模型,为SHORT-ROOT 蛋白模型。

图5 SiSHR 蛋白二级结构预测Fig.5 Secondary structure prediction of SiSHR proteins

图6 SHR 蛋白三级结构预测Fig.6 Tertiary structure prediction of SHR proteins
2.4 SiSHR 蛋白互作分析
为探究谷子中SHR 蛋白在谷子生长发育过程中的作用,对SiSHR 蛋白的互作情况进行预测,结果发现,SiSHR1 和SiSHR2 均为根形态建成的核心作用因子(图7),均可与5 个蛋白互作,CYCLIN家族蛋白(Si032222m)调控细胞周期,C2H2 转录因子蛋白(Si005031m)调控分生组织的形成,GRAS 转录因子家族的SCL 蛋白(Si032551m)调控根的生长发育,SHBY 家族蛋白(Si013112m)调控细胞分裂,WOX 家族蛋白(Si002900m)调控根尖的生长,Ser/Thr 蛋白激酶(Si016636m)与植物生长发育过程中的多种途径有关。其中,SHR 蛋白与SCL 蛋白以共表达方式进行互作,其他蛋白与SHR 蛋白具体的互作情况还有待进一步试验验证。

图7 SiSHR 蛋白互作分析Fig.7 Interaction analysis of SiSHR proteins
2.5 SiSHR 基因的时空表达模式分析
以晋谷42 号的不同组织为材料,分析SHR基因在谷子中的时空表达情况,结果发现(图8),SiSHR1 和SiSHR2这2 个基因在谷子不同生育时期存在不同程度的表达,呈现出时空特异性。这2个基因在萌发3 d 的种子中都有一定的表达;在苗期,2 个SHR基因在根、茎、叶中均有表达,其中根中表达量最高,在茎中表达量最低;在灌浆期,2 个基因在根中高表达,在其余组织中表达量则很低。说明SHR基因在谷子根系的形态建成过程中有重要作用,同时也参与谷子苗期叶的生长。除根以外的其他组织中,SiSHR1的表达量均低于SiSHR2,且除根和叶以外的其他组织中SiSHR1的表达量很低,说明SiSHR基因对谷子的萌发、叶片发育及根的形态建成由SiSHR1、SiSHR2共同调控,而对其他方面的调控主要是SiSHR2在起作用。

图8 SiSHR1/SiSHR2 基因的组织特异性表达Fig.8 Tissue-specific expression of SiSHR1/SiSHR2 genes
3 结论与讨论
谷子有发达的根系,次生根密集。SHR基因介导侧根和不定根的发生、维管束细胞的发育以及根尖分生组织的生长,对根的形态构成有重要作用[5,12,16-17]。研究发现,不同物种中存在SHR基因数目的不同,拟南芥中有1 个[6],水稻中有2 个[21],在谷子基因组中鉴定到2 个SHR基因,编码的蛋白含有VHIID 结构域和PFYYE 结构域,它们是SHR蛋白保持活性的必要结构域,SHR 蛋白在VHIID结构域与其他转录因子结合发挥作用[29]。
有研究发现,GA 信号与SHR 共同调控拟南芥根的形成[30];SHR 和SCR 可以促进PIN 蛋白的表达和极性分布,调控根尖生长素转运[31];生长素响应因子(ARFs)调控SHR 由维管组织向基本组织移动[32],同时它可以促进生长素从胚芽向胚根运输,为胚根提供生长素的位置信号[33]。在侧根原基形成过程中,SHR 启动子介导mIAA14-GR 影响侧根原基中的生长素信号,抑制侧根的形成[34]。本研究中,SiSHR基因的启动子区含有GA、生长素、水杨酸和ABA 信号响应元件,可能通过调控GA、生长素、水杨酸和ABA 信号途径参与调控谷子根的形态建成;蛋白互作预测结果表明,SiSHR 蛋白与SCL 蛋白的互作方式为共表达,与拟南芥中SHR基因与SCR基因和SCL基因常形成SHR-SCRSCL3 复合体共同影响根辐射的形态形成[35]的研究结果一致。
有研究发现,SHR基因缺失导致植物出现短根的形态[30],在本研究中,SiSHR1/SiSHR2基因在谷子的苗期和灌浆期在根中均有相对较高的表达量,且在苗期根中的表达量高于灌浆期的表达量,由此推测,SiSHR基因在谷子中有调控根系形成的作用。SHR的过表达促进叶脉组织形成,zmshr1突变体的维管组织、叶组织发育不正常(包括叶肉细胞和维管鞘细胞)[11];拟南芥SHR功能缺失抑制细胞分裂、扰乱细胞核内复制过程,导致细胞增殖过程提前停止[36],shr突变体和scr突变体的莲座叶生长受到抑制[37];OsSHR2在发育的小叶脉中表达,促进气孔分化,但OsSHR1不表达[38];SiSHR1在叶片中的表达量低于SiSHR2,与水稻中一致,SiSHR基因在谷子苗期叶片中的相对表达量远高于灌浆期成熟的叶片中的表达量,表明SiSHR基因可能调控谷子叶片的发育。由此推测,谷子的萌发、叶片发育及根的形态建成由SiSHR1、SiSHR2共同调控,而对其他方面的调控主要是SiSHR2在起作用。
本研究从谷子中鉴定出2 个SHR基因,其中,SiSHR1基因位于9 号染色体,编码635 个氨基酸;SiSHR2基因位于2 号染色体,编码594 个氨基酸。SiSHR 蛋白均为不稳定的酸性亲水性蛋白,二级结构主要由α-螺旋和无规则卷曲组成,三级结构预测与SHORT-ROOT 蛋白模型(5b3g.1)相似。值得注意的是,SiSHR启动子区含有光、激素(GA、ABA、生长素、水杨酸)等响应元件,SHR 蛋白与CYCLIN、C2H2、SCL、SHBY、WOX 蛋白互作,其中SiSHR 蛋白与SCL 蛋白的互作方式为共表达,故推测SiSHR 蛋白可能通过应答GA、生长素和ABA 信号途径,及蛋白互作的方式参与调控。进一步对晋谷42 号中SiSHR基因在不同时期组织中的表达进行差异分析,结果发现,SiSHR1/SiSHR2基因在根中的表达量最高;更重要的是,苗期根和叶片中的表达量均显著高于灌浆期根和叶片中表达量,表明SiSHR基因的表达参与调控谷子根的形态建成和叶片发育,为谷子SiSHR基因在根和叶片中的调控机制研究奠定了理论基础。
