玫瑰茄多糖对HeLa细胞凋亡相关蛋白的影响
2022-06-15王家豪王冰烃郑大恒
王家豪 陈 晨 王冰烃 郑大恒
(绍兴文理学院 生命科学学院,浙江 绍兴 312000)
多糖(Polysaccharides)又被称作多聚糖,是由10个或10个以上的单糖通过糖苷键连接而成的高分子化合物,其相对分子质量为数万至数百万[1].多糖广泛存在于生物体中,是生物体内重要的生物大分子,广泛参与细胞增殖、细胞分化、细胞迁移以及细胞的信号识别和传导等[2].多糖在自然界分布极广,存在于动物、植物及微生物体内[3], 具有抗氧化、 抗肿瘤等多种生物活性[4].
玫瑰茄(HibiscussabdazifaL.)又名山茄、洛神花、洛神葵,属锦葵科木槿属一年生药食同源植物,玫瑰茄中含有多糖、黄酮、多酚、花色苷等多种成分[5],具有抗炎[6]、抗高血压、调血脂等多种药理作用[7].多糖作为玫瑰茄中重要的生物成分,研究表明具有提高机体免疫力的功效[8],然而关于玫瑰茄多糖是否具有抗肿瘤活性少有报道.
宫颈癌作为最为常见的妇科恶性肿瘤之一,其全球死亡率仅次于乳腺癌,位于全球第二.HeLa细胞作为研究宫颈癌的模式细胞,研究表明植物多糖可以诱导HeLa细胞凋亡[9-10],然而玫瑰茄多糖是否能引起HeLa细胞凋亡未见报道.因此,本研究选择HeLa细胞,探究玫瑰茄多糖对其诱导凋亡的作用.
1 材料与方法
1.1 材料
玫瑰茄,购自东莞市巴科医药科技有限公司;HeLa细胞,购自中国科学院上海细胞研究所;MTT细胞增殖检测试剂盒、DMEM培养基、胎牛血清(FBS)购自美国Bio-Rad生物有限公司;蛋白提取试剂盒、BCA蛋白定量试剂盒以及Western Blot试剂盒,购自碧云天生物有限公司;Bax、Bcl-2、pro-Caspase-3、Caspase-3和二抗β-actin购于美国BBI公司;其余试剂均为国药集团分析纯试剂.
1.2 方法
1.2.1 玫瑰茄多糖的制备与纯化
采用水提醇沉法制备玫瑰茄粗多糖,具体如下:定量称取干燥玫瑰茄粉末,置于洁净干燥的500 mL圆底烧瓶中,按1∶25料液比,95 ℃水浴温度,浸提3 h.冷却后将所得水提液抽滤去除杂质,合并上清液,减压浓缩,将浓缩后的上清液加入烧杯中,缓慢加入95%乙醇(边加边用玻璃棒顺时针搅拌)至乙醇的最终浓度为80%,充分搅拌后放入4 ℃冰箱静置过夜,4 000 rpm离心10 min,收集沉淀用双蒸水复溶后挥醇,加15%三氯乙酸除去蛋白,用0.1 M NaOH调pH 7.0后装入透析袋,流水透析48 h,蒸馏水透析24 h,冷冻干燥后得到玫瑰茄粗多糖.将制备好的粗多糖采用DEAE-52纤维素交换树脂法纯化,以ddH2O洗脱控制流速为1 min/mL,采用硫酸-苯酚法进行糖含量测定,收集水洗多糖组分,冷却干燥后得到玫瑰茄纯化多糖.
1.2.2 细胞的培养
取HeLa细胞在37 ℃、5% CO2培养箱中培养.当贴壁细胞数量达到80%~90%时,无菌条件下,弃去原培养液,用PBS溶液清洗两次,然后加入胰蛋白酶1 mL消化1 min弃去,加入含10%FBS的DMEM培养液,用移液枪吹打贴壁的细胞,当细胞成为均匀的单细胞悬液后,停止吹打,将细胞悬液按1∶3比例转移至新的细胞培养皿中,加入培养液,放于培养箱中培养.
1.2.3 玫瑰茄多糖对HeLa细胞增殖的影响
取玫瑰茄多糖至离心管中,放入超净台,在离心管中加入不含FBS的DMEM培养液配置浓度为4 mg/mL的多糖溶液,上下摇晃至多糖溶解,过滤至无菌,加入10%的胎牛血清,然后用含10% FBS的DMEM培养液稀释玫瑰茄多糖至终浓度为3 mg/mL、2 mg/mL、1 mg/mL和0.5 mg/mL.
取对数生长期的HeLa细胞,制成悬液后计数,用含FBS的DMEM培养液调整细胞浓度为2×105个/mL,接种于96孔板上,每孔100 μL.培养24 h弃去原培养液,分别加入100 μL含玫瑰茄多糖的培养液, 使玫瑰茄多糖的浓度分别为4 mg/mL、3 mg/mL、2 mg/mL、1 mg/mL、0.5 mg/mL,以不加玫瑰茄多糖的培养液生长的细胞作为阴性对照,每个组别设置5个复孔.培养48 h后,弃去原有培养液加入100 μL MTT试剂,培养4 h,弃去上清液,每孔加入100 μL DMSO放置摇床振荡1 h 后,于570 nm下测定吸光度,并按公式细胞抑制率(%)=(A1-A2)/A1×100%计算其抑制率,其中,A1表示空白对照组细胞的OD值的平均值;A2表示加玫瑰茄多糖组的细胞OD值的平均值.
1.2.4 HeLa细胞凋亡相关蛋白表达的检测
取对数生长期的HeLa细胞,调整细胞浓度为5×105个/mL接种于6孔板培养24 h,分别加入4 mg/mL和1 mg/mL的玫瑰茄多糖的培养液作为高剂量组和低剂量组,同时不添加玫瑰茄多糖的正常对照组作为空白对照,培养24 h,按蛋白提取试剂盒制备细胞浆蛋白,BCA试剂检法测定蛋白浓度,采用western-blot法[11]检测细胞浆蛋白中Bax、Bcl-2、pro-Caspase-3和Caspase-3的表达量,采用Quantity One软件分析目标蛋白的灰度.
1.3 统计与分析
数据采用SPSS 21.0统计软件进行分析,结果均用Mean±SD表示,采用ANOVA进行方差分析,P<0.05被认为有显著性差异,具有统计学意义.
2 结果和分析
2.1 玫瑰茄多糖的制备
通过水提醇沉法和DEAE-52纤维素离子交换柱制备玫瑰茄纯化多糖.采用硫酸-苯酚法测定纯化后的玫瑰茄多糖,发现随着洗脱时间的延长,从第2管到第18管检测到了糖的存在,并且第10管的糖含量达到峰值(如图1),收集了第6管到第14管的组分进行冻干,从而获得玫瑰茄多糖纯化组分.
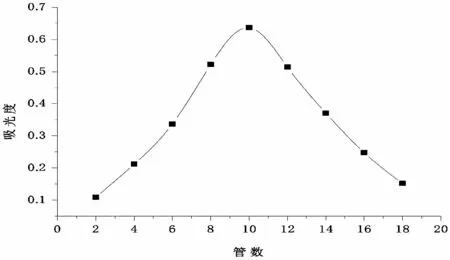
图1 玫瑰茄纯化多糖的洗脱曲线
2.2 玫瑰茄多糖对HeLa细胞增殖的影响
采用0.5~4 mg/mL浓度的玫瑰茄多糖作用HeLa细胞后,HeLa细胞的增殖活性降低,并且随着多糖浓度的升高,细胞抑制率也升高,呈现正比例关系. 当玫瑰茄多糖浓度为2 mg/mL、3 mg/mL、4 mg/mL时,HeLa细胞增殖活性被显著抑制(P<0.05,P<0.01)(见图2).
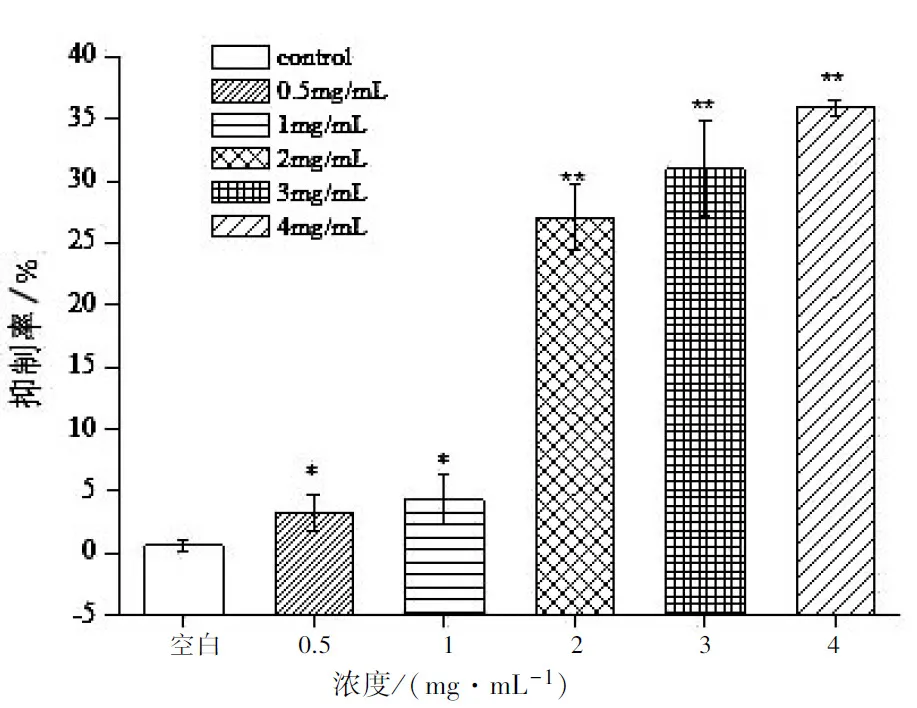
图2 玫瑰茄多糖对HeLa细胞增殖的影响
2.3 玫瑰茄多糖对HeLa细胞相关凋亡蛋白的影响
2.3.1 玫瑰茄多糖对Bax蛋白的影响
Western Blot分析方法是一种可以检测样品内蛋白含量的方法.对于HeLa细胞内的Bax蛋白,与对照组相比,添加玫瑰茄多糖后HeLa细胞内的Bax蛋白含量明显增高(P<0.01),随着玫瑰茄多糖浓度增大,Bax蛋白含量呈现剂量依赖性(图3).
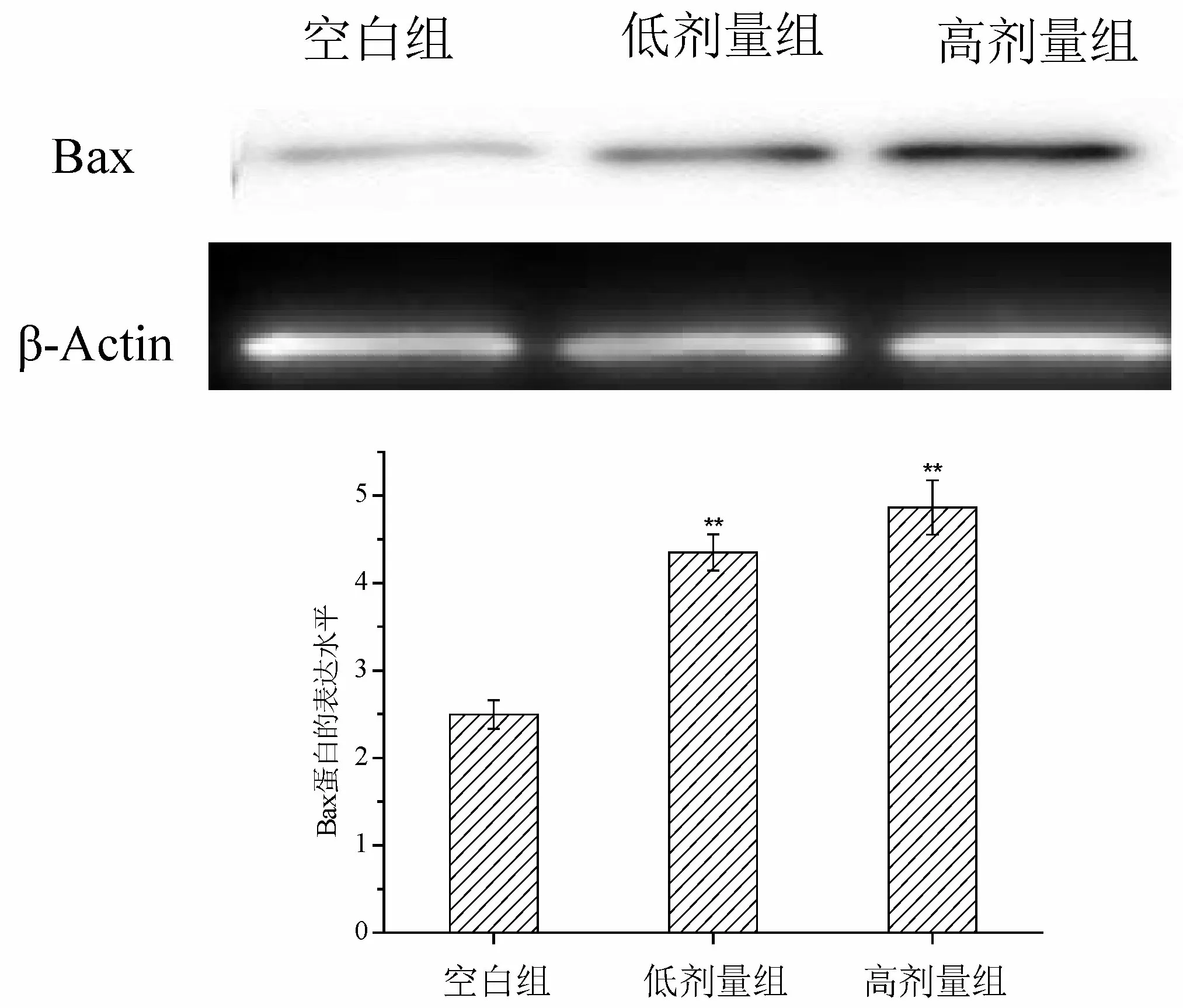
图3 玫瑰茄多糖对HeLa 细胞中Bax 蛋白的影响
2.3.2 玫瑰茄多糖对Bcl-2蛋白的影响
对于HeLa细胞内的Bcl-2蛋白,与空白对照组相比,添加玫瑰茄多糖后HeLa细胞内的Bcl-2蛋白含量降低,与低剂量组相比,高剂量组的玫瑰茄多糖更能抑制HeLa细胞内Bcl-2蛋白的表达,与空白对照组存在显著差异(P<0.05)(图4).
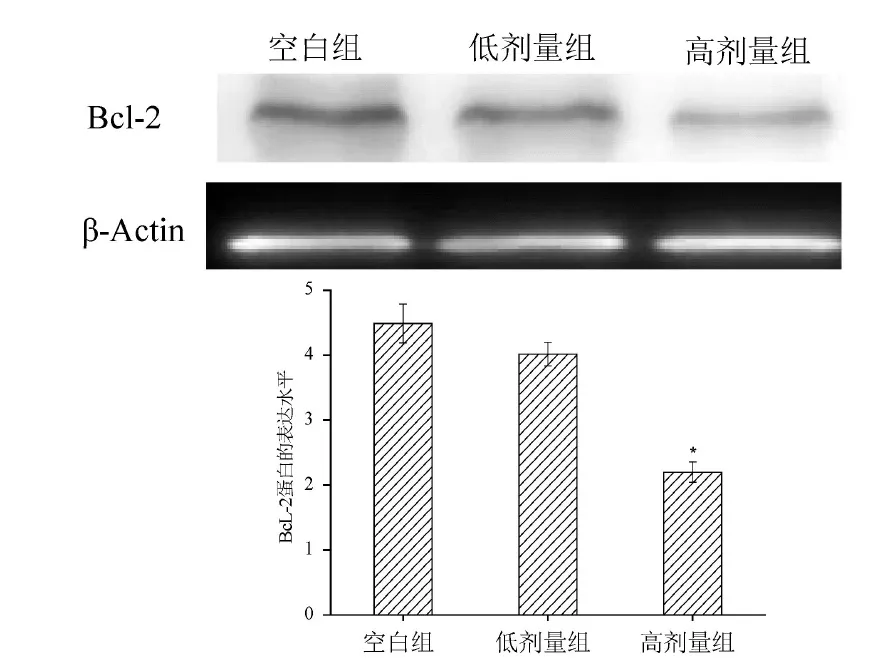
图4 玫瑰茄多糖对HeLa细胞中Bcl-2蛋白的影响
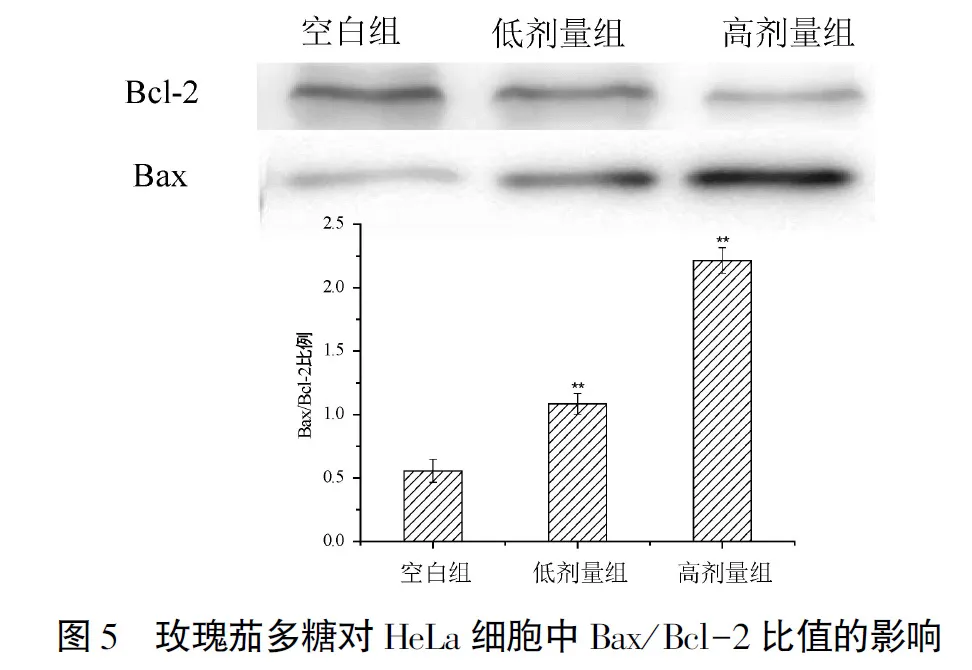
2.3.3 玫瑰茄多糖对Bax/Bcl-2比值的影响
Bax和Bcl-2是细胞线粒体凋亡信号通路中的重要蛋白,Bax/Bcl-2比值的细微变化决定了细胞是否发生凋亡,如图5所示.对Bax、Bcl-2二者含量进行比较分析.添加玫瑰茄多糖后,低剂量组与高剂量组Bax/Bcl-2比值高于空白组(P<0.01),并且随着玫瑰茄多糖剂量的提高,Bax/Bcl-2的比值也逐渐升高,呈现量效关系.
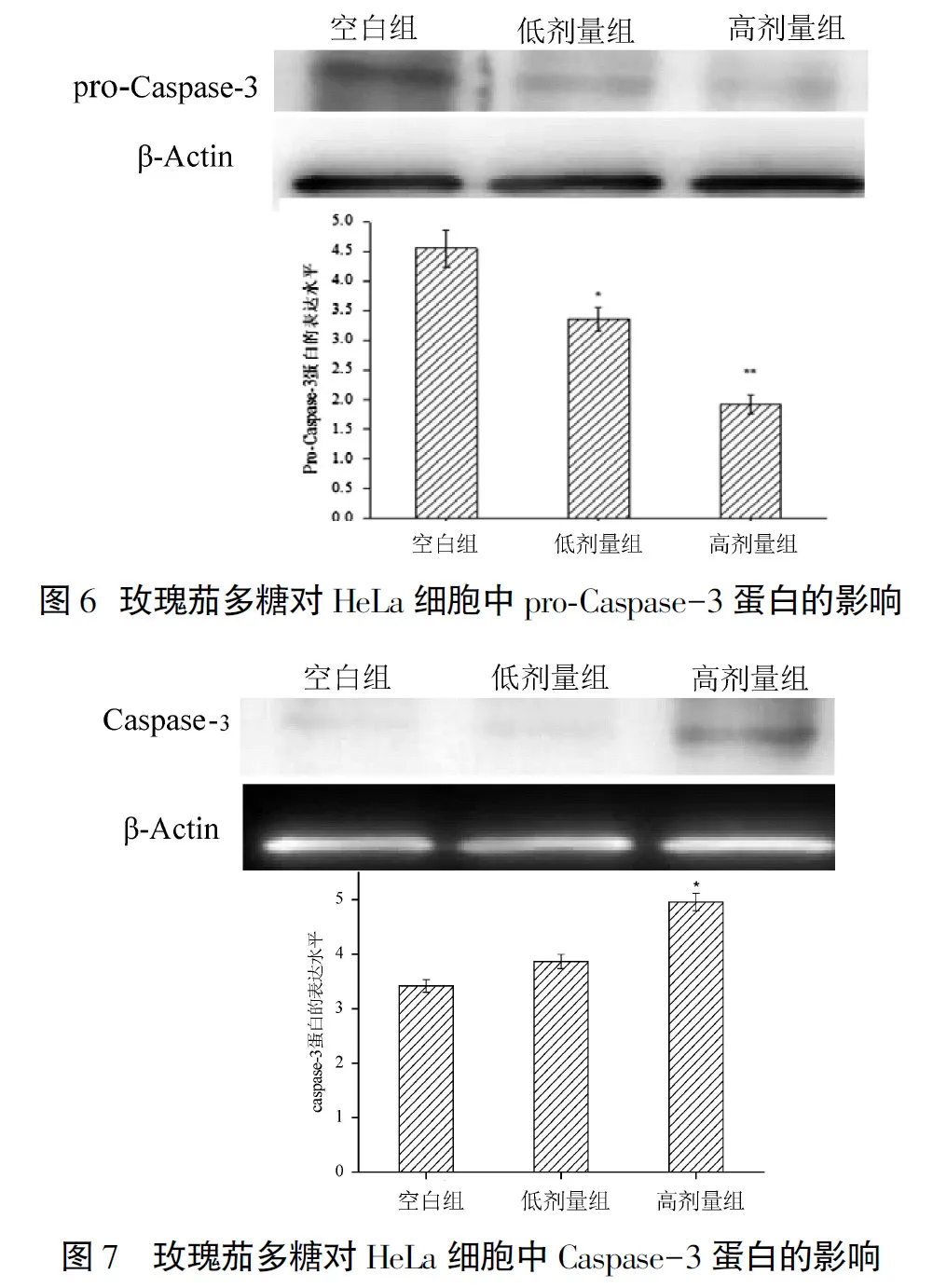
2.3.4 玫瑰茄多糖对pro-Caspase-3蛋白的影响
对于HeLa细胞内的pro-Caspase-3蛋白,与空白对照组相比,玫瑰茄多糖作用于HeLa细胞后,HeLa细胞内的pro-Caspase-3蛋白含量明显降低(P<0.05,P<0.01),随着玫瑰茄多糖剂量的增大,pro-Caspase-3蛋白含量逐渐下降(图6).
2.3.5 玫瑰茄多糖对Caspase-3蛋白的影响
对于Caspase-3蛋白,添加高剂量玫瑰茄多糖后HeLa细胞内的Caspase-3蛋白含量明显升高,与空白对照组差异显著(P<0.05); 与低剂量组相比,高剂量组的玫瑰茄多糖作用HeLa细胞后更促进HeLa细胞内Caspase-3蛋白的表达(图7).
3 讨论
研究表明多糖能刺激HeLa细胞,启动细胞凋亡通路中的相关蛋白.细胞凋亡通路有3种途径:内质网通路、死亡受体通路、线粒体通路[12],其中线粒体通路是细胞凋亡最重要的一种途径.当细胞受到外界应激条件或药物刺激后,线粒体释放凋亡介质促进细胞凋亡[13].Bcl-2家族存在于线粒体中,是调节线粒体凋亡途径的关键因子,它们中的部分蛋白质是抗凋亡的,如Bcl-2,其余是促凋亡的,如Bax[14],同时细胞的命运也由Bax/Bcl-2的比例微小的变化决定[15].外界刺激通过级联反应传导线粒体后,使Bax蛋白被活化,Bax在细胞内的表达升高后会增加线粒体外膜的通透性,引起细胞内半胱天冬氨酸酶活化从而引发促凋亡因子释放[16],促凋亡因子活化Caspase-9,切割pro-Caspase-3使其转变为有活性的Caspase-3,导致细胞凋亡的发生.
本研究发现,4 mg/mL的玫瑰茄多糖作用于HeLa细胞,细胞中Bcl-2蛋白含量显著降低(P<0.01),Bax蛋白含量显著升高(P<0.01),这说明玫瑰茄多糖能够刺激HeLa细胞内Bax蛋白含量升高,Bcl-2蛋白含量降低.Bcl-2是抗凋亡成员,Bax则是具有代表性的促凋亡成员[17].Bax蛋白量升高,Bcl-2蛋白量降低,说明细胞线粒体凋亡通路被启动,同时Bax/BcL-2的比值升高,这说明玫瑰茄多糖可促进HeLa细胞发生凋亡.
Caspase的活化是一种级联反应,是按照一定顺序进行水解的复杂过程[18].Caspase-9作为体内Caspase级联的关键上游激活因子[19],Caspase-9的前体在外来蛋白的切割下转变为有活性的Caspase-9,然后激活pro-Caspase-3,使其变为Caspase-3.很多研究将Caspase-3定义为细胞凋亡的执行者,Caspase-3蛋白含量的上升,代表凋亡已经发生[20].本研究发现,添加玫瑰茄多糖后,HeLa细胞内的pro-Caspase-3蛋白含量下降,而Caspase-3蛋白含量明显升高(P<0.05),这说明玫瑰茄多糖能通过级联反应刺激pro-Caspase-3蛋白水解,成为Caspase-3,引起HeLa细胞凋亡.
综上所述,玫瑰茄多糖处理HeLa细胞后,细胞内Bax蛋白量升高,Bal-2蛋白量降低,同时pro-Caspase-3蛋白量降低,Caspase-3蛋白量提高.这说明玫瑰茄多糖可通过线粒体介导途径诱导HeLa细胞凋亡的发生.
