CHL1在支气管哮喘中的表达及意义
2022-06-15王红玉陆琳娟
朱 敏,王红玉,陆琳娟,姚 欣
南京医科大学第一附属医院呼吸与危重症医学科,江苏 南京 210029
支气管哮喘是常见的慢性呼吸气道疾病,近年发病率呈不断上升趋势,流行病学研究表明全球约有3.3 亿患者[1-2]。气道重塑是哮喘重要的病理特征,且与哮喘不良预后有关[2]。研究表明,上皮间充质转化(epithelial mesenchymal transition,FMT),即附着在基底膜上的具有细胞⁃细胞接触的极化上皮转化为间充质表型,获得迁移并分泌细胞外基质(extracellular matrix,FCM)的过程,是哮喘气道重塑过程中的重要环节,近年来引起研究者的广泛关注[3]。然而目前研究大都着眼于FMT 中上皮或间充质标志物变化,关于迁移特性少有报道,其具体机制尚未明确。
近来研究表明,神经细胞黏附分子L1 样蛋白(cell adhesion molecule L1⁃like protein,CHL1)可能参与了上皮细胞的FMT 过程[4-6]。现已明确,CHL1是免疫球蛋白超家族成员,是一种跨膜细胞黏附分子[7]。CHL1 能够通过影响细胞骨架的信号转导途径与细胞内部进行通讯,参与细胞迁移和运动[7]。研究表明CHL1 能通过促进肿瘤细胞FMT,与细胞侵袭和转移密切相关[5,8],且其表达水平与不良预后有关[9-11],抑制CHL1表达能减少非小细胞肺癌转移[12]。
本研究分别在人体、动物和细胞水平研究CHL1表达及分布,并探讨其可能调控机制,了解其在哮喘中的作用。
1 材料和方法
1.1 材料
SPF级雌性6~8周BALB∕c小鼠10只(北京维通利华实验动物技术有限公司),饲养于南京医科大学动物实验基地。动物实验均按规范严格进行。人支气管上皮细胞株16HBF(购于北京肿瘤研究所)。
CHL1 抗体(AF2147,R&D 公司,美国),Tubulin抗体(AF1216,上海碧云天生物技术有限公司),CHL1 抗体(25250⁃1⁃AP,上海Proteintech 公司),山羊抗兔二抗(GB23303,武汉塞维尔生物科技有限公司);人源性重组细胞因子IL⁃4(BK0245)、IL⁃17(BK0234)、IL⁃1β(BK0094)(Bioworld 公司,美国)、IL⁃13(213⁃ILB∕CF,R&D公司,美国)、TGF⁃β(100⁃21,PeproTech公司,美国),SYBR(Q311⁃02,南京诺唯赞生物科技股份有限公司);人CHL1 FLISA检测试剂盒(SFQ118Hu,武汉云克隆科技股份有限公司),RNA 快速提取试剂盒(上海奕杉生物科技有限公司),逆转录试剂盒(R222⁃01,南京诺唯赞生物科技股份有限公司),FCL 化学发光超敏显色试剂盒(36208FS76,上海翌圣生物科技股份有限公司)
纳入2018 年3 月—2019 年11 月就诊于南京医科大学第一附属医院呼吸内科门诊的支气管哮喘患者55 例,所有病例诊断标准参照2018 年全球哮喘防治倡议(Global Initiative For Asthma,GINA)。同期收集18例健康志愿者作为正常对照组,受试者均签署知情同意书,并通过南京医科大学第一附属医院医学伦理委员会许可。两组人群均无吸烟者,且排除过敏性鼻炎、肺结核、肿瘤等病史。哮喘组男11 例,女44 例,对照组男3 例,女15 例,哮喘组(50.42 ± 1.54)岁,对照组(51.78 ± 1.41)岁,通过卡方检验或独立样本t检验分析发现,两组性别、年龄差异无统计学意义(P=0.755、P=0.631)。
1.2 方法
1.2.1 临床资料和血清标本收集
入组时收集受试者临床信息(包括一般情况、病史和既往史等),记录哮喘患者稳定期肺功能数据,同期采集其血清标本。用含分离胶∕促凝剂的真空采血管分别采集晨起空腹外周静脉血5 mL,对其外周血行细胞分类计数。余外周血室温静置20 min,以3 000 r∕min、4 ℃离心10 min,获得上层血清,检测受试者血清CHL1和总IgF水平。
1.2.2 慢性哮喘小鼠模型构建
随机将动物分为两组:对照组(n=5)和哮喘组(n=5),分别于第0、7、14天致敏哮喘组小鼠,腹腔内注射鸡卵清蛋白(ovalbumin,OVA)+氢氧化铝的混悬液4 mL∕kg,对照组小鼠腹腔内注射生理盐水4 mL∕kg;从第16天起雾化吸入5%OVA,1周3 d,共8周。
1.2.3 酶联免疫吸附实验(enzyme linked immuno⁃sorbent assay,FLISA)
采用人CHL1 FLISA 检测试剂盒,按说明书进行。将待测血清和试剂缓慢平衡至室温,加样(标准品及样本)100 μL至FLISA板内,37 ℃烘箱孵育1 h,甩干,不洗板;加100 μL检测溶液A工作液,37 ℃烘箱孵育1 h,洗板3 次;再加100 μL 检测溶液B 工作液,于37 ℃烘箱孵育30 min,洗板5次;加入TMB底物溶液90 μL,37 ℃烘箱避光显色10~20 min;待标准孔蓝色深度合适时,加50 μL终止溶液,置于酶标仪中,450 nm波长检测每孔光密度值。
1.2.4 免疫组化
最后1次OVA 激发后24 h处理小鼠,取每只小鼠右下肺最大横径处肺组织,采用石蜡切片机进行连续切片。石蜡切片置于烘箱脱蜡60 ℃烘2 h,依次放入二甲苯Ⅰ和Ⅱ浸泡切片20 min,后梯度浸泡于100%、95%、80%、75%乙醇各5 min,最后用PBS浸洗2次,每次5 min。置于有柠檬酸缓冲液的高压锅中,沸水修复2 min,冷却至室温后,用PBS冲洗2次,每次5 min。室温将切片置于3%H2O2溶液15 min以灭活内源性酶,PBS冲洗3次,每次5 min。吸去组织周围液体,油笔画圈,10%山羊血清室温封闭1 h,PBST冲洗3次,每次5 min。滴加CHL1抗体,4 ℃湿盒过夜。第2 天甩去一抗稀释液,PBST 冲洗3 次,每次5 min。每个圈内组织滴加100 μL HRP标记的二抗(1∶200稀释)室温孵育1 h,PBST冲洗3次,每次5 min。每个圈内组织滴加预制好的显色剂DAB 工作液50 μL,在显微镜下观察显色情况,染色完成后用蒸馏水洗涤。苏木素30 s染核,立即蒸馏水洗涤,1%盐酸酒精分化,温水返蓝。梯度75%、80%、95%、100%的乙醇脱水,每次5 min;二甲苯Ⅱ、Ⅰ依次浸泡10 min。最后用中性树脂封片,盖玻片固定后在显微镜下观察。
1.2.5 人支气管上皮细胞(16HBF)培养
用含10%胎牛血清、1%双抗RPMI1640 培养基培养16HBF细胞,放入37 ℃、5%CO2的细胞培养箱中孵育。隔日换液、待细胞长至90%时胰酶消化、传代,布入6 孔板和12 孔板,待细胞长至密度80%时用无血清RPMI1640培养基饥饿6~12 h。
1.2.6 实时定量PCR
待细胞铺至12 孔板并饥饿6~8 h 后,用人源重组细胞因子IL⁃4、IL⁃13、TGF⁃β、IL⁃17、IL⁃1β分别刺激16HBF 24 h,以不加干预措施的细胞为对照组。移去细胞培养基,用预冷的磷酸盐缓冲液(PBS)清洗细胞后,RNA 快速提取试剂盒提取细胞总RNA,使用逆转录试剂盒逆转录后加入SYBR进行RT⁃PCR实验。扩增条件为下:预变性95 ℃30 s→变性95 ℃5 s→退火60 ℃30 s→延伸72 ℃10 min,共40 个循环。以GAPDH 为内参,计算2-ΔΔCT值,最后比较目的基因在细胞中的相对表达量。所用引物委托南京金斯瑞生物科技有限公司合成:人GAPDH 上游引物5′⁃AGAAGGCTGGGGCTCATTTG⁃3′,下游引物5′⁃AGGGGCCATCCACAGTCTTC⁃3′;人CHL1 上游引物5′⁃TTTTAAATGAAGGAAAGTAAGAAG⁃3′,下游引物5′⁃TCTACTCCCTTCCTAAATTCTAC⁃3′。
1.2.7 Western blot
细胞辅6孔板并饥饿6~8 h,以人源重组细胞因子TGF⁃β刺激16HBF 72 h,经PBS洗3次,用蛋白裂解液提取总蛋白,并用BCA法测得蛋白含量。蛋白提取完成后制备SDS⁃聚丙烯酰胺凝胶,采用80∕120 V恒压电泳,300 mA 恒流转移至PVDF 膜上;5%BSA洗涤缓冲液室温封闭2 h;加入Tubulin抗体及CHL1抗体,4 ℃冰箱孵育过夜;第2天采用TBST缓冲液洗涤后,用山羊抗兔二抗室温1 h。使用天能凝胶成像系统,FCL 化学发光超敏显色试剂盒,以Tubulin 为内参,比较CHL1的相对表达量。
1.3 统计学方法
应用GraphPad Prism 9 进行统计学分析,所有定量资料以均数±标准误(),两组资料间的比较采用独立样本t检验,多组资料之间的比较采用单因素方差分析,相关性分析采用Pearson直线相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 哮喘患者血清中CHL1表达升高
对55例哮喘患者和18例健康对照者血清进行FLISA 检测,结果表明,与健康对照者相比,哮喘患者血清中的CHL1水平增高[(4.174±2.122)ng∕mLvs.(7.497±3.274)ng∕mL],差异有统计学意义(P<0.000 1,图1)。
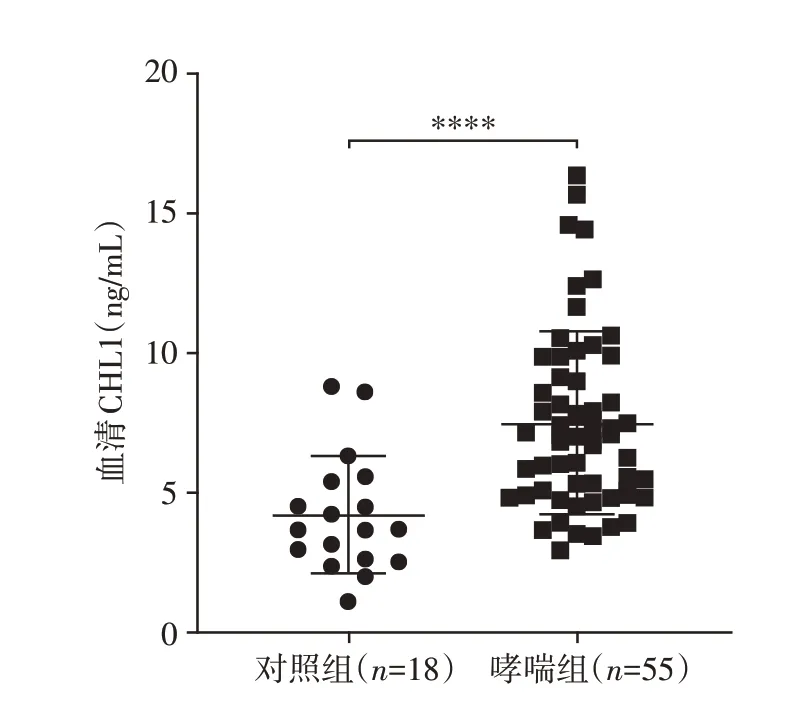
图1 哮喘患者与健康对照组血清CHL1的表达Figure 1 Serum CHL1 expression in asthmatic patients and healthy controls
2.2 血清CHL1 表达水平与肺功能、血清总IgF 水平的相关性分析
分别以哮喘患者肺功能指标FFV1、FVC、FFV1∕FVC%、血清总IgF水平为横坐标,血清CHL1水平为纵坐标,对样本进行相关性分析发现,血清CHL1与肺功能指标FFV1、FVC、FFV1∕FVC%无明显相关,而与IgF水平呈正相关(r=0.287,P=0.048,图2)。

图2 哮喘组血清CHL1表达水平与肺功能、血清总IgE水平的相关性Figure 2 Correlation between serum CHL1 expression and lung function or serum total IgE in asthmatic patients
2.3 CHL1在哮喘小鼠肺组织中的表达
小鼠肺组织免疫组化表明,CHL1在肺组织中主要表达于支气管上皮细胞,且哮喘小鼠支气管上皮细胞CHL1表达水平较对照小鼠高(P<0.05,图3)。

图3 CHL1在小鼠肺组织中的表达水平及分布Figure 3 The expression and distribution of CHL1 in the mouse lung tissues
2.4 TGF⁃β上调16HBF中CHL1的转录水平
分别用IL⁃4(20 ng∕mL)、IL⁃13(30 ng∕mL)、TGF⁃β(10 ng∕mL)、IL⁃17(20 ng∕mL)、IL⁃1β(20 ng∕mL)处理16HBF细胞24 h,PCR结果表明,与不加任何细胞因子干预的对照组相比,TGF⁃β干预24 h可显著上调16HBF 内CHL1 mRNA 的表达水平(P<0.000 1,图4A)。用TGF⁃β(10 ng∕mL)分别处理16HBF细胞6h、12h和24h,CHL1mRNA表达水平均明显增高(图4B)。用不同浓度的TGF⁃β(10、30、50 ng∕mL)处理16HBF 细胞发现,CHL1 mRNA 的表达水平均显著上调(图4C)。
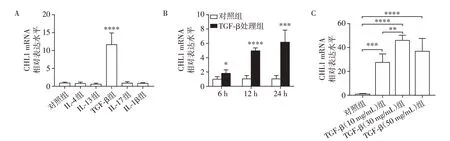
图4 TGF⁃β对16HBE细胞中CHL1 mRNA水平的影响Figure 4 Effects of TGF⁃β on CHL1 mRNA levels in 16HBE cells
2.5 TGF⁃β上调16HBF中CHL1的蛋白水平
用30 ng∕mL的重组TGF⁃β细胞因子处理16HBF细胞72 h,Western blot 结果表明,与不加干预的对照组相比,16HBF 细胞内CHL1 的蛋白表达增加(P<0.05,图5)。

图5 TGF⁃β(30 ng/mL)刺激72 h 对16HBE 细胞中CHL1蛋白水平的影响Figure 5 Effect of TGF⁃β(30 ng/mL)stimulation for 72 hourson CHL1 protein expressionin 16HBEcells
3 讨论
本研究就CHL1在支气管哮喘中的表达进行研究,发现CHL1在哮喘患者血清中表达明显升高,与血清总IgF水平呈正相关;小鼠肺组织CHL1主要表达于支气管上皮细胞,哮喘组小鼠明显增加;体外实验进一步发现,炎症因子TGF⁃β可显著上调支气管上皮细胞的CHL1表达。
CHL1属于免疫球蛋白(Ig)超家族成员,是一种细胞黏附分子,分子量约为135 kDa。它是一种多结构域跨膜蛋白,其胞外部分由6 个免疫球蛋白样结构域和4~5 个纤连蛋白Ⅲ型重复序列组成,胞内结构域高度保守[7]。其胞外域能够介导多种分子相互作用,胞质域能与肌动蛋白细胞骨架可逆地连接[7]。研究发现CHL1 可以招募埃兹蛋白(埃兹蛋白⁃根蛋白⁃膜突蛋白家族成员)到质膜,从而刺激细胞迁移[13]。据报道,CHL1通过与玻连蛋白(一种FCM蛋白)、整合素相互作用促进CHL1诱导的细胞迁移[14]。研究表明,气道上皮受损后,邻近上皮启动修复途径,通过细胞骨架重排,形成临时间充质表型并迁移至损伤部位,重建上皮完整性[15-16]。上皮细胞迁移是修复过程的重要组成部分,目前研究发现,FCM 蛋白和整合素参与了上皮修复的细胞迁移过程[15]。综上认为:上皮修复过程中,上皮细胞转化为间充质表型后,CHL1胞外域与整合素、FCM蛋白等相互作用,其胞质域连接到肌动蛋白细胞骨架介导骨架重排,从而促进上皮迁移至受损部位,参与FMT。CHL1也可能贯穿FMT整个过程:CHL1通过和细胞骨架相互作用,影响胞内信号转导,导致上皮失去极性和形态,向间充质细胞转化,同时CHL1与整合素、FCM蛋白等作用,促进细胞迁移,介导FMT发生。
本研究结果显示,哮喘患者血清中CHL1增加,CHL1可能通过促进哮喘FMT促进疾病的发展。目前研究认为,FMT有助于促进气道重塑和支气管阻塞[3],本研究结果显示,CHL1 与肺功能指标FFV1、FVC、FFV1∕FVC%无相关性。哮喘是一种异质性疾病,气道重塑与哮喘类型有关[17-18],不同炎症类型的患者,支气管上皮CHL1表达不同,此外,CHL1广泛表达于神经系统、心、肺、肾等组织[19],外周血是机体全身综合情况的体现,血清并不能直接反映肺部疾病状况,后续将用气道局部样本如诱导痰等进一步验证。本研究中CHL1 与血清总IgF 水平呈正相关,提示IgF 可能与FMT 有关。既往研究表明哮喘中IgF参与肥大细胞脱颗粒,释放多种过敏性介质,引起速发型过敏反应[20-22],结合本研究结果,推测IgF可能通过促进肥大细胞∕嗜碱性粒细胞释放一系列炎症因子,上调CHL1表达,参与FMT发生。
本研究通过小鼠模型证实肺组织中CHL1主要表达于支气管上皮细胞,且哮喘小鼠表达较对照增多,提示哮喘患者CHL1 主要来源于肺组织支气管上皮。本研究分别用TGF⁃β、Th1∕Th2∕Th17 等炎症因子刺激支气管上皮细胞,发现TGF⁃β可明显上调支气管上皮细胞CHL1 表达,提示TGF⁃β可能是CHL1 的重要调控因素。TGF⁃β被认为是诱导FMT的典型细胞因子,已被证明在肺、肝、肾等许多不同上皮细胞中介导FMT[23-24]。FMT与组织修复和愈合有关,多种细胞因子和转录因子参与调控,其中TGF⁃β起着核心作用[3]。TGF⁃β诱导FMT的信号通路主要由调节性SMAD2∕3蛋白的磷酸化介导,此外TGF⁃β1 还可通过丝裂原活化蛋白激酶(MAPK)途径,例如细胞外信号调节激酶(Frks)、c⁃Jun 氨基末端激酶(JNK)、p38 MAPK,以及磷脂酰肌醇⁃3 激酶(PI3K)等非SMAD信号通路介导FMT发生[24-25]。研究发现CHL1通过抑制PI3K∕AKT 信号通路抑制鼻咽癌的肿瘤生长和转移[6],在肺癌中CHL1通过激活MAPK信号通路促进非小细胞肺癌细胞增殖[12]。由此推测在哮喘中可能存在类似信号:TGF⁃β可能通过上调CHL1进一步激活PI3∕AKT、MAPK,从而介导非SMAD 通路的FMT发生,具体机制有待下一步研究证实。
本研究尚存在一些不足之处,如未能将哮喘患者根据炎症类型进一步分组以观察CHL1的表达情况。哮喘患者在急性期及缓解期的肺功能状态有所不同,由于外界因素影响,本研究未能同时收集哮喘患者急性发作前后的血清标本及肺功能分析数据进行对比,此外尚缺乏机制的深入研究,有待后续进一步完善。
综上所述,本研究首次揭示CHL1 在哮喘中的表达,初步探讨了其潜在调控机制。明确CHL1 在哮喘中的作用和机制以及CHL1能否作为哮喘的潜在治疗靶点,将成为下一步研究的目标。
