USP14调控OSBPL2蛋白去泛素化作用的实验研究
2022-06-15张洪都王红顺王天明
张洪都,王红顺,王天明,姚 俊,曹 新
南京医科大学医学遗传学系,江苏 南京 211166
氧化固醇结合蛋白(oxysterol binding protein,OSBP)和氧化固醇结合蛋白样蛋白(OSBP⁃relatedprotein,ORP)是一类与脂质代谢相关的蛋白,进化上高度保守,在大多数真核生物中广泛表达。人类ORP家族中包含12个成员,它们参与了囊泡运输、脂质代谢、信号转导和泛素化修饰等生物过程[1-3]。氧化固醇结合蛋白样蛋白2(oxsterol binding protein⁃like 2,OSBPL2∕ORP2)是OSBP∕ORP 家族成员,与其他ORP 成员相比,仅含FFAT(phenylalanines in an acidic tract)和OSBP相关配体结合结构域(OSBP⁃re⁃lated ligand binding domain,ORD)[4-5]。本课题组前期研究结果显示,OSBPL2突变是人常染色体显性遗传性耳聋(DFNA67)的分子病因,OSBPL2 缺失与胆固醇代谢紊乱和肥胖表型相关[5-8]。本课题组在前期研究中发现,OSBPL2通过与其他效应蛋白的互作介导了细胞内胆固醇合成、脂滴分解和脂肪前体细胞发育与分化等过程[7-9]。其中,去泛素化酶泛素特异性蛋白酶14(ubiquitin⁃specific peptidase 14,USP14)也是OSBPL2的效应蛋白之一。
泛素化修饰是真核生物中蛋白修饰的一种重要方式,80%~90%的蛋白通过泛素化途径降解[10-11]。去泛素化是泛素化的逆向过程,通过去泛素化酶发挥作用,泛素化与去泛素化之间呈现出可逆的动态平衡[12]。哺乳动物体内包含6个家族共约100种去泛素化酶,其中USP14是泛素特异性蛋白酶(ubiquitin⁃specific peptidase,USP)家族中唯一一个与蛋白酶体可逆结合的去泛素化酶,由类泛素(ubiguitin⁃like,UBL)结构域和催化(catalytic,CAT)结构域构成。其中UBL 结构域通过与蛋白酶体的19S 亚基结合,抑制蛋白酶体活性,从而使靶蛋白免于降解;而CAT 结构域主要发挥去泛素化作用,通过与泛素化蛋白结合,移除泛素链,使之不能被蛋白酶体识别和降解,进而达到稳定蛋白表达的目的[12-15]。此外,USP14 在线粒体自噬、内质网应激、DNA 损伤修复以及炎症发生中具有重要作用[16-19]。目前已有关于OSBP∕ORP家族某些成员泛素化研究的报道[20-21],但关于OSBPL2泛素化和去泛素化的研究尚未见报道,本研究将探索USP14调控OSBPL2去泛素化的作用机制,为从OSBPL2泛素化与去泛素化修饰水平探索OSBPL2生物学功能提供理论依据和新思路。
1 材料和方法
1.1 材料
HeLa 细胞和293Ta 细胞由本实验室保存;pXJ40 载体由本实验室保存;E.coliDH5ɑ化学感受态细胞(南京诺唯赞公司);pCDNA3.1⁃3×HA⁃UBB、pCDNA3.1⁃HA⁃K48、pCDNA3.1⁃HA⁃K63(武汉淼灵质粒平台)。
ANTI⁃FLAG®M2 Affinity Gel(A2220,Sigma 公司,美国)、Western 及IP 细胞裂解液(P0013)、RIPA裂解液(P0013B)(杭州碧云天公司),GAPDH(5174S)(CST 公司,美国)、OSBPL2(A14199)(武汉爱博泰克生物科技有限公司)、放线菌酮(cyclohexi⁃mide,CHX,S7418)(上海Selleck 公司)、免疫(共)沉淀(Co⁃immunoprecipitation,Co⁃IP)试剂盒(abs955)(北京爱必信生物技术有限公司),HA⁃Tag(3724S)、Ubiquitin 抗体(3936)(CST 公司,美国),K48 抗体(A18163)(武汉爱博泰克生物科技有限公司)、K63抗体(ab179434)(Abcam 公司,美国)、Flag 抗体(14793)(CST 公司,美国)、乳胞素(XY⁃LC26246)(上海熹垣生物科技有限公司)、PSMD2 抗体(A1999)(武汉爱博泰克生物科技有限公司)、MG132(HY⁃13259)(上海MCF 公司);Lipofectamine 3000转染试剂盒(L3000150)(ThermoFisher公司,美国)、X ⁃ tremeGFNF siRNA Transfection Reagent(04476093001)(Roche 公司,瑞士);定量PCR引物、过表达载体构建引物、截短体构建引物和点突变载体构建引物均由北京擎科生物科技有限公司合成,siR⁃NA序列由上海吉玛公司合成。
1.2 方法
1.2.1 质粒转染
过表达实验:转染前1 天细胞种板,过夜培养,第2 天待细胞密度达到70%~80%后,使用Lipo⁃fectamine 3000转染试剂盒,用Opti转染试剂分别稀释Lipo3000、p3000 和质粒,分别静置5 min,混合后再静置20 min。将混合液加入细胞中,6 h 后换液,48~72 h收集细胞,提取蛋白。
siRNA 敲降实验:转染前1天细胞种板,过夜培养,第2 天待细胞密度达到30%~50%后,使用X⁃tremeGFNF siRNA Transfection Reagent 试剂盒,用Opti 转染试剂稀释小干扰试剂和siRNA,混合静置15~20 min,将混合液加入到完全培养基中,24~48 h收集细胞提取RNA,48~72 h收集细胞提取蛋白。
1.2.2 Co⁃IP试验
293Ta 细胞共转目的质粒48 h 后,加入IP 裂解液提取蛋白,取150 μL 为对照(Input),剩余裂解液中加入proteinA∕G 和目标抗体原液,置于颠倒混匀器上摇晃过夜,第2天对样品进行洗脱之后,加入蛋白Loading变性,金属浴100 ℃10 min,-20 ℃保存。
1.2.3 蛋白质免疫印迹
取培养细胞加入RIPA裂解液提取总蛋白,使用BCA 试剂进行蛋白定量。取等量的蛋白加入10%SDS⁃PAGF电泳胶中,分离并转膜至硝酸纤维膜上。5%脱脂奶粉溶液封闭2 h,加入目标一抗稀释液4 ℃孵育过夜。次日回收一抗,加入相应二抗室温孵育2 h。然后用FCL发光液孵育,凝胶成像系统曝光。
1.2.4 实时定量PCR
TRIzol 提取细胞总RNA,测定提取的RNA 浓度,取1 μg总RNA反转录成cDNA,然后进行实时荧光定量PCR(real⁃time quantitative PCR,qRT⁃PCR)检测。采用20 μL 扩增体系:SYBR®Green Master Mix(2×)10 μL,cDNA 1 μL,上游引物0.5 μL,下游引物0.5 μL,ddH2O 8 μL。扩增程序如下:预变性95 ℃5 min;变性95 ℃10 s,退火∕延伸60 ℃30 s,共40个循环,目标基因CT值使用GAPDH 基因CT值校正。引物序列见表1。

表1 实时定量PCR引物Table 1 Primers for qRT⁃RCR
1.2.5 过表达质粒构建
采用https:∕∕www.uniprot.org∕在线软件分别查询USP14的UBL结构域和CAT结构域以及OSBPL2的ORD 结构域的氨基酸范围,采用http:∕∕plmd.bio⁃cuckoo.org∕在线数据库预测OSBPL2的泛素化位点,在截短体和突变位点附近设计截短引物和点突变引物,使用Mut Fxpress ⅡFast Mutagenesis Kit V2 试剂盒进行目的片段的扩增和消化,然后切胶回收,产物进行重组转化,将转化产物均匀涂布在相应抗性的LB平板上,平板倒置于37 ℃培养箱中培养12~16 h。挑板、摇菌,菌液送公司测序,比对测序结果,找出序列正确的菌斑,扩增保存菌液,用于后续实验。USP14 过表达与截短体载体构建引物见表2,点突变载体构建引物见表3。USP14⁃siRNA 序列:Forward⁃5′⁃GCCUCGCAGAGUUGAAAUATT⁃3′,Re⁃verse⁃5′⁃UAUUUCAACUCUGCGAGGCTT⁃3′。

表2 USP14过表达与截短体载体构建引物Table 2 Primers for USP14⁃overexpression and truncated vector

表3 突变体载体构建引物Table 3 Primers for mutant vector
1.2.6 泛素化信号检测及OSBPL2泛素化水平检测
泛素化信号检测:在细胞中过表达目的蛋白Flag⁃OSBPL2、Myc⁃USP14以及HA⁃Ub质粒,48~72 h收取细胞RIPA 裂解液,提取蛋白,以标签定量目的蛋白,以GAPDH定量总体泛素化,Western blot检测目的蛋白泛素信号的改变。
OSBPL2泛素化水平检测:293Ta细胞中共转染目的蛋白Flag⁃OSBPL2、Myc⁃USP14 以及HA⁃UBB、HA⁃K48 或者HA⁃K63 质粒,使用ANTI⁃FLAG®M2 Affinity Gel 富集目的蛋白,以Flag 标签定量目的蛋白,检测目的蛋白的泛素化水平。
1.3 统计学方法
采用GraphPad Prism 7.0 进行统计分析。两独立样本采取t检验,定量结果和灰度扫描等数据采用均数±标准差()表示,P<0.05 为差异有统计学意义。
2 结果
2.1 OSBPL2与USP14的相互作用验证
外源性过表达和Co⁃IP 实验结果显示,OSBPL2与USP14 之间存在相互作用(图1A)。通过构建Flag⁃OSBPL2 和HA⁃USP14 的截短蛋白(图1B)进一步阐明两者互作的关键结构域,Co⁃IP 检测结果发现,USP14 的CAT 结构域与OSBPL2 的ORD 结构域存在相互作用关系,而UBL结构域不与ORD结构域相互作用(图1C)。这一结果提示,CAT 是OSBPL2与USP14互作的关键结构域。

图1 OSBPL2与USP14的相互作用验证以及关键结构域Figure 1 Interaction between USP14 and OSBPL2 and the key interactional domains
2.2 USP14参与OSBPL2的翻译后修饰过程
过表达USP14 的HeLa 细胞中OSBPL2 的蛋白水平增加,而转录水平没有改变(图2A)。敲降USP14 的HeLa 细胞中OSBPL2 的蛋白表达水平降低,而转录水平并未改变(图2B)。采用USP14活性抑制剂IU1 处理细胞之后,USP14 表达量并没有改变,OSBPL2的表达量降低,并且有剂量依赖趋势(图2C)。用CHX处理过表达USP14的细胞,OSBPL2蛋白的周转速率降低(图2D)。综合以上结果说明,USP14 通过与OSBPL2 相互作用参与OSBPL2 的翻译后修饰过程,从而稳定OSBPL2蛋白的表达。
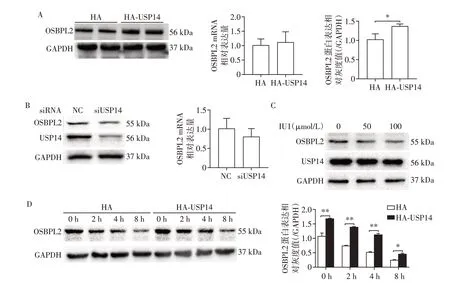
图2 USP14参与OSBPL2的翻译后修饰过程Figure 2 USP14 involved in the post⁃translational modification of OSBPL2
2.3 USP14 通过抑制OSBPL2 的K48 泛素链降低OSBPL2的泛素化水平
体外过表达实验的结果表明USP14能够识别并切割多泛素基团,尤其是Ub4⁃8泛素基团的信号明显减弱(图3A)。采用Anti⁃Flag富集OSBPL2,Western blot检测结果显示USP14可以明显降低OSBPL2的泛素化水平(图3B)。进一步探究USP14抑制的泛素链类型可知,USP14抑制了OSBPL2偶联的K48链泛素化水平(图3C)而不影响K63链泛素化水平(图3D)。综合以上结果说明,USP14通过抑制OSBPL2的K48链泛素化进而调控OSBPL2的泛素化水平。

图3 USP14通过抑制OSBPL2的K48链泛素化降低OSBPL2的泛素化水平Figure 3 USP14 reduced the ubiquitination level of OSBPL2 by inhibiting K48 ubiquitin chain of OSBPL2
2.4 蛋白酶体抑制或UBL 结构域突变诱导USP14与OSBPL2互作增强
UBL 结构域是USP14 的另一个结构域,介导USP14 与蛋白酶体的结合。乳胞素(Lactacysin)是一种蛋白酶体抑制剂,可以特异性不可逆地从蛋白酶体上解离USP14。在乳胞素处理的HeLa细胞中,USP14与非ATP酶蛋白酶体26S亚基2(PSMD2)的相互作用明显减弱(图4A)。UBL结构域中第54~60位的氨基酸高度保守,所以将第58位的色氨酸突变为丙氨酸(W58A),构建UBL结构域突变的质粒,以模拟乳胞素抑制蛋白酶体的效果,Co⁃IP 检测结果显示,USP14 与PSMD2 的结合明显减弱(图4B),与乳胞素处理所得结果相同,进一步确定了USP14通过UBL 结构域与蛋白酶体相结合。HeLa 细胞转染过表达野生型USP14质粒和UBL结构域突变的USP14质粒,Co⁃IP 检测结果表明,当USP14 的UBL 结构域突变之后,USP14 与OSBPL2 的结合会明显增强(图4C)。当加入MG132 抑制蛋白酶体活性之后,与对照组相比,USP14 与OSBPL2 的相互作用也有所增强,趋势与UBL 结构域突变之后的结果一致(图4D)。综合以上结果可知,当抑制蛋白酶体活性或者突变UBL结构域之后,都会导致USP14与OSBPL2相互作用增强,进而稳定OSBPL2蛋白的表达。
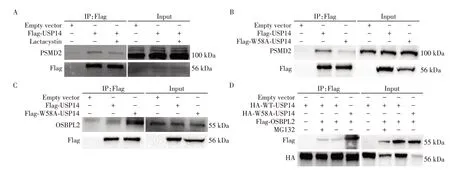
图4 蛋白酶体抑制或UBL结构域突变诱导USP14与OSBPL2互作增强Figure 4 Proteasome inhibition or UBL domain mutation induced enhanced⁃interaction between USP14 and OSBPL2
2.5 Lys209 和Lys361 位点参与OSBPL2 去泛素化调控
为了进一步探究OSBPL2 上K48 泛素链可能的连接位点,通过蛋白质赖氨酸修饰数据库(Protein⁃Lysine Modifications Database,PLMD,http:∕∕plmd.biocuckoo.org∕)预测,提示OSBPL2 有5 个泛素化位点且都在ORD结构域中(表4)。根据预测结果,构建5个位点的突变质粒(图5A)。Co⁃IP检测结果发现,当Lys209 和Lys361 位点突变后,OSBPL2 与USP14的相互作用减弱(图5B、C),OSBPL2 的泛素化水平未受影响(图5D)。此结果说明OSBPL2 的Lys209和Lys361 很可能是K48 泛素链连接OSBPL2 并被USP14去泛素化修饰的关键位点。
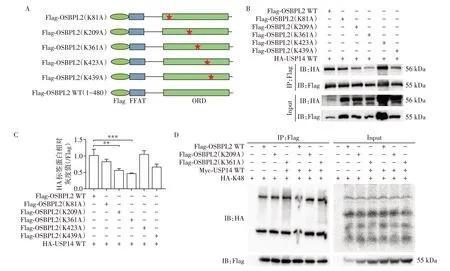
图5 Lys209和Lys361位点参与OSBPL2去泛素化调控Figure 5 Lys209 and lys361 sites involved in the regulation of OSBPL2 deubiquitination

表4 OSBPL2蛋白泛素化位点预测Table 4 Prediction of ubiquitination sites of OSBPL2 pro⁃tein
3 讨论
本课题组在国际上最先定位和克隆了人常染色体显性遗传性耳聋的致病基因OSBPL2,但OSBPL2突变致聋的分子发病机制迄今仍未阐明。该基因编码的蛋白属于OSBP∕ORP 家族成员,ORP 作为一类重要的固醇感受器,参与了脂质代谢与转运、囊泡运输和信号转导等过程[1-2]。此外,研究发现一些OSBP∕ORP成员通过泛素化修饰参与一系列生物学过程,如在探索镉元素(cadmium,Cd)对胆固醇代谢影响的研究中发现,Cd能够诱导OSBPL蛋白泛素化而降解,进而导致胆固醇代谢紊乱[20]。OSBP∕ORP家族的另一个成员OSBPL8是USP5的新底物,USP5使OSBPL8 去泛素化并在结直肠癌细胞内累积,进而导致内质网应激产生[21]。这些结果均提示了OSBP∕ORP家族成员具有泛素化修饰的可能性。
目前关于OSBPL2泛素化与去泛素化的相关研究还鲜见报道。基于PLMD在线软件的预测结果提示,OSBPL2的ORD 结构域有5个泛素化位点,并且实验结果显示OSBPL2 能够与泛素Ub 和K48 泛素链结合,提示存在OSBPL2 翻译后去泛素化修饰的可能。本研究进一步证实USP14与OSBPL2之间具有相互作用,USP14 过表达或者敲降对OSBPL2 mRNA水平无明显影响,而对其蛋白表达影响显著,因此认为USP14 通过与OSBPL2 互作参与OSBPL2的翻译后修饰过程,从而稳定OSBPL2 蛋白的表达。USP14 作为去泛素化酶,其作用就是结合并切割靶蛋白的泛素链,避免靶蛋白的降解而维持蛋白表达的稳定[22]。因此,如同USP14在FASN、RIG⁃I等蛋白表达中的作用[23-24],USP14 可能通过翻译后去泛素化修饰稳定OSBPL2表达。
本研究进一步验证了USP14对OSBPL2的去泛素化修饰作用,这与文献报道的USP14 参与cGAS等的生理调控功能一致[25-26]。USP14通过CAT结构域发挥去泛素化功能,CAT 结构域包含两个保守基序:Cys和His盒,这也是USP家族共有的保守基序,催化残基就位于这段基序中。研究结果表明USP14的CAT 结构域能够与OSBPL2 结合,因此USP14 通过CAT 结构域切割OSBPL2 泛素链,从而实现OSB⁃PL2 去泛素化,进而稳定OSBPL2 表达,这与文献报道的CAT 结构域能够稳定Tau 蛋白的表达一致[13]。本研究还进一步证实USP14 通过UBL 结构域与蛋白酶体相结合,并调控OSBPL2的表达。
Kim等[27]研究显示USP14的UBL结构域通过与泛素链结合,能展现出一些共有的特性。例如,UBL可以刺激19S蛋白酶体的ATPases,刺激内在26S蛋白酶体中无序蛋白Sic1的降解,增加内源性蛋白的降解速率等。这些研究提示,UBL 结构域在调控蛋白酶体活性以及蛋白降解方面的作用也非常重要。本研究表明UBL 结构域突变导致USP14 与蛋白酶体结合减弱,这与蛋白酶体抑制剂的效应一致。此外,UBL 结构域突变或抑制蛋白酶体活性都能够增强USP14 与OSBPL2 的互作,且UBL 突变的USP14 与OSBPL2 的结合能力远大于加入抑制剂之后的结合能力,这可能是由于USP14与蛋白酶体结合抑制了蛋白酶体活性的同时提高了自身活性[28]。
近年来,USP14 引起了研究者们的广泛关注。综合现有的关于USP14去泛素化底物的研究发现,USP14 广泛参与了机体各种生理过程,并且与多种疾病密切相关,其中约61%的癌症都与USP14 有关[29]。USP14 主要通过去泛素化Cyclin B1 等细胞周期蛋白,抑制细胞的侵袭和迁移。USP14 还参与了自噬的调控,如USP14 通过与RNF168 和Beclin 1等蛋白的互作调控DNA损伤修复过程,进而调控自噬[18,30]。在炎症反应中,USP14 可通过去泛素化RIG⁃I 耦连的K63 泛素链介导免疫应答等[24]。此外,USP14 与脂质代谢关系密切,如脂肪酸合酶(synthase,FASN)是USP14的直接底物,在小鼠体内过表达USP14可维持FASN的稳定表达并导致脂肪肝[23]。最近研究表明,蛋白酶体系统是调控初级纤毛形成的核心系统之一,并且纤毛相关蛋白与蛋白酶体亚基具有相互作用[31-34]。本研究中OSBPL2 的生物学功能与脂质代谢关系密切,而USP14可以通过抑制K48 链调控OSBPL2 的泛素水平,进而稳定OSBPL2的表达。上述结果提示,USP14可能通过调控OSBPL2的表达进而参与脂质代谢和听觉细胞纤毛的调控。
本研究证实了去泛素化酶USP14对OSBPL2的去泛素化修饰的调控作用,从泛素化和去泛素化修饰角度研究OSBPL2的生物学功能将为探索OSBPL2突变致聋的分子发病机制提供新思路。
