雄激素受体作为三阴性乳腺癌放疗抵抗的介质和生物标志物的临床研究
2022-06-15赖寒陆持双郭宏穆庆交
赖寒 陆持双 郭宏 穆庆交
三阴性乳腺癌是一种侵略性亚型,其特征是缺乏雌激素、孕激素和人表皮生长因子受体类型2(human epidermal growth factor receptor type 2,Her2)受体[1]。由于缺乏治疗靶标,细胞毒性化学治疗仍是三阴性乳腺癌的治疗标准,因此有必要为患者开发新的更有效的靶向治疗方法[2]。目前正在研究的针对三阴性乳腺癌管理的几种治疗靶标是雄激素受体(androgen receptor,AR)。AR是一种核甾体激素受体,三阴性乳腺癌中表达率为10%~43%[3]。在没有ERα的情况下,AR驱动“腔样”基因表达模式。研究显示AR在三阴性乳腺癌中的预后作用,以更好地了解三阴性乳腺癌中的雄激素作用,确定驱动结果的可操作因素,并确定AR状态测试是否应成为三阴性乳腺癌常规临床实践的一部分[4]。但是,笔者所见关于三阴性乳腺癌中AR的预后价值的报道相互矛盾。尽管一些研究报告说AR阳性与更好的预后相关,但其他研究则认为AR阳性表型预示了较差的长期预后或AR状态对三阴性乳腺癌的预后没有重大影响[5]。在某种程度上,这些差异性的结果可归因于小样本量,同类人群的种族差异,用于染色的抗AR抗体,染色/评分方法以及使用不同的阈值定义AR阳性[6]。除手术和全身治疗外,放射治疗仍是当前乳腺癌临床管理的主要手段[7]。尽管对大多数女性有效,但尽管采取了多种形式的疗法,但仍有一些会复发疾病[8]。鉴于缺乏针对性三阴性乳腺癌药物及其相对放射治疗不敏感性(通过局部复发风险增加证明),放射致敏性其他靶标的开发代表了关键的未满足临床需求[9]。本研究以80例三阴性乳腺癌患者为对象,探讨AR作为三阴性乳腺癌放疗抵抗的介质和生物标志物的临床研究。
1 资料与方法
1.1 一般资料 选取2016年1月至2018年12月黔南州人民医院就诊的80例三阴性乳腺癌患者,接受早期乳腺癌治疗的手术,年龄25~71岁,平均年龄(48.03±5.67)岁。术后根据实际情况,患者进行放射和非放射辅助治疗,并分为非放疗组18例和放疗组62例。其中放疗组平均年龄(47.68±5.27)岁;平均BMI(24.08±1.66)kg/m2;肿瘤大小(2.51±0.39)cm;家族曾有肿瘤史4例。非放疗组平均年龄(48.39±4.05)岁;平均BMI(23.74±1.42)kg/m2;肿瘤大小(2.48±0.33)cm。2组患者年龄、BMI、肿瘤大小、饮酒及吸烟和肿瘤家族史比较差异无统计学意义(P>0.05)。患者或其监护人签署知情同意书或口头同意知情同意书。见表1。

表1 一般资料情况
1.2 纳入与排除标准
1.2.1 纳入标准:①年龄18~75岁女性;②术前没有进行相关激素、药物治疗;③临床资料记录完整;④满足两年的跟踪回访调查史。
1.2.2 排除标准:①严重心脑血管疾病;②AR免疫组化分析阳性细胞细胞<10%;③意识模糊不清晰者;④拒绝签署知情同意书。
1.3 方法
1.3.1 人口统计学资料:患者被诊断为三阴性乳腺癌,且在过去6个月内所有患者未进行相关的治疗史(未知的情况下)。对2组患者统计,包括年龄,身高体重,肿瘤大小、家族肿瘤得病史。并在定期门诊处得到所有患者的复查结果(2年内),计算复发率和生存率。
1.3.2 免疫组织化学:患者接受治疗前进行穿刺活检,并在当地进行了乳房切除术或保留乳房的腋窝淋巴结清扫术。对核心针头活检标本进行免疫组织化学研究,将肿瘤标本固定在10%甲醛溶液中并包埋在石蜡中,将4 μm厚的切片固定在载玻片上。将载玻片在二甲苯中脱蜡,并在高压釜(105℃,0.4 kg/m2)中的目标提取溶液(Dako,Carpinteria,CA,美国)中加热20 min。将标本与3%的过氧化氢的甲醇溶液孵育15 min,以阻断内源性过氧化物酶的活性,在10%的正常山羊或兔血清中孵育以阻断非特异性反应。针对AR的一级单克隆抗体。将组织切片与每种抗体在室温下孵育70 min,或在4℃下过夜,与辣根过氧化物酶偶联的抗兔或抗小鼠IgG二抗一起孵育。随后用抗生蛋白链菌素-过氧化物酶试剂处理玻片,并在磷酸盐缓冲液-二氨基联苯胺和1%过氧化氢(v/v)中孵育,用Mayer’s苏木精复染。根据供应商的数据表使用每种标记的阳性和阴性对照。
1.3.3 免疫组织化学评分:免疫组织化学评分采用盲法确认每种诊断的客观性和可重复性。判断标准为雄激素受体在细胞膜染色,镜下可见棕黄色为阳性,细胞核上出现棕黄色为阳性;100个高倍视野着色细胞数<10%为阴性,>10%为阳性。

2 结果
2.1 AR阳性表达率比较 放疗组较非放疗组肿瘤中的AR表达阳性率升高,差异有统计学意义(P<0.05)。见图1,表2。
非放疗组 放疗组

表2 AR阳性表达率
2.2 AR高表达增加复发率比较 与非放疗组比较,放疗组AR高表达复发率增加,AR低表达复发率降低(P<0.05)。见表3。
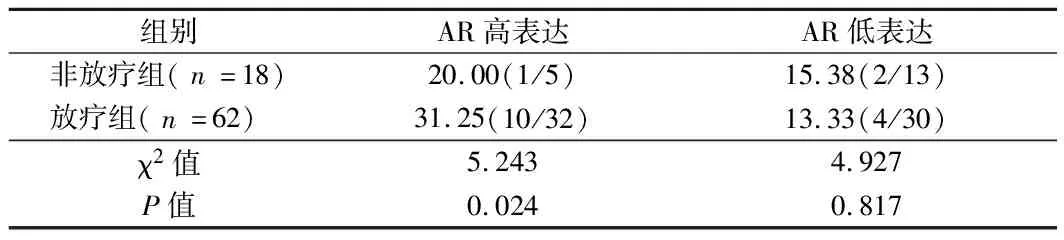
表3 AR高表达增加复发率比较 %(例)
2.3 AR高表达降低生存率 与非放疗组比较,放疗组AR高表达生存率降低,AR低表达生存率增加(P<0.05)。见表4。
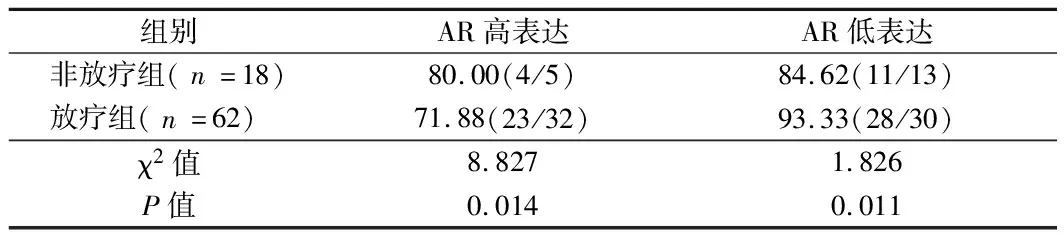
表4 AR高表达降低生存率比较 %(例)
2.4 三阴性乳腺癌患者复发率多因素分析 三阴性乳腺癌患者复发率的多因素 Logistic 回归分析结果显示,组织学分级、淋巴结状态和AR状态与之相关(P<0.05),BMI越高、居住地条件越差以及文化程度越低,皮损严重程度越高,而年龄、肿瘤大小和肿瘤家族史与复发情况差异无统计学意义(P>0.05)。见表5。

表5 三阴性乳腺癌患者2年病发多因素分析
3 讨论
AR与雌激素、孕激素和糖皮质激素受体一起是类固醇激素家族受体的成员[10]。在过去的10年中,其作为所有内在亚型的乳腺癌生物学驱动者的作用已得到认可[11]。最引人注目的是AR在三阴性乳腺癌中的作用,三阴性乳腺癌是乳腺癌的一个子集,通常以缺乏雌激素和孕激素受体表达为特征,并且与不良预后相关[12]。
AR在乳腺癌的发病机制中起重要作用,并且可能被证明是AR驱动的乳腺癌患者的相关治疗靶标[13]。这在三阴性乳腺癌的患者子集中最为明显,其中约50%的肿瘤可能具有雄激素依赖性[14]。拮抗AR或减少雄激素产生的药物的最新2期临床试验已显示出不同程度的临床益处和功效。最近的基因组分析研究已经确定了表达AR且很容易受到AR阻滞作用的三阴性乳腺癌的重要亚组[15]。这一发现表明至少某些三阴性乳腺癌患者可能对AR阻滞治疗有反应,并提供了潜在的有效方法,针对被诊断患有三阴性乳腺癌的女性的分子策略[16]。
实际上,多项临床试验正在评估AR阻滞在肿瘤表达AR的转移性乳腺癌患者中的作用。尽管这些研究旨在确定治疗患有转移性疾病的三阴性乳腺癌女性的临床效用,但有数据表明,AR阻滞可能是一种在预先确定的环境中有效的放射增敏策略[17]。本研究报道人类乳腺癌(包括三阴性乳腺癌)在AR 蛋白质表达水平上的显著异质性。此外证明了在保乳手术和放射治疗的女性的临床数据集中,AR表达水平是三阴性乳腺癌女性局部复发和放射反应的潜在预测生物标志物[18]。在接受放射治疗的患者中,2年内复发率分析以评估AR的敏感性作为局部复发的预测指标,随后对与三阴性乳腺癌局部控制相关的因素进行单变量分析,结果表明AR表达水平与放疗后局部复发相关[19]。此外,对先前显示与放疗后局部控制有关的所有临床和病理因素的多变量分析(T期,淋巴结状态,肿瘤大小,AR状态等)显示,AR表达水平(分析为连续变量)最为显著与局部复发相关。因此,仅在接受放射治疗的患者中,AR与局部控制率降低相关。该观察结果表明,低AR表达预示着对辐射的有利反应,而AR过表达三阴性乳腺癌中AR信号的泽预示着复发率的升高。本结果显示,与非放疗组比较,放疗组AR高表达复发率增加,AR低表达复发率降低。
众所周知,乳腺癌是典型的激素依赖型恶性肿瘤。在乳腺癌患者中经常观察到AR的表达,并且在疾病的发展和进展中起着核心作用[20]。另外,AR的表达也经常被注意到,这表明雄激素也可能在乳腺癌的生物动力学中起作用。已在70%~90%的乳腺肿瘤中发现了AR的表达,与雌激素受体表达的频率相似[21]。尽管先前已有相关报道表明雄激素抑制乳腺癌的进展[22],但是AR在乳腺癌中的确切机制和临床意义仍不清楚。
乳腺癌亚型的多样性以不同个体对化疗的敏感性不同为。使用cDNA微阵列进行的遗传分析显示,根据临床差异,乳腺癌可分为多个组:5种乳腺癌固有亚型(腔A,腔B,Her2富集,claudin低,基底样)和正常的乳腺样人群等。其中,基底样亚型表现出与肌上皮/基底细胞相似的特征,许多病例与三阴性乳腺癌一致,因为它们在免疫组织化学上是雌激素阴性,孕激素受体(PgR)阴性和Her2阴性由于缺乏治疗选择和三阴性乳腺癌的生物学特性,这种类型的乳腺癌通常预后较差,并且正在研究新的治疗靶标。AR表达可能是三阴性乳腺癌中抗雄激素治疗的潜在靶标。同样,从临床前实验观察到,表达AR的三阴性乳腺癌与雌激素阳性乳腺癌相似,被认为对放疗具有抗性。然而,很少有研究在临床水平上证实放疗疗法在AR阳性三阴性乳腺癌患者中的疗效。
综上所述,AR可以作为三阴性乳腺癌放疗抵抗的介质和生物标志物,放疗降低AR表达可以提高患者的生存率,降低复发率。
