右美托咪定对高糖诱导大鼠乳鼠海马神经元损伤的保护作用
2022-06-15施葵张浩
施葵 张浩
糖尿病是一种以血糖浓度升高为主要特征的代谢紊乱综合征,治疗不当会引起一系列糖尿病慢性并发症,危害机体心脏、大脑、肾脏等多个器官[1,2]。糖尿病脑病是公认的一种糖尿病慢性并发症,即由糖尿病代谢紊乱引起的中枢神经损伤[3]。糖尿病脑病主要导致语言、认知和运动功能障碍,临床表现为短期记忆缺陷、理解能力下降、行动迟缓等[4,5]。目前有研究报道糖尿病脑病与海马神经元凋亡具有密切关系[6],因此寻找一种有效抑制海马神经元凋亡的药物对于糖尿病脑病的深入研究具有重要意义。右美托咪定是一种α2-肾上腺素受体激动剂,具有镇痛、镇静、抑制交感神经活性等作用[7]及有神经保护作用[8]。本文拟对右美托咪定在高糖诱导的神经元损伤中是否具有保护作用及机制进行研究,以期为临床治疗糖尿病脑病提供实验研究基础。
1 材料与方法
1.1 实验动物与主要试剂仪器 SPF级SD大鼠乳鼠10只购自北京维通利华实验动物技术有限公司,体重5~10 g,雌雄各半,许可证号:SCXK(京)2019-0009;控制SPF屏障内温度20℃~25℃,湿度50%~70%。本实验室对SD大鼠的处理符合实验动物福利及伦理规范。DMEM培养液(31600034)、胎牛血清(FBS)(16000-044)、胰蛋白酶(25200-056)等购自Gibco公司;CCK-8试剂盒(4020ES60)购自上海翊圣生物科技有限公司;BCA蛋白浓度测定试剂盒(PT0001)购自北京雷根生物技术有限公司;TUNEL检测试剂盒(C1088)、Hoechst 染色液(C1018)购自碧云天生物技术有限公司;总蛋白提取试剂盒(78510)购自Thermo公司;GAPDH单抗(ab181602)、NeuN抗体(ab104224)、SYP抗体(ab184176)、cleaved cas-3抗体(ab13847)、Bax抗体(ab32503)、Bcl-2抗体(ab182858)、p-Akt蛋白抗体(ab38449)、Akt蛋白抗体(ab18785)、p-STAT3蛋白抗体(ab76351)、STAT3蛋白抗体(ab119352)等兔源多抗以及FITC标记的羊抗兔荧光二抗(ab6717)和HRP标记的羊抗兔二抗(ab6721)均购自Abcam。倒置荧光显微镜(Olympus IX70);台式高速冷冻离心机(Eppendorf centrifuge,5415R);PCR仪(Bio-Rad,S1000);超低温冰箱(HISENSE);蛋白凝胶成像仪(Thermo);细胞恒温CO2培养箱(SANYO);其他常规仪器均由本实验室提供。
1.2 原代大鼠乳鼠海马神经元细胞培养 脱颈处死出生24 h内的SD大鼠乳鼠,置于75%乙醇中浸泡消毒10 min,置于冰盒上操作。分层剪开头部皮肤和颅骨,暴露双侧大脑,用眼科镊分开大脑皮层,暴露双侧海马组织,分离出新月形海马组织后置于事先加入预冷PBS的细胞培养皿中,剔除海马组织中血管和脑膜组织后,将其剪成1 mm3的小碎块,随后转移至2 ml离心管中,加入胰蛋白酶置于37℃培养箱中消化10 min,期间振荡2~3次,待消化液变浑浊且不见组织块时终止消化。168 g离心5 min,弃上清液,加入2 ml DMEM培养液再次离心5 min,弃上清液后用加入10%FBS及双抗的DMEM培养液重悬沉淀,轻轻捶打混匀,转移至细胞培养瓶中置于37℃、5%CO2培养箱中培养,24 h后更换全部培养液,之后每2~3天进行半量换液培养。
1.3 免疫荧光试验鉴定海马神经元 待海马神经元细胞培养至第12天时,将其接种至24孔板中(孔内提前放入爬片)培养24 h后对其进行鉴定。弃掉细胞培养液,PBS缓冲液洗涤3次,预冷的4%多聚甲醛固定30 min后,PBS缓冲液再冲洗3次,加入预冷的甲醇室温透化10 min,PBS再冲洗3次,加入5%BSA室温封闭45 min,弃掉封闭液,加入1∶1 000稀释的NeuN单抗,室温孵育1 h,回收一抗后PBS冲洗3次,加入1∶5 000 稀释的FITC标记的羊抗兔荧光二抗避光孵育1 h,弃二抗,加入1∶500稀释的鬼笔环肽,37℃孵育50 min,PBS清洗3次,加入1 μg/ml DAPI染料,避光作用15 min,弃DAPI,PBS冲洗3次,最后加入少许PBS,将爬片转移至载玻片置于荧光显微镜下观察。
1.4 CCK-8试验 分组及处理:制备海马神经元细胞悬液,将细胞悬液随机分为3组,参考相关文献[9]分别给予100 mmol/L葡萄糖处理(高糖组,HG group)、400 μmol/L右美托咪定与100 mmol/L葡萄糖共同处理(高糖+右美托咪定组,HG+Dex group)以及不做任何处理(对照组,control group)置于培养箱中培养24 h后进行后续试验。分别制备各组细胞悬液并进行细胞计数,将细胞悬液加入96孔板中,每孔加100 μl,用培养液做10倍倍比稀释,共设置5个细胞浓度梯度,同时每个样本设置3个重复,置于37℃、5%CO2培养箱中预培养24 h。向每孔中加入10 μl CCK-8溶液,培养箱中培养1~4 h,置于酶标仪中测定其在450 nm波长处的吸光度。
1.5 TUNEL试验 分组及处理方法同1.4,分组处理24 h后进行后续试验。首先进行Hoechst活细胞染色,将各组处理后的细胞悬液计数,将106个细胞悬浮于1 ml含有10%FBS的培养液中,加入10 μl Hoechst 染色液混匀后置于37℃培养箱中培养10 min,将细胞置于冰上冷却,4℃离心后弃上清,将细胞用培养液重悬接种于24孔板中(提前放入爬片),进行后续TUNEL染色。参照TUNEL检测试剂盒说明书进行试验。待细胞长满爬片的70%~80%后取出爬片,室温晾干固定20 min,PBS冲洗3次,5 min/次。封闭液室温封闭10 min,PBS洗涤3次,5 min/次。通透液室温透化2 min,在湿盒中进行后续标记反应。PBS冲洗细胞爬片并用滤纸吸干周围洗液,每个样本加入100 μl TdT酶反应液,置于细胞培养箱中孵育60 min。20×SSC溶液终止反应,室温静置15 min,PBS冲洗3次,每次5 min。将爬片置于0.3%H2O2/PBS溶液中室温封闭5 min,PBS冲洗3次。加入 Streptavidin-HRP工作液100 μl,置于37℃细胞培养箱中孵育60 min,PBS冲洗3次。加入DAB显色液,去离子水冲洗数次后用中型树胶封片,置于荧光显微镜下观察。
1.6 实时荧光定量PCR(qRT-PCR)检测mRNA表达 分组及处理方法同1.4,分组处理24 h后进行后续试验。取处于对数生长期的细胞接种至6孔板中,细胞接种量为2.5×105个细胞。通过Trizol法提取细胞中的总RNA,逆转录成cDNA。然后进行PCR扩增。以GAPDH为内参,通过法计算海马突触素蛋白(SYP)mRNA相对表达量。见表1。
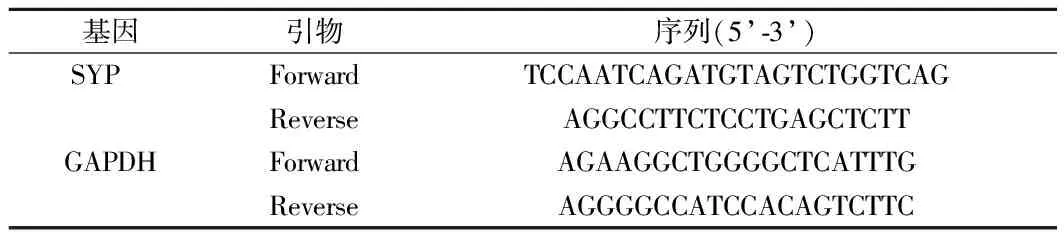
表1 引物序列
1.7 Western Blot检测蛋白表达 分组及处理方法同1.4,分组处理24 h后进行后续试验。按照总蛋白提取试剂盒说明书操作提取细胞总蛋白,利用BCA试剂盒测定蛋白浓度,蛋白定量后涡旋混匀,置于沸水浴中煮样10 min,存放于-80℃备用。配制SDS-PAGE凝胶,电泳时浓缩胶电压为90 V,分离胶电压为120 V,电泳结束后采用恒流转印,将蛋白转印至PVDF膜上,转印条件为恒流250 mA,1~2 h。转膜后TBST洗膜3次,5%脱脂乳封闭1 h,分别加入GAPDH单抗、SYP、cleaved cas-3、Bcl-2、Bax、p-Akt、Akt、p-STAT3和STAT3的兔源多抗,稀释倍数均为1∶1 000,室温孵育4~6 h,TBST洗膜3次,每次5 min。加入1∶5 000稀释的HRP标记二抗室温摇床孵育2 h,TBST洗膜3次,每次5 min。显色液显色,置于蛋白凝胶成像仪下分析目的蛋白的相对含量。

2 结果
2.1 海马神经元的鉴定 原代培养的海马神经元采用NeuN蛋白进行特异性标记,免疫荧光结果显示,NeuN蛋白主要表达在细胞核,且NeuN呈强阳性蛋白,表达强度为(93.21±3.01)%。见图1。
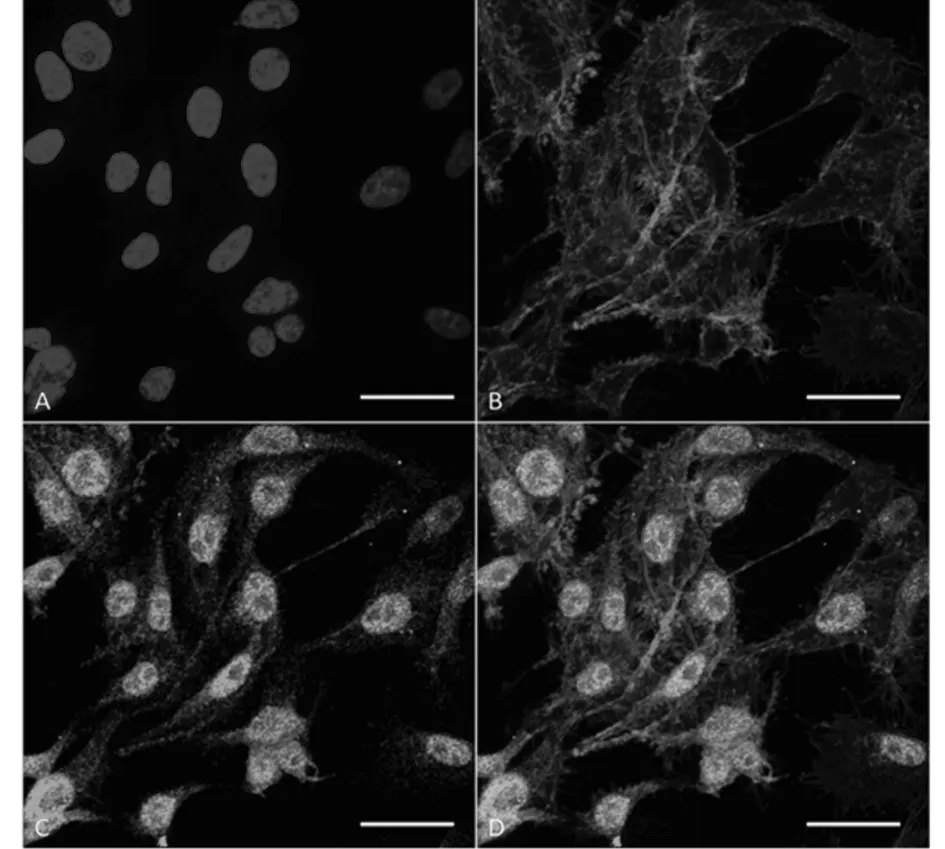
图1 免疫荧光检测海马神经元中NeuN蛋白表达;A 细胞核:DAPI;B 骨架蛋白:鬼笔环肽;C NeuN蛋白;D Merge,标尺50 μm
2.2 右美托咪定抑制高糖诱导的神经元细胞活力的降低 CCK-8检测3组细胞存活率,与对照组比较,高糖组神经元细胞的存活率显著降低(P<0.05);与高糖组比较,高糖+右美托咪定组神经元细胞的存活率显著升高(P<0.05)。见表2。
表2 MTT检测3组细胞存活率
2.3 右美托咪定抑制高糖诱导的神经元细胞凋亡 TUNEL实验检测各组细胞凋亡,与对照组比较,高糖组神经元细胞的凋亡率显著升高(P<0.05);与高糖组比较,高糖+右美托咪定组神经元细胞的凋亡率显著降低(P<0.05)。WB检测凋亡相关蛋白cleaved cas-3、Bcl-2和Bax蛋白的表达,结果显示,与对照组比较,高糖组神经元细胞cleaved cas-3、Bax蛋白显著升高,Bcl-2蛋白表达显著降低(P<0.05);与高糖组比较,高糖+右美托咪定组神经元细胞cleaved cas-3、Bax蛋白显著降低,Bcl-2蛋白表达显著升高(P<0.05)。见表3,图3。
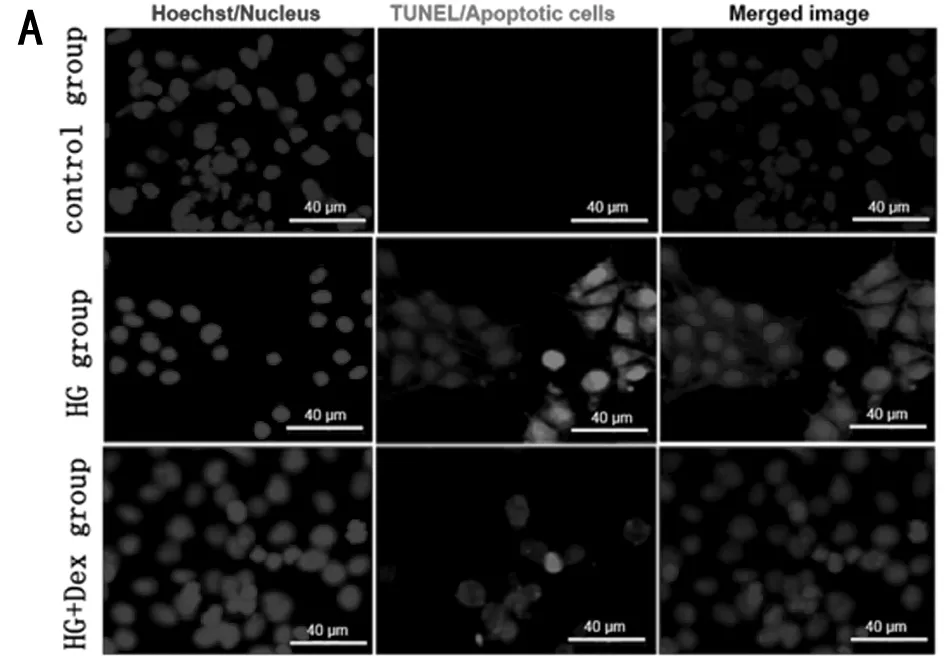
图3 右美托咪定抑制高糖诱导的神经元细胞凋亡;A TUNEL实验检测各组细胞凋亡;B WB检测各组细胞凋亡相关蛋白表达
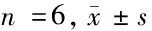
表3 右美托咪定抑制高糖诱导的神经元细胞凋亡
2.4 右美托咪定促进突触素蛋白和mRNA的表达 与对照组比较,高糖组神经元细胞SYP蛋白显著降低(P<0.05);与高糖组比较,高糖+右美托咪定组神经元细胞SYP蛋白显著升高(P<0.05)。qRT-PCR检测SYP mRNA表达,结果显示,与对照组相比,高糖组神经元细胞SYP mRNA显著降低(P<0.05);与高糖组比较,高糖+右美托咪定组神经元细胞SYP mRNA显著升高(P<0.05)。见图4,表4。
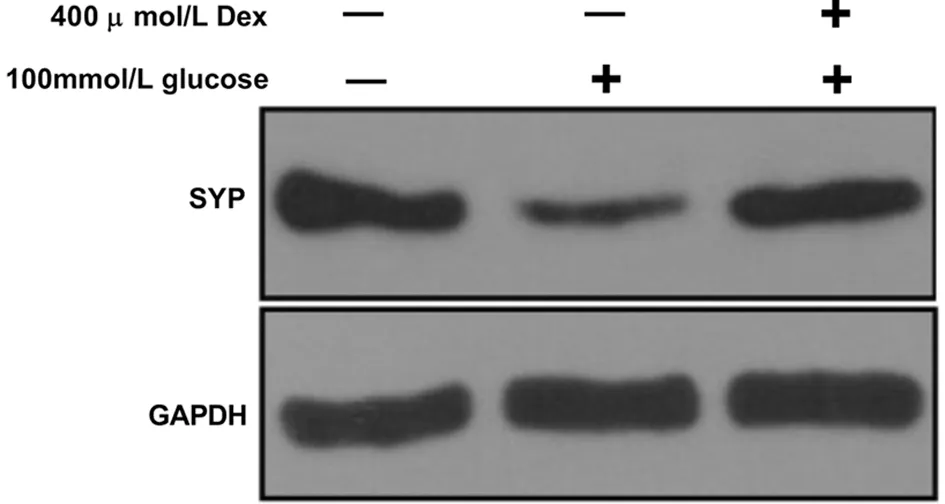
图4 右美托咪定对SYP蛋白表达的影响(WB检测各组SYP蛋白表达)
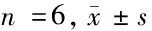
表4 右美托咪定对SYP蛋白表达的影响
2.5 右美托咪定激活PI3K/Akt和JAK2/STAT3信号通路 与对照组比较,高糖组神经元细胞p-Akt和p-STAT3蛋白显著降低(P<0.05);与高糖组比较,高糖+右美托咪定组神经元细胞p-Akt和p-STAT3蛋白显著升高(P<0.05)。各组Akt和STAT3蛋白表达差异无统计学意义(P>0.05)。见图5,表5。
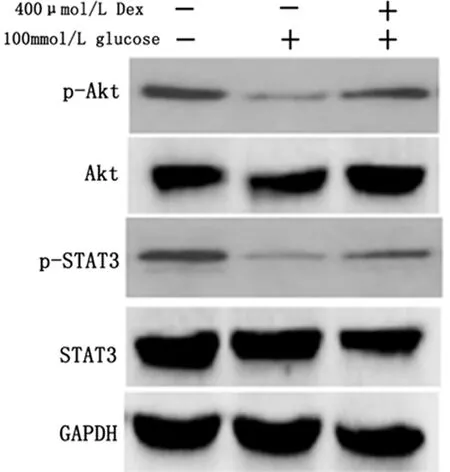
图5 3组PI3K/Akt和JAK2/STAT3信号通路蛋白表达
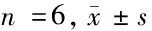
表5 3组PI3K/Akt和JAK2/STAT3信号通路蛋白表达
3 讨论
糖尿病脑病与海马神经元损伤密切相关,具体表现为高糖可导致机体代谢紊乱、血液黏稠度升高、血管内皮细胞损伤等[10,11],进而引发大脑供血不足,造成与认知有关的大脑海马神经元损伤[12]。临床上对于糖尿病脑病所引起的神经元损伤治疗大多以药物控制为主,但目前所用的药物存在较为严重的不良反应。右美托咪定是一种主要作用于神经系统的药物,临床上多与镇静药物等联合使用进行麻醉,具有良好的抑制交感神经活性作用[13],且近期有研究显示右美托咪定对神经性疾病具有良好的治疗效果[14]。本研究的免疫荧光试验、CCK-8、TUNEL以及WB等实验表明右美托咪定能有效抑制高糖诱导的大鼠乳鼠海马神经元细胞活性降低和细胞凋亡,对于高糖诱导的神经元损伤具有保护作用。
Cas-3蛋白是细胞凋亡过程中最主要的终末剪切酶,cleaved cas-3是其活化后被剪切产生的活性片段,具有蛋白水解酶的作用,能够促使细胞凋亡[15]。Bcl-2家族在调控细胞凋亡过程中具有重要作用,Bcl-2蛋白是抗凋亡基因,可降低细胞内氧化还原电位从而抑制细胞凋亡[16]。Bax则是凋亡促进基因,可以和Bcl-2结合形成二聚体抑制Bcl-2的抗凋亡作用[17]。本研究显示,高糖可诱导cleaved cas-3和Bax表达量增加以及Bcl-2表达量减少,与高糖组比较,高糖+右美托咪定组大鼠海马神经元中cleaved cas-3和Bax表达量显著降低,Bcl-2表达量显著升高,表明在加入右美托咪后,cleaved cas-3和Bax表达被抑制,而Bcl-2表达被增强,即右美托咪定具有对抗高糖引起的大鼠乳鼠海马神经元细胞凋亡的作用。
SYP是主要存在于海马神经元突触前膜的囊泡中的一种糖蛋白,与突触功能和结构密切相关[18,19]。有研究报道,SYP的表达能够反映突触的再生和重构能力,神经元损伤后导致突触功能异常或丧失,进而引发严重的认知功能障碍[20]。本研究显示,高糖损伤的神经元细胞中SYP表达量降低,而给予右美托咪定处理后,与高糖组比较,高糖+右美托咪定组中SYP蛋白表达量显著增加,进一步佐证了右美托咪定能够抑制高糖导致的大鼠乳鼠海马神经元损伤。
有研究报道,某些药物治疗对脑损伤具有保护作用,而该过程是在PI3K/Akt信号通路激活的参与下完成的,其中的机制为:抑制Akt蛋白的磷酸化能够加重神经元损伤患者的认知和记忆损伤,反之,促进Akt蛋白磷酸化则能显著抑制信号通路中Bax蛋白的表达上调,进而抑制细胞凋亡发生[21]。JAK2/STAT3信号通路是一条参与细胞增殖、凋亡和炎症等多个生理和病理过程的重要信号通路[22],李霞等[23]观察STAT3被激活后能够有效抑制神经细胞凋亡,当JAK2/STAT3信号通路受到抑制且STAT3磷酸化被干扰时会加重神经元损伤。本研究通过检测p-Akt、p-STAT3的表达量显示,与对照组比较,高糖组p-Akt蛋白表达减少,右美托咪定处理后p-Akt蛋白表达量显著增加;高糖诱导神经元发生损伤后,由于STAT3磷酸化被抑制而发生细胞凋亡,但当加入右美托咪定后,p-STAT3蛋白表达量显著增加,即右美托咪定可在一定程度上解除磷酸化抑制并发挥对神经元损伤的保护作用。以上结果表明,应用右美托咪定后,PI3K/Akt和JAK2/STAT3信号通路被激活并增加p-Akt和p-STAT3表达量,但右美托咪定是否通过这两条信号通路发挥保护神经元细胞作用,以及这两条信号通路的具体信号转导和通路间的相互关系还需进一步深入研究。
综上所述,右美托咪定对高糖诱导的大鼠乳鼠海马神经元损伤具有保护作用,右美托咪定可以激活PI3K/Akt和JAK2/STAT3信号通路,推测右美托咪定可能通过激活PI3K/Akt和JAK2/STAT3信号通路对高糖诱导的大鼠乳鼠海马神经元损伤发挥保护作用。
