乌司他丁联合持续血液净化治疗在急性呼吸窘迫综合征患者中的应用效果
2022-06-15左文霞黄园琴
左文霞,黄园琴,刘 彬
(武汉亚洲心脏病医院外科重症监护室,湖北 武汉 430022)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种弥漫性肺损伤,在短时间内发生,其主要致病原因为休克、严重感染、创伤等,临床主要表现为呼吸困难、低氧血症等,该病具有较高的病死率,对于患者的生命健康有严重的威胁。临床上常采取持续血液净化的方式,通过改善机体血液循环以达到治疗效果[1];但持续血液净化会导致患者的血流动力学与水、电解质发生紊乱,临床治疗存在一定的风险,不利于患者的预后[2]。乌司他丁是一种可对机体内多种蛋白酶的活性进行抑制的蛋白酶抑制剂,可调节机体血管内皮细胞的通透性,维持机体的水、电解质平衡,改善体外循环[3];同时还有较好的抑制炎性介质因子释放作用[4]。因此,本研究旨在探讨乌司他丁联合持续血液净化对ARDS患者治疗效果的影响,现报道如下。
1 资料与方法
1.1 一般资料 按随机数字表法将武汉亚洲心脏病医院2019年9月至2021年9月收治的ARDS患者120例分为对照组和观察组,各60例。对照组中男、女患者分别为32、28例;年龄45~55岁,平均(50.02±1.45)岁;急性生理学及慢性健康状况评分系统(APACHEⅡ)评分[5]为22~27分,平均(25.07±1.44)分。观察组中男、女患者分别为26、34例;年龄46~57岁,平均(50.05±1.50)岁;APACHEⅡ评分为21~28分,平均(25.09±1.45)分。两组患者一般资料经比较,差异无统计学意义(P>0.05),组间可比。诊断标准:参照《呼吸科急症临床诊疗要点》[6]中的诊断标准。纳入标准:符合上述诊断标准且经检查确诊者;氧合指数<300 mmHg(1 mmHg=0.133 kPa)者;APACHEⅡ评分≥ 21分者等。排除标准:有重度高血压或其他严重呼吸疾病者;有肺炎疾病史者;有严重心、肝、肾等疾病者等。本研究经院内医学伦理委员会批准,患者或其家属均签署知情同意书。
1.2 治疗方法 入院后均给予患者常规治疗,即氧疗、糖皮质激素、维持内环境稳定、肺保护机械通气及积极治疗原发性疾病等。在此基础上对照组患者采用连续性血液净化设备(重庆山外山血液净化技术股份有限公司,型号:SWS-3000)治疗,血流速度设置为150~200 mL/min,前置换液速度1.5 L/h,后置换液速度1.5 L/h;以24 h/d为初始治疗时间,病情趋于稳定后改为12 h/d,共治疗3 d。观察组患者在对照组的基础上使用乌司他丁注射液(广东天普生化医药股份有限公司,国药准字H20040506,规格:2 mL∶10万U)治疗,将4 mL药物溶于50 mL的0.9%氯化钠注射液中,微泵持续注射1 h,每间隔8 h治疗1次,共治疗7 d。
1.3 观察指标 ①临床指标。统计两组患者的机械通气、重症加强护理病房(ICU)住院时间及治疗后APACHEⅡ评分。其中APACHEⅡ评分总分71分,评分越高提示患者病情越严重。②内皮功能。于治疗前后采集两组患者的空腹静脉血约3 mL待其自行凝固后,以3 500 r/min的转速离心15 min取血清待检,此外给予患者佩戴鼻夹,使其进行单向活瓣平静呼吸,应用呼出气冷凝液收集器收集3 mL的呼气冷凝液待检,呼气冷凝液一氧化氮(NO)、血清NO和呼气冷凝液内皮素(ET-1)、血清ET-1水平使用酶联免疫吸附实验法检测。③炎性因子。样本采集、处理及检测方法同②,检测血清白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)水平。④血清钙结合蛋白S100A12与诱骗受体3(DcR3)水平。样本采集、处理及检测方法同②,检测血清S100A12、DcR3水平。
1.4 统计学方法 采用SPSS 20.0统计软件分析数据,计数资料、计量资料分别以[ 例(%)]、(±s)表示,组间比较分别采用χ2、t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床相关指标 观察组患者ICU住院与机械通气时间均短于对照组,治疗后APACHEⅡ评分低于对照组,差异均有统计学意义(均P<0.05),见表1。
表1 两组患者临床相关指标比较( ±s)
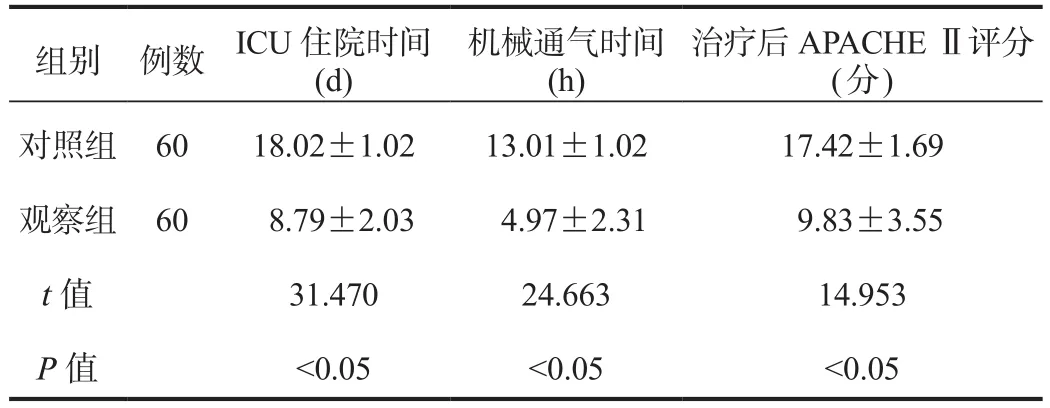
表1 两组患者临床相关指标比较( ±s)
注:ICU:重症加强护理病房;APACHEⅡ:急性生理学及慢性健康状况评分系统。
组别 例数 ICU住院时间(d)机械通气时间(h)治疗后APACHEⅡ评分( 分 )对照组 60 18.02±1.02 13.01±1.02 17.42±1.69观察组 60 8.79±2.03 4.97±2.31 9.83±3.55 t值 31.470 24.663 14.953 P值 <0.05 <0.05 <0.05
2.2 内皮功能 与治疗前比,治疗后两组患者呼气冷凝液NO和血清NO水平均升高,呼气冷凝液ET-1和血清ET-1水平均降低,且观察组呼气冷凝液NO和血清NO水平均高于对照组,呼气冷凝液ET-1和血清ET-1水平均低于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者内皮功能指标比较( ±s)
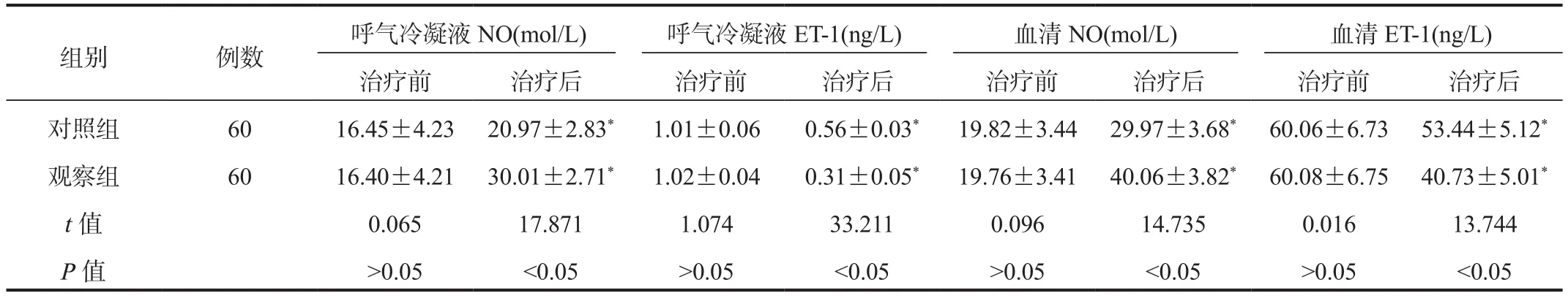
表2 两组患者内皮功能指标比较( ±s)
注:与治疗前比,*P<0.05。NO:一氧化氮;ET-1:内皮素。
组别 例数 呼气冷凝液NO(mol/L) 呼气冷凝液ET-1(ng/L) 血清NO(mol/L) 血清ET-1(ng/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 60 16.45±4.23 20.97±2.83* 1.01±0.06 0.56±0.03* 19.82±3.44 29.97±3.68* 60.06±6.73 53.44±5.12*观察组 60 16.40±4.21 30.01±2.71* 1.02±0.04 0.31±0.05* 19.76±3.41 40.06±3.82* 60.08±6.75 40.73±5.01*t值 0.065 17.871 1.074 33.211 0.096 14.735 0.016 13.744 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 炎性因子 与治疗前比,治疗后两组患者血清IL-6、TNF-α、IL-1β水平均降低,IL-10水平均升高,且观察组血清 IL-6、TNF-α、IL-1β 水平均低于对照组,IL-10 水平均高于对照组,差异均有统计学意义(均P<0.05),见表3。
表3 两组患者炎性因子指标水平比较( ±s)

表3 两组患者炎性因子指标水平比较( ±s)
注:与治疗前比,*P<0.05。IL-6:白细胞介素-6;TNF-α:肿瘤坏死因子-α;IL-10:白细胞介素-10;IL-1β:白细胞介素-1β。
组别 例数 IL-6(pg/mL) TNF-α(pg/mL) IL-10(pg/mL) IL-1β(ng/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 60 23.07±0.69 11.04±1.67* 50.01±6.05 20.01±5.03* 7.58±2.21 8.97±2.83* 3.52±0.73 2.23±0.71*观察组 60 23.10±0.71 4.16±1.21* 50.06±6.07 6.97±3.01* 7.54±2.19 18.06±3.09* 3.50±0.75 0.47±0.12*t值 0.235 25.841 0.045 17.231 0.100 16.804 0.148 18.933 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 血清S100A12与DcR3水平 治疗后两组患者血清S100A12、DcR3水平较治疗前均降低,且观察组低于对照组,差异均有统计学意义(均P<0.05),见表4。
表4 两组患者血清S100A12与DcR3水平比较( ±s , ng/mL)

表4 两组患者血清S100A12与DcR3水平比较( ±s , ng/mL)
注:与治疗前比,*P<0.05。DcR3:诱骗受体3。
组别 例数 S100A12 DcR3治疗前 治疗后 治疗前 治疗后对照组 60 160.44±12.78 110.03±10.72*4.26±1.93 3.22±1.17*观察组 60 161.07±13.55 81.57±10.01*4.30±1.95 1.65±0.56*t值 0.262 15.030 0.113 9.376 P值 >0.05 <0.05 >0.05 <0.05
3 讨论
ARDS是临床上较为常见的一种危重疾病,其发病机制较为复杂,多由患者肺内外多种因素相互作用而导致[7]。ARDS患者肺部血管通透性增加,导致机体的血管外肺水增多,出现血流比例失调、通气困难等症状[8];临床常采用持续血液净化治疗,即使用血液净化装置,将循环血液引出体外,并进行净化处理,滤出致病的炎性因子和毒素,但其在机体炎症反应控制方面效果欠佳[9]。
乌司他丁属于一种蛋白酶抑制剂,其通过对多种蛋白水解酶的活性进行抑制,使得机体内氧自由基与炎性因子的释放得以抑制,进而减轻机体的炎性损伤[10];此外,其还可以调节血管内皮细胞的通透性,改善机体微循环,减轻机体的组织损伤,改善患者的临床症状[11]。在ARDS的病理过程中,内皮细胞的活化和血管内皮的损伤具有重要意义,机体中ET-1和NO水平与患者的病情密切相关[12]。NO可促进血管的扩张,ET-1能够使血管收缩,在正常状态下两者处于动态平衡,当患者血管内皮受损时,会释放大量ET-1,导致血管痉挛,从而加剧机体微循环障碍[13]。本研究中,观察组患者ICU住院时间、机械通气时间均短于对照组,治疗后APACHEⅡ评分与呼气冷凝液、血清ET-1水平均低于对照组,呼气冷凝液、血清NO水平均高于对照组,提示乌司他丁与持续血液净化联合治疗ARDS可以缩短患者的ICU住院和机械通气时间,同时降低病死率,改善患者血管内皮通透性,与高威[14]研究相符。
TNF-α是ARDS炎症反应的启动因子,可促进中性粒细胞吞噬,诱导IL-6、IL-1β及其自身产生,作用于内皮细胞,并会增加毛细血管的通透性,促进血栓在局部组织的形成,或造成局部组织缺血,导致组织损伤[15]。IL-10是一种抗炎因子,可由多种组织与细胞产生,抑制中性粒细胞和单核巨噬细胞分泌TNF-α、IL-6等促炎因子,与ARDS的发生、发展密切相关[16]。DcR3属于肿瘤坏死因子受体超家族的一员,是一种常见的与炎症反应进展密切相关的多向免疫调节因子,通常在恶性肿瘤中表达较为显著,若血清DcR3水平呈高表达,会导致机体的肺炎菌清除功能下降,进而加重ARDS患者的病情[17];而血清S100A12属于S100的一种,其通过与血管内皮黏附因子相互作用,可促进机体炎性因子的分泌;当急性肺损伤发生时,机体血清S100A12处于较高水平,导致机体发生急性肺部损伤,加重ARDS患者肺部的病理性损伤[18]。乌司他丁对肺组织中性粒细胞的趋化功能有抑制作用,通过抑制黏附因子的分泌,而抑制机体中炎性因子的释放,从而缓解机体的炎症反应,改善患者肺通气[19]。此外,乌司他丁还可以有效地抑制蛋白酶的活性,清除氧自由基,进而抑制机体炎性因子的分泌,减轻机体的炎症反应,有效改善ARDS患者的临床症状,减轻机体病理性损伤,提高患者治疗效果[20]。本研究中,治疗后观察组患者血清IL-6、TNF-α、IL-1β、S100A12、DcR3水平均低于对照组,血清IL-10水平高于观察组,提示乌司他丁联合持续血液净化治疗ARDS可有效减轻患者机体的炎症反应、纠正肺泡水肿,进而缓解患者的临床症状,发挥更为有效的治疗效果。
综上,乌司他丁与持续血液净化联合治疗ARDS可在有效缩短患者ICU住院时间、机械通气时间的同时降低病死率,改善患者血管内皮通透性,并且可缓解机体炎症反应,纠正肺泡水肿,促进临床症状的缓解,疗效确切,建议临床进一步推广。
