西红花苷调节己糖激酶促进糖酵解改善心肌缺血再灌注损伤
2022-06-14贾敏贾凌梅李汭傧马泽军马进
贾敏 贾凌梅 李汭傧 马泽军 马进
伴随着冠状动脉(冠脉)介入治疗、冠脉搭桥和冠脉溶栓等治疗手段的广泛应用,继之出现的心肌缺血/再灌注(myocardial ischemia/reperfusion,MI/R)造成的二次损伤为临床冠脉介入治疗、冠脉搭桥和冠脉溶栓等治疗手段的有效运用带来极大障碍[1,2]。因此围绕前处理预防降低MI/R造成的二次损伤是目前临床研究的热点。线粒体是细胞的能量供应器,心肌缺血再灌注导致的心肌损伤直接影响心肌细胞线粒体功能。MI/R引起线粒体功能障碍可以引起线粒体代谢抑制,线粒体活性氧的大量生成,引起内质网应激及线粒体应激反应,诱导细胞凋亡发生,最终导致心肌细胞损伤。HKⅡ是机体糖酵解关键限速酶,心肌线粒体保护起重要调节作用[3,4]。HKⅡ与线粒体相互作用可以稳定细胞线粒体功能,促进糖酵解发生,糖酵解在缺血再灌注早期可以有效补充细胞ATP能量生成,改善细胞线粒体功能及能量平衡[5]。西红花苷(crocin)为西红花的提取物,又称为西红花素,研究表明西红花苷在心脏疾病中具有一定的保护作用,西红花苷可以改善二嗪农(DZN)所致的大鼠心脏损伤对大鼠心脏组织的丙二醛(MDA)、肌酸激酶同工酶(CK-MB)的含量显著降低,而谷胱甘肽(GSH)的含量有所升高,西红花苷具有抗氧化应激的作用[6-8],但西红花苷在心脏缺血再灌注中的作用及机制有待研究。本研究将采用H9c2大鼠心肌细胞建立体外缺血再灌注损伤细胞模型[9],通过考察细胞糖酵解水平及己糖激酶评价西红花苷对缺血再灌注损伤细胞的影响。
1 材料与方法
1.1 材料 西红花苷(质量分数≥98%,批号:160122)购自阿拉丁公司。H9c2大鼠心肌细胞株,购自中国科学院上海细胞库。DMEM培养基、胎牛血清(fetal bovine serum,FBS)购自GIBCO公司,乳酸检测试剂盒,NAD+/NADH 检测试剂盒(BioVision公司)、己糖激酶抑制剂(3-BrPA),葡萄糖检测试剂盒(Sigma 公司),己糖激酶试剂盒,丙酮酸激酶试剂盒(南京建成生物工程研究所),HKⅡ抗体(abcam公司)。
1.2 H9c2大鼠心肌细胞株培养 H9c2大鼠心肌细胞株培养在含10%的新生牛血清的DMEM培养基中,于37℃,5% CO2细胞培养箱中孵育。取对数生长期细胞,D-hanks液漂洗后加入含1%新生牛血清的DMEM培养基。
1.3 H9c2缺氧/复氧模型建立 将H9c2心肌细胞于37℃,95%N2,5%CO2的恒温培养箱中培养后,10%FBS的DMEM培养液更换为PBS缓冲液,在缺氧复氧培养箱充入95%N210 min后,把缺氧复氧培养箱放入37℃的恒温培养箱中进行缺氧4 h,然后去掉PBS缓冲液,重新加入10%FBS的DMEM培养基,放置于37℃,20% O2,5%CO2中培养12 h后进行检测各项指标。
1.4 MTT法检测H9c2细胞存活率 将H9c2心肌细胞以1×104个/孔接种于96 孔板中,细胞贴壁后加入不同浓度(20、40、80 μmol/L)的西红花苷,己糖激酶抑制剂组及抑制剂与西红花苷联合组(15 μmol/L 3-BrPA +40 μmol/L西红花苷)每孔200 μl,每个浓度设5个复孔,与缺氧细胞4 h后加入,培养12 h 后,向每孔中加入5 g/L的MTT 20 μl继续培养4 h,弃上清液,向每孔中加入二甲基亚砜100 μl溶解结晶体,置于摇床振荡10 min,至蓝紫色颗粒完全溶解后,于酶标仪570 nm波长处测定每孔吸光度值(A),重复3次。
1.5 检测心肌细胞葡萄糖消耗及乳酸水平 将处于对数生长期的H9c2心肌细胞接种于12孔板中,每孔4×105个细胞,1 ml培养液,培养12 h,待细胞覆盖板底70%后建模加药处理。设置药物浓度为20、40、80 μmol/L,己糖激酶抑制剂组及抑制剂与西红花苷联合组(15 μmol/L 3-BrPA+40 μmol/L西红花苷),另设对照组。采用Lactate Colorimetric Assay Kit Ⅱ检测细胞培养基中的乳酸含量,操作按照实际盒提供的操作说明进行;葡萄糖检测采用Glucose(GO)Assay Kit 提供的操作说明进行分析。
1.6 检测心肌细胞ATP含量 将处于对数生长期的H9c2心肌细胞接种于12孔板中,每孔4×105个细胞,1 ml培养液,培养12 h,待细胞覆盖板底70%后建模加药处理。设置药物浓度为20、40、80 μmol/L,己糖激酶抑制剂组及抑制剂与西红花苷联合组(15 μmol/L 3-BrPA +40 μmol/L西红花苷),另设对照组。收集细胞于离心管中,10 000 r/min离心5 min,弃上清,每管加入100 μl裂解液。待细胞充分裂解后,4℃,12 000 r/min,离心10 min,取上清用于后续测定。取新96孔板,每孔加入100 μl ATP工作液(1∶100),在室温下放置5 min。待本底性ATP消耗完毕,避光条件下每孔加入30 μl BCA法蛋白定量后的样品,2 s后立即检测。以上实验重复3次。
1.7 检测心肌细胞NAD+/NADH变化 将处于对数生长期的H9c2心肌细胞接种于12孔板中,每孔4×105个细胞,1 ml培养液,培养12 h,待细胞覆盖板底70%后建模加药处理。设置药物浓度为20、40、80 μmol/L,己糖激酶抑制剂组及抑制剂与西红花苷联合组(15 μmol/L 3-BrPA +40 μmol/L西红花苷),另设对照组。采用NAD+/NADH Kit检测细胞培养基中的NAD+及NADH含量(BioVision,Inc,USA),操作按照实际盒提供的操作说明进行。
1.8 Western blot检测HKⅡ蛋白水平的影响 收集细胞,用冰预冷0.9%氯化钠溶液洗2次,用RIPA细胞裂解液提取总蛋白质。提取液蛋白质浓度用BCA 试剂盒定量。将蛋白提取液用12.5% SDS-PAGE进行电泳分离,将电泳分离胶通过电转方法将蛋白质转到PVDF 膜上,用HKⅡ或β-actin 单克隆抗体孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2 h,蛋白条带用ECL 试剂盒显色发光。

2 结果
2.1 MTT实验评价西红花苷对H9c2模型细胞增殖作用的影响 随着西红花苷浓度的增加促进心肌细胞细胞增殖,并具有明显的浓度依赖性。但当将西红花苷与己糖激酶抑制剂联合使用后,西红花苷对细胞的增殖作用明显降低。见图1,表1。

图1 西红花苷对H9c2细胞增殖率细胞的影响

表1 西红花苷对西红花苷对H9c2细胞增殖率细胞的影响
2.2 西红花苷可以提高H9c2模型细胞糖酵解水平 随着西红花苷浓度(20、40、80 μmol/L)的增加,与模型细胞比较,西红花苷可以明显升高H9c2模型细胞对葡萄糖的消耗,中高剂量组与对照组比较,差异有统计学意义(P<0.05),同时西红花苷可以明显促进细胞乳酸生成,并均呈现浓度依赖性,中高剂量组与对照组比较,差异有统计学意义(P<0.05)。但当给于己糖激酶抑制剂后,西红花苷对细胞糖酵解的影响作用显著降低,但与抑制剂组仍差异有统计学意义(P<0.05)。见表2。
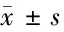
表2 西红花苷对H9c2缺氧/复氧细胞葡萄糖消耗及乳酸水平的影响
2.3 西红花苷可以升高H9c2模型细胞线粒体能量生成 随着西红花苷浓度(20、40、80 μmol/L)的增加,与模型细胞组比较,西红花苷可以明显升高模型细胞中ATP的含量,同时降低模型细胞中NAD+/NADH的比例,提高糖酵解能量供应水平,促进ATP产生。西红花苷对ATP含量及NAD+/NADH的影响与模型组比较差异有统计学意义(P<0.05)。表明西红花苷可以明显升高模型细胞能力供应水平。而给于己糖激酶抑制剂后,西红花苷对细胞能量供应的影响作用显著降低,但与抑制剂组仍有差异(P<0.05)。见表3,图2。
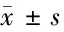
表3 西红花苷对H9c2细胞ATP含量及NAD+/NADH的影响

图2 西红花苷对H9c2缺氧/复氧细胞HKⅡ的蛋白表达的影响
2.4 西红花苷可升高H9c2细胞中己糖激酶活性 在H9c2细胞中,不同剂量的西红花苷均可以明显升高己糖激酶的活性,但当给予己糖激酶抑制剂后对己糖激酶活性明显降低。见表4。
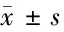
表4 6组己糖激酶相对活性检测结果
2.5 西红花苷促进H9c2模型细胞HKⅡ表达 通过Western blot检测川楝素对H9c2细胞HKⅡ的蛋白表达影响,结果表明在H9c2细胞缺氧/复氧模型中HKⅡ表达降低,当给于西红花苷后可明显促进HKⅡ表达升高,但是当给于己糖激酶抑制剂后,该作用明显降低,但与抑制剂组仍具有显著差异。见图2,表5。
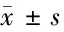
表5 西红花苷对H9c2缺氧/复氧细胞HKⅡ的蛋白表达的影响
3 讨论
心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)的发生率逐年增高。MIRI是指心肌在缺血的基础上恢复血流后组织损伤反而加重,甚至发生不可逆损伤的现象,常发生于心肌梗死血管再通、冠脉痉挛解除、心脏移植、心肺手术体外循环及心肺复苏后。导致MIRI发生的机制复杂,多种生物活性分子及细胞内信号转导通路均参与该类疾病的发生发展[1,2]。
急性心肌缺血时,无氧糖酵解代谢承担能源生产的核心作用,由于缺乏氧气氧化磷酸化不能出现。从而转向无氧代谢,无氧代谢需要葡萄糖的吸收,迅速增加糖原分解和糖酵解。但在严重缺血后,由于氢离子和糖酵解中间产物的积累,最终抑制糖酵解,导致细胞能量供应水平下降进一步促进细胞凋亡发生。研究表明葡萄糖和胰岛素促进的葡萄糖代谢可以有效的用于保护心脏在MI/R损伤[10,11]。本研究通过采用H9c2细胞建立缺氧/复氧模型,发现模型建立后细胞糖酵解水平明显低于正常组,葡萄糖消耗、乳酸水平明显降低,当给于西红花苷后可以明显提高细胞葡萄糖消耗、乳酸水平,促进糖酵解,同时可以有效促进细胞ATP含量升高,促进细胞能量供应。在成人心脏,MI/R发生时,HKⅡ亚细胞定位发生改变,由于G6P的积累导致由线粒体向胞浆转移,促进糖酵解的发生,为细胞提供能量补充。己糖激酶Ⅱ(HexokinaseⅡ,HKⅡ)作为机体糖酵解关键调控蛋白,是糖酵解的第一步限速酶[12]。同时在实验中我们发现当给于己糖激酶抑制剂后,模型细胞糖酵解水平明显降低,当给于抑制剂组联合使用西红花苷后,可以有效提高抑制剂组模型细胞糖酵解水平。此外己糖激酶不仅参与细胞糖酵解的过程,还参与调节线粒体功能和细胞凋亡;包括结合并调节线粒体电压依赖性阴离子通道(voltage dependent anion channel,VDAC)和mPTP的形成及调控。VDAC能够与已糖激酶(hexokinase,HK)结合,HK能够促进通道关闭,抑制ATP通过VDAC进出线粒体。同时HK与VDAC结合会使Bax与线粒体结合会降低,从而表现出抑制凋亡的作用。研究发现HK与VDAC连接愈密切,可以明显促进线粒体稳定性,减少凋亡发生,从而保护细胞功能[13-15]。
本实验结果表明,西红花苷可以有效促进己糖激酶活性并升高己糖激酶蛋白表达。本研究初步表明西红花苷在缺血再灌注损伤中可以有效提高心肌糖酵解水平,改善缺血再灌注导致是细胞损伤并对细胞己糖激酶具有显著调节作用,而西红花苷在己糖激酶中的调节机制还有待进一步探究。
