基于跨反向剪接位点引物特异性检测circRNA的PCR方法
2022-06-10孙宝箴全龙萍康慧姚玉新沈甜陈卫平杜远鹏高振
孙宝箴 全龙萍 康慧 姚玉新 沈甜 陈卫平 杜远鹏 高振
(1. 山东农业大学园艺科学与工程学院 山东果蔬优质高效生产协同创新中心 作物生物学国家重点实验室,泰安 272018;2. 宁夏农林科学院园艺研究所,银川 750002)
环状RNA(circRNA)是一类不具有5'末端帽子和3'末端poly(A)、并以共价键形成环形结构的非编码RNA分子,在生物界中广泛存在。长期以来,它们被认为是由于异常剪接而形成的副产品,功能潜力很小[1]。随着研究的不断深入,植物circRNA的特征和功能逐步被挖掘[2]。通过设计1对跨反向剪接位点两侧的背向引物进行qRT-PCR已被广泛用于检测circRNA的表达水平,但使用常规背向引物无法特异地扩增发生可变剪接环化时被包含的circRNA,所以开发一种适用于发生可变剪接环化的circRNA的定量分析方法至关重要。
逆转录PCR(RT-PCR)、实时荧光定量PCR(qRT-PCR)是验证circRNA并分析其表达量简便、快速的方法,其关键在于引物设计的位置。由于circRNA和线性RNA序列相同,为避免扩增出线性序列,circRNA验证时需要跨反向剪接位点(backsplice site)两侧设计引物,称为背向引物(divergent primer),扩增产物包含反向剪接位点。背向引物仅可扩增环化后首尾相接的circRNA,因此,通过背向引物RT-PCR结合Sanger测序检验可变剪接位点是验证植物circRNA存在与否的标准。由于qRTPCR成本低且适于大规模试验,通过背向引物进行qRT-PCR是目前检测植物circRNA表达水平最常用的方法。使用背向引物通过RT-PCR和qRT-PCR扩增circRNA的方法在番茄[3]、水稻[4]、枸橘[5]和杨树[6]中均得到应用。将背向引物中的正向和反向引物设计得彼此接近或者重叠可以用于扩增全长circRNA序列[7]。
可变剪切通常指从一个mRNA前体中通过选择不同的剪接位点组合方式产生不同的mRNA剪接异构体的过程。circRNA同样存在可变剪接现象,在拟南芥[8]、番茄[3]、棉花[9]、水稻[4,7]、玉米[10]、枸橘[5]和杨树[6]等植物中均有报道。circRNA可变剪接可分为2种类型,同一基因产生具备相同剪接位点但转录本长度不同的circRNA为可变剪接环化,其中同一基因产生不同反向剪接位点的circRNA为可变反向剪接环化[11]。由于circRNA生信分析软件主要基于反向剪接位点进行筛选,目前,circRNA可变剪接事件的报道集中在可变反向剪接环化。枸橘558个circRNA共出现143个可变反向剪接环化事件[5],来源于水稻175个基因的1 356个circRNA共出现486个可变反向剪接环化事件[4],说明可变反向剪接环化事件具有高频率性。且已有研究通过背向引物RT-PCR方法在拟南芥[8]、番茄[3]、棉花[9]、水稻[4]和枸橘[5]中成功验证可变反向剪接环化事件的存在。
截止目前,尚没有针对植物circRNA发生可变反向剪接环化事件时特异检测被包含circRNA表达量的研究报道。究其原因,使用常规背向引物对被包含的circRNA进行qRT-PCR定量分析时势必出现非特异扩增,导致无法准确定量。
本研究对葡萄高可信度circRNA的可变剪接环化事件进行分析,旨在开发一种适用于circRNA可变反向剪接环化事件下被包含circRNA定量分析的引物设计方法,并运用RT-PCR和qRT-PCR验证了该方法可以提高circRNA发生可变反向剪接环化事件时扩增被包含circRNA的特异性,为circRNA的表达研究提供了参考。
1 材料与方法
1.1 材料
试验材料为一年生‘巨峰’盆栽葡萄,培养于山东农业大学园艺学院光照培养室。培养基质为土壤∶珍珠岩∶蛭石(1∶1∶1)混合物,培养温度为28℃,光照强度为2 000-2 400 lx,光照/黑暗时间12 h/12 h。
1.2 方法
1.2.1 circRNA测序数据的获取 对玫瑰香根、茎、叶、花、果实混合组织进行circRNA测序,使用FIND_CIRC[12]、CIRI[13]和CIRCexplorer[14]3种 工具筛选获得8 354个独立的circRNA,取3种算法的交集获得1 432个高可信度的circRNA[15],用于分析可变剪接事件。
1.2.2 RNA提取及检测 取‘巨峰’葡萄根或叶片约0.5 g,液氮研磨,用Biospin多糖多酚植物总RNA提取试剂盒(BSC65S1,博日科技)提取总RNA。取3-5 μL RNA溶液进行琼脂糖凝胶电泳,检测RNA质量。
1.2.3 cDNA第一链的合成 按照PrimeScriptTMRT Master Mix(Perfect Real Time)(宝日医生物技术(北京)有限公司)试剂盒说明书标准步骤进行逆转录,所用引物为6碱基随机引物。逆转录获得的cDNA作为RT-PCR和qRT-PCR的模板。
1.2.4 引物设计标准 设计标准:引物GC含量比为40%-60%,TM值为60-65℃,引物长度为20-30 bp,产物大小为150-250 bp,使用NCBI网站的Primer Blast进行特异性验证(表1)。改进引物基于手动选择,尽量满足引物设计标准(表2)。

表1 RT-PCR与荧光定量PCR所用引物Table 1 Primers for RT-PCR and qRT-PCR

表2 RT-PCR与荧光定量PCR改进引物Table 2 Improved primers for RT-PCR and qRT-PCR
1.2.5 RT-PCR检测 RT-PCR反应体系为10 μL Taq Master Mix(E005-02A,Novoprotein)、上下游引物 0.5 μmol/L、模板1 μL,用水补齐至20 μL。扩增程序 为94℃ 90 s;94℃ 20 s,57℃ 20 s,72℃ 30 s,35个循环;72℃ 5 min。产物经1.5%琼脂糖凝胶电泳检测,并用柱式DNA胶回收试剂盒(DC301,南京诺唯赞生物科技股份有限公司)进行纯化,通过Sanger测序确认反向剪接位点序列。
1.2.6 qRT-PCR检 测 按 照TB Green® Premix Ex TaqTMII(Tli RNaseH Plus)(RR820A,TaKaRa Bio)试剂盒说明进行qRT-PCR检测。反应体系为10 μL SYBR Premix Ex Taq、上下游引物0.5 μmol/L、模板1 μL和灭菌水8 μL。反应程序为95℃ 30 s;95℃ 5 s,60℃ 10 s,40个循环。溶解曲线程序为起始温度65℃,每个循环增加0.5℃至95℃。qRT-PCR引物同RT-PCR(表1和表2)。经qRT-PCR扩增后,检查溶解曲线和扩增曲线,以评估是否为特异性扩增。
2 结果
2.1 葡萄circRNA可变反向剪接环化事件
对前期试验获得的1 432个高可信度葡萄circRNA进行分析,结果显示,这些circRNA共由1 043个基因产生。其中,817个基因只产生一个circRNA,226个基因可发生可变反向剪接环化事件,即产生2个或以上的circRNA,共涉及615个circRNA。根据2个circRNA之间的位置将可变反向剪接环化事件分为并列关系(图1-a)、交叉关系(图1-b)和包含关系(图1-c和图1-d)。

图1 circRNA可变反向剪接环化事件Fig. 1 Alternative back-splicing circularization of circRNA
以VIT_201s0010g01480为例,其第7-13个外显子可以产生6个circRNA,分别为circRNA_0376、circRNA_0379、circRNA_0380、circRNA_0381、circRNA_0382和circRNA_0383(图2)。circRNA_0380 和circRNA_0383以及circRNA_0379和circRNA_0383 属于并列关系;circRNA_0380和circRNA_0382属于交叉关系;circRNA_0380和circRNA_0379、circRNA_0382和circRNA_0383、circRNA_0381和circRNA_0379、circRNA_0381和circRNA_0380、circRNA_0381和circRNA_0382、circRNA_0381和circRNA_0383、circRNA_0376和其余5个circRNA属于包含和被包含关系。

图2 VIT_201s0010g01480第7-13个外显子产生的circRNAFig. 2 circRNA produced by exons 7-13 of VIT_201s0010g01480
理论上,设计背向引物对被包含的circRNA进行RT-PCR和qRT-PCR反应的过程势必会出现非特异扩增的现象。从1 432个circRNA中选取4组具有包含关系的circRNA进行验证(图3和图4),其中circRNA_4363、circRNA_6017、circRNA_6044 和circRNA_7086分 别 被circRNA_4364、circRNA_ 6018、circRNA_6045和circRNA_7085包含。

图3 circRNA_4363、circRNA_6017、circRNA_6044和circRNA_7086的RT-PCR结果Fig. 3 RT-PCR results of circRNA_4363, circRNA_6017, circRNA_6044, and circRNA_7086
运用RT-PCR扩增4个被包含的circRNA(circRNA_4363、circRNA_6017、circRNA_6044和circRNA_7086)时,出现非特异扩增(图3),同预期结果一样。经sanger测序后,发现较小的片段分别 为circRNA_4363、circRNA_6017、circRNA_6044和circRNA_7086(图4),较大的片段分别是包含 它 们 的circRNA(circRNA_4364 circRNA_6018、circRNA_6045和circRNA_7085)。运用qRT-PCR扩增后4个circRNA溶解曲线均呈双峰(图5),说明qRT-PCR过程同样出现了非特异扩增,导致表达量分析结果不可信。

图4 circRNA反向剪接位点及其附近序列Fig. 4 Back-splicing sites and nearby sequences of circRNA

图5 circRNA_4363、circRNA_6017、circRNA_6044和circRNA_7086的qRT-PCR溶解曲线Fig. 5 qRT-PCR dissolution curve of circRNA_4363, circRNA_6017, circRNA_6044, and circRNA_7086
2.2 改进引物的特异性检验
由 于circRNA_4363、circRNA_6017、circRNA_ 6044和circRNA_7086的成熟体序列分别被circRNA_4364 circRNA_6018、circRNA_6045和circRNA_7085完全覆盖,仅在反向剪接位点处存在差异。基于此,设计引物时可将一端引物3'端跨反向剪接位点3-4个碱基(图6,表2)。

图6 改进后的引物设计方法Fig. 6 Improved primer design method
使用改进引物分别对circRNA_4363、circRNA_ 6017、circRNA_6044和circRNA_7086进 行RTPCR,结果显示,circRNA_4363、circRNA_6017和circRNA_7086扩增产物条带单一,但circRNA_6044出现了新的非特异性扩增片段(图7)。检测qRTPCR溶解曲线发现均呈单峰(图8),表明使用该引物设计方法可以提高circRNA可变反向剪接环化事件RT-PCR和qRT-PCR的特异性。

图7 引物改进后circRNA_4363、circRNA_6017、circRNA_6044和circRNA_7086的RT-PCR结果Fig. 7 RT-PCR results of circRNA_4363, circRNA_6017, circRNA_6044, and circRNA_7086 after using improved primers
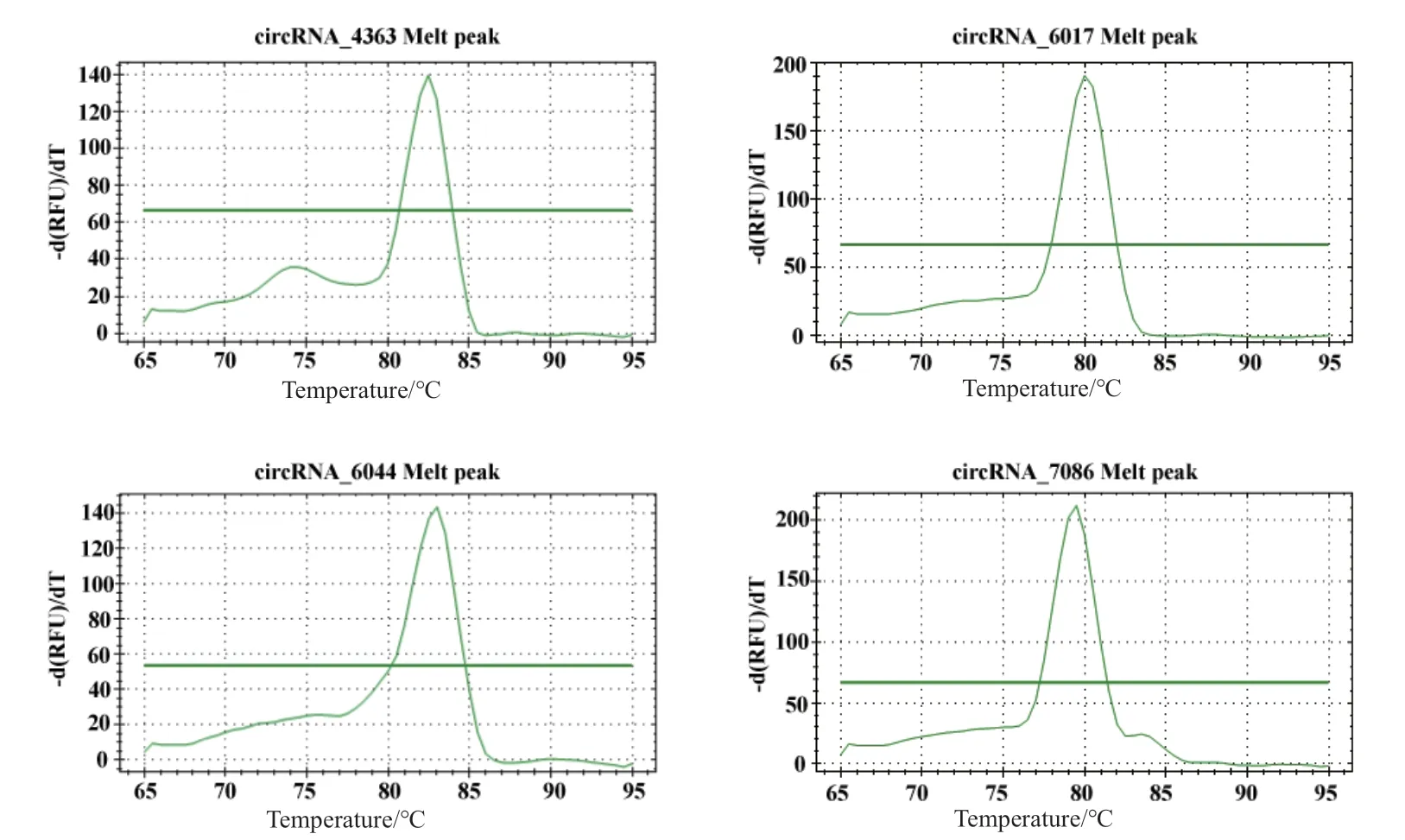
图8 引物改进后circRNA_4363、circRNA_6017、circRNA_6044和circRNA_7086的qRT-PCR溶解曲线Fig. 8 qRT-PCR dissolution curve of circRNA_4363, circRNA_6017, circRNA_6044, and circRNA_7086 after using improved primers
3 讨论
circRNA目前已知的主要功能包括miRNA吸附作用、与功能蛋白结合调控细胞功能、转录调控和蛋白翻译等[16]。circRNA来源丰富,可分为外显子来源的circRNA、内含子来源的circRNA、外显子-内含子来源的circRNA、基因间区circRNA和反义链circRNA。拟南芥、番茄、水稻和葡萄中绝大多数circRNA来源于编码蛋白质的基因,外显子类型的circRNA占比例最大。多外显子circRNA为其发生可变反向剪接环化事件提供了多种可能。高通量测序表明植物circRNA可变反向剪接环化事件广泛存在,并且响应胁迫[8],暗示不同circRNA可变反向剪接环化体在逆境等生物学过程中发挥功能。circRNA的表达规律分析是研究其功能的基础,当circRNA可变反向剪接环化事件发生时,运用PCR扩增的方法无法对被包含的circRNA进行精确定量。基于此本研究提出了一种适用于对circRNA可变反向剪接环化事件中被包含circRNA定量分析的引物设计方法,即一端引物的3'端跨反向剪接位点3-4个碱基,本研究以上游引物的3'端跨剪接位点为例。本研究中circRNA_4363、circRNA_6017和circRNA_7086通过应用该引物改良方法解决了circRNA可变反向剪接环化引起的非特异扩增问题。由于改进引物设计方法必须跨剪接位点,无法满足所有的引物设计原则,在进行PCR扩增时有一定的局限性。例如本实验中的circRNA_6044,使用上游引物3'端跨剪接位点的方法依然不能获得特异性条带,可能是由于引物的特异性不高。在遇到这种情况时,可使用下游引物3'端跨剪接位点进行尝试。另外,由于circRNA可变剪接环化具备相同的反向剪接位点,本研究引物改进方法无法用于发生可变剪接环化的circRNA的表达分析。因此,circRNA定量分析的方法有待进一步的完善和优化。
另外,该引物设计方法也可用于非可变剪接和可变反向剪接环化事件中并列关系、交叉关系中circRNA的表达量分析,并且跨剪接位点的引物既可以是上游引物也可以是下游引物,为葡萄及其他物种circRNA的表达分析研究提供了新的参考,填补了植物circRNA发生可变反向剪接环化事件时特异检测被包含circRNA表达量方法的空白。
4 结论
本研究提出了一种适用于葡萄circRNA可变反向剪接环化事件中被包含circRNA表达分析的引物设计改良方法,即一端引物的3'端跨反向剪接位点3-4个碱基。通过应用该引物改良方法提高了circRNA_4363、circRNA_6017和circRNA_7086扩增的特异性,相较于常规的背向引物设计方法,该引物设计改良方法更加适用于circRNA发生可变剪接环化事件时的定量分析,其结果更加准确可靠。
