儿童及青少年分化型甲状腺癌核医学诊治中国专家共识(2022年版)
2022-06-10中国临床肿瘤学会核医学专家委员会中国临床肿瘤学会甲状腺癌专家委员会中国医疗保健国际交流促进会甲状腺疾病专业委员会中国人口文化促进会甲状腺疾病防治专业委员会
中国临床肿瘤学会核医学专家委员会,中国临床肿瘤学会甲状腺癌专家委员会,中国医疗保健国际交流促进会甲状腺疾病专业委员会,中国人口文化促进会甲状腺疾病防治专业委员会
儿童及青少年分化型甲状腺癌(differentiated thyroid carcinoma in children and adolescents,caDTC)的发病率虽低,但近年来仍在不断上升[1-2]。临床上对其关注度仍存在不足和误区,且与成人甲状腺癌相比,caDTC在病理生理学特征、临床特征及远期预后等方面均存在一定差异,用于指导成人甲状腺癌的指南及治疗策略并不能完全适用于儿童及青少年。美国甲状腺协会(American Thyroid Association,ATA)在2015年首次发表儿童甲状腺结节与分化型甲状腺癌诊治指南[3],为caDTC的诊治提供了指导依据。本共识旨在结合现有的循证医学证据、临床经验及中国caDTC患者的特点,指导并规范中国caDTC的诊疗工作,避免过度治疗及治疗不足,使患者受益最大化。
针对caDTC这样一类复发率高、死亡风险相对低的人群,客观权衡利弊、基于可靠证据的核医学治疗决策及后续临床管理在患者全程管理中有重要意义。值得一提的是,由于caDTC相关的循证医学证据尤其是来自中国的研究证据仍很有限,使目前有关caDTC的临床管理及相关推荐尚缺乏充分的说服力;此外,由于目前儿童及青少年的年龄界定不一,本共识所纳入的证据并未局限于本共识的年龄界定。期待不久的将来,caDTC的诊疗有更多来自中国的循证医学证据。
1 流行病学及临床表现
目前对于儿童及青少年的年龄界定并不统一。从儿科学角度来说,根据人体生长发育的特点及不同阶段,儿童及青少年的年龄一般为20岁以前,男女略有差异。2015年ATA指南[3]将儿童及青少年的年龄限定在≤18岁。国内文献将青少年的年龄限定在10~19岁,也有部分将上限定至21岁[4-5],但日本的最新研究[6]认为caDTC中年龄<15岁者与15~18岁者在预后及临床表现方面具有显著差异,caDTC患者的年龄限定为<15岁更适合。目前相关证据均不足,本共识中暂定儿童及青少年的年龄上限为18岁。
1.1 流行病学
2010年中国统计数据[4]显示,甲状腺癌的发病率约为4.12/10万,死亡率约为0.34/10万;其中儿童及青少年的发病率约为0.44/10万,死亡率约为0.02/10万,均远低于全国平均数值。发病年龄主要分布在5~20岁,并以15~20岁年龄段居多,男女比例约为1.00∶3.85。目前15~19岁青少年人群中,甲状腺癌的发病率位列该年龄段所有恶性肿瘤的第8位,在女性中已高居第2位,需要引起关注[7]。
1.2 临床表现及生物学特征
caDTC生长缓慢,发病隐匿,患者多以颈部无痛性肿块就诊。肿块可为甲状腺结节,也可为颈部转移的淋巴结。由于病程较长,仅有少数患者表现为声音嘶哑、呼吸困难、吞咽困难等,也有部分患者以远处转移为首发症状。
caDTC具有其独特的生物学行为和疾病特征:①病理学类型以甲状腺乳头状癌(papillary thyroid carcinoma,PTC)多见。② 肿瘤体积较大,更易出现局部侵犯、颈部淋巴结和远处转移[8-9]。研究[10]认为,caDTC中年龄≤10岁者,较年龄10~19岁者,更容易出现肿瘤局部侵犯、颈淋巴结转移和远处转移。③复发率高、死亡率低,caDTC复发的主要危险因素包括年龄≤10岁、肿瘤直径>2 cm、多发病灶、合并淋巴结转移、肺部转移及侵袭性的病理学亚型等[11]。④ 放射性暴露是DTC发生的主要危险因素[12]。对于儿童及青少年,小剂量辐射(0.50 Gy)就可能对甲状腺造成潜在的伤害并增加甲状腺结节和甲状腺癌的发病风险;但当放射量>20.00 Gy时,由于甲状腺组织遭受大量破坏,发生癌的机会反而较小。⑤RET/PTC重排是caDTC主要的基因突变方式,发生比例远高于成人[13]。
2 辅助检查
2.1 颈部超声检查
高分辨率超声检查是目前诊断甲状腺结节的首选影像学方法,具有安全、有效、无创、无辐射、实时动态及价格低廉等优点,可用于评估结节数量、位置、大小、超声特征、有无腺体外侵犯及淋巴结转移等。
caDTC 的超声检查表现与成人DTC 类似[14-15],但也存在差异:①纵横比>1少见[16];② 囊实性的恶性率高[17];③结节更大[18],直径>4 cm比例高,直径<1 cm比例低;④ 合并微钙化比例高[19],且粗钙化与caDTC显著相关[20]。caDTC合并颈部淋巴结转移比例较高(40%~70%)[21-23],因此,可疑恶性甲状腺结节均应评估颈部淋巴结,评估方法与成人类似,包括颈部Ⅰ~Ⅶ区,重点为Ⅱ~Ⅳ区及Ⅵ区[3]。
2.2 超声引导下细针穿刺活检(ultrasound guided-fine needle aspiration,US-FNA)
儿童及青少年甲状腺结节恶性比例较高,且获取重复样本有潜在困难,因此所有结节FNA均应在超声引导下进行。US-FNA指征,不能仅依据结节大小,而应综合考虑其超声及临床特征,如出现低回声、边缘不规则、结节内血流增加、出现微钙化、合并颈部淋巴结转移等,或具有甲状腺癌家族史、放疗史和(或)结节呈快速生长等,即使结节<1 cm,也应行US-FNA[24]。
建议1:所有儿童及青少年甲状腺结节患者均需要行颈部超声检查。
建议2:US-FNA应作为诊断甲状腺结节及可疑淋巴结性质的常规方法。
2.3 核医学显像与其他影像学检查
放射性同位素扫描(99mTc-高锝盐或碘-123)一般用于甲状腺功能亢进合并甲状腺结节的儿童及青少年患者检查,以及异位甲状腺检测,不作为甲状腺结节的常规检查方法[25]。但对于血清促甲状腺激素(thyroid stimulating hormone,TSH)低于正常值且甲状腺结节直径>1 cm的儿童及青少年患者,应行核素甲状腺扫描以获知其结节功能。
18F-F D G 正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)不能准确鉴别甲状腺结节的良恶性[26],下列情况可考虑使用:①caDTC患者术后随访中出现刺激性(TSH>30 mU/L)甲状腺球蛋白(stimulated thyroglobulin,s-Tg)升高(>10 ng/mL),且碘-131诊断性全身显像(diagnostic whole body scan,DxWBS)阴性者查找转移灶;② 侵袭性或转移性caDTC患者术后进行放射性碘-131治疗前评估(18F-FDG PET/CT代谢增高的病灶,摄碘-131能力差,碘-131治疗获益可能有限)。
CT和磁共振(magnetic resonance,MR)检查在鉴别甲状腺结节良恶性方面不优于超声检查[27],且由于放射性辐射暴露的问题,儿童及青少年应慎行颈部CT检查[25]。若必须使用CT检查时,建议应用低剂量扫描协议以减少电离辐射[3],且注意保护敏感部位。CT和MR检查能够精确地进行解剖定位和优化手术方案,可用于甲状腺病灶侵犯范围较大或伴上纵隔、咽后、咽旁、锁骨下等深层淋巴结转移者;检查时应慎用含碘对比剂,以免延后碘-131治疗时间[3]。MR检查对神经系统微小转移病灶、水肿、脑膜转移具有更高的诊断效能,可用于诊断中枢神经系统转移[3]。caDTC合并肺转移且摄碘-131者,可行术后s-Tg监测及Dx-WBS检查替代胸部CT[28]。
建议3:核素甲状腺扫描不作为甲状腺结节的常规检查方法,18F-FDG PET/CT在特殊情况下可用于鉴别结节良恶性。
建议4:优化手术方案或怀疑中枢神经系统等远处转移者可酌情行CT或MR检查。
2.4 血清Tg及Tg抗体(Tg-antibody,TgAb)
Tg:亚急性甲状腺炎、慢性淋巴细胞性甲状腺炎及结节性甲状腺肿等良性病变均可引起血清Tg水平不同程度升高。因此,不能依赖血清Tg水平进行术前甲状腺结节良恶性的鉴别诊断。
首次术后碘-131治疗前s-Tg(preablation s-Tg,ps-Tg):Ps-Tg在caDTC中的诊治价值已逐步受到重视。有研究报道,caDTC患者血清ps-Tg以154 ng/mL[29]和156 ng/mL[30]为截断值预测远处转移,灵敏度和特异度较高(ps-Tg能够潜在预测远处转移)。中国一项纳入166例caDTC患者(伴颈淋巴结转移者90%,伴肺转移者15%)碘-131疗效的回顾性研究[31]显示,ps-Tg是预测碘-131疗效的重要因素,低ps-Tg水平者(≤16.1 ng/mL)更易获得临床缓解。
TgAb:TgAb与caDTC的疾病特征及预后相关性的研究证据极为有限。迄今为止的研究[32]显示,TgAb与caDTC疾病特征、疾病持续及复发均无显著相关性。但TgAb的存在会影响通过Tg评估病情的准确性,故应同时监测Tg和TgAb水平的变化。诊断自身免疫性甲状腺疾病时,TgAb阴性的判断标准为低于参考区间;分析TgAb是否干扰Tg测定时,TgAb阴性的判断标准则为低于分析灵敏度。
建议5:血清Tg不能用于术前甲状腺结节的良恶性鉴别。
建议6:血清ps-Tg具有潜在预测caDTC患者远处转移和碘-131疗效的价值。
2.5 组织病理学分类及分子表型
起源于滤泡上皮细胞的caDTC病理学类型略少于成人[33],其组织学和病理学分型的镜下表现与成人基本相同。DTC包括PTC、甲状腺滤泡癌(follicular thyroid carcinoma,FTC)和少见的嗜酸细胞癌[34-35]。PTC亚型包括经典型、高细胞型、弥漫硬化型、实体型、柱状细胞型及滤泡亚型等13个亚型,其中弥漫硬化型、实性型和高细胞型3个亚型为高危型[33,36-38],经典型和滤泡亚型属于低危型。最新流行病学调查[39]显示,caDTC中PTC及其亚型约占80%以上,其次是FTC(10%),PTC最常见的是经典型(48%)、弥漫硬化型(16%)和滤泡亚型(15%),高危型PTC约占37%。PTC整体预后极好,高危型与初诊疾病范围和无病生存率无关[36]。caDTC中嗜酸细胞癌约占5.8%,发病年龄趋向较年幼者,预后与其他类型无差异[40]。
caPTC多为惰性肿瘤,基因组功能稳定,与成人相比,基因重排发生率较高(约为50%),与PTC相关的原癌基因点突变频率较低。BRAFⅤ600E突变率不如成人显著,且BRAFⅤ600E与临床病理学特征无明显相关性,RET/PTC、ETV6-NTRK3和BRAF融合基因(AGK-BRAF和AKAP9-BRAF)突变率较高[41],并且RET融合与远处转移具有相关性[42];而RAS和hTERT基因启动子突变更为罕见。caFTC中RAS或PAX8/PPARG突变较为常见,可能是PTEN错构瘤-肿瘤综合征(包括Cowden综合征)的组成部分,因此儿童甲状腺癌患者应高度怀疑潜在的PTEN突变[41]。儿童甲状腺癌中低分化甲状腺癌(poorly differentiated thyroid carcinoma,PDTC)较为罕见。儿童PDTC多携带DICER1突变,可能为DICER1综合征的一种临床症状,同时缺乏成人PDTC的分子改变(BRAF、RAS、TERT及RET/PTC等)[42]。
儿童及青少年患者中高达35%接受FNA者病理学类型模糊不定,根据Bethesda报告系统(TBSRTC)定义为3类(异型性意义不确定)或4类(滤泡性肿瘤,含具有嗜酸性细胞特征者)。这些类别中,儿童及青少年的恶性风险较成人更高[17]。术前检测肿瘤基因组、基因表达分类及miRNA表达等辅助检测已纳入细胞学不确定的成人患者的临床实践,caDTC患者纳入分子检测仍有待更多数据支持。
3 外科手术治疗策略
caDTC外科治疗的总体目标是保持极低的疾病特异性死亡率,降低复发率,同时减少手术相关并发症。
3.1 甲状腺原发病灶的手术策略
caDTC患者双侧或多灶性肿瘤比例较高(分别为30%和65%),甲状腺部分切除后复发及再次手术风险明显增加[43],因此推荐甲状腺全切除术作为caDTC的首选治疗方式。局限于单侧腺体内且不伴有淋巴结转移者可选择行腺叶或腺叶加峡部切除[28,43-44],术后需密切随访监测,但对于存在放射线暴露史或家族史等高危因素的caDTC患者,仍建议行甲状腺全切除术[3,45]。
建议7:caDTC原发灶的首选手术方式是甲状腺全切除术。
3.2 颈部淋巴结清扫的手术策略
caDTC患者的淋巴结转移率高于成人,因此颈部淋巴结清扫显得尤为重要。肿瘤存在明显腺体外侵犯或术前伴中央区淋巴结转移者,应常规行中央区颈部淋巴结清扫(central neck dissection,CND)。由于caDTC患者术后复发率较高,对于甲状腺单侧局灶癌变不伴腺外侵犯和(或)局部转移者,推荐行同侧预防性CND,以减少复发[3,28];合并患侧颈部中央区淋巴结转移者,推荐行对侧预防性CND;若患侧颈部中央区淋巴结转移未证实,则不推荐也不反对对侧预防性CND[43]。影像学检查或FNA明确转移时,需行颈侧区淋巴结清扫,清扫范围不应小于Ⅱ、Ⅲ、Ⅳ和Ⅴb区[3]。目前缺乏长期、前瞻性研究数据及可靠标准来判断颈部淋巴结清扫手术的获益,必须权衡积极手术的风险与降低肿瘤持续存在或复发间的利弊。
建议8:存在腺外侵犯或淋巴结转移证据的caDTC,推荐行中央区淋巴结清扫;甲状腺单侧局灶癌变不伴腺外侵犯和(或)局部转移者,推荐行同侧预防性CND。
3.3 复发/转移性病灶的手术策略
caDTC残留/复发的主要部位是颈部淋巴结。最佳治疗方案的选择主要取决于几个因素,包括病灶的位置和大小、既往手术和碘-131治疗史(包括治疗的并发症)、远处转移,以及病灶摄碘活性[46]。对于颈部碘-131摄取,Tg升高,但由于病变较小或CT等影像学检查未发现明显可疑病灶者推荐碘-131治疗,可降低患者复发风险[47]。此外,在规范性TSH抑制治疗的前提下,密切随访观察也可作为安全的策略[30]。
3.3.1 局部进展期caDTC的手术策略
对于超声和(或)CT等影像学检查发现并经FNA证实的病灶>1 cm的患者,特别是疾病位于纵隔区域且之前未曾接受手术者,手术切除比碘-131治疗更可取[48]。我们推荐此时应优先评估手术可行性,特别是由经验丰富的外科医师进行手术。
建议9:针对病灶>1 cm的局部进展性caDTC患者,尤其是位于纵隔区域,且既往未行治疗,建议由经验丰富的外科医师评估其手术可行 性。
3.3.2 远处转移灶(肺转移)的手术策略
caDTC患者比成人远处转移率高[48],肺转移率约为10%,骨转移率约为1%,脑转移少见,大多数远处转移病灶通常表现出良好的碘-131摄取。因此,caDTC出现远处转移时推荐碘-131治疗[3]。对于碘-131不摄取者,成人DTC非弥漫性肺转移数据[47]显示,肺转移灶切除术可作为一种选择方式,R0切除可使患者生存期明显延长,但这种手术方式是否同样适用于caDTC患者,有待进一步探索。
建议10:caDTC合并非弥漫性肺转移且不摄碘-131者,可行肺转移灶切除。
4 分期及初始复发风险分层
4.1 TNM分期
caDTC的TNM分期方法,目前与成人相同,即使用美国癌症联合会(American Joint Committee on Cancer,AJCC)的第8 版TNM分期。
相较于成人,caDTC的特点表现为侵袭性强、淋巴结及肺转移的发生率高,但预后良好、死亡率低。TNM分期不仅对于手术方式及术后碘-131治疗的选择具有重要指导意义,也是影响预后的重要因素,较高的T分期、N分期发生远处转移及复发的风险更高[4,49]。需要指出的是,影响远处转移及预后的因素是多方面的,除肿瘤分期外,年龄、性别、病理学类型、多灶性肿瘤、术后Tg水平及分子表型等均为重要的影响因素,TNM分期并不能囊括和替代上述各种因素的影响,仅用TNM分期来预测预后结果并不全面,肿瘤复发风险分层的预后分析较TNM分期可能更为全面。
4.2 初始复发风险分层
初始复发风险评估一般于术后12周内进行;2015年ATA指南[3]主要依据颈部淋巴结转移和病灶局部侵犯程度,更侧重于识别患者持续存在的淋巴结病变风险,将caDTC患者的复发风险分为低风险、中风险及高风险(表1)。然而,该复发风险分层并未将caDTC像成人DTC复发风险评估一样从病理学特征、分子特征等方面进行多因素权重并细化,因此,caDTC的准确评估及完善尚待今后更多的循证医学证据。

表1 caDTC术后初始复发风险分层
5 放射性碘-131治疗策略
5.1 放射性碘-131治疗前评估
caDTC患者的碘-131治疗前评估应该是一个严谨的、基于可靠证据的决策治疗过程。评估目的在于明确疾病本身的复发风险特征、前期治疗措施所发挥的疗效,以及当前的疾病状态,以辅助判断后续碘-131治疗的获益;同时还应兼顾儿童及青少年这类特定人群对于辐射暴露更为敏感的风险因素。因此,针对caDTC患者的碘-131治疗更应充分权衡治疗决策的可能获益与潜在风险。遗憾的是,由于该群体人数较少,目前仍缺乏设计严谨的临床试验或大样本队列研究证据。国内外相关指南中针对caDTC患者碘-131治疗前评估也尚无明确推荐。因此,本共识主要参照成人DTC的碘-131治疗前评估内容[48]。
治疗前评估主要从血清学及影像学两方面进行考量:①血清学指标以Tg、TgAb及TSH为主。血清Tg水平是判断甲状腺残存组织、残存或转移病灶的重要指标,Tg变化趋势是判断疗效及疾病变化的重要依据[50]。检测血清Tg时应兼顾TgAb以排除对Tg水平的干扰。碘-131治疗前应升高患者体内TSH水平,因此在治疗前评估阶段应常规监测TSH水平。② 影像学检查主要包括颈部超声和DxWBS。颈部超声有助于探查术后残留甲状腺情况及可疑淋巴结。DxWBS在碘-131治疗前对术后残甲量、可疑残存病灶或转移灶情况的明确具有重要意义。2015年ATA指南[3]推荐对于caDTC患者尽可能采用碘-123进行DxWBS,以减少辐射剂量。若怀疑有残存病灶或远处转移等情况,上述检查结果不能完全解释临床发现,必要时可加做单光子发射CT(singlephoton emission CT,SPECT)/CT、CT、MRI及18F-FDG PET/CT等检查,以辅助病灶探查及治疗决策[51]。
5.2 初始碘-131治疗指征
AJCC的TNM分期中对于年龄小于55岁的DTC仅划分为Ⅰ(无远处转移)和Ⅱ期(存在远处转移),在caDTC患者的治疗过程中难以判断预后和指导临床。因此,临床上通常采用2015年ATA指南[3]的复发风险分层制定治疗策略。
caDTC低风险者直接行TSH替代治疗;中、高风险者需先行s-Tg检测和DxWBS检查。依据检查结果选择碘-131治疗指征:①摄碘性远处转移;② 手术不能切除的局部摄碘性残存病灶或转移淋巴结;③DxWBS阴性且s-Tg≥10 ng/mL;④ DxWBS阴性且2 ng/mL≤s-Tg<10 ng/mL,也可权衡利弊后酌情考虑碘-131治疗(图1)。

图1 caDTC中高风险患者初次碘-131治疗指征
建议11:caDTC中、高风险者行s-Tg联合DxWBS检查,评估是否行碘-131治疗。
出于低死亡风险、人群对辐射敏感性及辐射相关风险如继发肿瘤等方面的考量,目前针对caDTC国际上不推荐以清甲为目的的碘-131治疗,清灶是治疗的主要目的。辅助治疗在成人碘-131治疗中已获得临床认可和应用,而caDTC中缺少相关研究及数据。目前多项研究[52-53]发现,年龄小(<15岁)、肿瘤体积大(最大径>15 mm)提示预后不良。因此,许多专家建议,肿瘤较大(T3/T4期)或伴有广泛颈部淋巴结转移者(N1a/N1b期),也可考虑行碘-131治疗,以减少疾病复发和转移风险[33,54]。Chow等[55]研究发现,术后给予碘-131治疗,caDTC患者局部复发率从42.0%降至6.3%(P=0.001)。caDTC患者基因融合发生率高,基因融合阳性肿瘤被认为更具有侵袭性,预后不佳[56],因此,caDTC伴基因融合者也可考虑行碘-131治疗,但缺少相关研究证据。
现阶段缺少强有力的证据证明碘-131治疗能够延长DTC早期患者的无病生存期,因此,强调在治疗caDTC患者前进行评估,以实时动态评估证据明确碘-131治疗的目的及可能获益,建议在权衡利弊后进行碘-131治疗决策[3]。
建议12:强调在caDTC患者的碘-131治疗前进行评估,以实时动态评估证据明确治疗的目的及可能获益。
5.3 放射性碘-131治疗剂量决策
迄今为止,尚未开展针对caDTC患者碘-131治疗剂量决策的专项研究。临床处置上,通常借鉴成人剂量的决策方法并根据患者体重或体表面积进行调整。
经验剂量法简单易行。根据儿童及青少年患者的实际体重,对体重为70 kg的成人推荐用量进行折算[57](100~150 mCi碘-131治疗残留、复发或淋巴结转移性肿瘤,150~200 mCi碘-131治疗远处转移瘤)。一般而言,5岁患者的用量为成人用量的1/3,10岁患者的用量为成人用量的1/2,15岁患者的用量为成人用量的5/6[54]。此外,1.0~1.5 mCi/kg的经验剂量法更为简单。
全身剂量法,即最大耐受剂量法,在一些特殊情况下可以采用,如弥漫性肺转移、放化疗所致骨髓储备下降、多次碘-131治疗等。全身剂量法有利于将单次碘-131治疗时的血液吸收剂量限定在200 cGy以下,保证服用48 h后全身碘-131滞留不超过120 mCi,肺部碘-131滞留不超过80 mCi[58]。
病灶剂量法是一种基于病灶吸收剂量的个体化剂量计算方法,可能更加适用于肿瘤负荷较大的病例[59]。该方法的毒性尚未在儿童及青少年患者人群中得到验证,且过程复杂,难以推广应用[59-60]。
由于缺乏上述3种方法之间的比较研究,就大多数患者而言,目前难以在这3种方法中进行优先级推荐。在临床实践中,大多数专家采用经验剂量法;在遇到年龄小、骨髓储备差、弥漫性肺转移、需要接受多次碘-131治疗等情况时,全身剂量法和个体化剂量法值得尝试。此外,出于控制碘-131的毒性和不良反应所需,临床工作中有必要对碘-131累计用量设定上限。有研究[61]显示,对于弥漫性肺转移性甲状腺癌患者累计用量不宜超过1 500 mCi,以免引起肺纤维化。
建议13:caDTC患者碘-131治疗剂量,按照成人剂量进行年龄分层折算并根据体重或体表面积进行调整。
5.4 碘-131疗效评估
疗效评估通常在碘-131治疗后6~12个月进行[30],主要评估方法包括血清学评价及影像学评价。通过比较碘-131治疗前后的变化,明确此次治疗的作用,并为后续治疗、随访及全程管理方案提供决策依据。血清学评价标志物有Tg和TgAb,评价的目标包括标志物测定结果的绝对值、随时间变化趋势及其与疾病状态的相关性。血清Tg和TgAb水平较之前下降提示治疗有效;治疗后6~12个月出现TgAb增高可能与治疗后Tg释放有关;持续阳性或升高者要考虑疾病持续或复发的可能[34,60-62]。影像学评价方法包括DxWBS、超声、CT、MRI及18F-FDG PET/CT等。影像学评价的目标包括是否存在影像学可观测病灶、可观测病灶的性质(大小、数量、范围及摄碘能力等)及随时间变化的特征。实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1标准(表2)可用于评估可测量病灶的疗效[63],血清学作为DTC的早期敏感生化指标,可作为影像学评价的必要补充。此外,综合血清学与影像学评价的成人动态风险评估系统经验证在caDTC中也有较高的应用价值[63]。

表2 caDTC治疗的血清学(生化)和影像学疗效评估
5.5 放射性碘-131多程治疗策略
5.5.1 淋巴结转移治疗策略
caDTC患者复发转移最常见部位是颈部淋巴结,PTC更易出现区域淋巴结转移,而FTC区域淋巴结转移则相对少见[64]。有研究[65]认为,微小甲状腺外浸润是caDTC出现颈部转移的有力预测因子。
caDTC合并淋巴结转移者治疗方案的制订取决于颈部淋巴结转移的部位、大小、手术史、摄碘能力及是否合并远处转移等。对于淋巴结转移灶较小(直径<1 cm)或其他影像学检查(如超声、CT)无法识别的摄碘病灶,首选碘-131治疗以降低复发风险[66]。影像学检查提示的结构性淋巴结转移灶(直径>1 cm),通过US-FNA明确诊断后首选手术治疗;若无法手术切除(如侵犯呼吸道、消化道等),可使用非手术治疗方法[50]以提高生存率,包括乙醇注射治疗[67]、射频消融/激光消融、立体定向放射治疗等[68],但这些治疗方式目前多针对成人。
建议14:caDTC伴淋巴结转移者,对于淋巴结转移灶较小(直径<1 cm)或其他影像学检查无法识别的摄碘性病灶,可再次行放射性碘-131治疗;影像学检查提示结构性淋巴结转移灶(直径>1 cm),首选手术治疗。
5.5.2 肺转移治疗策略
caDTC合并肺转移的发生率显著高于成人,为7%~30%[47];肺转移多以双肺弥漫性微小转移灶为主,并且大多数对碘-131敏感,治疗后多数患者的疾病处于长期稳定状态,预后显著好于成人[47,69]。有研究[70-71]指出,年龄、T分期、N分期及AGK-BRAF基因融合等因素可能与肺转移的发生有关。
2015年ATA指南[3]指出,DxWBS证实摄碘性肺转移者,碘-131治疗大于12个月且s-Tg呈上升趋势者,碘-131治疗结束疾病稳定后s-Tg再次上升或12个月内出现疾病进展者,依据病灶摄碘-131情况及对前次治疗的反应进行后续个体化治疗决策;对于摄碘-131但仍疾病持续进展的患者,应纳入远期不良反应等因素多方面综合判断其获益情况后决定(图2)。

图2 caDTC合并肺转移患者碘-131治疗的处置
caDTC合并肺转移者需持续动态监测Tg水平(每3~6个月)直至其对前次治疗达到完全的治疗响应后再考虑下一步治疗;计划或接受多次碘-131治疗者,应监测其肺功能。对于非弥漫性肺转移灶也可联合手术治疗,具体详见3.3.2。
建议15:caDTC合并肺转移者,s-Tg升高且距离前次治疗大于12个月,可考虑再次碘-131治疗;s-Tg稳定后再次升高或影像学提示进展者,依据病灶摄碘-131情况进行个体化治疗。
5.5.3 骨、脑及其他部位远处转移的治疗策略
骨、脑及软组织等部位的远处转移在caDTC患者中发生率低,相关报道[72-73]很少,其治疗原则基本参照成人[50]。caDTC合并远处转移者建议行基因检测,为后续可能需要的靶向治疗药物筛选提供依据。
合并骨转移灶且摄碘-131的caDTC患者,放射性碘-131治疗可作为一线治疗方案,延长患者的总生存期及无进展生存期。骨转移应是多学科联合治疗,根据病灶具体情况选择手术、外照射、栓塞、消融、碘-125粒子植入或骨水泥成形术等局部治疗,以及二膦酸盐、地诺单抗抑制破骨细胞的系统治疗或靶向药物治疗。
脑转移大多发生于大脑半球,很少发生于小脑和垂体。患者通常无症状,少数表现为头痛、视觉障碍或眼肌无力等,预后差,平均总生存期为7.1~33.0个月[74]。合并脑转移病灶且摄碘-131的caDTC患者,应首选手术和立体定向外照射治疗;碘-131治疗时也需结合外照射治疗及糖皮质激素等[48-49]治疗,以预防或减轻脑水肿的发生。
建议16:caDTC合并骨或脑等部位远处转移者,治疗参考成人,遵循多学科联合治疗和个体化治疗原则。
5.6 不良反应及管理
5.6.1 近期不良反应及管理
①恶心呕吐:可考虑使用止吐药物进行预防。② 唾液腺肿痛:多较轻微,可在数小时至数天内自行消失,一般无需医疗干预;慢性唾液腺炎导致的周期性唾液腺肿痛,应尽早进行唾液腺内镜介入检查和治疗。③溢泪:相对少见,随访时询问患者眼部症状,以便早期诊断,及时进行内镜鼻腔泪囊造口术干预[75]。④ 骨髓抑制:暂时性骨髓抑制多数较轻微,一般不需要临床干 预。
5.6.2 远期不良反应及管理
①肺纤维化:caDTC患者弥漫性肺转移发生率明显高于成人,多次大剂量碘-131治疗后肺纤维化发生率可高达25%[76]。为预防严重的肺纤维化发生,弥漫性肺转移者碘-131治疗前,建议常规行DxWBS,依据48 h全身残留率计算碘-131治疗剂量,确保48 h放射性碘-131全身残留量不超过80 mCi[77];且治疗前应进行肺功能综合评估[50,78]。② 生殖系统不良反应:与成人比较,caDTC女性患者治疗后不孕、流产、早产及新生儿缺陷发生率并没有增高[76,79-80];碘-131治疗对caDTC男性患者睾丸的影响尚不清楚,目前小样本研究[79]尚未观察到不良生育结局。对生育有需求的男性患者可考虑治疗前预先储存精子,但尚缺乏可靠证据[81]。③第二原发恶性肿瘤(second primary malignancies,SPM):关于碘-131治疗与SPM发生率的关系目前尚达成统一共识。两项专门针对未成年及年轻成人(<25岁)来源于美国监测、流行病学和最终结果(the Surveillance,Epidemiology and End Results,SEER)数据库的小样本研究[82-83]认为,SPM总体风险显著增加,累积发生率较低,绝对增量风险也较低。目前相关研究证据均不足,考虑到儿童及青少年对辐射诱发癌变可能更为敏感,并且有更长的剩余寿命,权衡碘-131治疗的风险和获益至关重要[82]。
5.7 诊疗流程及注意事项
5.7.1 放射性碘-131治疗前准备
⑴ 低碘准备:碘-131治疗前应保持低碘状态(碘日摄入量<50 μg)2~4周。具体方法:服用无碘盐、禁食高碘食物(海产品等)、避免服用胺碘酮等影响碘摄取或代谢的药物、避免碘伏消毒皮肤、治疗前4~8周避免应用含碘对比剂;也可依据患者尿碘、尿碘/肌酐比值,合理选择治疗时机[3]。
⑵ 升高TSH:一般认为血清TSH水平升高至30 mU/L以上,可取得较好的碘-131疗效[2]。提高TSH的方法有两种:①提高内源性TSH的分泌,即停用左旋甲状腺素(levo-thyroxine,L-T4)≥2周[84];② 给予外源性TSH,可肌肉注射重组人TSH(recombinant human TSH,rhTSH)0.9 mg,1次/d,连续2 d。尽管该方法应用较少,但有研究[85]表明,儿童应用外源性TSH是安全有效的。有并发症者应给予相应药物控制症状(按医嘱禁服含碘药物)。
⑶ 治疗前常规检查:主要包括血清甲状腺激素、TSH、Tg、TgAb、血/尿常规、肝肾功能、甲状旁腺激素、电解质、心电图、颈部超声及DxWBS检查等;必要时可进行甲状腺吸碘率(有助于评估甲状腺残留,协助鉴别高Tg原因)、胸部CT等检查。
⑷ 医患沟通、患者教育、签署知情同意书:应向患儿家属介绍治疗目的、实施过程、治疗后可能出现的不良反应及出院后辐射安全防护指导等,并签署知情同意书。
5.7.2 放射性碘-131治疗后的管理
⑴ 通常碘-131治疗后24~72 h开始/继续口服甲状腺素,常规用药为L-T4,TSH抑制时单位体质量的L-T4剂量高于成人。早餐前30~60 min(最好60 min)以上空腹顿服L-T4最有利于维持稳定的TSH水平,特殊情况下如不能保证晨间空腹用药,也可选择睡前口服[86]。治疗过程中应定期监测甲状腺功能,及时调整剂量。
⑵ 碘-131治疗后5~10 d进行治疗剂量碘-131全身显像,了解甲状腺残余量和转移灶情况。
⑶ caDTC碘-131治疗后的放射防护和出院隔离标准与成人一致。
5.8 心理问题及调适
儿童及青少年正处于身心发育的关键时期,甲状腺癌的诊断和治疗可能会影响其心理健康。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南指出,儿童及青少年癌症患者有一些独特的心理社会问题,其中包括对生育能力的影响、在校教育问题及成年后就业问题等[87]。最常见的问题有以下两种:
①心理发展方面:患儿正常的心理发展可能受到影响,出现青春期发育滞后等;碘-131治疗期间停服甲状腺激素造成的甲减状态,也可能对患儿的心理体验、行为和学习能力有影响[84]。② 抑郁焦虑情绪:儿童及青少年缺乏完全成熟的认识和情绪应对能力,如甲状腺切除手术导致的颈部瘢痕、碘-131治疗的隔离式治疗环境、周围同龄人群对患儿的接纳及与同龄人群的融入障碍等都会使患儿产生抑郁或焦虑情绪。
caDTC患者在诊断、治疗阶段的心理反应不尽相同,每个阶段都会有新的适应过程,疾病诊治过程中积极缓解患儿的心理压力,能够增强其心理适应能力。在各个阶段,给患儿合适的支持性照顾和专业心理治疗,能提高患儿的自信心,有助于治疗的顺利进行,对促进心理健康发育也是非常有必要的。
建议17:caDTC患者出现心理问题,建议进行积极干预;严重者可接受专业心理治疗。
6 放射性碘难治性DTC(radioiodine refractory-DTC,RAIR-DTC)的界定及治疗策略
6.1 RAIR-DTC的界定
目前对RAIR-DTC的界定主要基于某些特定的临床情形(表3)而非病理学改变,通常在无外源性碘负荷干扰的情况下,TSH刺激时出现下列情形者,则判断可能为RAIR-DTC[57,88-89]。

表3 RAIR-DTC的常见临床情形
RAIR-DTC指病灶不摄碘,以致患者无法从碘-131治疗获益,或病灶虽摄碘,但碘-131治疗反应差,疾病缓解不佳甚至出现进展,继续仅采取碘-131治疗获益有限。当临床界定为RAIR-DTC,仅能说明患者在目前的状态下从单一碘-131治疗模式中获益较少,或临床获益与承担风险失衡,应考虑综合治疗策略,如TSH抑制治疗下密切随诊观察,当疾病出现进展,则可考虑其他局部治疗(如外照射等)、分子靶向药物等系统治疗,以及这些治疗与碘-131治疗的联合应用。RAIR-DTC的界定不应简单地作为终止碘-131治疗的指征,而应进行个体化决策。
6.2 靶向治疗
处于疾病进展期的局部晚期或远处转移性RAIR-DTC患者,尤其伴有明显临床症状甚至威胁生命者,应及时启动系统性治疗[90-91]。其中靶向药物治疗正得到越来越多的关注和应用。目前关于靶向药物疗效及安全性的循证医学依据主要来自针对成人RAIR-DTC开展的多项临床试验及真实世界的研究结果,部分临床试验正逐渐延展到儿童及青少年人群,如评价多靶点激酶抑制剂仑伐替尼治疗儿童及青少年难治或复发实体肿瘤有效性的多中心、多队列(其中队列2为RAIR-DTC患者)Ⅰ/Ⅱ期临床试验(NCT02432274),评价TRK抑制剂拉罗替尼治疗包括甲状腺癌在内的多种晚期实体肿瘤有效性的Ⅰ/Ⅱ期临床试验(针对儿童患者的SCOUT研究)及Ⅱ期篮子试验(针对成人及青少年患者的NAⅤIGATE研究)等[92]。常见RAIR-DTC相关靶向治疗药物及作用靶点见表4,其中多纳非尼、阿帕替尼、安罗替尼和索凡替尼均为中国自主研发的靶向治疗药,为RAIR-DTC患者(尤其前线靶向药治疗发生耐药后)提供了更多的治疗选择。
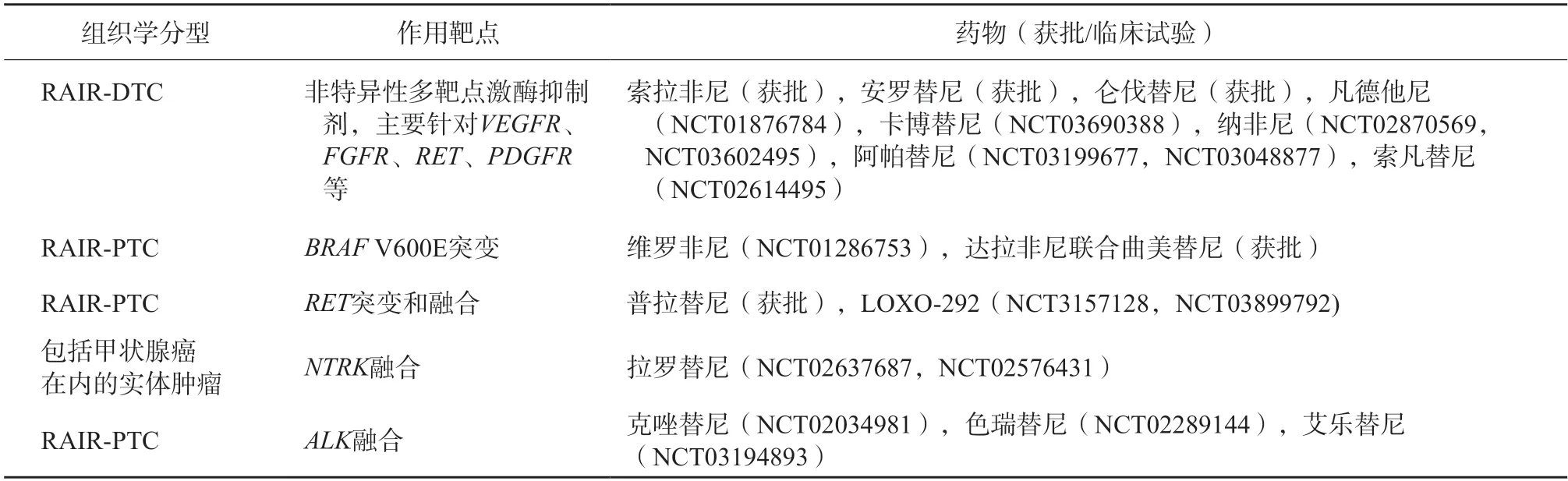
表4 常见RAIR-DTC相关靶向治疗药物及作用靶点
caDTC患者基因突变谱与成人存在差异(具体详见2.5),对复发中、高风险患者进行分子标志物检测(需包括融合基因检测)可发现特异性的基因融合或点突变,以期早期识别RAIR-DTC患者,提高其生存获益。
6.3 治疗流程
儿童及青少年RAIR-DTC的治疗流程见图3。

图3 儿童及青少年RAIR-DTC治疗流程图
6.4 其他治疗
儿童及青少年RAIR-DTC资料较少,参考成人可考虑外放疗、化疗、诱导再分化治疗及肿瘤免疫治疗等方式,但其在caDTC患者中应用的循证医学证据均不足。
建议18:儿童及青少年RAIR-DTC患者遵循多学科联合治疗和个体化治疗原则。
7 TSH抑制治疗及管理
DTC细胞表面存在TSH受体,术后TSH抑制治疗可降低甲状腺细胞的摄碘能力,阻断DTC细胞生长,进而预防肿瘤复发。针对caDTC患者的回顾性研究[93-94]发现,术后TSH抑制治疗可提高其无进展生存率,与针对成人的研究[95-96]结果一致。
TSH抑制治疗方式为口服L-T4,L-T4成分类似于甲状腺自然分泌的四碘甲状腺原氨酸,生物疗效显著。TSH抑制目标主要基于caDTC患者特殊的肿瘤复发风险进行[3]。2015年ATA指南[3]指出,复发低风险caDTC患者暂不行TSH抑制治疗,积极监测,根据监测结果调整治疗方案;复发中、高风险者术后均需进行TSH抑制治疗。复发低、中及高风险caDTC患者TSH控制目标分别为0.5~1.0、0.1~0.5及<0.1 mU/L。2020年美国APSA癌症委员会专家同样支持这一观点[97]。儿童和青少年进行TSH抑制治疗时,L-T4服用剂量高于成人。有研究[98]推荐,10岁以下儿童L-T4起始剂量为3~4 μg/kg/d,10岁以上逐步减少,16~18岁为2.4~2.8 μg/kg/d。服药3个月复查血清TSH水平,并据此调整L-T4剂量直至达标。
鉴于儿童及青少年处于生长发育的特殊时期,需要格外关注DTC术后TSH抑制治疗对其生长发育的潜在影响。
建议19:caDTC患者术后TSH抑制治疗基于复发风险分层进行。
8 随访及监测
8.1 随访控制目标及监测项目
随访控制目标是既能控制肿瘤进展,又能满足患者个体需要,尽可能地减少因TSH抑制治疗引起的不良反应。根据caDTC患者术后复发危险度分层,低、中及高风险患者3~5年TSH控制目标分别为0.5~1.0、0.1~0.5及<0.1 mU/L。为避免亚临床甲亢对其成长的影响,TSH可处于控制目标的上限水平,如发现或怀疑疾病持续存在,可维持该目标,否则在监测一段时间后恢复到正常低值。目前中国临床肿瘤学会核医学专家委员会推荐,caDTC患者术后监测和随访及TSH控制目标应根据复发风险分层进行(表5)。
8.2 实时动态评估
现阶段尚无单独有效的caDTC患者术后评估系统,参考成人相关动态评估体系,caDTC的实时动态评估应包括术后初始复发风险分层评估和碘-131治疗后的动态评估,动态评估应贯穿于初始治疗后的疗效评估和随访的全程管理,以便为随访及治疗提供实时的决策依据。
8.2.1 初始复发风险分层
2015年ATA指南[3]基于术前、术中及术后短期内获得的实时临床病理学特征资料(肿瘤大小、局部浸润、颈部淋巴结转移数目和大小),将caDTC患者复发风险分为低风险、中风险及高风险3个等级(具体见4.2)。初始复发风险分层可预测患者的初始治疗反应,但无法有效地预测其远期临床转归情况[49]。
8.2.2 动态评估
(1) 初始疗效评估:建议治疗后6个月内进行初始疗效评估,评价方法同5.4,评估后随访参照表5,定期监测Tg并进行颈部超声等检查。
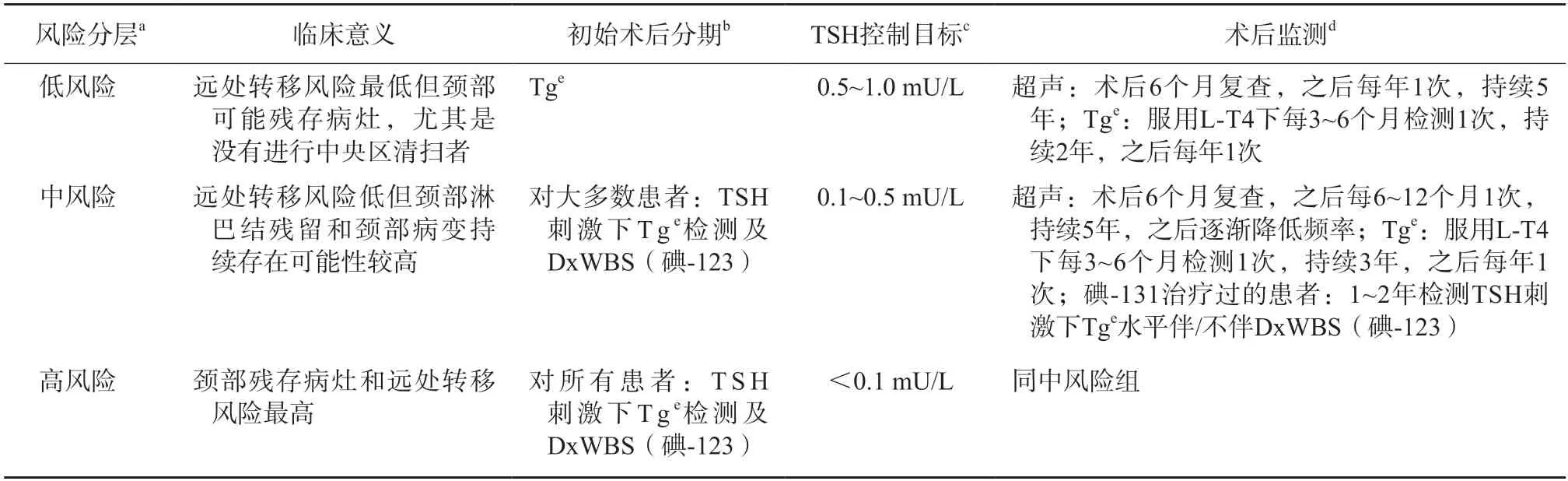
表5 caDTC患者术后监测、随访及TSH控制目标
(2) 治疗反应评估:2015年ATA指南[3]推出了DTC患者的动态评估系统(dynamic risk stratification,DRS),该系统主要依据初始治疗(甲状腺切除术及首次碘-131治疗)后随访1~2年期间血清Tg、TgAb及DxWBS检查等结果作为判断治疗最佳反应的指标[37,50],该动态评估模式强调应用修正后的DRS评估患者的临床转归。
建议治疗后1~2 年内进行DRS 评估,将caDTC患者的治疗反应分为疗效满意(excellent response,ER)、疗效不确切(indeterminate response,IDR)、生化疗效不佳(biochemical incomplete response,BIR)及结构性疗效不佳(structural incomplete response,SIR),具体定义详见表6。对于最初被归类为中风险组的患者,采用DRS更为有价值。临床实际应用中,DRS更有助于修订caDTC患者后续随访强度及治疗策略。也有研究[37]指出,美国ATA甲状腺癌复发风险分层,侧重于预测疾病复发或持续状态,而DRS更适于指导随访监测。

表6 caDTC动态风险评估
利益冲突声明:所有作者均声明不存在利益冲突。
