HER2阳性浸润性乳腺癌新辅助治疗反应的预测因子及治疗前后HER2状态变化的评估
2022-06-10刘建兰陈黛诗周冬仙胡锦涛
刘建兰,陈黛诗,胡 泓,周冬仙,胡锦涛
1.深圳市人民医院(暨南大学第二临床医学院,南方科技大学第一附属医院)病理科,广东 深圳 518020;2.深圳市人民医院(暨南大学第二临床医学院,南方科技大学第一附属医院)耳鼻咽喉科,广东 深圳 518020;3.深圳市人民医院(暨南大学第二临床医学院,南方科技大学第一附属医院)甲乳外科,广东 深圳 518020
15%~20%的浸润性乳腺癌为人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性,表现为HER2基因扩增或蛋白过表达,HER2阳性乳腺癌的侵袭性强,患者预后较差[1]。然而,HER2特异性单克隆抗体曲妥珠单抗和帕妥珠单抗,以及以恩美曲妥珠单抗为代表的抗体药物偶联物(antibody-drug conjugate,ADC)的出现,显著降低了早期HER2阳性乳腺癌的复发率[2-3]。有研究[4]显示,HER2阳性乳腺癌患者术前新辅助治疗达到病理学完全缓解(pathological complete response,pCR)后生存获益更好,因此,新辅助治疗方案的选择是在追求毒性可控的前提下获得更高的pCR率。新辅助化疗联合HER2靶向治疗,由于其与pCR率有关,常被用于治疗HER2阳性乳腺癌[5]。
HER2 阳性定义为免疫组织化学(immunohistochemistry,IHC)3+或HER2基因扩增,是抗HER2靶向治疗的主要预测指标和有效的生物标志物。荧光原位杂交(fluorescencein situhybridisation,FISH)是评估HER2基因扩增的常规方法,无论是HER2 IHC 3+或IHC 2+组FISH阳性的乳腺癌患者,都可以接受抗HER2靶向治疗,因此正确检测和评定乳腺癌的HER2蛋白表达和基因扩增状态,并选择适合抗HER2靶向治疗的乳腺癌患者对临床治疗及预后判断至关重要。随着HER2检测的广泛应用,HER2异质性逐渐被认识,尽管HER2靶向药物可以显著改善HER2阳性乳腺癌患者的预后,但耐药性仍然是一个重大挑战。耐药的一个潜在机制是肿瘤内治疗靶点的异质性表达,HER2异质性被认为是抗HER2靶向治疗的耐药机制之一。因此,了解肿瘤内异质性如何影响靶向治疗的反应非常重要。本研究旨在确定各临床病理学因素尤其是抗HER2异质性对HER2阳性乳腺癌新辅助治疗反应的影响,并进一步评估新辅助治疗前后HER2状态的变化。
1 资料和方法
1.1 研究对象
收集深圳市人民医院2019—2021年经术前空芯针活检确诊的110例HER2阳性乳腺癌患者,经新辅助治疗后行手术切除。所需临床病理学资料均来自医院电子病历资料库。
1.2 方法
所有标本经4%甲醛溶液固定,常规脱水,石蜡包埋制片,H-E染色,在光镜下观察。IHC染色采用EnⅤision两步法。雌激素受体(estrogen receptor,ER)、Ki-67的检测试剂盒均购自福州迈新生物技术开发有限公司,孕激素受体(progesterone receptor,PR)、HER2的检测试剂盒购自美国Roche公司。IHC均常规设置阳性和阴性对照。操作步骤按说明书进行。
1.3 判读结果
ER、PR及Ki-67免疫染色阳性均定位于细胞核,HER2免疫染色阳性定位于细胞膜。ER、PR表达结果的判读根据中国乳腺癌专家组推荐的《乳腺癌雌、孕激素受体免疫组织化学检测指南》[6]:阳性细胞数≥1%为阳性。HER2抗体按照《乳腺癌HER2检测指南(2019版)》[7]进行判读,HER2 IHC检测结果为2+时,采用FISH HER2探针进行HER2基因扩增分析。HER2异质性评价:HER2 IHC表达3+时,弥漫100% 3+视为无异质性,否则视为具有异质性。
1.4 残余肿瘤负荷(residual cancer burden,RCB)分级评估
根据美国MD Anderson癌症中心提出的RCB分级系统[8],计算乳腺癌新辅助治疗后的RCB评分。RCB-0:RCB值=0.00,pCR(乳腺原发灶无浸润性癌且区域淋巴结无癌细胞);其余则视为非病理学完全缓解(non-pathological complete response,non-pCR)。RCB-Ⅰ:0.00<RCB值≤1.36,肿瘤少量残余;RCB-Ⅱ:1.36<RCB值≤3.28,肿瘤中等量残余;RCB-Ⅲ:RCB值>3.28,肿瘤广泛残余。
所有患者均接受化疗及靶向治疗,根据接受的新辅助治疗类型分为两组:①化疗联合曲妥珠单抗单靶治疗;② 化疗联合曲妥珠单抗及帕妥珠单抗双靶治疗。给予的化疗方案均为个体化方 案。
1.5 统计学处理
采用SPSS 23.0软件对数据进行分析,计量资料采用χ2检验。应用logistic回归模型分析各变量对pCR的影响。如果一个变量保持在P<0.2的水平,则将其纳入最终的多变量模型。通过Wilcoxon检验和McNemar检验比较新辅助治疗前后的HER2、ER和PR状态变化。P<0.05为差异有统计学意义。
2 结果
2.1 HER2异质性、RCB分级与临床病理学特征的相关性
110例患者均为女性,确诊时中位年龄为48岁(25~72岁)。除1例为浸润性小叶癌(invasive lobular carcinoma,ILC)外,其余均为浸润性非特殊类型癌(no special type,NST)。新辅助治疗前穿刺标本中HER2 IHC 3+组101例(91.8%),HER2 IHC 2+组9例(8.2%),HER2 IHC2+均经FISH检测证实基因扩增。进一步将HER2 IHC 3+组根据HER2有无异质性分为弥漫3+组(81例,73.6%)和异质性3+组(20例,18.2%)。80.0%(16/20)异质性3+病例为激素受体(hormone receptor,HR)阳性。
新辅助治疗前HER2表达与年龄、ER、PR、肿瘤大小、Ki-67增殖指数、淋巴结转移、组织学类型及治疗方案均无相关性(表1)。术后RCB分级高与ER、PR阳性相关,差异有统计学意义(P<0.05),而与年龄、肿瘤大小、Ki-67增殖指数、淋巴结转移、组织学类型及治疗方案无相关性(表2)。ER、PR阴性组的pCR率均明显高于ER阳性组,差异有统计学意义(P<0.05)。

表1 HER2异质性与临床病理学特征的关系Tab.1 The correlation between HER2 and clinicopathological characteristics
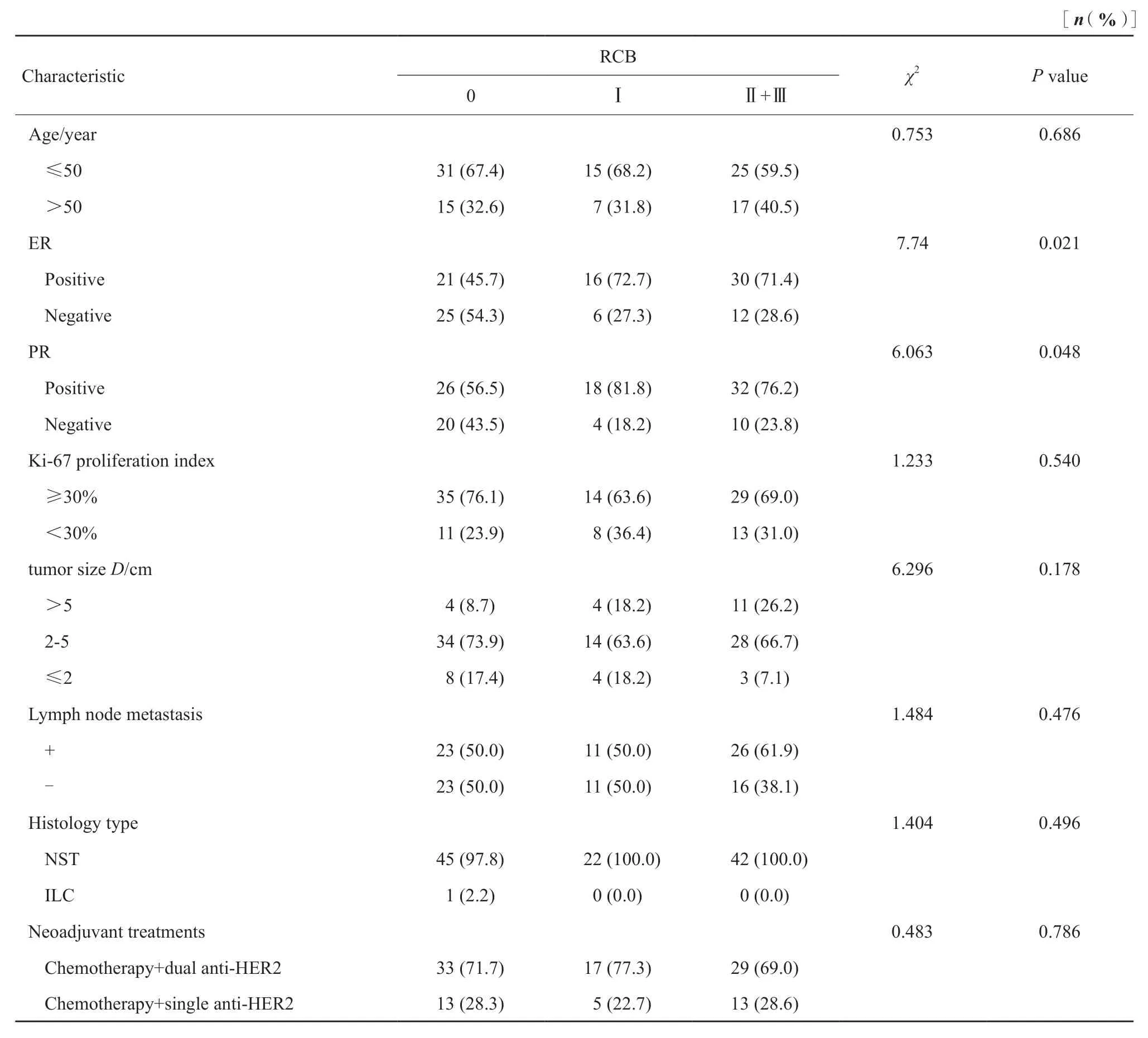
表2 RCB分级与临床病理学特征的关系Tab.2 The correlation between RCB and clinicopathological characteristics
2.2 HER2异质性与pCR的相关性
41.8 %的患者达到pCR(RCB-0)。HER2弥漫3+组pCR率为54.3%(44/81),而异质性3+组为5.0%(1/20),2+FISH+组为11.1%(1/9),差异有统计学意义(P<0.001,图1)。HER2 3+组总pCR率[44.6%(45/101)]明显高于2+FISH+组[11.1%(1/9)],差异有统计学意义(P<0.001)。
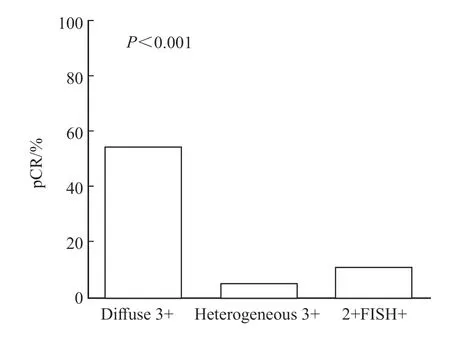
图1 HER2异质性与pCR率的相关性Fig.1 The correlation between HER2 heterogeneity and pCR rate
46例达到pCR的患者中,大部分(95.7%)为HER2弥漫3+组(44例),另有异质性3+组1例,2+FISH+组1例。64例non-pCR患者中RCB分布:RCB-Ⅰ为20%(22/110),RCB-Ⅱ为26.4%(29/110),RCB-Ⅲ为11.8%(13/110)。RCB-Ⅰ组大部分(77.3%)为HER2弥漫3+病例,而异质性3+及2+FISH+组的RCB分级更高。
2.3 pCR的相关预测因素
通过单变量和多变量逐步回归模型分析各临床病理学参数与pCR的相关性。在所有HER2阳性乳腺癌患者中,单因素分析结果显示,HER2异质性、ER、PR表达与pCR相关(P均<0.05),多因素分析结果显示,HER2弥漫3+是pCR的独立预测因子(OR=6.912,95% CI:2.048~23.329,P=0.002,表3)。在IHC弥漫3+组中,pCR与研究的任何因素均无相关性(表4)。其他两组样本量相对较少,未单独进行回归分析。

表3 HER2阳性乳腺癌中pCR相关单因素与多因素回归分析Tab.3 Univariate and multivariate logistic regression for pCR in HER2 positive breast cancer

表4 HER2弥漫3+乳腺癌中pCR相关单因素与多因素回归分析Tab.4 Univariate and multivariate logistic regression for pCR in HER2 diffuse 3+breast cancer
2.4 新辅助治疗前后HER2、ER及PR状态的一致性比较
在64例non-pCR患者中,对新辅助治疗后残留癌灶中的59例HER2状态、60例ER状态及59例PR状态进行评估。7例(11.9%)在新辅助治疗后HER2转为阴性(IHC 2+且FISH-或IHC 0/1+),其中1例为弥漫3+,3例异质性3+,3例2+FISH+,差异有统计学意义(P<0.001,表5)。4例(6.7%)在新辅助治疗后ER状态发生改变,43例ER阳性患者中2例(4.7%)在治疗后转为阴性;而17例ER阴性患者中2例(11.8%)在治疗后转为阳性。13例(22%)在新辅助治疗后PR状态发生改变,46例治疗前PR阳性患者治疗后9例(19.6%)转为PR阴性,13例治疗前PR阴性患者治疗后4例(30.8%)转为PR阳性,但差异无统计学意义(P>0.05)。然后根据不同的HER2类别评估新辅助治疗前后HER2状态的一致性,IHC弥漫3+组一致性最高(97.1%,33/34),其次为IHC异质性3+组(83.3%,15/18),IHC 2+FISH+组最低(57.1%,4/7)。7例IHC HER2 3+患者新辅助治疗后转为2+,其中6例患者新辅助治疗前为异质性3+(FISH检测结果:3例阳性,2例阴性,1例未做),1例为弥漫3+(未行FISH检测)。

表5 新辅助治疗前后HER2、ER及PR状态比较Tab.5 Comparison of HER2,ER and PR status between pre-and post-neoadjuvant treatment
3 讨论
HER2阳性乳腺癌对新辅助化疗和靶向治疗的反应并不一致,虽然同为HER2阳性,但部分患者反应较差,本研究应用最基本、最简单易行的IHC评估肿瘤内部存在的HER2表达的异质性,评价其与新辅助治疗反应的相关性。
本研究的101例HER2 IHC 3+乳腺癌患者中,19.8%具有HER2异质性,其中80.0%为HR阳性。当接受抗HER2靶向治疗时,HER2 IHC 3+比2+FISH+乳腺癌有更高的pCR率,这与之前的报道[9]一致。本研究中,HER2 IHC 3+乳腺癌的pCR率为44.6%,在之前的临床试验[10-11]报告的范围内,而HER2 3+乳腺癌中HER2异质性3+组的pCR率(5.0%)明显低于弥漫3+组(54.3%)。HER2异质性与pCR显著相关,是一个强有力的预测因子,可能被用于优化治疗选择。进一步多因素回归分析显示,HER2弥漫3+是HER2阳性乳腺癌新辅助治疗后pCR的独立预测因子,HER弥漫3+时,pCR与其他任何因素均无相关性,凸显了HER2蛋白表达水平在预测HER2阳性乳腺癌对新辅助治疗反应中的重要性。IHC检测简单易行,成本相对较低,染色玻片易于保存,常规报告中应在尽可能准确的情况下对HER2 IHC染色进行异质性评价,可为临床诊治提供额外有价值的信息。
作为HER2阳性乳腺癌治疗的靶点,HER2基因扩增水平如FISH检测中的HER2基因拷贝数、HER2/CEP17比值对新辅助治疗反应的影响是目前研究的热点。然而,文献中存在相互矛盾的观点,不同研究中HER2基因拷贝数的截断值也各不相同。目前认为,HER2阳性乳腺癌中较高的HER2基因拷贝数及HER2/CEP17比值与较好的预后相关,可以作为新辅助治疗反应的预测指标,但仍需要进一步验证,另外,还需要仔细评估CEP17状态,HER2基因拷贝数的最佳截断值也有待于进一步研究。但有文献[12]报道,在IHC 2+FISH+组中,pCR率与HER2基因拷贝数及HER2/CEP17比值无明显相关性。而且,在IHC 2+组中,当HER2/CEP17比值≥2.0时,HER2基因拷贝数<4.0亚组与≥4.0亚组(或该亚组加HER2/CEP17比值<2.0且HER2基因拷贝数≥6.0亚组),pCR率差异无统计学意义[13]。Filho等[14]研究发现,HER2异质性小的患者HER2水平较低且一致,异质性大的患者则具有更高的HER2拷贝数,non-pCR患者具有更高比例的HER2非扩增细胞。靶向治疗提高了HER2阳性乳腺癌的治愈率,表明在一部分患者中可以避免化疗。HER2异质性,特别是HER2非扩增细胞的比例是HER2治疗耐药性的一个强有力的预测因子,并可能用于优化治疗选择。能否通过HER2扩增水平实现HER2阳性乳腺癌患者治疗的降级与升级仍需要大样本临床试验的探索。
HR状态会影响乳腺癌对新辅助化疗和抗HER2治疗的敏感性。因为HER2阳性、HR阴性乳腺癌的生长可能高度依赖HER2基因,这些肿瘤通常对于抗HER2治疗表现出良好的反应[15]。本研究结果显示,ER、PR阳性时RCB分级更高,HR阴性组pCR率(65.5%)明显高于HR阳性组(33.3%)。在HER2 3+组中,HR阴性组pCR率为64.3%,高于HR阳性组的32.5%。在异质性3+组中,HR阳性组没有pCR,仅1例HR阴性患者获得pCR,在2+FISH+组中也是如此。由此可见,无论在HER2 IHC 3+组还是2+FISH+组中,HR阴性组的pCR率明显高于HR阳性组。回归分析提示HR阴性与pCR相关,而弥漫3+组pCR与HR无相关性,异质性3+及2+FISH+组与HR的关系则需要更多的病例来证实。最新文献[16]报道,在2+FISH+组中ER阴性被确定为pCR的独立预测因子。此前有研究[17]显示,HER2 IHC 3+与2+FISH+肿瘤的病理学特征不同,IHC 3+肿瘤往往具有较高的组织学分级,肿瘤通常较大,ER、PR通常为阴性。按照当前的HER2分组,HR与HER2无明显相关性,但当HR以10%为临界值时,与其他两组相比,HER2弥漫3+组的ER更多为阴性或低表达(P<0.05)。这些研究强调了综合考虑HER2和HR状态的重要性,以选择最有可能受益于新辅助抗HER2治疗的患者。尽管在HER2阳性/HR阳性乳腺癌中pCR的发生率较低,但这类肿瘤患者预后良好,因此,在HER2阳性/HR阳性肿瘤中pCR与长期预后的相关性较HER2阳性/HR阴性肿瘤弱[18-19]。然而,HER2阳性/HR阳性患者的新辅助内分泌治疗并没有显著改善其pCR率,需要进一步的研究来改善HER2阳性/HR阳性乳腺癌患者的预后。本研究结果显示,HR作为HER2阳性乳腺癌中pCR的影响因素,对HER2弥漫3+组无明显影响,从而进一步强调了评价HER2异质性的重要性。
本研究结果证实,一小部分病例新辅助治疗后HER2、ER和PR状态发生变化,文献[16,20]报道的比例各不相同。新辅助治疗后HER2转为阴性时HER2状态的变化差异有统计学意义(P<0.05),可能提示肿瘤内部HER2存在异质性,HER2阳性肿瘤细胞对化疗和靶向治疗有效,残留HER2阴性肿瘤细胞。然而,值得注意的是,这部分患者大部分(85.7%)为异质性3+或IHC 2+FISH+患者,弥漫3+组HER2状态的改变极少。目前尚不清楚HER2转为阴性是肿瘤对治疗的反应、耐药机制还是HER2异质性。有研究[20-21]显示,与新辅助治疗后HER2仍然阳性的肿瘤相比,残留病灶中HER2阴性的肿瘤与较差的预后相关。在新辅助抗HER2治疗后,Luminal A型是残留病灶中最常见的亚型。建议应尽可能在新辅助治疗后的手术标本中重新检测HER2状态,特别是在HER2具有异质性的肿瘤中,少部分HR阴性患者新辅助治疗后变为HR阳性,因此,对于新辅助治疗后ER、PR及HER2状态的重新评估将有助于进一步治疗决策的选择。
虽然本研究中HER2异质性3+及2+FISH+组样本量较小,然而,HER2 IHC弥漫3+与pCR高度相关证实了IHC在评估HER2表达中的关键作用,且与具有较大样本量的报道[16]一致,HER2 IHC 3+组pCR与研究的其他任何因素无相关性,IHC 2+FISH+组ER阴性是独立预测因子,本研究中该组仅1例HR阴性患者获得pCR,证明了本研究结果的可靠性。至于HER2异质性3+组,文献报道较少,可能因为大部分IHC 3+病例为弥漫3+,从而忽略了这部分病例,这一组病例具有更高的RCB分级,预后较IHC弥漫3+组差[22]。因此,有必要将这组病例从IHC 3+组中区分开来,从而使患者获得更精准的治疗,本研究中该组仅1例HER2 IHC>50%的HR阴性患者获得pCR,HER2高表达或HR阴性可能与该组患者的pCR相关,还需要更多的病例来证实。有研究[14]发现,HER2异质性与较差的预后和较低的抗HER2治疗反应有关,因此如何定义HER2异质性,如何为具有异质性的患者选择最佳治疗方案,需要给出一个统一的、可重复的关于HER2异质性的定义。
评价HER2异质性有助于新的抗HER2靶向药物的开发,最近提出了HER2低表达的定义:IHC示1+或2+且FISH检测阴性。约高达50%的乳腺癌会被归类为HER2低表达,这些肿瘤不能从曲妥珠单抗治疗中获益,然而新的抗HER2治疗,特别是ADC如DS-8201(T-DXd)已证明对HER2过表达或低表达的肿瘤均可发挥作用[23]。这些新型ADC通过肿瘤细胞膜上最低限度的HER2受体发挥作用,而且具有强大的旁观者效应,可将药物扩散到邻近的肿瘤细胞甚至HER2阴性的肿瘤细胞内产生杀伤作用。这类新型ADC的出现,可能使HER2具有异质性的这部分乳腺癌患者极大获益。因此应该开始重视IHC HER2阴性及阳性表达中异质性的评价。
鉴于HER2异质性评价对HER2表达(高表达、低表达)乳腺癌的重要意义,建议在日常HER2 IHC评价时应分别报告HER2阳性百分比及阳性强度(0、1+、2+和3+);联合IHC及FISH结果综合评价HER2表达情况,更好地选择HER2靶向治疗患者,更准确地评估新辅助治疗效果及预后。结合本研究结果,认为HER2 IHC≥50%3+为高表达组,新辅助治疗的pCR率高,IHC<50% 3+及IHC 2+FISH+应归为低表达组,新辅助治疗的pCR率低,DS-8201等ADC成为新的选择。
综上所述,HER2异质性会影响HER2阳性乳腺癌对新辅助治疗的反应,HER2弥漫3+患者新辅助治疗后pCR率最高,且与其他因素无明显相关性。约11.9%的HER2阳性乳腺癌患者在新辅助治疗后变为HER2阴性,在HER2 IHC异质性3+及2+FISH+肿瘤中更为常见。对于新辅助治疗后HER2、ER及PR状态的重新评估将有助于进一步辅助治疗决策的选择。
利益冲突声明:所有作者均声明不存在利益冲突。
