胸腔镜食管癌根治术联合左侧颈部吻合术治疗食管癌疗效观察
2022-06-10樊宏哲杜鹏程
樊宏哲,郭 浩,杜鹏程
(1.新乡医学院第三附属医院心胸外科,河南 新乡 453003;2.新乡医学院第三附属医院重症医学科,河南 新乡 453003;3.新乡医学院第三附属医院消化科,河南 新乡 453003)
食管癌是消化道恶性肿瘤,其发病率和病死率均较高,患者 5 a生存率为30%~40%[1-2]。临床上对食管癌患者的治疗主要采用手术切除,传统开放切除术是治疗食管癌的常用方案,可有效改善预后,延长患者远期生存率。传统开放切除术需经右胸切除食管癌,并于胸内行胃食管吻合,其术中淋巴结清扫、病灶清除及术后游离残胃重建消化道等过程对患者具有较大的损伤,甚至会对肺功能造成损伤,并产生一系列并发症[3]。随着微创技术的发展,胸腔镜食管癌根治术被广泛用于食管癌的治疗,胸腔镜手术不需要暴露胸腔,与传统开放手术相比能够更有效地减轻手术对患者的损伤以及器械操作对肺部组织造成的挤压,且减少并发症的发生[4-5]。研究表明,胸腔镜食管癌根治术可有效减轻对机体的创伤程度,具有失血少、创伤小、肿瘤切除便捷、术后康复快等特点,可有效减轻炎症反应,改善肺功能和预后[6]。左侧颈部吻合术是在颈部行胃食管吻合,可减少对胸部的损伤,从而保护患者肺功能[7]。而临床尚缺乏采用胸腔镜食管癌根治术联合左侧颈部吻合术治疗食管癌的报道,因此,本研究通过比较传统开放食管癌切除术与胸腔镜食管癌根治术联合左侧颈部吻合术对食管癌患者的疗效及对患者肺功能的影响,探讨胸腔镜食管癌根治术联合左侧颈部吻合术的临床应用价值,以期以为食管癌患者的治疗提供参考。
1 资料与方法
1.1 一般资料选择2018年1 月至2020年12月新乡医学院第三附属医院收治的80例食管癌患者为研究对象。病例纳入标准:(1)符合《食管癌诊疗规范(2018年版)》[8]中食管癌的诊断标准;(2)CT检查、消化道造影显示有食管占位,且术后病理活检确诊为食管癌;(3)TNM分期[9]Ⅰ~Ⅱb期;(4)患者签署知情同意书。排除标准:(1)有远处转移或者淋巴结浸润者;(2)患有严重心肺功能障碍,如慢性阻塞性肺疾病、心力衰竭者;(3)合并其他恶性肿瘤者;(4)有大出血、穿孔等急诊手术指征者;(5)对本研究手术有禁忌证者;(6)有胸部手术史者;(7)妊娠期或哺乳期女性。根据手术方法将患者分为对照组(n=38)和观察组(n=42)。对照组:男26例,女12例;年龄49~75(62.56±13.23)岁;肿瘤体积3.6~6.9(5.39±1.63)cm3;TNM分期:Ⅰ期18例,Ⅱa期11例,Ⅱb期9例;病变位置:上段4例,中段26例,下段8例;肿瘤病理类型:腺癌4例,鳞状细胞癌34例。观察组:男26例,女16例;年龄50~73(61.96±12.42)岁;肿瘤体积4.5~6.5(5.52±1.09)cm3;TNM分期:Ⅰ 期23例,Ⅱa期9例,Ⅱb期10例;病变位置:上段6例,中段31例,下段5例;肿瘤病理类型:腺癌8例,鳞状细胞癌34例。2组患者的性别、年龄、肿瘤体积、TNM分期、病变位置、肿瘤病理类型比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准。
1.2 手术方法
1.2.1 对照组对照组患者行常规经右胸食管癌切除术联合胃食管胸内吻合术治疗。患者全身麻醉,行气管插管,取平卧位,在上腹部正中做切口,常规游离胃大小弯侧,采用血管闭合器双重结扎胃短血管后,离断胃左侧动脉,清扫血管、食管、胃周围的淋巴结,然后将胃游离至幽门处。患者取左侧卧位,重新铺巾消毒,经右胸做切口,长约 15 cm,并将皮下组织依次切开,检查胸腔内是否存在肿瘤转移,游离食管,并对气管支气管周围、食管旁的淋巴结进行清扫,开腹后置入吻合器,将游离的胃由膈肌裂孔提至胸部,吻合食管和胃。置入胸腔引流管,确定无活动性出血后,关闭胸腔。
1.2.2 观察组观察组患者行胸腔镜食管癌根治术联合左侧颈部吻合术治疗。患者全身麻醉,单腔行气管插管,取左侧卧位,选择右侧腋中线第7肋间隙作为观察孔,右侧肩胛下角线第7肋间隙以及内侧第9肋间隙、右侧腋后线第3肋间隙作为操作孔(宽1.0~1.5 cm),置入胸腔镜。游离奇静脉弓并夹闭,切断奇静脉弓,将食管游离至胸膜腔顶部、食管裂孔,清扫隆突下、双侧喉返神经、食管旁的淋巴结。患者取平卧位,铺巾消毒后,在剑突下、肋缘下以及脐旁做操作孔(宽0.5~1.0 cm),置入胸腔镜。打开小网膜,将肝胃韧带分离至幽门,在胰腺的上缘进行游离,直到出现胃左动脉和胃右静脉,用血管钳钳夹胃左动脉,并用超声刀切缘。将胃结肠韧带分离至贲门,采用超声刀对胃短血管进行切缘,将肝胃韧带分离至食管裂孔。在颈部做切口(左胸的锁乳突肌前缘),切开颈阔肌和皮下组织,向外牵引颈血管鞘和胸锁乳突肌,扩大胸廓的入口间隙。在颈部切口将食管横断,在远端食管预先置入荷包,置入一次性吻合器(23#)的底顶座,采用荷包结扎食管断端,在近端食管采用7# 线缝扎,并结合负压球引流管固定近端食管。将剑突下的操作孔纵向延长约3 cm,将食管(已游离)、贲门、胃底、胃体从食管裂孔拉入腹腔,并经小切口脱离到腹腔外面,采用直线切割缝合器沿着胃大弯侧将其裁制成管状胃,移除食管、贲门、胃底、小弯侧胃组织。加强缝合胃残端处,将管状胃从食管床提到颈部。打开管状胃置入一次性吻合器(23#),并与颈部的正常食管机械吻合,置入十二指肠营养管和胃管,缝合切口。
1.3 观察指标(1)围手术期相关指标:记录2组患者术中出血量、手术时间、淋巴结清扫个数、拔管时间、总引流量、住院时间。(2)疼痛情况:分别于术前及术后12、24、48、72 h,采用视觉模拟评分(visual analogue scale,VAS)[5]评估患者疼痛情况,总分0~10分,分值越高表示疼痛程度越高。(3)肺功能:分别于术前、术后4周采用肺功能仪(德国Jaeger公司)检测患者肺功能相关指标,包括第1秒用力呼气容积(forced expiratory volume in one second,FEV1)、用力肺活量(forced vital capacity,FVC)、肺活量(vital capacity,VC)、最大通气量(maximum voluntary ventilation,MVV),并计算FEV1/FVC。(4)血清中一氧化氮合酶(nitric oxide synthase,NOS)、癌胚抗原(carcinoembryonic antigen,CEA)、可溶性白细胞介素-2受体(soluble interleukin-2 receptor,SIL-2R)水平:于术前、术后4周抽取患者外周静脉血5 mL,3 000 r·min-1离心15 min,收集上层血清待测。采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测血清NOS、SIL-2R水平,试剂盒购自上海酶联生物科技有限公司;采用放射免疫分析法检测血清CEA水平,试剂盒购自北京福瑞润泽生物技术有限公司。(5)并发症:记录2组患者术后并发症发生情况,包括切口感染、乳糜胸、吻合口漏、心律失常、喉返神经损伤、肺部感染等。
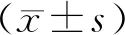
2 结果
2.1 2组患者围手术期相关指标比较结果见表1。2组患者淋巴结清扫个数比较差异无统计学意义(P>0.05)。观察组患者术中出血量、总引流量显著低于对照组,拔管时间、住院时间显著短于对照组,手术时间显著长于对照组,差异均有统计学意义(P<0.05)。
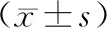
表1 2组患者围手术期相关指标比较
2.2 2组患者疼痛情况比较结果见表2。术前2组患者的VAS评分比较差异无统计学意义(P>0.05)。 2组患者术后12、24、48、72 h VAS评分呈下降趋势(F时间=422.331,P<0.05)。2组患者术后12、24、48、72 h VAS评分均显著低于术前,差异有统计学意义(P<0.05)。术后12、24、48、72 h,观察组患者的 VAS评分均显著低于对照组,差异有统计学意义(P<0.05)。
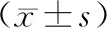
表2 2组患者手术前后VAS评分比较
2.3 2组患者肺功能指标比较结果见表3。术前2组患者的VC、MVV、FEV1、FEV1/FVC比较差异均无统计学意义(P>0.05)。 2组患者术后4周的VC、MVV、FEV1、FEV1/FVC均显著低于术前,差异有统计学意义(P<0.05)。术后4周,观察组患者的VC、MVV、FEV1、FEV1/FVC均显著高于对照组,差异有统计学意义(P<0.05)。
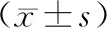
表3 2组患者肺功能指标比较
2.4 2组患者血清NOS、CEA及SIL-2R水平比较结果见表4。术前2组患者血清NOS、CEA、SIL-2R 水平比较差异无统计学意义(P>0.05)。2组患者术后4周血清NOS、CEA、SIL-2R水平均显著低于术前,差异有统计学意义(P<0.05)。术后4周,观察组患者血清NOS、CEA、SIL-2R水平均显著低于对照组,差异有统计学意义(P<0.05)。
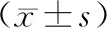
表4 2组患者血清NOS、CEA及SIL-2R水平比较
2.5 2组患者并发症比较结果见表5。观察组患者总并发症发生率显著低于对照组,差异有统计学意义(χ2=8.590,P<0.05)。观察组患者切口感染发生率显著低于对照组,差异有统计学意义(χ2=4.654,P<0.05)。2组患者乳糜胸、吻合口漏、心律失常、喉返神经损伤、肺部感染发生率比较差异无统计学意义(χ2=0.011、0.611、0.956、0.066、0.664,P>0.05)。
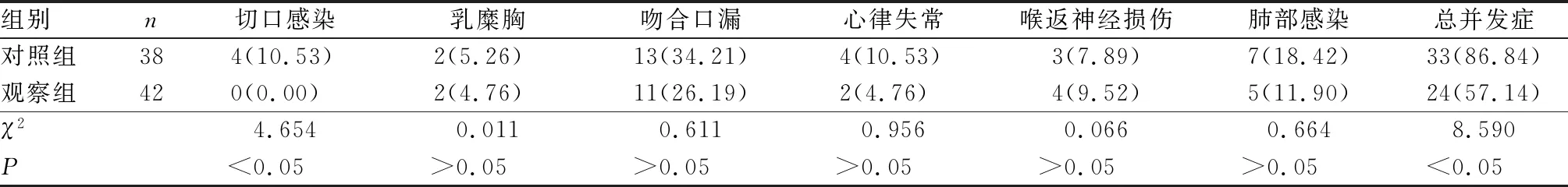
表5 2组患者并发症发生情况比较
3 讨论
食管癌根治术是临床治疗食管癌的主要方法。有研究表明,我国食管癌手术切除率为90.0%~97.0%,患者术后5 a生存率为30.0%~55.5%[10]。早期食管癌患者无明显体征和症状,当出现疼痛、进食梗阻感时,多数患者已属于中晚期。因此,对食管癌患者进行早期诊断并给予有效治疗十分重要。
食管癌开放手术一般是采用传统右胸入路的三切口(颈、胸、腹)以切除病灶、清除淋巴结,病灶切除后于胸腔内将食管与管状胃残端吻合以重建消化道,从而延长患者的生命,但术后易发生切口感染、肺部感染等并发症,对肺功能造成损伤[11-12]。胸腔镜食管癌根治术具有切口小、创伤小、操作视野良好、疼痛少、术后并发症少以及恢复快等优点,手术操作中不需要将肋间肌肉切断,也不需要将肋骨撑开,可更好地保护胸腔壁的完整性,减少患者术后心肺相关并发症的发生,并可减少患者的疼痛感[13-14]。本研究结果发现,观察组患者术中出血量、总引流量显著少于对照组,拔管时间、住院时间显著短于对照组,手术时间显著长于对照组,说明胸腔镜食管癌根治术联合左侧颈部吻合术能够减少术中出血量和总引流量,缩短患者的拔管时间以及住院时间,有利于患者尽快恢复,但其手术操作更为复杂,且对医生的要求也更高,如果患者存在胸膜广泛粘连则胸腔镜不能够顺利置入,导致其手术时间相对较长。本研究对患者术后72 h内的疼痛情况进行监测,结果显示,2组患者术后12、24、48、72 h VAS评分呈下降趋势,且观察组患者的 VAS评分均显著低于对照组,说明胸腔镜食管癌根治术联合左侧颈部吻合术可有效减轻患者的疼痛;分析其原因可能在于,胸腔镜食管癌根治术创伤小,患者的机体应激反应相对较轻,术后疼痛程度也会相对较轻。
肺功能的好坏与呼吸肌和胸廓完整性、肺组织和胸廓的顺应性、呼吸道的通畅程度、胸腔内有无负压、肺脏有无扩张等有关。食管癌开胸根治术使患者胸腔外露时间长,且在消化道重构过程中,肺门多受到挫伤和挤压,创伤较大,术后患者肺部相关并发症也较多,其中肺功能所受损伤最大。有研究表明,食管癌患者行传统食管癌切除术后会出现呼吸功能衰退[15]。肺功能的好坏还与胸壁膈肌以及肌群完整性有关,膈肌为呼吸肌的核心,膈肌的完整性和移动度与肺功能密切相关[16]。本研究中,2组患者术后4周的VC、MVV、FEV1、FEV1/FVC均显著低于术前,提示不管是传统开放食管癌切除术还是胸腔镜食管癌根治术联合左侧颈部吻合术均会对患者肺功能产生一定的影响;术后4周观察组患者的VC、MVV、FEV1、FEV1/FVC均显著高于对照组,说明胸腔镜食管癌根治术联合左侧颈部吻合术治疗食管癌较传统食管癌切术对肺功能的损伤小。分析原因在于,胸腔镜食管癌根治术联合左侧颈部吻合术是微创手术,胸腔暴露的时间相对较短,能够减少肺组织感染发生率,且该手术从膈肌右侧做小切口入路,对膈肌完整性起到较好的保护作用,较小限制膈肌的运动,对胸壁膈肌以及肌群的损伤较小,能够更好地保护肺功能[17]。而传统经右胸食管癌切除联合胃食管胸内吻合术,选择在右胸做大切口(长约15 cm),严重破坏胸腔壁的膈肌以及肌群,使膈肌完整性遭到破坏,对肺组织的损伤相对较大。
NOS是生成一氧化氮(nitric oxide,NO)的关键酶,参与生理性血管张力的调节,还会在其他因子的作用下对血管内皮细胞造成损伤,从而产生大量的NO[18]。CEA是一种单体糖蛋白,具有胚胎抗原特异性,但其在正常组织中的表达水平较低,是临床诊断恶性肿瘤如食管癌、结直肠癌、肺癌、肝癌以及评估其预后的重要指标,是肿瘤标志物之一[19]。SIL-2R由白细胞介素-2(interleukin-2,IL-2)诱导而产生,具有免疫抑制作用,可反映机体的细胞免疫状态[20]。本研究中,2组患者术后4周血清NOS、CEA、SIL-2R水平均显著低于术前;术后4周,观察组患者血清NOS、CEA、SIL-2R水平均显著低于对照组,说明胸腔镜食管癌根治术联合左侧颈部吻合术治疗食管癌可有效改善机体的细胞免疫状态及预后。分析原因可能在于,2组患者淋巴结彻底清扫后,食管癌患者的缺氧缺血状态得到改善,机体合成NO增多,从而消耗大量NOS,导致血清NOS水平降低。本研究还对患者术后并发症发生情况进行分析,结果显示,观察组患者切口感染发生率及总并发症发生率显著低于对照组,可见胸腔镜食管癌根治术联合左侧颈部吻合术可有效减少食管癌患者并发症的发生率尤其是术后切口感染的发生率,可能与胸腔镜食管癌根治术联合左侧颈部吻合术手术切口小、不需要暴露胸腔有关。
综上所述,与常规经右胸食管癌切除术联合胃食管胸内吻合术比较,胸腔镜食管癌根治术联合左侧颈部吻合术虽然手术操作时间较长,但患者术中出血量、术后总引流量较少,术后患者疼痛更轻,患者住院时间较短、恢复较快,术后患者肺功能损伤小,血清NOS、CEA、SIL-2R水平低,且术后切口感染发生率低。但本研究样本量相对较少,未对患者的长期预后情况进行随访,今后有待加大样本量,并延长随访时间做进一步的研究验证。
