血清sclerostin和Klotho蛋白水平对维持性血液透析患者血管钙化的预测价值
2022-06-10石新慧任东升陶雅非李海剑
石新慧,任东升,陶雅非,谷 裕,徐 光,李 征,李海剑
(1.南阳市中心医院肾病风湿免疫科,河南 南阳 473000;2.南阳市中心医院泌尿外科,河南 南阳 473000)
血管钙化是维持性血液透析(maintenance hemodialysis,MHD)患者常见的并发症之一,可增加MHD患者发生不良心血管事件的概率,为终末期肾病患者死亡的独立危险因素[1]。以往认为血管钙化是一个被动的、退化的、不可避免的终末过程,但最近研究表明,血管钙化类似于骨发育和软骨形成的过程,是一个主动的、可调节的、可治疗和预防的过程[2]。因此,早期预测MHD患者血管钙化的发生对延缓疾病进程尤为重要[3]。研究表明,Wnt信号通路在血管钙化的发生和发展过程中扮演关键角色,sclerostin蛋白为该通路的抑制因子,但其在血管钙化发生机制中的作用尚不明确[4]。Klotho蛋白为一类主要由肾脏合成的具有抗衰老功能的蛋白,多用于预测肾脏损伤的预后,可溶性Klotho蛋白随血液循环形式作用于全身,并参与血管钙化的发生和发展过程[5]。本研究旨在探讨血清sclerostin、Klotho蛋白水平对MHD患者血管钙化的预测价值。
1 资料与方法
1.1 一般资料选择2017年10月至2019年10月南阳市中心医院肾病风湿免疫科收治的MHD患者为研究对象。病例纳入标准:(1)长期规律血液透析,且透析龄≥3个月;(2)年龄≤75岁;(3)临床资料完整;(4)患者及其家属知情同意,并签署知情同意书。排除标准:(1)合并严重的心、肝、肺等重要器官功能障碍;(2)合并恶性肿瘤、自身免疫病;(3)入组前3个月接受免疫抑制剂或激素治疗者;(4)合并感染性、炎症性疾病者;(5)入组前1个月发生急性心、脑血管事件者;(6)合并可能影响血管钙化的其他疾病者。本研究共纳入MHD患者105例,根据是否有血管钙化将患者分为血管钙化组和非血管钙化组。血管钙化组69例,男39例,女30例;年龄36~75(57.62±15.72)岁。非血管钙化组36例,男20例,女16例;年龄35~75(57.59±15.66)岁。2组患者的年龄、性别分布比较差异无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会审核批准。
1.2 血液透析方法使用F80透析器(德国费森尤斯公司)和碳酸氢盐透析液,每次4 h,每周3次,透析液钙浓度为1.5 mmol·L-1,血流量为250~300 mL·min-1,透析液流量为500 mL·min-1,每次透析时超滤量均可达临床评估干体质量。
1.3 血管钙化评估方法采用X线片评估2组患者的血管钙化情况。患者分别行腰椎侧位、双手正位、骨盆平片X线检查,其中腰椎侧位片以第2、3腰椎间隙为界分隔腹主动脉为上、下2部分,双手正位片以双手上端为界分隔为4部分,骨盆平片以股骨头切面为水平线、以脊柱为垂直线分隔为4部分,共10个部分,每个部分无血管钙化计0分,有血管钙化计1分,由3位资深放射科医师双盲法单独阅片,意见不一致时讨论得出结果,取均值作为最终结果。总分0分为无血管钙化,1~3分为轻度血管钙化,4~6分为中度血管钙化,7~10分为重度血管钙化。本研究将无血管钙化患者纳入非血管钙化组,轻、中、重度血管钙化患者纳入血管钙化组。
1.4 资料采集通过查阅病历采集2组患者的临床资料,包括性别、年龄、体质量指数(body mass index,BMI)、透析龄、吸烟史、饮酒史、原发疾病(慢性肾小球肾炎、糖尿病肾病、高血压肾小动脉硬化、慢性肾盂肾炎等)、血清sclerostin蛋白水平、血清Klotho蛋白水平、血清肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)、尿素清除指数(Kt/V)、血红蛋白(hemoglobin,Hb)、白蛋白(albumin,Alb)、血清超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesferol,HDL-C)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、校正的血清钙浓度、血清磷浓度、钙磷乘积、血清全段甲状旁腺激素(intact parathyroid hormone,iPTH)水平等。
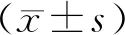
2 结果
2.1 MHD患者血管钙化影响因素单因素分析结果见表1。单因素分析结果显示,性别、年龄、BMI、吸烟史、饮酒史、原发疾病、Scr、BUN、Kt/V、Hb、Alb、hs-CRP、TC、TG、LDL-C、HDL-C、SBP、DBP、血清磷、钙磷乘积与MHD患者血管钙化无关(P>0.05),透析龄及校正的血清钙、iPTH、sclerostin蛋白、Klotho蛋白与MHD患者血管钙化有关(P<0.05)。
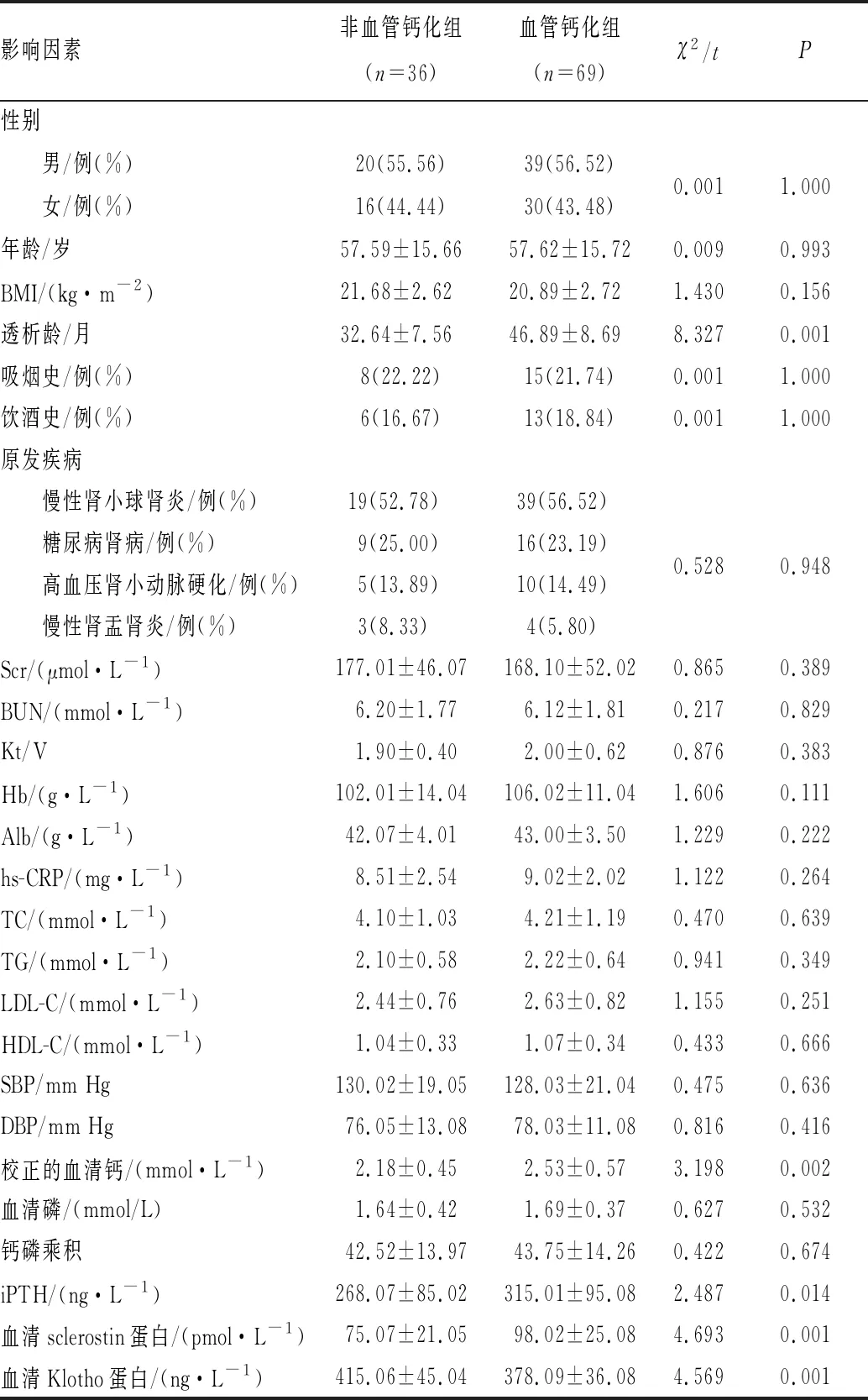
表1 MHD患者血管钙化影响因素单因素分析结果
2.2 MHD患者血管钙化影响因素多因素logistic回归分析结果见表2。多因素logistic回归分析显示,透析龄及校正的血清钙、iPTH、sclerostin蛋白为MHD患者血管钙化的独立危险因素,血清Klotho蛋白为MHD患者血管钙化的独立保护因素(P<0.05)。
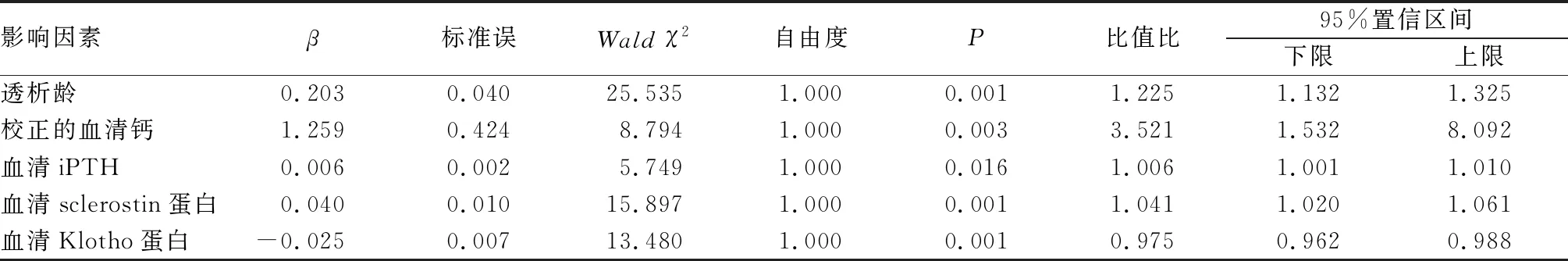
表2 MHD患者血管钙化影响因素多因素logistic回归分析
2.3 血清sclerostin、Klotho蛋白对MHD患者血管钙化的预测价值结果见图1和表3。ROC曲线显示,血清sclerostin、Klotho蛋白预测MHD患者血管钙化的AUC分别为0.870、0.840;以ROC曲线靠左上方约登指数的最大切点作为最佳临界值(血清sclerostin蛋白为87.575 pmol·L-1,Klotho蛋白为393.220 ng·L-1),血清sclerostin蛋白预测MHD患者血管钙化的敏感度和特异度分别为71.0%、88.9%,血清Klotho蛋白预测MHD患者血管钙化的敏感度和特异度分别为73.9%、94.4%;血清sclerostin、Klotho蛋白联合检测预测MHD患者血管钙化的AUC为0.903,敏感度和特异度分别为85.5%、97.2%;血清sclerostin蛋白与Klotho蛋白预测MHD患者血管钙化的AUC、敏感度、特异度比较差异均无统计学意义(P>0.05);血清sclerostin、Klotho蛋白联合检测预测MHD患者血管钙化的AUC、敏感度和特异度显著高于二者单独检测,差异有统计学意义(P<0.05)。

图1 血清sclerostin、Klotho蛋白预测MHD患者血管钙化的ROC曲线

表3 血清sclerostin、Klotho蛋白对MHD患者血管钙化的预测价值
3 讨论
血管钙化是指钙、磷异常沉积于血管壁的病理过程,普遍发生于糖尿病和慢性肾脏疾病患者,是MHD患者发生不良心血管事件的重要因素,也是最终导致MHD患者死亡的独立危险因素[6]。本研究结果显示,105例MHD患者中有69例患者发生血管钙化,发病率为65.71%,提示MHD患者血管钙化发生率较高。目前,血管钙化的有效治疗方式较少,主要以预防为主[7]。因此,探寻MHD患者的血管钙化机制及早期预测指标对降低MHD患者不良心血管事件发生率尤为重要。
既往报道认为血管钙化是因人体脉管系统衰老导致的被动钙盐沉积过程,但最新研究表明,机体细胞主动参与了此过程[8]。血管钙化的机制非常复杂,与血管弹性蛋白退化、钙磷代谢紊乱、血管平滑肌细胞凋亡、骨软骨分化等多种因素有关,其中以钙磷代谢紊乱最为关键[9]。研究表明,成纤维细胞生长因子23(fibroblast growth factor 23,FGF23)、Klotho蛋白为调节血磷代谢的重要因子[10]。FGF23主要由骨成纤维细胞、骨细胞分泌,其能以调控维生素D水平并作用于甲状旁腺、肾脏近段肾小管等方式促进尿磷排泄,抑制肠道磷重吸收。FGF23与其受体结合时需Klotho蛋白协助方可发挥作用。Klotho蛋白可由脑脉络丛、甲状旁腺、肾脏等器官合成分泌,但主要存在于肾脏[11]。Klotho蛋白包括膜型Klotho蛋白及可溶性Klotho蛋白2种,其中膜型Klotho蛋白主要与FGF23受体结合为共受体,发挥FGF23功能[12]。而可溶性Klotho蛋白源自膜型Klotho细胞外片段,是FGF23信号通路的关键调节因子,以血液循环为媒介作用于全身。MHD患者因肾功能衰退及可溶性Klotho蛋白表达降低,抑制了成纤维细胞生长因子受体-Klotho复合体的生成,使尿磷排泄减少、肠道磷重吸收增加,进而引发血管钙化[13]。本研究结果显示,血管钙化组患者血清Klotho蛋白水平显著低于非血管钙化组,Klotho蛋白是MHD患者血管钙化的独立保护因素,提示Klotho蛋白与MHD患者血管钙化密切相关。
除钙磷代谢紊乱外,Wnt信号通路也是血管钙化的重要因素之一[14]。Wnt信号通路主要通过Wnt/β-catenin、Wnt/Jun氨基末端激酶、Wnt/Ca2+等信号通路来调节MHD患者的骨-血管轴代谢过程,进而影响血管钙化。sclerostin蛋白为骨细胞、软骨细胞分泌的一类特异性糖蛋白,是Wnt信号通路的抑制剂,其可与低密度脂蛋白受体相关蛋白5/6受体结合,抑制Wnt与其表面受体结合,从而发挥抑制Wnt信号通路的的作用。杨海等[15]研究显示,血清sclerostin蛋白与慢性肾衰竭患者的桡动脉钙化有关,且桡动脉钙化组患者的血清sclerostin蛋白水平显著高于未钙化组。本研究结果显示,血管钙化组患者血清sclerostin蛋白水平显著高于非血管钙化组,且血清sclerostin蛋白是MHD患者血管钙化的独立危险因素。分析其相关机制可能为:(1)sclerostin蛋白水平受年龄、iPTH、血清磷等多种因素影响,骨细胞分泌的sclerostin蛋白虽能延缓血管钙化进程,但随着MHD患者病情进展,sclerostin蛋白的主要来源转变为钙化脉管系统,因而导致血清sclerostin蛋白上调;(2)sclerostin蛋白介导的骨转换受到抑制,导致血钙、磷水平升高,诱发血管钙化。ROC曲线显示,血清sclerostin、Klotho蛋白及二者联合预测MHD患者血管钙化的AUC分别为0.870、0.840、0.903;以血清sclerostin蛋白水平为 87.575 pmol·L-1,Klotho蛋白水平为393.220 ng·L-1,血清sclerostin蛋白与Klotho蛋白预测MHD患者血管钙化的AUC、敏感度、特异度比较差异无统计学意义,血清sclerostin、Klotho蛋白联合检测预测MHD患者血管钙化的AUC、敏感度和特异度显著高于二者单独检测;提示血清sclerostin、Klotho蛋白对MHD患者的血管钙化均有一定的预测价值,而二者联合具有更高的预测价值。另外,透析龄及校正的血清钙、iPTH也是MHD患者血管钙化的独立危险因素,提示MHD患者血管钙化与多种因素有关,但各因素之间是否存在关联有待进一步研究证实。
综上所述,血清sclerostin、Klotho蛋白与MHD患者的血管钙化有关,血清sclerostin蛋白为MHD患者血管钙化的独立危险因素,而血清Klotho蛋白为MHD患者血管钙化的独立保护因素;血清sclerostin、Klotho蛋白对MHD患者的血管钙化均有一定的预测价值,且二者联合检测具有更高的预测价值,血清sclerostin、Klotho蛋白可作为MHD患者血管钙化的预测指标。但本研究样本量较少,血清sclerostin、Klotho蛋白对MHD患者血管钙化的具体作用机制尚不清楚,仍需大样本、前瞻性基础及临床研究予以证实。
