玉米秸秆高效降解微生物复合菌系的构建及降解效果评价
2022-06-09王新光田磊王恩泽钟成田春杰
王新光 田磊 王恩泽 钟成 田春杰
(1.天津科技大学生物工程学院,天津 300457;2.中国科学院东北地理与农业生态研究所 黑土区农业生态重点实验室,长春 130102)
我国是世界农业大国,以秸秆为代表的农业废弃物产量十分丰富,尤其是玉米秸秆。据统计,2014-2018年我国秸秆年均产量约为65 386.6万t,其中玉米秸秆占总秸秆产量的45%左右[1]。玉米秸秆中含有多种营养元素,包括C、N、P、K和微量元素等,是重要的生物质资源[2],如果加以合理高效利用,则会避免出现焚烧而导致的环境污染问题。早在2017年,党的十九大报告提出了乡村建设的发展方向,其中最关键的就是农业废弃物的无害化、资源化利用[3]。因此,研究如何高效利用玉米秸秆是十分必要的。
玉米秸秆是典型的纤维素类物质,目前采用物理和化学的方法处理纤维素类物质存在成本高和污染环境等问题,而生物降解法相对于其它处理手段具有成本低、无污染等优点,是降解纤维素物质的重要手段[4-5]。近年来,利用微生物降解秸秆成为国内外研究的热点,主要关注玉米秸秆和水稻秸秆的降解。苏玉春等[6]从长白山腐殖土样品中筛选出一株毛头鬼伞菌(Coprinus comatus),其纤维素酶活为3.57 U/mL,28℃条件下发酵玉米秸秆,15 d后玉米秸秆失重率达到23.65%,其中纤维素降解率为17.06%。真菌降解纤维素能力强,但相对于细菌来说生长缓慢,纤维素酶耐热性和耐碱性差,实际应用中限制因素多[7-8]。Olowomofe等[9]从土壤中分离出一株密歇根克雷伯氏菌(Klebsiella michiganensis),通过条件优化发现其在pH 7条件下培养后,纤维素酶活可达35.6 U/mL。以往的研究大多是利用分离得到的单菌降解秸秆,获得的单菌酶活较低,产生的酶系较单一,导致秸秆不能被高效降解[10]。
复合菌系处理秸秆被认为是一种稳定高效的降解手段,它主要是依靠不同菌株之间的协同作用来发挥更强的秸秆降解能力[11-12]。Sui等[13]将纤维素降解菌N05、N13和N21组合成复合菌群,在30℃的条件下培养5 d后酶活达到最大值为6.07 U/mL,与单菌相比酶活提高了2倍。崔鸿亮等[14]将蜡状芽孢杆菌(Baccillus cereus)、解淀粉芽孢杆菌(B.amyloliquefaciens)、地衣芽孢杆菌(B.licheniformis)和中间苍白杆菌(Ochrobactrum intermedium)组合构建成复合菌群,在30℃条件下培养8 d后水稻秸秆的降解率达到73.3%,比蜡状芽孢杆菌单菌的降解能力提高了22.4%。显然,复合菌系纤维素酶活及对秸秆的降解能力均优于单菌,构建高效复合菌系对提高秸秆的降解率具有积极作用。
目前复合菌剂因其高效的降解能力备受关注,但对于细菌组合构建的复合菌系的研究报道比较少[15-17]。尤其对于细菌和放线菌组合构建的复合菌系发酵体系优化研究相对不足。链霉菌作为一种最高等的放线菌,常被用于制备抗生素,但链霉菌也具有较强的降解秸秆的能力。有研究报道,通过高通量测序的方法对降解秸秆细菌群落中主要降解菌进行分析发现,链霉菌是降解秸秆的主要降解菌[18]。因此,本研究将芽孢杆菌属与链霉菌属组合构建玉米秸秆高效降解复合菌系,为秸秆资源化利用提供菌种资源,并对其进行发酵条件及培养基的优化,对高效发挥微生物功能及玉米秸秆降解复合菌剂的开发制备具有重要意义。
1 材料与方法
1.1 材料
1.1.1 玉米秸秆及降解菌株 玉米秸秆来自中国科学院东北地理与农业生态研究所玉米试验田,切割粉碎至2-5 cm的小段;秸秆降解菌株为:枯草芽孢杆菌WF-8(Bacillus subtilis WF-8)、地衣芽孢杆菌 WF-11(B.lincheniformis WF-11)、蜡 状 芽 孢 杆菌WS-1(B.cereus WS-1)、和黑胡桃链霉菌WF-10(Streptomyces nogalater WF-10)由中国科学院东北地理与农业生态研究所土壤与微生物养分循环学科组提供。
1.1.2 培养基 LB(Luria-bertani)液体培养基:胰蛋白胨10.0 g,酵母粉5.0 g,NaCl 5.0 g,蒸馏水1 000 mL,pH调节至7.0。
ISP2(International Streptoyces Project 2) 液 体培养基:酵母粉4 g,麦芽浸出物10 g,碳酸钙2 g,葡萄糖4 g,蒸馏水1 000 mL。
液态发酵培养基/发酵产酶培养基:玉米秸秆粉 15 g,NaCl 0.1 g,KH2PO41.0 g,NaNO32.5 g,MgSO4·7H2O 0.3 g,CaCl20.1 g,FeCl30.01 g,蒸馏水1 000 mL。
无 机 盐 培 养 基:KH2PO41.0 g,NaCl 0.1 g,MgSO4·7H2O 0.3 g,NaNO32.5 g,CaCl20.1 g,FeCl30.01 g,蒸馏水1 000 mL。
1.2 方法
1.2.1 单菌纤维素酶活的测定 将4株活化后的菌株分别接种到发酵产酶培养基,于28℃ 200 r/min条件下振荡培养,每隔24 h取一次样,8 000 r/min离心5 min,上清液即为粗酶液。
CMCase酶活(羧甲基纤维素酶活性)和FPA酶活(滤纸酶活性)采用DNS法[19]测定。
酶活力定义:在50℃的反应条件下,1 mL粗酶液1 min内反应生成1 μmol葡萄糖所需的酶量为1 U/mL。
1.2.2 复合菌系的构建及确定最佳组合 将4种单菌株分别接种到LB液体培养基和ISP2液体培养基,28℃ 200 r/min条件下恒温摇床振荡培养24 h,4株菌通过等比例组合进行复配试验,并将复合菌OD600调至约108CFU/mL。构建的复合菌系如表1所示。

表1 不同菌种组合的复合菌系Table 1 Microbial consortiums formed by the combination of different strains
将4组复合菌系以4%比例分别接种至发酵产酶培养基,于28℃ 200 r/min条件下振荡培养,每隔24 h取一次样,8 000 r/min条件下离心5 min,然后取上清测定CMCase酶活和FPA酶活(方法同1.2.1)。
1.2.3 单因素及正交试验优化培养基 在发酵产酶培养基的基础上,以CMCase酶活为优化指标,对不同碳源(CMC-Na、秸秆粉、微晶纤维素、蔗糖、淀粉)、碳源添加量(5、7.5、10、12.5、15 g/L)、氮源(蛋白胨、硫酸铵、硝酸铵、酵母粉、尿素)和氮源添加量(1、2、3、4、5 g/L)进行单因素优化试验。将复合菌系按4%的接种量接入不同因素水平下的发酵产酶培养基,28℃ 200 r/min振荡培养5 d,实验设置3个重复。以单因素试验优化结果设置4因素4水平的正交试验L16(45)(表2),以CMCase酶活为优化指标,最终确定最优培养基配方。

表2 碳氮源正交试验表Table 2 Orthogonal test table for carbon and nitrogen sources
1.2.4 单因素及响应面试验优化发酵产酶条件 以CMCase酶活为优化指标,对不同培养时间(1、2、3、4、5、6、7、8 d)、培养温度(25、30、35、4℃、45℃)、接种量(1%、2%、3%、4%、5%、6%)和初始pH(4、5、6、7、8、9、10)进行产酶条件优化试验。实验设置3个重复。
以单因素试验优化后的最佳培养条件为中心点,利用Design Expert 8.0.6软件中的Box-Benhnken模型,以CMCase酶活为响应值,对发酵时间、发酵温度、接种量及初始pH四个影响因素进一步优化,设计四因素三水平的响应面试验(表3)。

表3 响应面试验因素及水平Table 3 Factors and levels of response surface experiments
1.2.5 复合降解菌系发酵试验及秸秆降解效果评价 为了验证构建的复合菌系的高效性和实际应用性,对构建的复合菌系进行液态发酵和固态发酵试验[20]。
液态发酵试验:取5 mL复合菌液接种到优化后的液态发酵培养基中,以不接菌液的培养基作为对照,在最优发酵条件下培养10 d后,离心弃上清,加稀酸溶液反复冲洗秸秆,然后再用蒸馏水冲洗,离心后采用失重法测定秸秆的相对降解率。
固态发酵试验:按照1.2.2中最佳复合菌系组合进行单菌复配,取5 mL混菌接入优化后的固态发酵培养基中,以不接菌液的培养基作为对照,在35℃的培养箱中进行固态发酵,每3 d摇匀一次。30 d后将秸秆取出,加稀酸溶液反复冲洗秸秆,然后再用蒸馏水冲洗,离心后采用失重法测定秸秆的相对降解率。
1.2.6 实验设计与数据统计分析 采用Origin 2019b绘图软件进行绘图,利用SPSS26进行正交试验数据分析,利用Design-Expert 8.0.6软件进行响应面试验数据分析,每组试验均做3次重复。
2 结果
2.1 复合菌系的构建筛选
将构建的复合菌系以及单菌接种到产酶培养基中28℃振荡培养,每24 h测定一次酶活。以纤维素酶活为指标,通过测定比较单菌与复合菌系的CMCase酶活和FPA酶活来筛选构建高效复合菌系。结果如图1和图2所示,单菌以及复合菌系的纤维素酶活基本上都是呈先升高后降低的趋势,4株单菌中WF11表现出较高的纤维素酶活,在第6 天达到最大,高于其它单菌;4组复合菌系都在第6天的时候酶活均达到最大,其中复合菌系HD产酶活性最高,CMCase酶活达到86.53 U/mL,FPA酶活达到22.03 U/mL,均显著高于单菌酶活。

图1 单菌和复合菌系的CMCase酶活Fig.1 CMCase activity of a single bacterial strain and microbial consortiums

图2 单菌和复合菌系的滤纸酶活Fig.2 FPA enzyme activity of a single bacterial strain and microbial consortiums
2.2 单因素试验筛选碳、氮源种类及其添加量
以CMCase酶活值为评价指标,通过混菌发酵对不同碳源、氮源及其添加量进行单因素实验优化,结果如表4和表5所示。复合菌系HD酶活随碳源种类及添加量的不同变化较大,以秸秆粉为碳源时,酶活较高,添加量为15 g/L时酶活最高;以蔗糖为碳源时,酶活较低,添加量为5 g/L时酶活最低。氮源种类及其添加量对酶活影响较大,硫酸铵更有利于复合菌系发酵产酶,添加量为4 g/L时酶活最高;以尿素为氮源时最不利于复合菌系发酵产酶,添加量为5 g/L时酶活最低。

表4 不同碳源及其添加量对复合菌系HD纤维素酶活的影响Table 4 Effects of different carbon sources and contents on the cellulose produced by microbial consortium HD
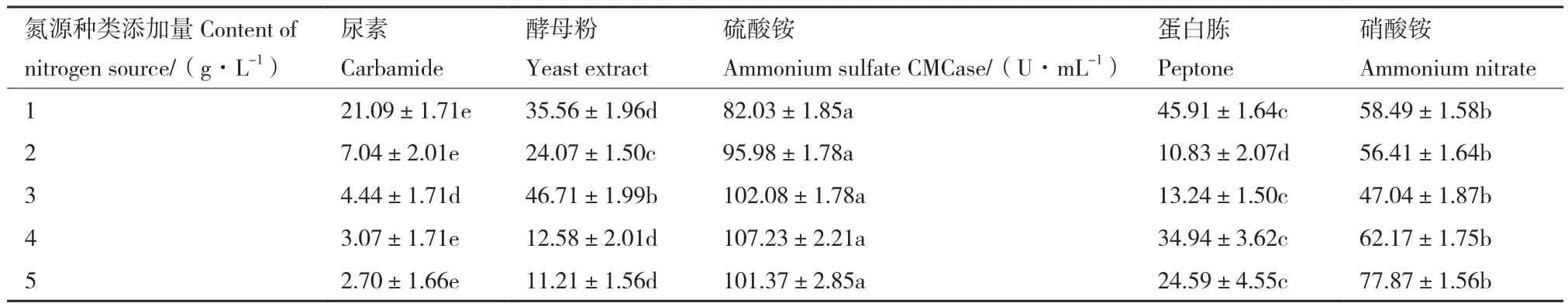
表5 不同氮源及其添加量对复合菌系HD纤维素酶活的影响Table 5 Effects of different nitrogen sources and contents on the cellulose produced by microbial consortium HD
2.3 正交试验优化培养基成分
根据单因素试验结果,综合考虑后去掉蔗糖、尿素、碳源添加量7.5 g/L和氮源添加量2 g/L,对碳源、氮源、碳源添加量和氮源添加量设计4因素4水平的正交试验,优化结果及方差分析结果如表6和表7所示。4个因素对复合菌系发酵产纤维素酶活性的影响从高到低为A-碳源>D-氮源添加量>B-氮源>C-碳源添加量,最优培养基组合为A4B3C4D3。综上所述,复合菌系HD的最优培养基为:秸秆粉15 g,(NH4)2SO44 g,KH2PO41.0 g,NaCl 0.1 g,MgSO4·7H2O 0.3 g,CaCl20.1 g,FeCl30.01 g, 蒸馏水1000 mL。进一步对最优培养基配方进行验证,结果显示复合菌系在最优发酵产酶培养基中发酵5 d后的纤维素酶活为98.63 U/mL,比未优化的培养基提高了1.46倍。

表6 正交试验结果Table 6 Results of orthogonal experiment

表7 单因素方差分析结果Table 7 One-way ANOVA results
2.4 单因素试验考察发酵条件对复合菌系产纤维素酶活性的影响
通过单因素试验考察温度、接种量、时间和初始pH对复合菌系HD产纤维素酶活性的影响,结果如图3所示。由图3-a可以看出,发酵温度为35℃时复合菌系产生的CMCase酶活及FPA酶活性最高,分别达到146.38 U/mL和28.70 U/mL,45℃时所产生的FPA酶活性高于25℃,表现出一定的耐热性。在最适温度范围内微生物酶促反应速度最大,酶活性最高,高于或低于最适温度均会抑制微生物代谢活动[21]。
由图3-b可以看出,FPA酶活随接种量的增大呈先升高后降低的趋势,CMCase酶活随接种量的增大出现两个峰值,当接种量为5%时,FPA酶活与CMCase酶活均达到最大值,分别为16.36 U/mL和155.23 U/mL。
由图3-c可以看出,发酵6 d后纤维素酶活达到最大值,FPA酶活和CMCase酶活分别为16.97 U/mL和53.29 U/mL,纤维素酶活随着发酵时间的继续延长呈下降趋势。
由图3-d可以看出,pH为7时,FPA酶活和CMCase酶活达到最大值,分别为22.65 U/mL和111.82 U/mL,纤维素酶活随着pH的增大逐渐降低。pH值的改变会影响酶活性中心的某些基团的解离程度,并且还会影响底物的解离程度,从而影响纤维素酶与底物的结合[22]。

图3 环境因素对复合菌系D产纤维素酶的影响Fig.3 Effects of environmental factors on the cellulose production of microbial consortium D
2.5 响应面试验优化复合菌系发酵条件
2.5.1 响应面模型的构建及方差分析 根据表3设计的因素和水平编码表,以温度(A)、接种量(B)、时间(C)和初始pH(D)为自变量,以CMCase酶活为响应值,利用Design-Expert 8.0软件中的Box-Benhnken中心组合设计29组实验,将实验数据进行多元回归方程拟合后得到的二次回归方程预测模型如下:
对所得到的回归方程预测模型进行方差分析及显著性检验,如表8所示,可以看出模型F=14.64,P<0.000 1,回归模型达到极显著,并且模型的失拟项P=0.785 9>0.05,表现为不显著,模型的决定系数R2=95.14%,说明此模型拟合度高,能够很好的分析预测复合菌系发酵产纤维素酶的最优发酵条件。另外,根据表9中各因素的F值和P值的大小可以得出它们对复合菌系产纤维素酶活性的影响顺序为:温度(A)>时间(C)>pH(D)>接种量(B)。

表9 回归模型方差分析Table 9 Variance analysis of the regression equations
2.5.2 变量交互作用的显著程度 响应面曲线图可以直观地反映出任意两个变量的交互作用对响应值的影响,根据表8绘制响应面曲线图(图4),以进一步分析筛选复合菌系最优发酵条件。由图4-a-c可知,当温度保持不变时,CMCase酶活值随着时间的增加而增加,随着接种比例和pH的增加均表现为先增加后降低的趋势,而其它因素保持不变时,随着温度的升高,纤维素酶活先增加后降低。结合曲面的倾斜程度以及方差分析结果可以看出,温度与时间之间的交互作用对酶活的影响显著,而温度与接种比例、温度与pH之间的交互作用对酶活的影响不显著。
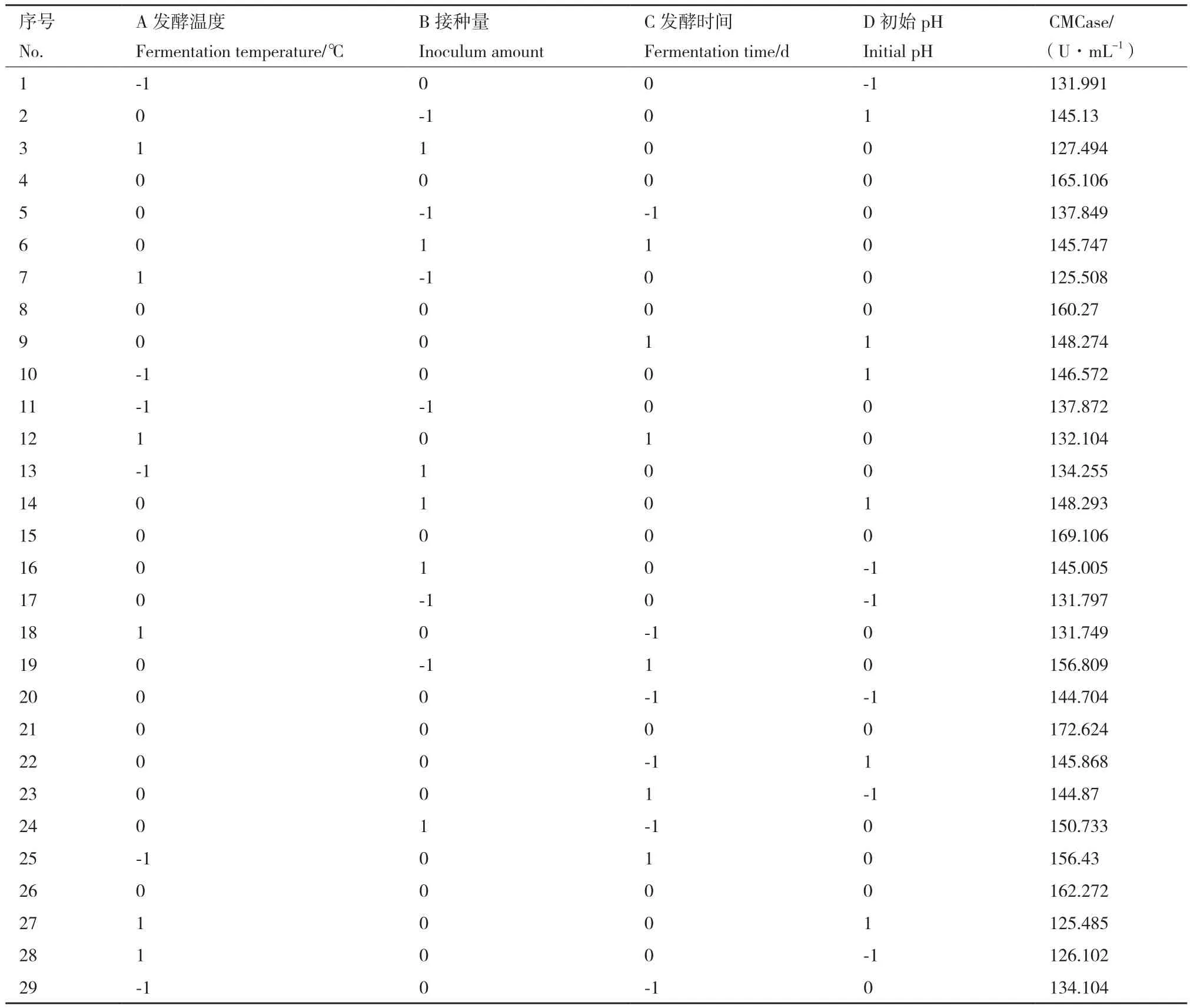
表8 响应面试验结果Table 8 Results of response surface experiments
同理,由图4-d-f可知,CMCase酶活值随着接种比例的增加呈先增加后小幅度降低的趋势,随时间的增加而增加。当pH保持不变时,酶活随接种比例的增加先增加后降低,随时间的增加呈小幅度的增加后缓慢降低,当接种比例与时间保持不变时,酶活随pH的增加均表现为先增加后降低的趋势。相对于图4-e和图4-f,图4-d倾斜度较高,同时结合方差分析结果可以看出,接种比例与时间之间的交互作用对酶活的影响显著,而pH与接种比例、时间与pH之间的交互作用对酶活的影响不显著。

图4 各因素交互作用的响应面图Fig.4 Response surface diagram of the interactions among various factors
2.6 复合菌系最佳发酵条件的确定及模型验证试验
由各因素交互作用的响应面曲线图可以看出此响应面存在最大值,通过Design-Expert 8.0软件进行分析,得到复合菌系HD最优发酵条件为:温度33.98℃、接种量4.93%、时间6.37 d和pH 7.17,在此条件下培养复合菌系,可以得到最大纤维素酶活的预测值为167.31 U/mL。考虑到实际操作的条件,将最优发酵条件调整为:温度34℃、接种量5%、时间6 d和pH7.2。在此条件下进行验证实验,测得纤维素酶活实际值为164.21 U/mL,与优化前(图1)相比,提高到原来的1.90倍。实际值和预测值相差很小,说明该模型拟合度高,并且准确可靠。
2.7 复合菌系降解玉米秸秆的效果评价
为了明确构建的复合菌系HD对玉米秸秆降解的有效性,进行了为期7 d的液态发酵实验,并且考虑到实际应用,同时也进行为期15 d的固态发酵实验,采用失重法考察复合菌剂HD对玉米秸秆的降解效率,结果如图5所示。复合菌剂HD处理过的秸秆降解率显著高于单菌处理过的秸秆。液态发酵实验中,混菌HD处理过的秸秆降解率为47%,相对于对照组提高了35%,相较于单菌W1、W8、W10和W11分别提高了21.67%、18.33%、7.33%和12.67%;固体发酵实验中,混菌HD处理过的秸秆降解率为63.6%,相对于对照提高了56.6%,相较于单菌W1、W8、W10和W11分别提高了44.1%、35.5%、9.3%和6.6%。以上结果表明,复合菌剂HD对秸秆有明显的降解效果。

图5 玉米秸秆液态和固态发酵结果Fig.5 Results of liquid and solid fermentation of corn straw
3 讨论
当前,全球环境治理面临挑战,我国作为农业大国,秸秆资源化利用势在必行[23-24]。其中生物法处理秸秆是一项重要的举措。由于单一菌株酶活性较弱、降解效率低等问题,高效降解纤维素复合菌系的构建在秸秆资源化利用中就显得尤为重要。
复合菌系的构建是一个复杂的过程,培养基成分以及发酵条件的优化是构建复合菌系发酵体系不可或缺的一部分[25-26]。目前微生物产酶培养基和发酵条件的优化大多数采用单因素实验结合正交试验或响应面实验,可以快速准确地得到优化条件。冯红梅等[27]从堆肥中筛选出6株纤维素降解菌,通过复配制成复合菌系M-1,发酵条件优化后纤维素酶活最高可达135.9 U/mL,产酶能力提高了1.8倍。菌种来源的选择对于复合菌系的构建也是一个重要的条件。Li等[28]从腐烂的玉米秸秆中筛选出纤维素降解菌并构建复合菌ADS3应用于秸秆还田,7 d后纤维素酶活高达252.8 U/mL,对秸秆降解作用明显。崔宗均等[29]从堆肥中筛选出4组混菌,经过混合培养成1组高效纤维素降解菌群,培养1 d后纤维素酶活最大,达到122.3 U/mL,对纤维素类物质具有较强的分解能力。本试验将来源于长期秸秆还田的土壤及堆肥中的4株菌组合构建出高效复合菌系HD,对其培养基及发酵条件进行优化后,纤维素酶活高达164.21 U/mL,显著高于优化前酶活,在以上研究中处于中等水平。显然,培养基成分及发酵条件的优化对于微生物酶活性的提高依旧是一种有效的手段。
温度是影响微生物的重要因素[30-31]。Qing等[32]成功构建了适应低温的玉米秸秆降解菌群GF-20,在10℃条件下发酵15 d后玉米秸秆降解率为32%。萨如拉等[33]构建了1号和8号两组复合菌系,在15℃条件下培养,15 d后玉米秸秆降解率分别达到30.21%和32.21%。而本研究构建的复合菌系HD在35℃时酶活性最大,具有一定的耐高温性能,可以用作秸秆堆肥微生物降解菌剂,提高其产品附加值。复合菌系HD在35℃的条件下,经过液态发酵和固态发酵后,对玉米秸秆的降解率分别为47%和63.6%,相对于上述研究,降解效果较好。在发酵过程中,纤维素酶不仅是产物,也是纤维素水解的催化剂,除了温度外,溶氧量和pH对于微生物发酵产纤维素酶也极为重要。溶氧量的大小取决于接种量的多少,接种量过大时,微生物生长过快,发酵体系溶氧不足,导致微生物活性和产酶速度降低;接种量过少,微生物生长缓慢,产酶速度同样会下降[34]。本实验中复合菌系在5%接种量的条件下酶活最高,显著高于1%接种量和6%接种量条件下的酶活。pH是微生物发酵产酶过程中一个重要的控制因素,很早就有学者通过优化pH来提高纤维素酶活[35-36]。有研究表明,pH的大小会影响纤维素酶活性部位上相关基团的解离,在最适pH的条件下,活性部位上的解离程度最适合酶与底物结合发挥作用,高于会低于最适pH都会降低纤维素酶的分解能力[37]。另外,耿冰等[38]通过研究pH对绿色木霉(Trichoderma viride)发酵产纤维素酶活的影响发现,纤维素酶活发生变化的一个重要原因就是pH改变了纤维素酶的构象。本研究中复合菌系HD最适pH值为7,当pH增大或减小时,纤维素酶活明显降低。并且在不同营养成分条件下纤维素酶最适pH也不同。杨振德等[39]对苍白杆菌属进行初始pH条件优化,以酵母膏为氮源,pH为6时纤维素酶活性最高,而以酒石酸铵为氮源,pH为7时纤维素酶活最高。由此可见,优化发酵条件前先优化培养基成分是提高纤维素酶活的一种比较合适的方式。
综上所述,复合菌系HD具有较强的玉米秸秆降解能力,这对高效降解秸秆复合菌剂的研制开发具有一定的指导意义,但在构建的过程中尚未探究微生物之间的协同机制,下一步将对4株菌之间的相互作用机制进行研究,研制和开发高效玉米秸秆降解复合菌剂,并加以推广应用。
4 结论
通过对4株玉米秸秆降解菌之间相互组合构建了不同复合菌系,以纤维素酶活指标,确定了最佳复合菌系HD。优化后的复合菌系产纤维素酶活为164.21 U/mL,是优化前的1.9倍。复合菌系HD处理过的玉米秸秆降解率分别达到了47%和63.6%,显著高于对照组和单菌。研究结果表明复合菌系HD具有较强的产纤维素酶和降解秸秆能力。
