二倍体马铃薯中SCFSLF复合体的组分分析
2022-06-09高蒙李富婷魏湛林张赛行白如仟尚轶马玲
高蒙 李富婷 魏湛林 张赛行 白如仟 尚轶 马玲
(1.云南师范大学生命科学学院,昆明 650500;2.云南师范大学能源与环境科学学院,昆明 650500)
植物繁殖方式的差异,对维持植物遗传多样性有着不同的影响。自交不亲和(self-incompatibility,SI)是一种广泛存在的遗传机制,可以有效地阻止自交促进杂交,对于维持物种基因型多样性有着重要作用[1]。自交不亲和表现为在受精过程中,雌蕊排斥自身或近缘植物花粉,但接受非自身花粉。植物自交不亲和是由雌雄蕊之间的相互作用控制的,根据雌雄识别部位的世代类型不同,植物自交不亲和性可分为配子体型自交不亲和(gametophytic self-incompatibility,GSI)和孢子体型自交不亲和(sporophytic self-incompatibility,SSI)[2]。 在 GSI植物中,雌雄蕊的识别部位是花粉管,花粉管作为配子体世代,故而得名。而SSI雌雄蕊在柱头识别,柱头是孢子体器官,因此被命名为孢子体型自交不亲和。GSI 和SSI均由一个具有高度多态性的基因座控制,被称为S-基因座(S-locus)[3]。S-基因座中至少包含两类独立的基因:一类编码雌蕊特异性基因,另一类编码雄蕊特异性基因[4]。在GSI的受精过程中,只有携带与雌蕊完全不同的S基因型的花粉才能萌发[5],如果单倍体花粉的S单倍型与二倍体雌蕊中的两个S单倍型之一相匹配,花粉也将被排斥导致受精失败[3]。车前科(Plantaginaceae)、茄科(Solanaceae)和蔷薇科(Rosaceae)等物种的自交不亲和均属于配子体型自交不亲和。罂粟科的虞美人(Papaver rhoeas)也属于配子体型自交不亲和,但其分子机制是不同的[6]。
在GSI植物中,S基因座上的雌蕊特异性因子编码了一类核糖核酸酶,被称之为S核酸酶(S-RNase),而雄蕊特异性因子编码了一类F-box蛋白,被称为SLF(S-Locus F-box)或SFB(S-haplotype-specific F-box)[7]。授粉后,当花粉管延伸至花柱中,花柱中的S-RNase进入到花粉管[8-9]。S-RNase具有细胞毒性作用,能够降解花粉管中的rRNA,并影响花粉管的细胞骨架[10],最终造成花粉管细胞死亡,导致受精失败[11-12]。而SLFs能够识别并降解非自身的S-RNase,解除其细胞毒性作用,从而使得杂交可以亲和[13]。SLF是一类F-box蛋白,包含有一个 F-box基序,能形成SCFSLF复合体,行使E3泛素连接酶的作用,通过26S蛋白酶体来实现对S-RNase的降解[13]。
SCF复合体是多亚基E3泛素连接酶中的一类,保守的SCF复合体由F-box、Skp1、Cullin1及Rbx1组成(图1)。其中Cullin1分子量较大,作为支架蛋白,其N端和C端分别与Skp1和Rbx1结合[14-15],Skp1通常作为连接F-box和Cullin1的接头亚基,植物中存在多种Skp类蛋白Skp1-Like[16],Rbx1则介导E2与E3的连接,其结构较为保守。F-box蛋白家族数量庞大,但均具有一个由50 个氨基酸左右形成的结构域,因这个结构域最早在周期素 F 中发现,故而被命名为F-box结构域,在SCF复合体中决定了底物识别的特异性[17]。已有研究表明,在GSI植物的花粉管中,SLFs蛋白可能通过其F-box结构域与Skp1类蛋白结合,再经由Skp1蛋白连接在Cullin1上组成了SCFSLF复合体,而另外的结构域则能够与特定类型的S-RNase蛋白相互作用,进而介导了被识别的S-RNase的泛素化降解[18-19]。在茄科作物中,S基因座内包含有不同数量的SLF基因,例如在矮牵牛(Petunia inflata)中包含有16-18种SLF基因,与Skp1类蛋白PiSSK1、花粉特异性的Cullin1(PiCUL1-P)和保守的Rbx1(PiRbx1)等亚基共同组成 SCF复合体[20-21]。SLF蛋白能够有效识别并降解非自身的S-RNase蛋白,却不能降解自身的S-RNase[22-23],因此茄科作物普遍存在自交不亲和而杂交亲和的现象。

图1 典型 SCF复合体模式图Fig.1 Typical structural pattern of SCF complex
二倍体马铃薯是典型的GSI植物,存在严重的自交不亲和以及较为普遍的杂交不亲和现象。随着二倍体马铃薯育种计划的推广,针对其自交不亲和以及杂交不亲和的研究就显得尤为重要,为了研究二倍体马铃薯自交不亲和及部分杂交不亲和的调控机制,首先需要对二倍体马铃薯花粉管中的SCFSLF复合体进行组分分析。为了鉴定马铃薯中的SCFSLF复合体,采用了同源比对获得了候选基因的信息,进一步验证了各组分蛋白间的互作,初步获得了马铃薯花粉管中SCFSLF复合体的组分信息,为二倍体马铃薯杂交育种工作提供关键信息。
1 材料与方法
1.1 材料
植物材料为种植于云南昆明的二倍体马铃薯E172。获取植物材料花粉、雄蕊、雌蕊、花瓣、叶子、萼片、块茎于液氮速冻后,保存在-80℃超低温冰箱。
1.2 方法
1.2.1 同源比对 为了确定马铃薯中的SCFSLF复合体的组成成分,采用同源比对的方法,在Phytozome网站上的马铃薯DM v6.1的基因组数据中利用同属于茄科的矮牵牛(Petunia inflata)中的Skp1的类蛋白 PiSSK1(JF429902.1)、PiCUL1-P(KF551593.1)、PiRBX1(DQ250021.1)序列进行 Blast分析[4]。
1.2.2 生物信息学及进化分析 首先从 NCBI数据库网站(https://www.ncbi.nlm.nih.gov)下载了膨大矮牵牛(Petunia inflata)、杂交矮牵牛(Petunia hybrida)、金鱼草(Antirrhinum hispamicum)、梨(Pyrus bretschneideri)、苹果(Malus domestica)、百合(Lilium longiflorum)、橘(Citrus reticulata Blanco)、李(Prunus tenella)这8个物种中已克隆到的SCFSLF复合体成分对应蛋白序列[5,13,19,24-30]。然后利用 ClustalW软件进行蛋白序列的比对,之后用ESPript 3.0和MEGA软件进行蛋白序列作图及进化树构建。
1.2.3 总RNA 的提取和第一链 cDNA合成 参照天根生化科技有限公司的植物总 RNA 提取试剂盒说明书提取马铃薯花粉、雄蕊、雌蕊、花瓣、叶子、萼片和块茎各部位的总 RNA。再利用TaKaRa公司的PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒对样品RNA进行反转录,合成相应的cDNA片段。
1.2.4 qRT-PCR 表达差异分析 利用同源比对所得同源基因序列设计特异性荧光定量引物见表1,以马铃薯的EF1α基因为内参基因。反转录后各部位的cDNA 稀释 5倍后作为模板,反应体系为 20 μL,在STEPONE PL实时荧光定量qPCR仪上进行荧光定量。
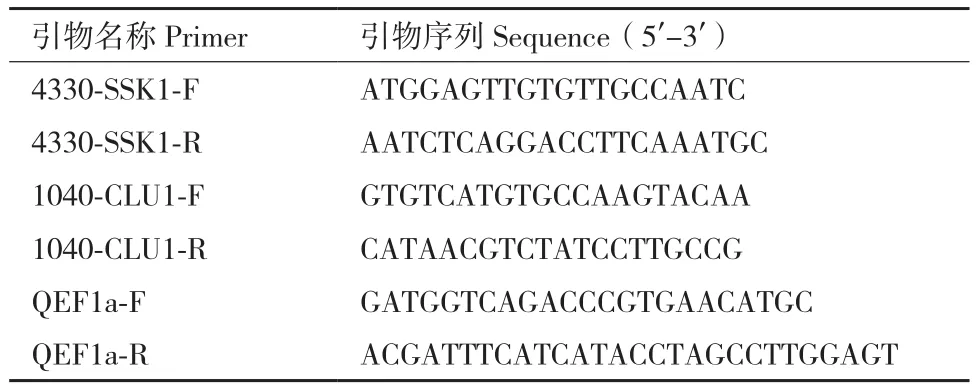
表1 马铃薯SSK1与Cullin1荧光定量引物Table 1 Fluorescent quantitative primers for SSK1 and Cullin1 in potato(S.tuberosum)
1.2.5 酵母双杂交蛋白互作实验 用同源重组的方法(南京诺唯赞无缝克隆试剂盒)构建SLF-pGBKT7载体和SSK1- pGADT7,并通过PCR菌检筛选出阳性菌液送测序,序列比对正确的菌液用天根质粒小提试剂盒提取重组质粒。经毒性检测和自激活验证后将SLF-BD和SSK1-AD质粒共转化进菌株感受态中,转化后的酵母菌液涂布于缺陷型培养基上二缺(SD/-Trp/-Leu)和三缺(SD/-Trp/-Leu/-His)后倒置于30℃恒温箱中培养3-5 d后观察结果,对三缺培养基中的菌斑鉴定后,于四缺(SD/-Trp/-Leu/-His/-Ade)培养基中进行点板验证。正如文中图示酵母结果独立地重复实验至少 3 次,结果一致。酵母菌株为 Y2H Gold,猎物载体为pGADT7,诱饵载体为 pGBKT7,阳性对照为 pGBKT7-53和 pGADT7-T,阴性对照为pGBKT7-Lam和 pGADT7-T。
1.2.6 烟草瞬时表达实验 首先将Soltu.DM.11G004330(SSK1)的基因编码区域去除终止密码子后克隆到pCAMBIA1301-nLUC中(nLUC-4330),同时构建SLF的pCAMBIA1301-cLUC-SLF载体(cLUC-SLF)。然后将每个重组质粒载体转化到农杆菌GV3101菌株中,转化后的菌株在28℃含卡那霉素(50 mg/L)和利福平(50 mg/L)的LB培养基中生长。培养至菌液OD600为0.8,然后3 000 r/min离心5 min,再悬浮于1 mol/L MgCl2、0.1 mol/L乙酰丁香酮和 0.5 mol/L MES的渗透缓冲液中,使得最终OD600值为0.6。缓冲液孵化菌株2-4 h后可进行共注射,用无针注射器注射cLUC-SLF和nLUC-4330的菌株混液,并使之渗透到完全展开的4周龄的烟草叶片中。渗透后,植株在黑暗下生长8 h,36-72 h后观察荧光结果。利用Tanon凝胶成像系统观察烟草中蛋白互作的结果,需要在叶片注射的位置上涂抹萤火虫荧光素酶底物,在黑暗处理5 min后,观察捕获的化学发光信号。
2 结果
2.1 SCFSLF复合体组分的同源比对
如表2所示,二倍体马铃薯DM中,PiRBX1在DM中的同源基因只有1个,是位于6号染色体上的Soltu.DM.06G022320,且Rbx1相对保守,在SCF复合体的研究中主要集中在Skp1和Cullin1上。而PiCUL1-P和PiSSK1的同源基因分别有10个和6个。PiSSK1的同源基因有4个分布在11号染色体上,1号和10号染色体上也各有1个。PiCUL1-P的同源基因在1号和9号染色体上分别有4个,6号染色体上2个。

表2 二倍体马铃薯DM中SCFSLF复合体组分的同源比对Table 2 Homologous comparison of SCFSLF complex components in diploid potato DM
2.2 同源基因的系统进化、蛋白序列与表达量分析
本研究对同源蛋白与植物中已克隆的SCFSLF复合体对应成分的蛋白组分进行了序列分析,如图2-A所示,植物中已克隆的SSK1蛋白位于一个大分支内,在这个分支内,蔷薇科的SSK1蛋白与茄科中的SSK1蛋白分别形成了两个独立小分支,而马铃薯中的Soltu.DM.11G004500和Soltu.DM.11G004300位于蔷薇科的SSK1小分支内,Soltu.DM.11G004330(缩写为11G004330)位于茄科的小分支。如图2-B所示,蔷薇科分支与茄科分支的F-box binding site基本类似,但是两个分支在cullin binding site出现了明显差异,这可能也暗示了cullin蛋白在两个分支内也会出现差异。值得注意的是位于茄科分支的11G004330蛋白,这个蛋白极有可能参与了马铃薯中SCFSLF复合体的形成。为验证11G004330蛋白是否参与马铃薯中SCFSLF复合体的形成,我们检测了11G004330在马铃薯不同部位内的表达水平。如图2-C所示,11G004330基因在花粉中特异性表达,这也符合在矮牵牛中发现的SCFSLF复合体中SSK1组分只在花粉中特异性表达的事实。因此马铃薯中Soltu.DM.11G004330基因可能就是SCFSLF复合体中的SSK1组分。
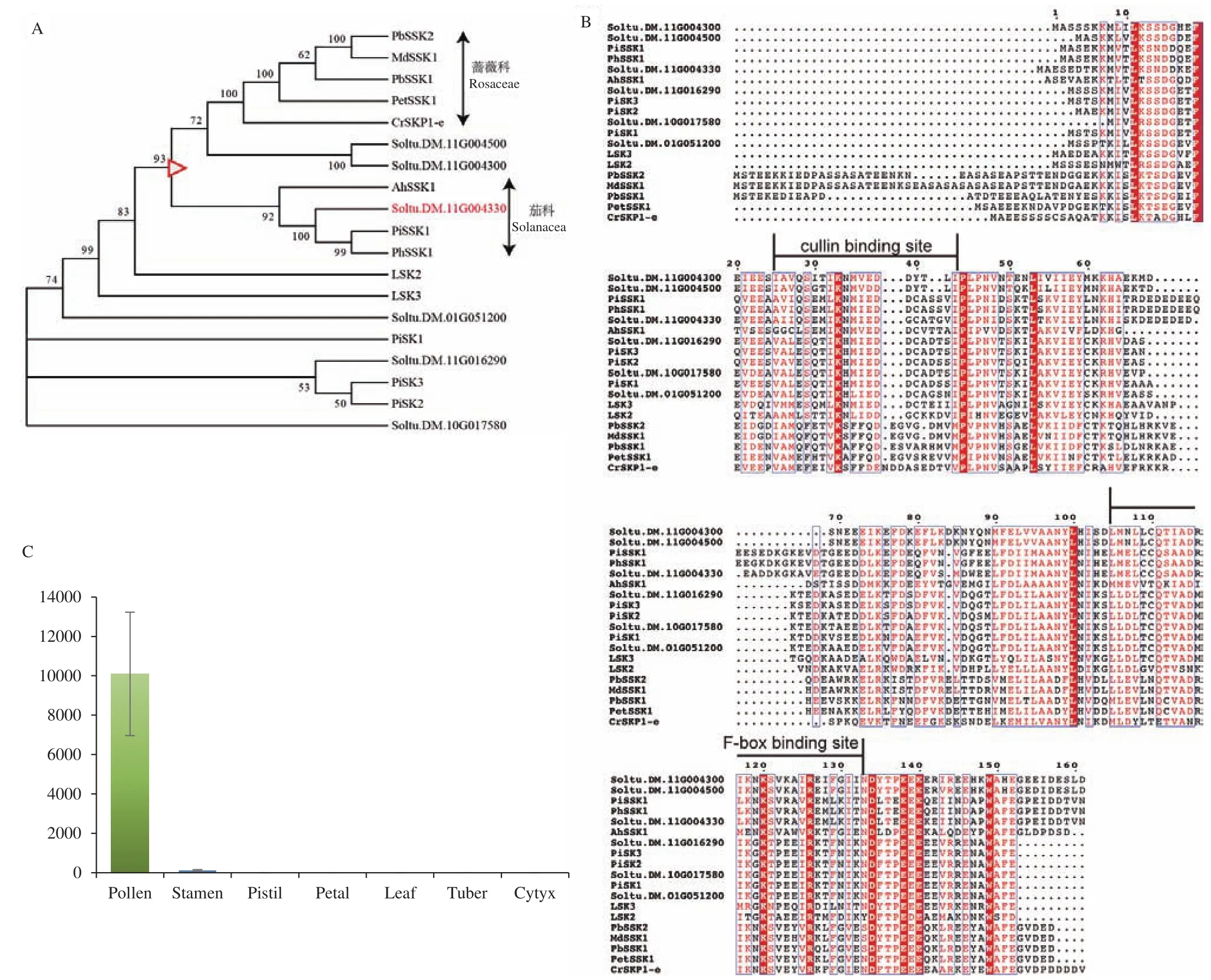
图2 SSK1蛋白序列与表达量分析Fig.2 SSK1 protein sequence and expression analysis
类似地,我们对SCFSLF复合体中的Cullin1组分进行了进化树、蛋白序列、表达量的分析。如图3-A所示,Cullin1蛋白在最小分支处,确实出现了茄科和蔷薇科的分离,而Soltu.DM.06G001040与矮牵牛中的Cullin1蛋白同处一个小分支,定量结果(图3-B)显示06G001040在马铃薯花粉中特异性表达。此外,对马铃薯中的Cullin1蛋白进行多序列比对后发现该基因具有高度保守性(图4),因此马铃薯中Soltu.DM.06G001040基因可能就是SCFSLF复合体中的Cullin1组分。

图3 Cullin1蛋白进化与表达量分析Fig.3 Cullin1 protein evolution and expression analysis

图4 马铃薯Cullin1蛋白的多序列比对Fig.4 Multiple sequence alignment of Cullin1 protein in potato
2.3 马铃薯SSK1蛋白与SLF蛋白有互作关系
根据现有研究,在矮牵牛与金鱼草中,SSK1(SLF-interacting Skp1-like1)蛋白是SCFSLF复合体与SLFs蛋白发生反应的接头,为验证与PiSSK1、PhSSK1和AhSSK1同处于一个分支上的Soltu.DM.11G004330是否确实是马铃薯中的SSK1蛋白,并在马铃薯SCFSLF复合体是否发挥类似作用,我们利用酵母双杂交和荧光素酶互补实验验证了SLF蛋白与Soltu.DM.11G004330蛋白之间是否存在直接互作。如图5所示,我们选取了马铃薯中的一种SLF蛋白用于酵母双杂实验。酵母双杂交结果和荧光素酶互补实验都证实了Soltu.DM.11G004330与SLF存在直接互作。这说明我们前期的分析结果是可靠的,Soltu.DM.11G004330蛋白确实可能是SCFSLF复合体中的接头亚基,与SLF蛋白直接互作。

图5 Soltu.DM.11G004330蛋白与SLF蛋白的互作分析Fig.5 Interaction analysis of Soltu.DM.11G004330 and SLF
3 讨论
茄科、车前科和蔷薇科中,花粉管中的SCFSLF复合体是雌雄识别的分子基础,借助于SLF这一亚基,SCFSLF能够有效识别并降解非自身的S-RNase蛋白,但不能识别自身的S-RNase,从而形成了自交不亲和而杂交亲和的繁殖方式[22-23]。但是二倍体马铃薯中存在较为普遍的杂交不亲和现象,已有研究结果表明S-RNase在茄科植物的杂交不亲和中也起着一定作用,但具体作用未知,SCFSLF在二倍体马铃薯杂交不亲和中是否起作用也是未知的。为了深入研究二倍体马铃薯中因雌雄识别所造成的亲和与否的分子机制,首先需要准确鉴定二倍体马铃薯中的SCFSLF复合体的组成成分,在此基础上才能进一步研究SCFSLF复合体在雌雄识别中的具体作用机制,为育种实践中打破自交不亲和及杂交不亲和提供理论指导。
在GSI植物中,例如矮牵牛、百日草、苹果、梨、砂糖橘及扁竹桃等,SCFSLF的组分信息已有报道,为了快速获得二倍体马铃薯中的SCFSLF的组成成分,我们首先采用了同源比对的方式,初步确定了各亚基在马铃薯中的同源基因信息。虽然同源比对是寻找具有相似功能的靶标基因的一种有效方法,能够迅速确定候选基因的范围,但是同源比对通常会获得大量的同源基因信息,一般情况下很难仅通过同源比对就获得准确的候选基因,还需要进一步验证。因此本研究在同源比对的基础上,又结合了蛋白序列保守性及进化树分析,初步确定了候选基因,并借助于qRT-PCR确定了候选基因的表达方式,利用酵母双杂交和荧光素酶互补实验初步验证了亚基间的互作。我们发现在二倍体马铃薯中,SCFSLF中的SSK1,Cullin1和SLF均只在花粉中表达,这同前人的发现一致,这也暗示植物体中的SCFSLF可能是有性生殖后才开始形成的,且只在雌雄识别中起作用,SCFSLF的进化对于植物的繁殖过程有着重要意义。本研究只是初步确定了二倍体马铃薯中的SCFSLF的组分,至于这些亚基所组成的复合体是否真的行使雌雄识别功能还需要进一步验证,但本研究为进一步揭示SCFSLF复合体在二倍体马铃薯中的功能研究奠定了基础。下一步我们将开展该复合体在雌雄识别中的作用研究,为最终解决二倍体马铃薯育种中面临的自交不亲和以及杂交不亲和提供分子基础。
4 结论
本研究从进化、蛋白序列和表达量方面对马铃薯SCFSLF复合体组分进行研究分析,马铃薯花粉管中的SCFSLF复合体可能是由Soltu.DM.06G001040,Soltu.DM.11G004330,Soltu.DM.06G022320以及 SLF蛋白组成的。其中Soltu.DM.06G001040行使Cullin1蛋白的功能,Soltu.DM.11G004330作为SSK1,起着连接Cullin1和SLF蛋白的作用,而Soltu.DM.06G022320是其中的RBX1组分。
