MRI扩散加权成像对肺内病变定性诊断的临床运用及病理对照分析*
2022-06-09董兴祥龙张刘一帆丁莹莹胡早秀
封 俊 董兴祥 陈 龙张 莹 刘一帆 丁莹莹胡早秀
1.昆明医科大学第三附属医院(云南省肿瘤医院)放射科 (云南 昆明 650018)
2.昆明医科大学第三附属医院(云南省肿瘤医院)病理科 (云南 昆明 650018)
低剂量CT肺癌筛查取得了实质性成果,但仍然面临挑战,包括大量的良性结节检出,较高的假阳性率,对筛查出的肺内结节作出明确的风险评估及随访复查建议等问题。为克服这些问题,人们要求有效检测肺癌的辅助检测方式,它既要无创用于早期检测,也具有较好的定量指标和可重复性,并具备更多的敏感度和特异性。磁共振扩散加权成像技术DWI也已经被应用到对全身肿瘤及肺癌评价中,本文运用MRI检查及扩散加权成像技术对LDCT筛查检出阳性结节进行评估及鉴别诊断,探讨MRI扩散加权成像影像征象(DWI信号、ADC值等)与肺结节良恶性相关性,评估不同病理类型肿瘤的影像特点,为临床提供更多可靠信息,并进一步指导临床做出合理、正确的处理。
1 资料与方法
1.1 临床资料本组前瞻性收集2015年7月至2019年6月本院经手术、穿刺病理证实的肺内结节病变,对47例肺内检出病变进行胸部MRI扫描及扩散加权成像检查,回顾分析经手术、纤支镜及病理证实的肺内病变的临床、病理资料。47例病患均为单发病变,10例为良性病灶(3例错构瘤、6例炎性肉芽肿病变、1例节细胞神经瘤),37例为恶性肿瘤(19例鳞癌、16例腺癌、2例小细胞肺癌),上述肺内病灶大小0.7cm×0.5cm~11.4cm×8.7cm;男32例,女15例,年龄段为38~76岁,平均年龄56.7岁;35例病变因体检发现肺部病变,12例因胸部不适或呼吸道症状就诊发现病变,病程1周~6个月。
1.2 影像检查方法
1.2.1 扫描技术方法 MR扫描设备:Seimens avanto 1.5T磁共振扫描仪,扫描方法:全部患者采取仰卧位头先进,常规M R I胸部扫描方法:轴位T1WI:层数:35,层厚:4mm,层间距:0.8mm,FOV:380mm×350mm,TR/TE/平均激励次数:4.09ms/2.26ms/1; 矩阵:256×224;带宽:610Hz。轴位T2WI:层数:35,层厚6mm:20%,层间距1.2mm,FOV:380mm× 350mm,TR/TE/平均激励次数:3500ms/74ms/1,矩阵:320×224,带宽:284Hz。
冠状T2WI扫描采用T2haste序列:扫描层数:30,每层厚:6mm,FOV:480mm×480mm,TR/TE/平均激励次数:600ms/30ms/1,矩阵:320×224,带宽:651Hz。DWI应用EPI图像序列:层数:30,层厚:6mm,层间距:1.2mm,FOV:380mm×350mm,TR/TE/平均激励次数:3800ms/71ms/2,矩阵:192×156,带宽:1736Hz。通过呼吸引擎回波技术实现扫描:分2个b值(50、800s/mm)。
1.2.2 数据分析 由胸部诊断组专业放射科医生,在影像工作站及 PACS 系统专用监视器上观看图像,记录结节的位置、大小、信号(T1WI、T2WI)、DWI信号及ADC值(多点测量取最低值)、边缘情况及伴随征象(如胸膜“凹陷”征等)、距肋胸膜的距离;同时观察肺及扫描野内其它器官的情况,结合CT影像特征对其良、恶性做出初步定性诊断。之后随访病例,对其手术或纤支镜病理结果回顾性分析研究其影像特点,对照良恶性病变间MR影像特点、在肺良恶性病变鉴别中的价值及DWI信号特征及ADC值差异是否有统计学意义。
1.2.3 病理评估 由病理科肺癌亚专业组高年资医师在物镜10倍,目镜4倍对病理切片直径约5.5mm肿瘤区域进行肿瘤细胞密集程度判定及计数,研判该同样视野内良恶性肿瘤的密集程度及周围组织排列情况。
2 结 果
2.1 病例基本情况47例病患均为单发病变,10例为良性病灶(3例错构瘤、6例炎性肉芽肿病变、1例节细胞神经瘤),37例为恶性肿瘤(19例鳞癌、16例腺癌、2例小细胞肺癌),上述肺内病变大小0.7×0.5cm至11.4×8.7cm,T1WI多呈等或低信号,T2WI呈高或稍高信号,扩散加权多呈45例高信号或稍高信号。
2.2 病例ADC值良性病灶组ADC值(1.27±0.23)×10-3mm2/s,恶性病灶组ADC值(0.81±0.18)×10-3mm2/s;鳞癌组(19例)平均ADC值0.74×10-3mm2/s,腺癌组(16例)平均ADC值0.90×10-3mm2/s,小细胞肺癌组(2例)平均ADC值0.58×10-3mm2/s,炎性病灶组(6例)平均ADC值1.14×10-3mm2/s,错构瘤组(3例)平均ADC值1.49×10-3mm2/s,节细胞瘤(1例)ADC值1.32×10-3mm2/s。
2.3 数据分析结果上述数值进行了统计分析,在单因素分析中,采用χ2检测,患者年龄、性别、病灶形态、位置等与病变ADC值均无关联,P>0.05;病变的良、恶性程度与ADC值存在着关联,χ2=27.1,P<0.001(见表1);在多因素分析中,只有病变良、恶性与ADC值相关,P<0.001。在恶性肿瘤中不同病理类型病灶的ADC值开展组内对比,鳞癌与腺癌、鳞癌与小细胞癌、腺癌与小细胞癌,组内两两对比其ADC值的差异并无统计意义,P>0.05。
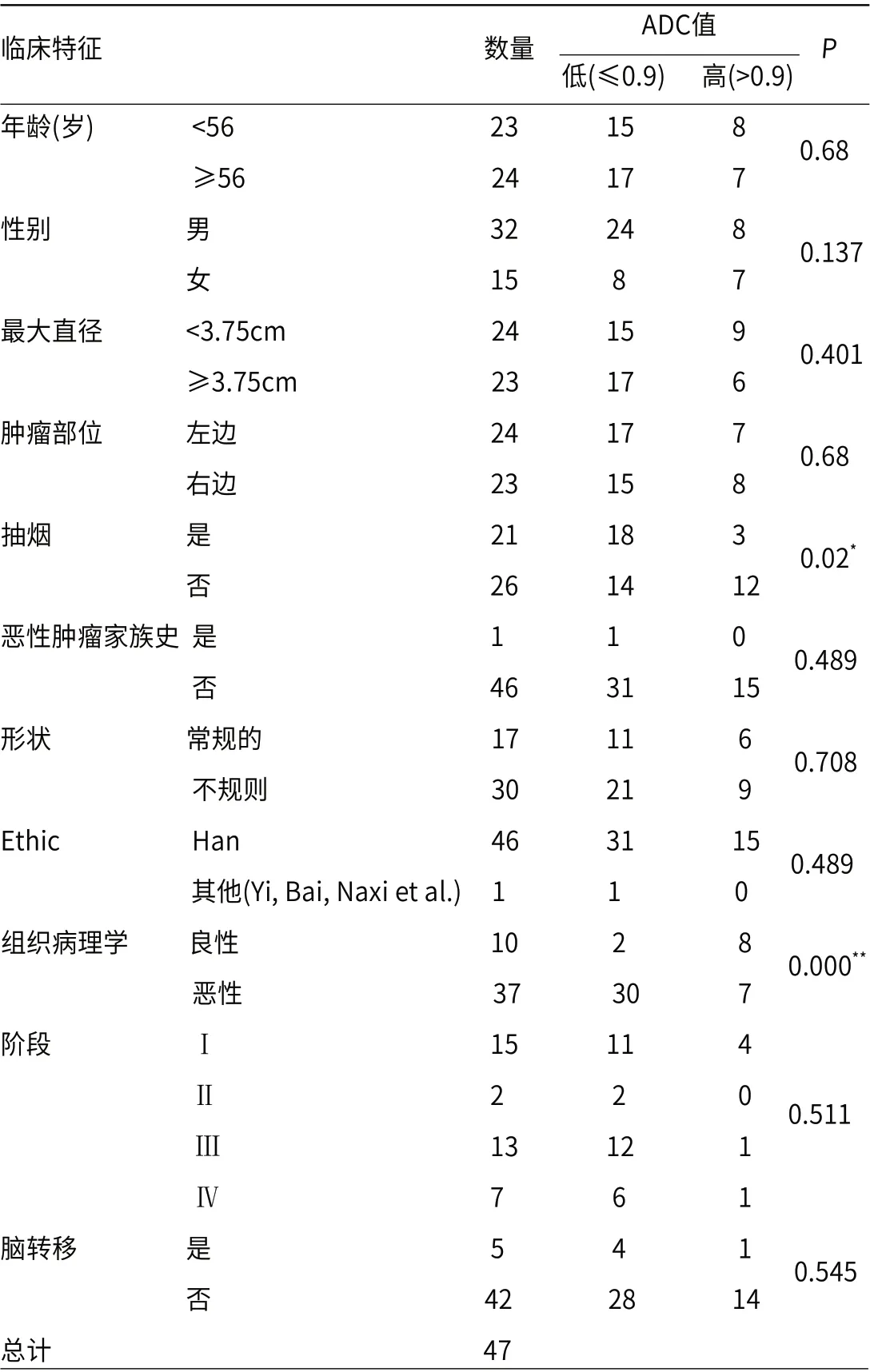
表1 肺结节临床参数及ADC值
2.4 病理对照结果腺癌、鳞癌、小细胞癌病例组病变内细胞密集度平均值分别为79.4%、62.1%、50%,良性病变组病变内细胞排列、密集程度均低于肺癌组;腺癌病例组在物镜10倍,目镜4倍对病理切片直径约5.5mm肿瘤区域视野下肿瘤细胞密集程度较高,接近80%,但周围散在分布含气组织及细小支气管及肺泡结构;鳞癌病例组在同样视野下肿瘤细胞密集程度平均在60%以上,但肿瘤细胞周围分布大量密实的纤维基质,肿瘤细胞周围密实程度较高;小细胞肺癌组细胞密实程度及周围结构大致同鳞癌;炎性病变区同样视野下大量炎性细胞浸润,结构松散,周围含气含液成分较多;错构瘤病例组同样视野下见黏液变纤维及脂肪、软骨成分,周围结构松散,含气组织较多;节细胞瘤同样视野内排列类似错构瘤,除了肿瘤细胞,周围也表现为结构松散,含气组织较多。
2.5 病例分析典型病例影像分析见图1~图2。
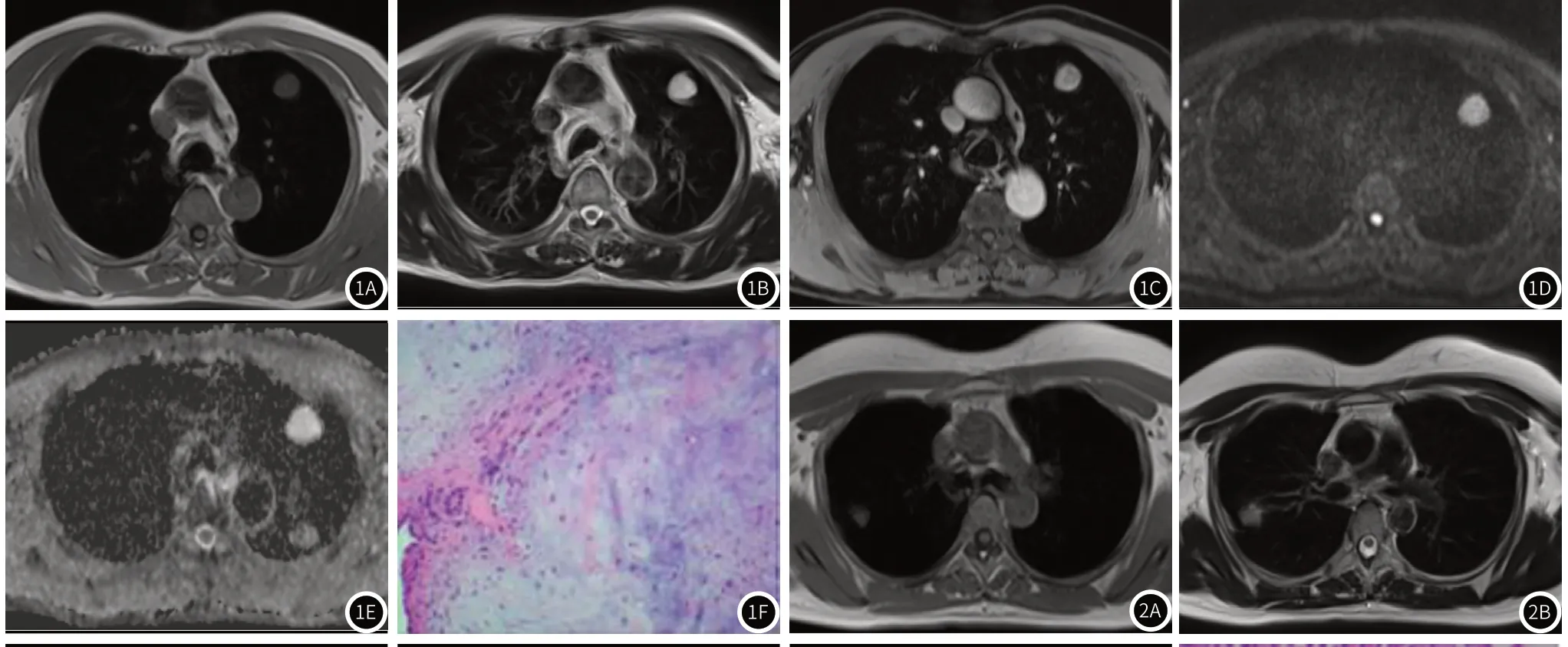
图1 病例1,男 69岁,左肺上叶前段错构瘤,MRI平扫T1WI低信号(图1A),T2WI高信号(图1B),扩散加权成像呈高信号(图1D),ADC图呈高信号,扩散不受限,ADC值1.51×10-3mm2/s(图1E),增强轻度强化(图1C),病理图片显示病变区散在黏液变纤维及脂肪、软骨成分,周围结构松散,含气组织较多(图1F)。
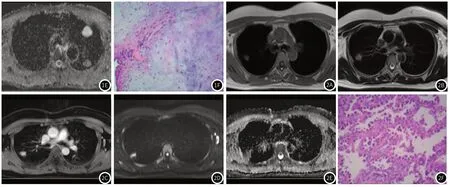
图2 病例2,女 62岁,右肺上叶后段浸润性腺癌,MRI平扫T1WI低信号(图2A),T2WI稍高信号(图2B),扩散加权成像呈高信号(图2D),ADC图呈低信号,扩散受限,ADC值0.87×10-3mm2/s(图2E),增强明显强化(图2C),病理图片显示病变区肿瘤细胞密集程度较高,接近80%,周围散在分布含气组织及细小支气管及肺泡结构(图2F)。
3 讨 论
近30年来,中国肺癌的发生率及死亡比率都呈现持续上升的趋势,肺癌也已成为中国首位恶性肿瘤死亡原因[1]。每年因肺癌致死的病例数约40万例[2]。因为许多病患发现肺癌时已为中晚期,无法实施手术切除治疗,而且治疗费用巨大且在五年生存率仅有约百分之十,因此对高危群体开展筛选,提升早期肺癌症治疗技术水平是提高肺癌患者预后的关键问题。低剂量螺旋CT(low-dose spiral CT,LDCT)是目前认可的唯一可以减少高危人群肺癌患者死亡率的影像学检测,美国联邦国立肿瘤研究所开展了一项国家肺部筛查试验(national lung screening trial,NLST),结果表明,与标准胸部X线检测方法相比,LDCT通过对吸烟者实施定期检查,可以将肺癌患者死亡率减少20%,甚至使任何原因导致的整体死亡率降低7%[3]。LDCT肺癌检测技术为人类健康带来了很多利益,但也因此产生了一些争议,如对辐射的影响、较高的假阳性率、过度检查所带来的经济负担、追加检测的并发症风险等。CT检查基于病灶的形态学征象,现在LDCT能检出更多的早期肺癌,特别是亚实性结节的诊断符合率不断提高,但实性结节的诊断仍然存在很大比例的误诊,部分炎性病变、肉芽肿病变在形态学及动态增强影像学表现上仍很难与肺癌鉴别,对这一部分病灶的进一步诊断及疗效评价提供的信息相对有限,运用其他辅助诊断联合筛查成为了关键。因此寻求一种更加安全有效、准确及时且在短期内可重复进行的检查方法已引起广泛重视。
磁共振成像(megnetic resonance imaging,MRI)在肺部检查中的使用,以往由于受肺实质质子能量密度较低,气体/组织界面积大,对磁场敏感性不一致,以及循环锻炼和心肌搏动假影等各种因素的影响,图像品质一直不高,图像信噪比也降低。随着高场强磁共振的应用,快速成像序列的开发,联合并行采集技术以及呼吸和心电门控的应用,图像的信噪比明显提高,保证了图像质量的稳定性。磁共振成像逐渐扩展至肺癌研究领域。近年来,MRI技术对于胸部病变的应用也日益发展,尤其是在各种功能图像方面,可以给出除形体学之外的所有定性检查指数,在肺结节的鉴别诊断方面显示出潜在的应用价值[4]。有调查结果表明,良恶性病变二组之间的ADC值差别具有统计学意义, 当ADC取1.12×10-3mm2/s时,AUC为0.903,判断良恶性病灶的敏感度和特异性率依次为83.3%和84.4%,表明恶性结节瘤细胞排列密集,扩散受限程度明显[5]。同时,DWI(扩散加权图像)技术可利用宏观图像表现活体运动组织中水分子物质的微观弥散运动过程,因此DWI对术前肺良恶性疾病的鉴定确诊具有较好的应用前景[6]。有研究报告中指出,良恶性结节的T1、T2弛豫时间有明显不同[7-8];MRI在提示肺结节宽基底以及胸膜或胸壁损害等方面均优于CT。
基于对磁共振功能成像序列的实用化改造,使得弥散加权图像技术(diffusion weighted imaging,DWI)可以较为稳定的提取细胞代谢等小分子水平的信息信号,并在肺癌的检测以及鉴别诊断、分期、评价预后等方面,表现出了更多的应用价值。DWI上区分良恶性病变的病理基础特征为:在恶性组织内细胞较密集,水分子的运动阻力较大,扩散范围受到限制,在DWI上呈现相对较高信号,ADC值较低;但在炎性病变和良性肿瘤中大部分水分子的运动阻较小,水分子活动也比较自由,在DWI上呈现相对的较低信号,ADC值较高。随着技术的不断进步,DWI也逐渐被应用到对肿瘤的评价中,并且推动了全身DWI的临床研究和发展。多b值DWI主要用于对前列腺、胰腺等的研究中,b值通常取0~800s/mm2时,ADC值就能较好地检出病变[9]。现在已有令人信服的数据支持这项技术在恶性肿瘤的特征性描述方面的使用,包括确定病变的良恶性和评价不同治疗方法的疗效。肺结节在DWI上的信号强度也有助于对其良恶性疾病的区分,且DWI检查能提供定量指标即扩散表观系数ADC值[10]。李智勇等[11]认为良性病灶的ADC值大于恶性病灶ADC值,多b值DWI扫描所获得的ADC值对鉴别肺部良、恶性病变具有一定价值;运用检测在施加水扩散敏感梯度场,组织信号强度的改变来测定活体组织中水分子弥散的微观分子物质扩散运动倾向和水平程度,从而能够透过使用ADC值对人体水中微量分子物质运动过程的定性解析,来反映病变组织的良恶性[12-13]。
DWI不需要注射造影剂、可进行量化的ADC值的测量,并能够从微观结构的改变为肺癌的早期化疗疗效提供了一种更及时、更准确的影像学评价。本组病例数据进行统计学分析,单因素分析中,病变的良、恶性与ADC值具有相关性,χ2=27.1,P<0.001;多因素分析中,只有病变良、恶性与ADC值相关,P<0.001。上述结果也提示良恶性肿瘤间扩散加权成像ADC值存在差异性。
结合病理对照单位视野内肿瘤细胞密集程度评价,结果也和本组良恶性病变扩散加权成像所反映的肿瘤内部细胞及组织密集度情况吻合,反映了其内自由水扩散受限的程度。腺癌、鳞癌、小细胞癌病例组病变内细胞密集度平均值分别为79.4%、62.1%、50%,良性病变组病变内细胞排列、密集程度均低于肺癌组;腺癌病例组在物镜10倍,目镜4倍对病理切片直径约5.5mm肿瘤区域视野下肿瘤细胞密集程度较高,接近80%,所以导致单位体积内自由水扩散受限明显,但周围散在分布含气组织及细小支气管及肺泡结构,提示其周围结构较肿瘤密集区松散,故其扩散表观系数ADC值平均约0.90×10-3mm2/s,在肿瘤组内相对较高;鳞癌病例组在同样视野下肿瘤细胞密集程度平均在60%以上,本组虽然单纯肿瘤细胞密集度小于腺癌组,但肿瘤细胞周围分布大量密实的纤维基质,肿瘤细胞周围密实程度较高,故鳞癌组单位体积内自由水扩散受限更加明显,其扩散表观系数ADC值平均约0.74×10-3mm2/s,在肿瘤组内相对较低;小细胞肺癌组细胞密实程度及周围结构大致同鳞癌,单位体积内自由水扩散受限最明显,其扩散表观系数ADC值最低;炎性病变区同样视野下大量炎性细胞浸润,结构松散,周围含气含液成分较多,提示炎性病变本身及周围结构较松散,单位体积内自由水扩散受限不明显,其扩散表观系数ADC值高于肿瘤组;错构瘤病例组同样视野下见黏液变纤维及脂肪、软骨成分,周围结构松散,含气组织较多,节细胞瘤同样视野内排列类似错构瘤,除了肿瘤细胞,周围也表现为结构松散,含气组织较多;错构瘤及节细胞瘤排列结构大致相同如上述,故单位体积内自由水扩散受限同样不明显,其扩散表观系数ADC值明显高于肿瘤组。
综上所述,结合对照病理肿瘤及周围组织密集程度评价,扩散加权成像ADC值能直接反映病变单位体积内自由水扩散程度,ADC值越低提示肿瘤及周围组织密集程度越高,倾向恶性肿瘤或肺癌,ADC值越高提示肿瘤及周围组织密集程度越低,考虑良性肿瘤或炎性病变可能。所以磁共振扩散加权成像ADC值对肺内病变具有一定的定性评估及鉴别诊断的能力,作为一项普遍运用的功能成像,有助于辅助CT对肺内疑难病变做出进一步定性分析,提高影像的综合诊断能力。
