氮素水平对土壤甲烷氧化和硝化微生物相互作用的影响*
2022-06-09孟春梅刘杏梅诸葛玉平贾仲君邸洪杰徐建明
潘 红,李 勇,孟春梅,郑 燕,刘杏梅,诸葛玉平,贾仲君,邸洪杰,徐建明
(1. 浙江省农业资源与环境重点实验室,浙江大学环境与资源学院,杭州 310058;2. 土肥高效利用国家工程研究中心,山东农业大学资源与环境学院,山东泰安 271018;3. 郑州轻工业大学食品与生物工程学院,郑州 450002;4. 中国科学院南京土壤研究所,南京 210008)
甲烷(CH)和氧化亚氮(NO)是两种重要的温室气体,其全球增温潜势分别是二氧化碳(CO)的28 倍~34 倍和265 倍~298 倍。旱地土壤(森林土壤、草原土壤等)是大气甲烷的有效汇,因其具有能够氧化大气浓度甲烷的高亲和力甲烷氧化单加氧酶(MMO)。好氧土壤中,NO 的主要产生途径是有氧硝化作用。氨氧化过程是有氧硝化的第一步,也是限速步骤,主要由具有氨单加氧酶(AMO)的氨氧化古菌(AOA)和氨氧化细菌(AOB)完成。研究发现,MMO 在进化上和AMO 密切相关,它们有高度相似的氨基酸序列、相似的蛋白复合体结构、相似结构的底物(CH和NH)、相似的被抑制特性和相似的生态位,而且都竞争N 源。甲烷氧化细菌(MOB)的生长繁殖需要氮源,但其自身不具备固氮能力,因此,MOB 需要获取外源氮源。鉴于以上研究背景,甲烷氧化和硝化过程有着必然的内在联系。
草原生态系统是世界上最大的陆地生态系统,草地面积占我国国土面积的41%。草原土壤既是CH的汇,又是NO 的源,因此,有关草原生态系统中土壤的碳氮循环一直是研究热点问题。当前关于草原土壤系统中硝化过程和甲烷氧化过程的研究发现,AOB 和MOB 分布广泛,在多种草原土壤生境中参与硝化和甲烷氧化过程。旱地土壤类群(USC)MOB 因其具有高甲烷亲和力在草原土壤中的重要性逐渐被发现。但目前关于草原土壤中不同氮水平下甲烷氧化活性和相关活性微生物,以及甲烷氧化和硝化之间复杂的相互作用关系机制的研究较少。因此本研究选取内蒙古锡林郭勒盟草原土壤为研究对象,结合稳定同位素核酸探针(DNA-SIP)、实时荧光定量PCR和Miseq 测序等分子生物学技术,分析不同氮水平下,甲烷氧化和硝化微生物的相互关系,阐明草原生态系统CH氧化和硝化的交互作用机制,以期为深入了解草原土壤碳氮循环、提高草原氮肥利用率、增强草原生产力、实现温室气体减排提供科学依据。
1 材料与方法
1.1 土壤样品概况
土壤样品采自位于内蒙古锡林郭勒盟草原(43°26′—44°39′N,115°32′—117°12′E)的中国科学院内蒙古草原生态系统定位研究站。该地区冬季寒冷,夏季凉爽,属于半干旱大陆性季风气候,每年大约102~136 d 无霜期,全年平均气温-0.4 ℃,年均降水量350 mm 左右,降雨多发生在六月至八月,雨热同期,季节分布不均,与植物生长期一致。主要植被类型包括羊草()、大针茅() 和 粗 隐 子 草()。土壤类型为暗栗钙土。该样地1996 年以前自由放牧,自1996 年起禁牧围封。样地大小为400 m × 60 m,包括5 个小区,每个小区70 m × 60 m,相邻的两个小区之间有10 m 的缓冲带便于取样。2016 年8 月用5 cm 直径土钻按照“S”型取样法采集0~20 cm 表层土,全部混匀,研磨过2 mm 筛。土壤基本理化性质如下:pH 7.22,容重1.32 g·cm,有 机 质 25.47 g·kg,全 碳 16.67 g·kg,全 氮1.50 g·kg, 硝 态 氮 63.36 mg·kg, 铵 态 氮4.45 mg·kg,有效磷(Olsen P)7.31 mg·kg,速效钾 251.10 mg·kg。
1.2 微宇宙培养实验
将相当于 6.0 g 干重的新鲜土壤样品转移至120 mL 血清瓶,调节40%田间持水量,胶塞加铝盖封口,25 ℃黑暗中预培养,每周监测CO浓度,当浓度降至5 000 μL·L时开始正式培养。
正式培养实验共设7 个处理,如表1 所示,每个处理3 个重复。CH处理(99 atom%C,Sigma-Aldrich,St Louis,MO,USA)用以分析甲烷氧化活性和活性甲烷氧化微生物;CO+Urea(99 atom%C,上海稳定性同位素工程技术研究中心,上海,中国)处理用以分析硝化活性和活性硝化微生物;CH+CO+Urea 和CH+CO+Urea处理用以分析甲烷氧化和硝化之间的相互作用。其中,添加尿素的处理均包括N 20 µg·g干土(U20)和100 µg·g干土(U100)两个氮素水平。试验流程如图1 所示,每周用高纯空气(20% O,80% N)换气1 min,保证有氧环境,同时以溶液的形式逐滴加入尿素溶液,调节60%田间持水量,血清瓶胶塞加铝盖密封后加5%的CO。其中甲烷浓度动态监测,随时添加,保证1%浓度。在25 ℃生化培养箱中黑暗培养21 d,分别在0、7、14、21 d 进行破坏性取样。所取样品分两部分,2 g 左右保存在-80 ℃冰箱,用以提取土壤DNA;剩余样品用以分析硝化活性。
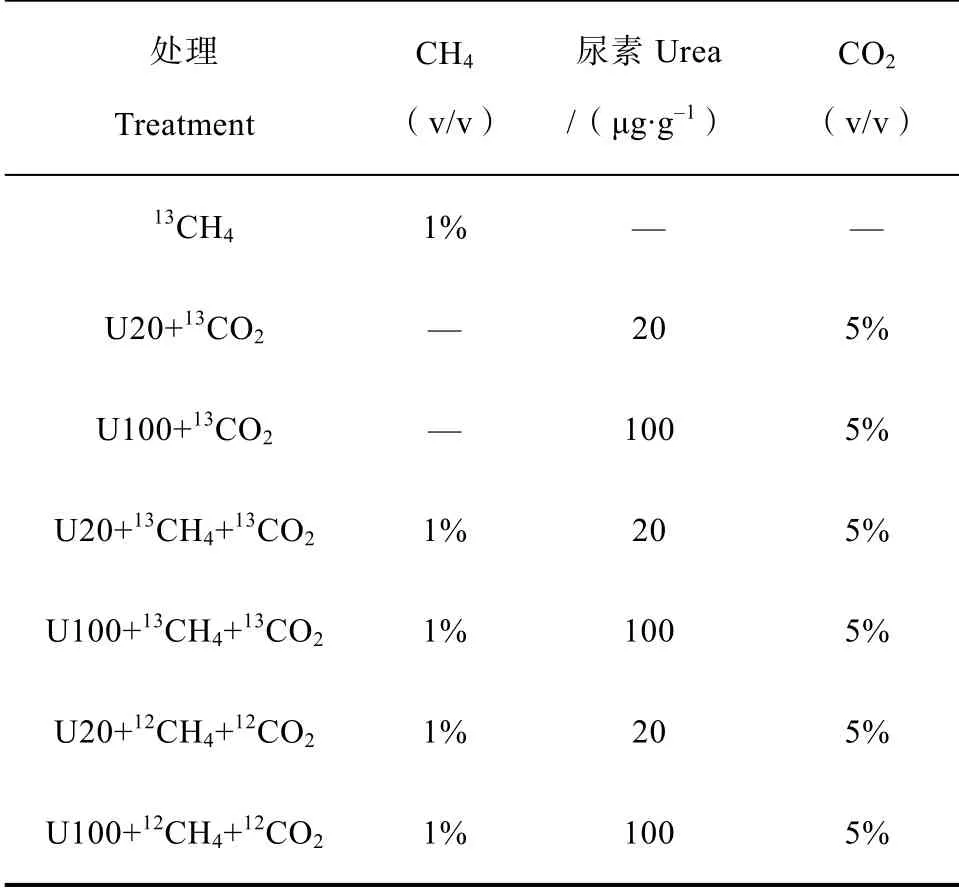
表1 微宇宙培养试验处理概况Table 1 Schedule of the treatments
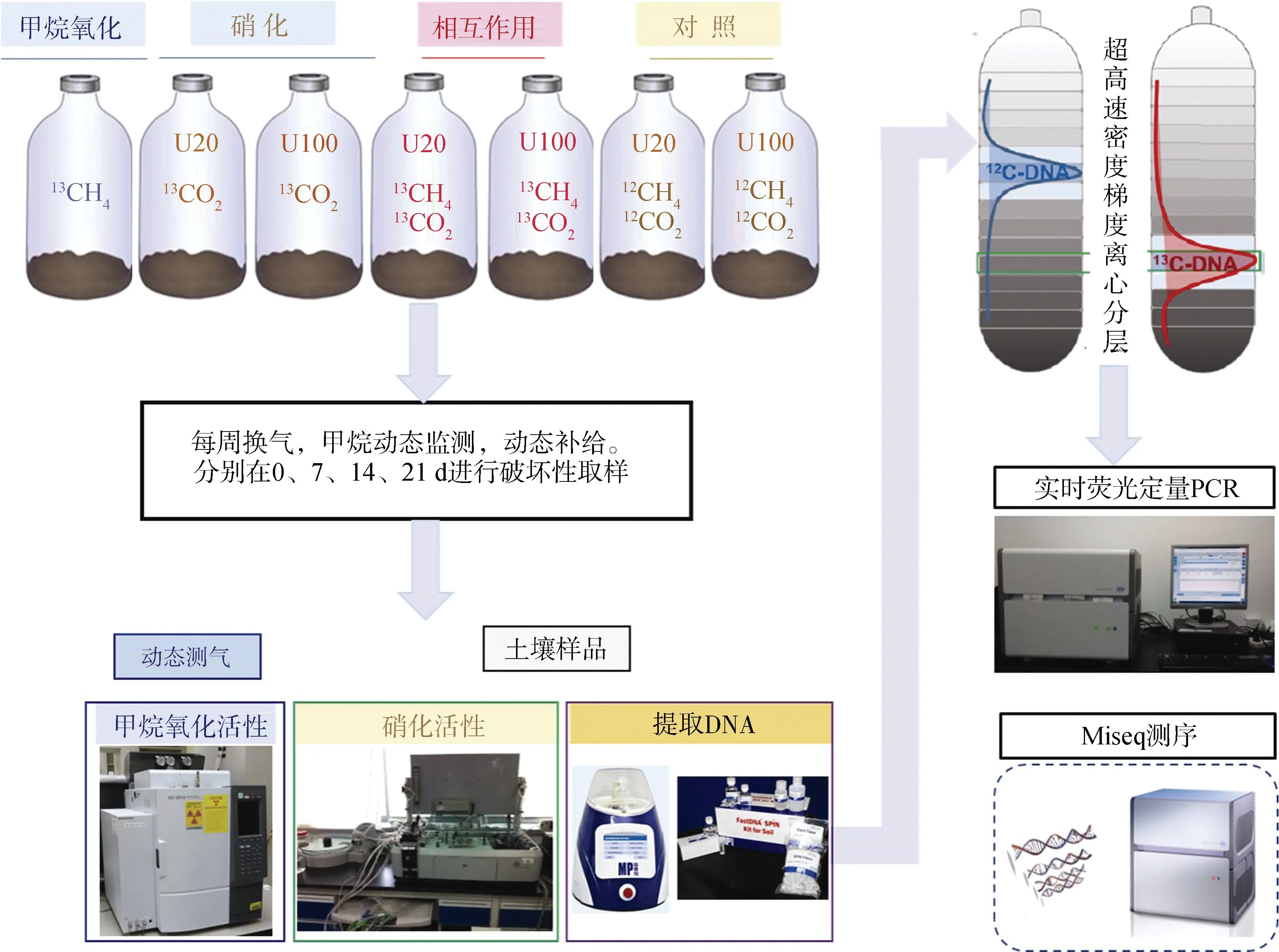
图1 实验流程图Fig. 1 The experimental procedure
1.3 DNA 提取和SIP 分层
将0 d 和21 d 的土壤样品用FastDNA Spin Kit for Soil(MP)提取土壤基因组总DNA。用0.7%的凝胶电泳检测DNA 的完整性,NanoDrop® ND-2000 UV-Vis spectrophotometer(NanoDrop Technologies,Wilmington,DE,USA)检测DNA 的质量和纯度。DNA 样品-20 ℃冰箱保存,用以进行超高速等密度梯度离心。
SIP 分层方法参考文献[13]。具体操作方法如下:大约3 μg DNA 与4.9 mL 氯化铯(CsCl)溶液混合,调节浮力密度至1.725 g·mL。然后将混合液转移至5.1 mL 超高速离心试管中,调平密封后用贝克曼Vti65.2 转子(Beckman Coulter Inc.,Palo Alto,CA,USA)在20 ℃条件下以177 000×的速度离心44 h。离心结束后,利用NE-1000 注射器泵(New Era Pump Systems Inc.,Farmingdale,NY,USA)将新灭菌蒸馏水以稳定流速(0.38 mL· min)从上向下将溶于CsCl 中的DNA 置换到15 个1.5 mL 离心管中,即每个土壤DNA 样品分层后总共得到15层DNA 组分溶液,每层体积为380 μL,取65 μL用手持式AR200 折光率仪(Reichert Inc.,Buffalo,NY,USA)测定折光率。将分层后的DNA 组分溶液用PEG6000 和乙醇纯化,溶于30 μL 新灭菌蒸馏水进行后续分析。
1.4 甲烷氧化菌pmoA 和氨氧化菌amoA 基因的定量PCR
将0 d 和21 d 的总DNA 以及上述分层纯化后的DNA 样品进行和基因的定量PCR分析(LightCycler 480,Roche Applied Science),具体引物信息和PCR 条件见表2。反应体系20 μL,包括10 μL SYBR Premix Ex Taq(TaKaRa,Dalian,China)、1.5 μL DNA 模板(1~10 ng)、0.79 μL milli-Q水,体系中引物终浓度0.5 μmol·L。最后跑溶解曲线,利用 50~99 ℃的升温连续检测荧光以确认PCR产物的特异性。本实验定量PCR 扩增效率在80.5%~108.3%之间,值在0.990~0.998 之间。

表2 本试验中引物信息及PCR 条件Table 2 Primers and conditions used in this study
1.5 Miseq 测序、系统发育分析和共线性网络分析
将0 d 和21 d 的总DNA 以及上述分层纯化后的重层DNA 样品进行Miseq 高通量测序。利用Illumina®MiSeq 测序仪(Illumina,San Diego,CA,USA)对上述DNA 的16S rRNA 基因的V4 区进行测序,引物序列及扩增条件见表2。本实验中,只有序列长度大于200 bp,平均质量大于25,没有模糊噪声,至少80%符合16S rRNA 序列的结果才会进行后续分析。在97%序列相似度水平上进行OTU(可操作分类单元)聚类,最后参考Silva 数据库对OTU 进行物种注释。
总DNA 样品共得到1 149 320 条高质量序列,平均每个样品得到47 888 个高质量序列。其中属于细菌的序列有1 123 384 条,占97.74%;属于古菌的序列有25 936 条,占2.26%。重层DNA 样品在CH、U20+CO、U100+CO、U20+CH+CO和U100+CH+CO处理下分别得到426 842、407 179、429 748、501 376 和480 393 条高质量序列。
选取属于MOB、AOA、AOB 和NOB 的序列,用Molecular Evolutionary Genetics Analysis(MEGA 7.0)分别进行系统发育分析。以重层MOB、AOB 和NOB 的OTU 丰度表为原始数据,采用Spearman 相关系数模型,显著性< 0.05,通过CoNet 软件构建共线性网络图,Gephi 0.9.2 对网络图进行可视化分析。网络图包括节点和边,各节点代表不同的物种,以颜色区分。边代表物种之间的相互作用,红色和绿色分别代表正相关和负相关,线的粗细表示相关性的大小。将总DNA 和重层DNA 的测序数据上传至NCBI 的Sequence Read Archive(SRA)数据库,检索号分别为PRJNA611699 和PRJNA611713。
1.6 数据处理
硝化活性、甲烷氧化活性、/基因丰度和相对丰度的显著性差异分析通过SPSS 20.0 单因素方差分析(one-way ANOVA)的Duncan 多重检验完成;作图通过Origin 9.0 完成;< 0.05 表示差异显著。
2 结 果
2.1 甲烷氧化活性和甲基营养微生物
氮素水平对甲烷氧化活性和相关微生物丰度均有显著影响(图2),经过21d 的微宇宙培养,相比不施氮(U0),甲烷氧化活性、基因丰度和甲基营养微生物相对丰度在低氮水平(U20)下显著增加,在高氮水平(U100)下显著降低。在U0、U20 和 U100 三个处理下,甲烷氧化活性分别是37.79、45.27 和16.11 μmol·g干土,基因丰度分别是3.08×10、4.24×10和9.50×10copies·g干土。甲烷氧化活性、基因丰度以及甲基营养微生物的相对丰度均在不同氮水平下呈现出“低促高抑”的规律(图2)。

图2 甲烷氧化活性(a)、甲烷氧化细菌pmoA 基因丰度(b)和甲基营养微生物相对丰度(c~d)分析Fig. 2 Changes in methane oxidation activity(a) and quantitative distribution of methylotrophs(b-d) in soil microcosms over an incubation period of 21 days
2.2 硝化活性和硝化微生物
净硝化速率、硝化微生物丰度和相对丰度如图3 所示。U20、U20+CH、U100 和U100+CH的净硝化速率分别为51.57、34.60、163.50 和165.02 μg·g干土(图3a);AOB基因丰度分别为1.90×10、1.23×10、6.34×10、8.04×10copies·g干土(图3b)。低氮水平下,CH的存在显著抑制硝化活性和AOB基因丰度;而高氮水平下,CH的存在对硝化活性和AOB基因丰度没有显著影响。AOB 和NOB 的相对丰度也符合该规律(图3d,3f)。AOA基因的丰度和相对丰度在培养21 d 之后显著降低,甲烷存在与否对AOA基因丰度影响不显著(图3c,图3e)。
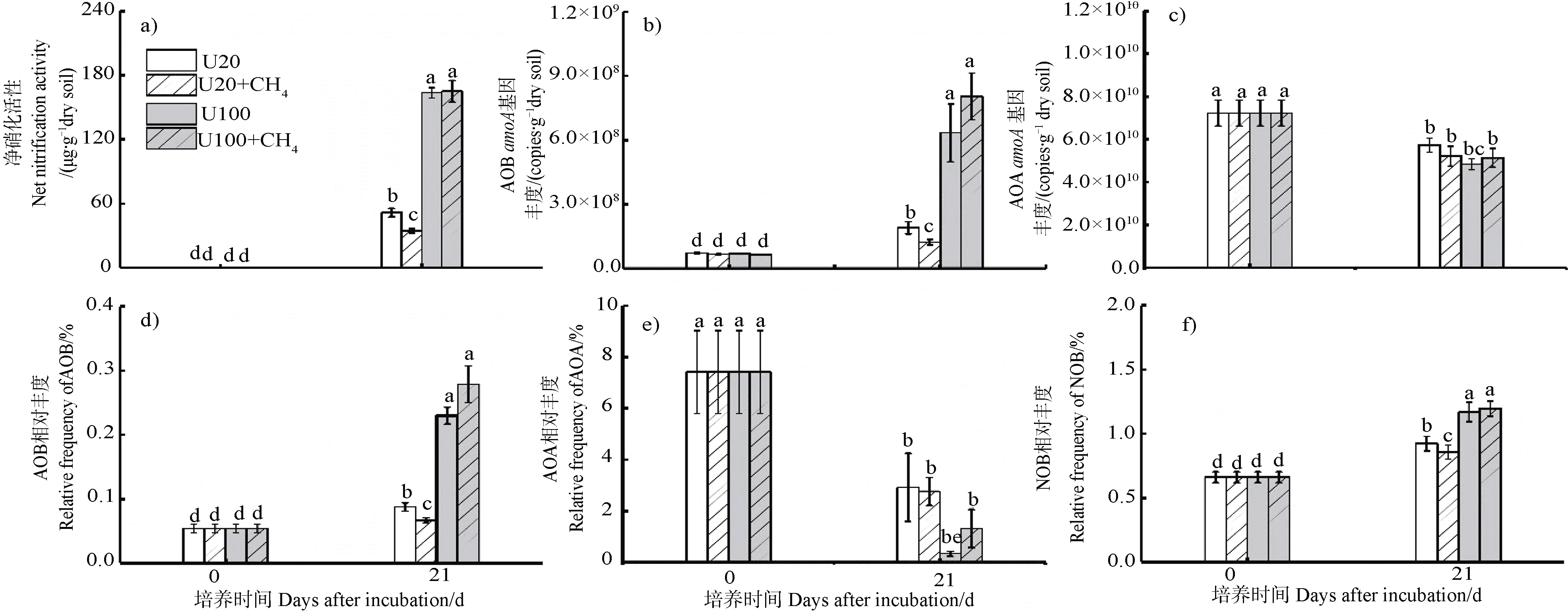
图3 净硝化活性(a)和氨氧化微生物amoA 基因丰度(b~c),硝化微生物相对丰度(d~f)分析Fig. 3 Net nitrification activity (a) and quantitative distribution of nitrifiers (b-f) in soil microcosms over an incubation period of 21 days
2.3 DNA-SIP 技术鉴定活性甲烷氧化和硝化微生物
离心后每个样品分为 15 层,浮力密度在1.676~1.791 g·mL之间。对每一层进行和基因的定量PCR 分析,然后将每一层的分析结果与各层次中最大的基因丰度作比,得到和基因在各浮力密度梯度中的分布图(图4a)。甲烷氧化菌在不施氮处理中被显著标记,低氮处理增加了MOB 被标记的程度,而高氮处理则降低了MOB 的标记程度。AOB 在低氮和高氮水平下均被显著标记,尤其是在高氮水平下的标记更显著。低氮水平下,甲烷的存在抑制AOB 的被标记程度。低氮和高氮水平下,AOA 均没有被标记。根据定量分布结果选取重层DNA(3~12 层)进行高通量测序,选择分别属于MOB、AOB 和NOB 的OTU 绘制各浮力密度上的相对丰度分布图,结果如图4b、图4c。MOB 和AOA 的相对丰度在各浮力密度的分布趋势和上述定量分析的结果完全一致。AOB 和NOB 的相对丰度分布图显示低氮水平和高氮水平下,甲烷的存在对AOB 和NOB 的被标记程度均有抑制效果。
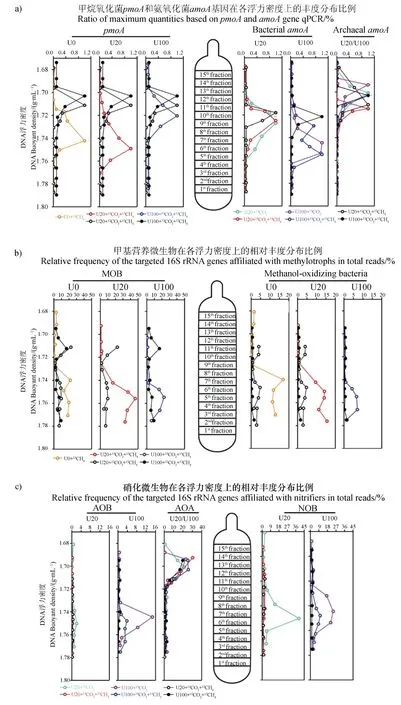
图4 甲基营养微生物和硝化微生物丰度和相对丰度在不同浮力密度上的分布Fig. 4 Quantitative distribution of methanotrophs as well as nitrifiers across the entire buoyant density gradient of the fractionated DNA from soil microcosms after incubation for 21 days
2.4 活性甲烷氧化微生物和硝化微生物的群落结构
如图5 所示,草原土壤99.7%以上的MOB 属于甲基杆菌属();活性MOB 包括甲基杆菌属()和甲基暖菌属(),以为主,占90%以上。活性MOB 在U0+CH、U20+CH和U100+CH的处理中所占的比例分别为92.62%、96.35%和91.79%,活性MOB 所占的比例分别为7.38%、3.65%和8.21%。硝化微生物AOB 主要包括亚硝化球菌属()、亚硝化螺旋菌属()和亚硝化单胞菌属(),分别占72.00%、26.00%和2.00%。65%以上的活性AOB 为,其在U20、U20+CH、U100、U100+CH处理中对AOB 的占比分别为65.33%、80.23%、78.30%和82.10%;在AOB 中的占比分别为28.41%、10.13%、20.77%和16.13%;在AOB 中的占比分别为6.25%、9.64%、0.93%和1.77%。该草原土壤中的亚硝酸盐氧化细菌(NOB)均隶属于,包括、和三个种。活性NOB 以为主,其在U20、U20+CH、U100、U100+CH处理的占比分别是:71.3%、61.9%、 78.4%和78.8%;的占比分别为:23.6%、27.7%、16.9%和 14.5%;的占比分别为5.1%、10.4%、4.7%和6.7%。
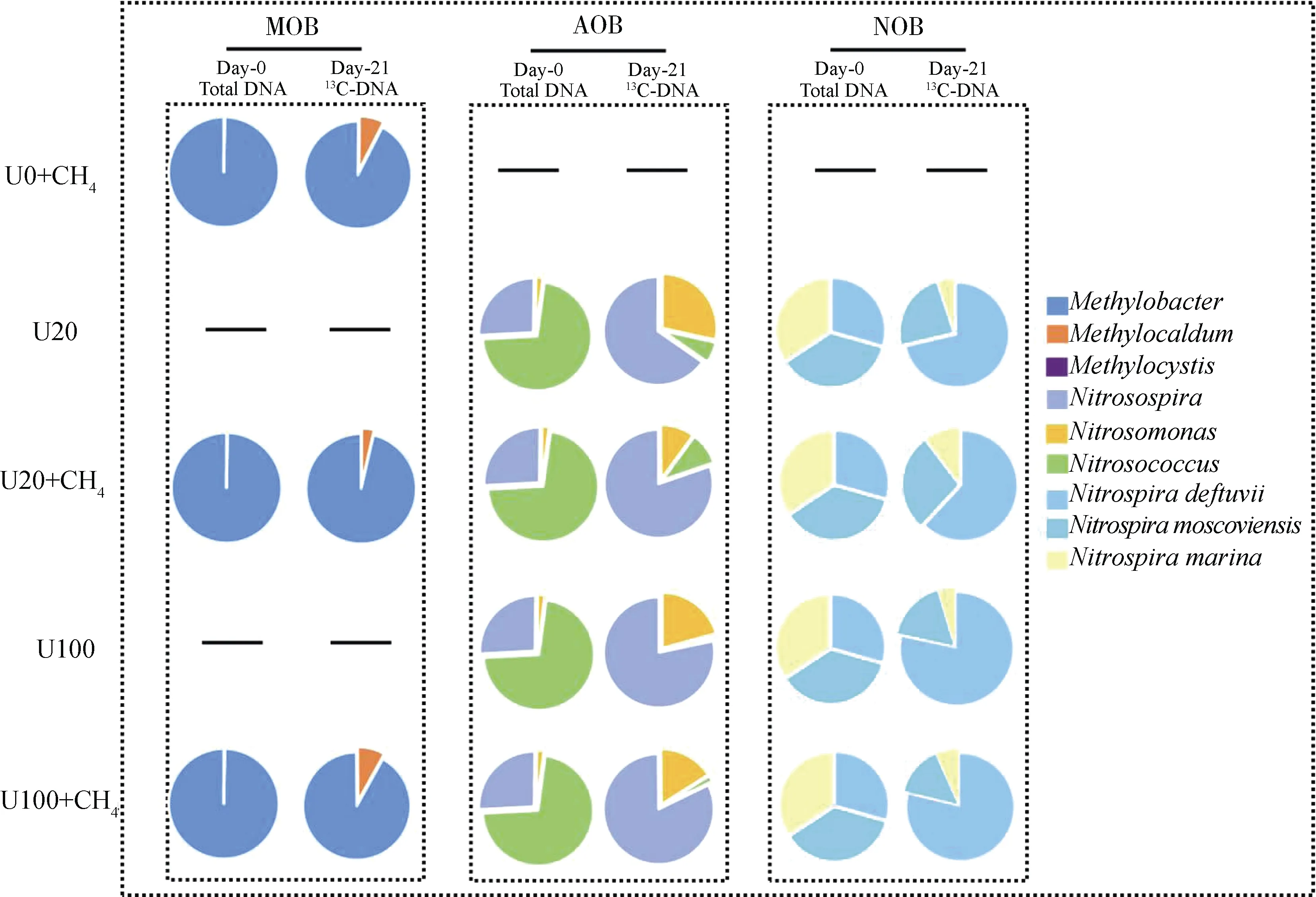
图5 活性甲烷氧化微生物和硝化微生物的群落组成分析Fig. 5 Proportional changes of active methanotrophs and nitrifying phylotypes in SIP microcosms after an incubation period of 21 days
2.5 活性甲烷氧化微生物和硝化微生物的共线性网络
为明确活性甲烷氧化微生物和硝化微生物的相互作用,将重层MOB、AOB 和NOB 的高丰度OTU构建共线性网络图(图6)。结果发现,MOB 与AOB 存在显著的负相关关系,此外,MOB 还与NOB 存在显著的负相关关系,AOB 与NOB 存在显著正相关关系。
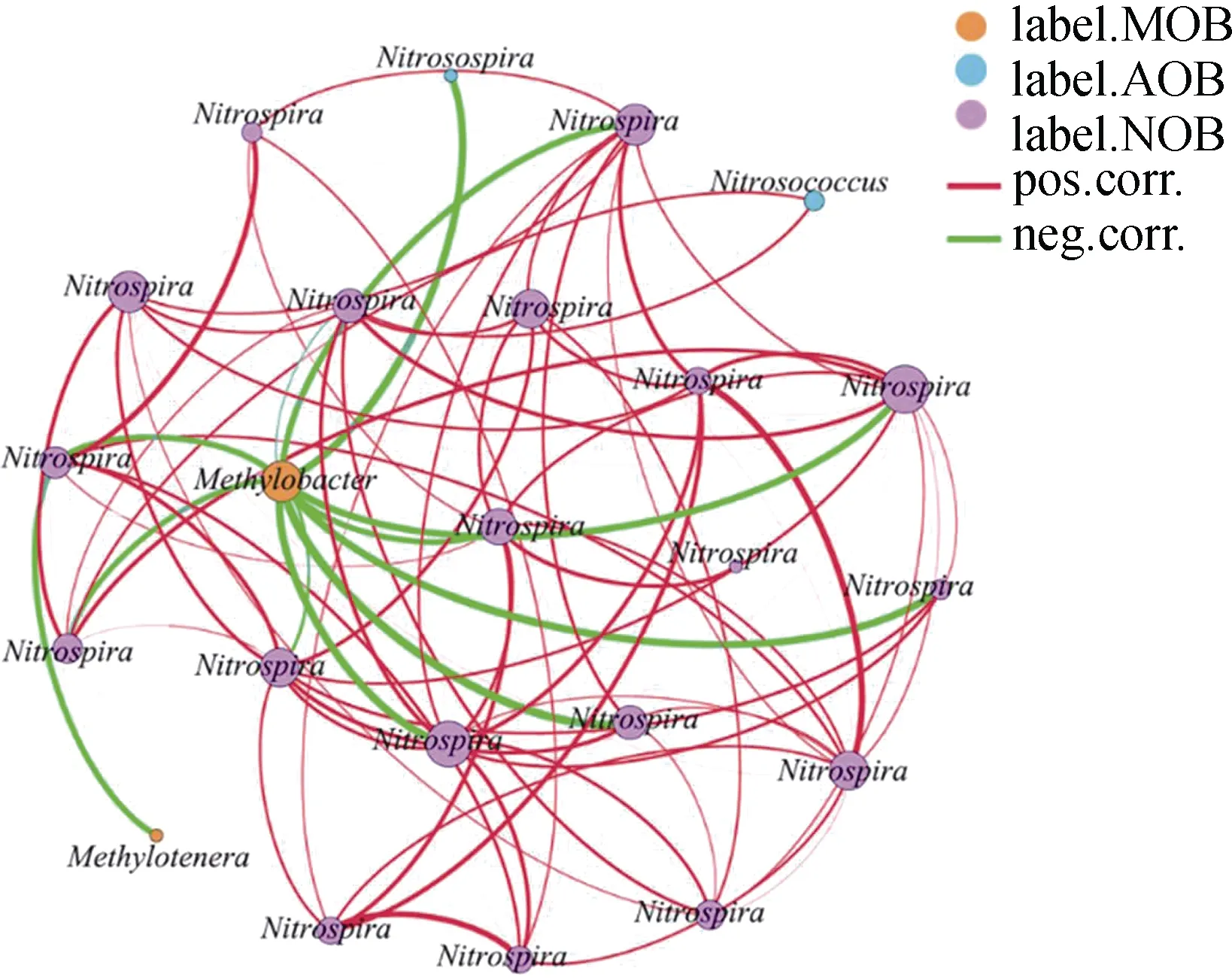
图6 活性MOB、AOB 和NOB 的共线性网络图Fig. 6 Network analysis of co-occurring phylotypes of active MOB,AOB and NOB in microcosms
3 讨 论
3.1 氮素水平对甲烷氧化活性和活性甲烷氧化微生物的影响

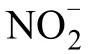
本世纪初,Stein 等提出铵盐对MOB 刺激还是抑制取决于铵态氮与甲烷态碳的比例(N-CH)。然而,Bodelier和Zheng等发现N-CH比分别为200 和0.11 时,尿素添加均显著刺激甲烷氧化。而本实验中U100(100 μg·g干土)处理的N-CH比仅为0.70,但是显著抑制了甲烷氧化。同样,Zhang等通过四年田间试验也发现100 kg·hm·a(约158 μg·g干土)的氮添加显著抑制甲烷氧化。Zhao等推测氮肥对甲烷氧化的刺激或抑制作用可能取决于主要甲烷氧化菌的种系型,比如,Zheng 等发现水稻土中添加尿素后,活性甲烷氧化微生物以为主,而未施加尿素的处理以为主。在本草原土的试验中,无论是否添加尿素以及添加尿素多少,均是以为主。因此,有关氮素水平对甲烷氧化的机理尚不明确,未来关于氮素对甲烷氧化影响的研究可考虑多种类型土壤的综合分析。
3.2 甲烷对净硝化活性和活性硝化微生物的影响
类似于对MOB 的分析,本实验对氨氧化功能微生物在0 d 和21 d 的总DNA 分别进行定量分析。结果显示(图3b),低浓度和高浓度氮添加均会刺激AOB 丰度的增长,而抑制AOA 的繁殖,说明AOB 在硝化作用过程中具有重要作用。DNA-SIP 结果发现AOB 在各处理中被C 标记,而AOA 在各种处理中均未表现出明显的被标记迹象(图4a),说明AOB 同化了来自CO的C,进一步证明AOB是驱动该草原土壤硝化作用的活性硝化微生物。
不同浮力密度范围的AOB分布,以及AOB 和NOB 相对丰度的分布进一步表明低氮水平下,甲烷添加显著抑制了活性硝化微生物同化CO(图4a,图4c)。Zheng 等在水稻土的研究发现,100 µg·g干土的尿素处理,甲烷添加显著抑制硝化活性和活性硝化微生物。而本研究发现,在草原土壤中,添加20 µg·g干土的尿素,甲烷即显著抑制活性硝化微生物同化CO,降低硝化活性,而100 µg·g干土的尿素处理下,硝化活性和活性硝化微生物对甲烷添加无响应。无机氮对于生物量的形成是至关重要的,尤其是对于那些缺乏固定分子态N 的甲烷氧化菌来说。说明甲烷对硝化活性的抑制作用可能只出现在氨氧化底物不足时,氨氧化微生物和甲烷氧化微生物竞争N 源,一部分N 作为N源被甲烷氧化菌同化,但是当N 源浓度较高时,甲烷氧化微生物反被抑制(图2,图4),丧失了与氨氧化微生物竞争的能力。结合上述氮水平对甲烷氧化的影响,氮素添加体现出对甲烷氧化的刺激效应时,甲烷的存在就会抑制氮素转化(硝化作用);氮素添加体现出对甲烷氧化的抑制效应时,甲烷的存在对氮素转化过程(硝化作用)没有显著影响,说明甲烷氧化和硝化过程的相互作用关系受氮素水平的调控。
3.3 活性甲烷氧化和硝化微生物及相互作用
群落组成分析发现,活性MOB 群落结构比较单一,以Type Ia 的甲基杆菌属()为主,占90%以上,还有一些Type Ib 的甲基暖菌属()和极少比例的 Type II 型的。一方面,研究发现Type Ia 型甲烷氧化菌在湿地、水稻土、冰下水系等多种环境中均作为主要的甲烷氧化微生物;另一方面,通过菌株分离分析发现,高浓度甲烷条件下的活性远高于低浓度甲烷环境。此外,在本试验中,尿素施入并没有改变草原土壤中活性甲烷氧化微生物的群落组成,这一结果与Zhao 等在水稻土中的发现一致,说明草原土和水稻土中氮有效性不是决定甲烷氧化微生物组成的关键因子。本试验发现活性硝化微生物以AOB 和NOB 为主,这一结果与之前在草原土壤、水稻土壤和森林土壤中的研究结果一致。
尿素对甲烷氧化菌群落的低促高抑主要反应在MOB,菌株生长需要氮源,但其不具备固氮能力,因此,氮施入可促进生长繁殖。但随着施氮量增加,硝化活性增强,硝化作用产生的NHOH 和NO以及硝化产物NO对 MOB 均存在毒害作用;活性AOB 和NOB 比例随施氮量增加而增加,导致MOB 与AOB/NOB 在同一生境中竞争O、NH-N 和生存空间,网络分析结果也发现与活性硝化微生物(AOB 和NOB)存在显著负相关关系。结合低氮条件下,甲烷氧化增强而硝化被抑制;高氮水平下,硝化增强而甲烷氧化被抑制,说明草原土壤中甲烷氧化和硝化之间存在氮引发的MOB 与AOB/NOB 之间的竞争性相互作用关系。
4 结 论
草原土壤甲烷氧化活性及微生物功能活性在低浓度氮素水平下显著增加,而在高浓度氮素水平下显著降低,呈现出“低促高抑”现象。N 对甲烷氧化的影响(刺激或抑制)可能是土壤条件和主要微生物种系型共同作用的结果。DNA-SIP 结果发现,活性甲烷氧化微生物以为主,活性硝化微生物以AOB 和NOB 为主。而网络分析结果发现MOB 和AOB/NOB 之间存在显著负相关关系,说明甲烷氧化和硝化微生物之间存在竞争性相互作用。以上结果表明甲烷氧化和硝化过程的相互作用受氮素水平的调控。
