基于Gouy-Chapman 理论估算碱金属离子在Cu2+-蒙脱石表面Hofmeister 能*
2022-06-09朱晔玮刘新敏
朱晔玮,刘新敏,李 睿,李 航
(土壤多尺度界面过程与调控重庆市重点实验室,西南大学资源环境学院,重庆 400715)
Hofmeister 效应随处可见,其通常表现为溶液中同价离子的行为差异。Hofmeister 效应普遍存在于物理化学和生物学过程中,在界面相互作用中扮演着重要角色。研究表明,Hofmeister 效应对土壤胶体凝聚、土壤团聚体稳定性以及土壤水分运动等有着深刻的影响,进而影响并控制了土壤中养分元素的保存、水土流失以及污染物的循环等过程。Du 等在碱金属离子交换K-蒙脱石研究中发现,碱金属离子的吸附量呈现 Cs> Na> Li的顺序,阳离子的吸附活化能顺序为Cs< Na< Li;通过研究Li、Na、Cs在黄壤颗粒表面交换吸附的特征,吴英博等发现Li、Na、Cs三种离子在扩散层中的扩散距离表现出一定的差异,并且Stern电位、电荷密度和电场强度均呈现出Hofmeister 效应。Zhang 等在探究溶菌酶的浊点温度与盐浓度的关系中发现,在低的盐浓度条件下,阴离子的相对有效性Hofmeister 序列为:ClO> SCN> I>NO> Br> Cl;在较高的盐浓度下,阴离子的Hofmeister 序列为:Cl> NO> Br> ClO> I>SCN。
目前,人们有关于Hofmeister 效应产生的原因多用离子的水化作用和离子的色散力来解释。这两种作用在电解质浓度较高时有显著影响,这是因为当电解质浓度较高时,体系中离子间距减小,离子的水合作用变得重要,另一方面,高浓度的电解质使得胶体颗粒周围的静电场被屏蔽,离子受到的静电力减弱,色散力作用显著增加。离子的水化作用和色散力作用随着电解质浓度的降低,对于Hofmeister 效应的影响将逐渐减弱。Liu和Tian等的研究发现,在黏土矿物体系中,随着电解质浓度的降低,Hofmeister 效应不但不会减弱,反而逐渐增强,那么,在低电解质浓度条件下,Hofmeister 效应产生的原因是什么呢?
黏土矿物表面带有大量电荷,这些电荷可在其表面形成强电场,土壤固液界面附近的吸附态离子,在强电场影响下,其核外电子的量子涨落被急剧放大,并引起离子的强烈极化,即离子非经典极化作用。Liu 等利用离子非经典极化作用来解释低电解质浓度下的Hofmeister 效应。非经典极化作用的发生使得离子产生了额外的附加能量,Du等定义此种超额能量为“Hofmeister 能”,并基于Gouy-Chapman 理论估算出Na、Cs在K-蒙脱石表面的总吸附能以及Hofmeister 能对总吸附能的贡献。潘小丽等研究碱金属离子在Cu-蒙脱石表面的吸附动力学时,计算出体系的活化能,利用活化能的差异解释离子吸附反应的Hofmeister 效应。本研究仍以蒙脱石为研究对象,采用恒流法进行离子吸附实验,比较三种碱金属阳离子Na、K、Cs在Cu-蒙脱石表面吸附的差异性,并基于Gouy-Chapmann 理论估算碱金属离子在Cu-蒙脱石表面的Hofmeister 能,区分Hofmeister 能和库伦相互作用能,以此分析碱金属离子在不同类型离子饱和的蒙脱石表面相互作用能的差异性。
1 材料与方法
1.1 供试材料
试验选用蒙脱石(内蒙古)为原材料,将其制成Cu(NO)饱和蒙脱石。取50 g 蒙脱石加入0.1 mol·LCu(NO)溶液1 L,恒温震荡24 h,离心,去除上清液,重复操作3 次,再用超纯水清洗样品3 次。将所得样品置于343 K 温度下烘干,过0.25 mm 筛备用。测得蒙脱石的比表面积为725 m·g,表面电荷数量为115 cmol·kg。
1.2 离子吸附动力学实验
离子吸附动力学实验采用恒流法进行。实验温度298 K,混合电解质溶液组成为XNO+ LiNO,其中X = Cs、Na、K,因为Li的Hofmeister 能近似为零,所以设置LiNO为背景电解质。混合溶液中两种电解质浓度相等,为阐明低电解质浓度条件下离子吸附行为差异,将电解质浓度设置为0.0001、0.001 和0.01 mol·L。称取约0.5 g 的Cu-蒙脱石饱和样,平铺于垫有滤纸的交换柱,平铺时,样品层尽可能薄,饱和样的实际重量在实验结束后,烘干测得,将XNO+ LiNO(X = Cs、Na、K)溶液以恒定流速(1 mL·min)通过样品,由于低电解质浓度条件下,离子交换时间较长,所以将时间间隔设置为10、5 和3 min,用自动部分收集器(DBS-100,上海)收集从样品中流出的流出液,用火焰光度计(AP1401 型,上海)测得流出液中Li、Na、K、Cs的浓度,通过差减法获得交换液质量,最后计算出各阳离子的吸附量。
1.3 数据处理
Li 等研究发现,考虑土壤表面静电场的作用后,当离子与带电颗粒表面存在强作用力吸附时,其吸附过程将表现出零级动力学特征:
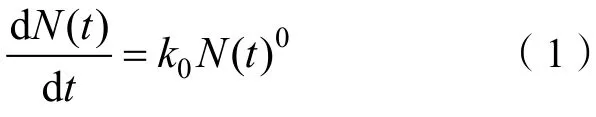
式中,()表示时刻的离子吸附量,表示零级速率常数。
当离子与带电颗粒表面存在弱静电力作用下的吸附时,其吸附过程将表现出一级动力学特征:
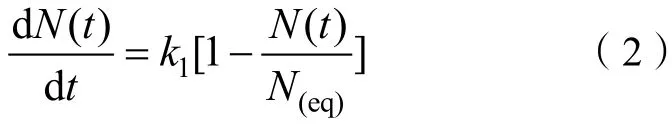
式中,表示一级速率常数。
研究发现,Hofmeister 效应的发生总是伴随着离子-表面能量的变化,定义“Hofmeister 能”为由Hofmeister 效应引起的离子-表面间相互作用能的变化。离子-表面间相互作用总能可表示为:
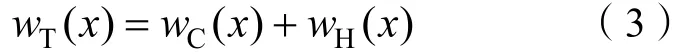
式中,()表示离子与土壤颗粒表面相距处的总能,()和()分别表示相应的库伦相互作用能和Hofmeister 能。
式(3)可以改写成:
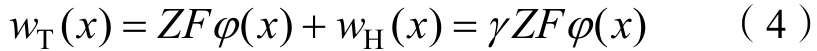

式中,为离子的表观电荷系数,为离子化合价,为法拉第常数,()为位于处的电势。当→0 时,则有
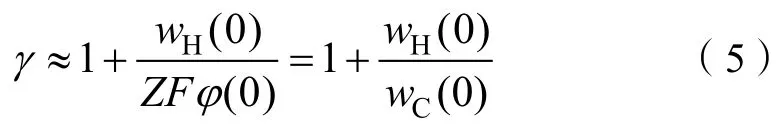
式中,(0)和(0)分别表示位于=0 处的库伦相互作用能和Hofmeister 能。
Gouy 和Chapman 求解Poisson-Boltzmann 方程得到了对称电解质体系中的解析解:
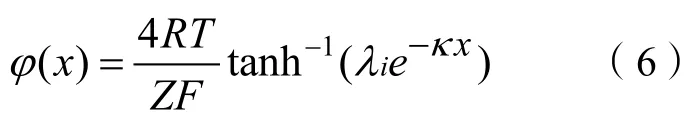
Du 等基于Gouy-Chapman 理论,得出()的计算方程式:
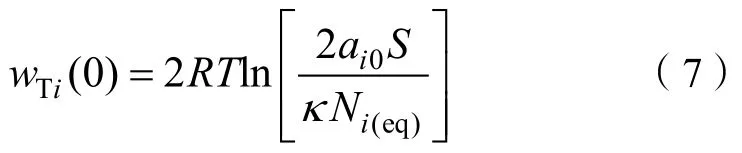
Li和Liu等通过实验分别得到(0)=1.18,(0)(0)≈ 0.901,因此,在蒙脱石分散体系中有(0)1.06 ≈ 1,Li可以作为参照阳离子((0)= 0),用来估算体系中其他离子的Hofmeister 能量。根据Li的吸附,可以得到库伦相互作用能:

式中,和分别表示Li在本体溶液中的平衡活度和Li的平衡吸附量。
开展i与Li的共同吸附实验分别获得i与Li平衡吸附量,根据式(7)和式(8)可以计算出阳离子的Hofmeister 能量。

其中
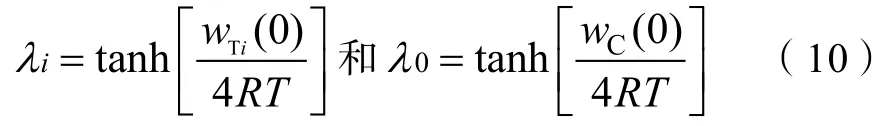
式中,()为与土壤颗粒表面相距处的总能,()和()分别表示在位于同样位置处的Hofmeister 能和库伦能。
2 结果与讨论
2.1 Hofmeister 效应对离子吸附动力学的影响
不同体系中的Na、K、Cs的累积吸附量随时间的变化如图1 所示。可以看出,在同一体系中,相同时间段内,各离子的累积吸附量均不相同,且离子吸附速率表现出明显的Hofmeister 效应,呈现出Na< K< Cs的趋势。例如,在电解质浓度为0.01 mol·L时,Na、K、Cs在27 分钟内的平均吸附速率分别为4.48,8.68 和11.74 mmol·kg·min。
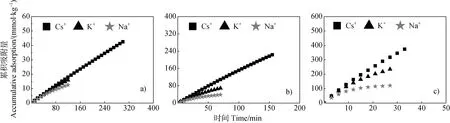
图1 Cs+、K+、Na+在Cu2+-蒙脱石表面累积吸附量随时间的变化Fig. 1 Variation of the accumulative adsorption of Cs+,K+ and Na+ on the surface of Cu2+-montmorillonite with time
将式(1)和式(2)写成差分形式,利用动力学实验数据作图,得到离子吸附速率dN()d和累积吸附量N()之间的关系,如图2 所示:(1)不同浓度条件下的碱金属离子Li、Na、K、Cs在交换Cu时均呈现出一级动力学特征,说明Cu-蒙脱石表面对该条件下碱金属离子Li、Na、K、Cs的吸附为弱静电力作用下的吸附;Du 等利用NaNO+ LiNO和CsNO+ LiNO在K-蒙脱石表面的吸附动力学研究发现,在电解质浓度为0.0001、0.001、0.01 mol·L时,Cs在交换K前期为强静电力作用下的零级动力学过程,一段时间后,转为弱静电力作用下一级动力学的过程。理论上,由于Cu等高价离子屏蔽土壤电场的能力强于K等一价离子,所以一价离子制作的饱和样相较于二价离子制作的饱和样,更易于在土壤颗粒表面形成负位能区,导致离子吸附的零级动力学过程更加容易出现,所以本研究中,Li、Na、K、Cs在Cu-蒙脱石表面下的吸附均未表现出零级动力学特征;(2)根据图2 得到的吸附动力学参数如表1 所示,表1 中Na、K、Cs平衡吸附量表现出明显的Hofmeister效应,呈现出Na< K< Cs的趋势。例如,在电解质浓度为0.01 mol·L时,Na、K、Cs的平衡吸附量分别为129.17、341.11、911.47 mmol·kg;(3)不同电解质类型条件下Li的平衡吸附量存在差异,在电解质浓度相等的条件下,依次表现为:Li(Na+Li)> Li(K+Li)> Li(Cs+Li)。例如,在电解质浓度为0.01 mol L时,(Na+Li)/Cu、(K+Li)/Cu、(Cs+Li)/Cu交换体系中Li的吸附量分别为107.08、94.67、91.22 mmol·kg。根据方程(8),体系中Li的Hofmeister 能均等于零。因此,Li吸附量差异的原因应是三个交换体系中Li-表面间的库伦相互作用能不同;(4)表1 中同时列出了碱金属离子交换K-蒙脱石饱和样的实验数据,在相同类型电解质及相等浓度的条件下,碱金属离子在K-蒙脱石饱和样中的平衡吸附量均大于本实验(Cu-蒙脱石饱和样)中得到的平衡吸附量。出现这种现象的原因是,在同等情况下,带两个电荷的Cu通常比带一个电荷的碱金属离子K与蒙脱石矿物表面具有更强的吸附力,并且Cu 属于过渡金属,易于提供内层的空轨道与蒙脱石表面形成配位键作用,使Cu在蒙脱石表面吸附时稳定性增强,故其吸附作用不同于碱金属的静电吸附。因此,二价Cu相比一价的K在蒙脱石表面吸附将会更牢固,所以当用一价离子去交换蒙脱石表面的二价离子Cu时,其平衡吸附量会降低。

图2 不同浓度Cs+、K+、Na+、Li+在Cu2+-蒙脱石表面的吸附动力学关系曲线Fig. 2 The adsorption kinetics relationship curves of Cs+,K+,Na+ and Li+ on the surface of Cu2+-montmorillonite relative to electrolyteconcentration
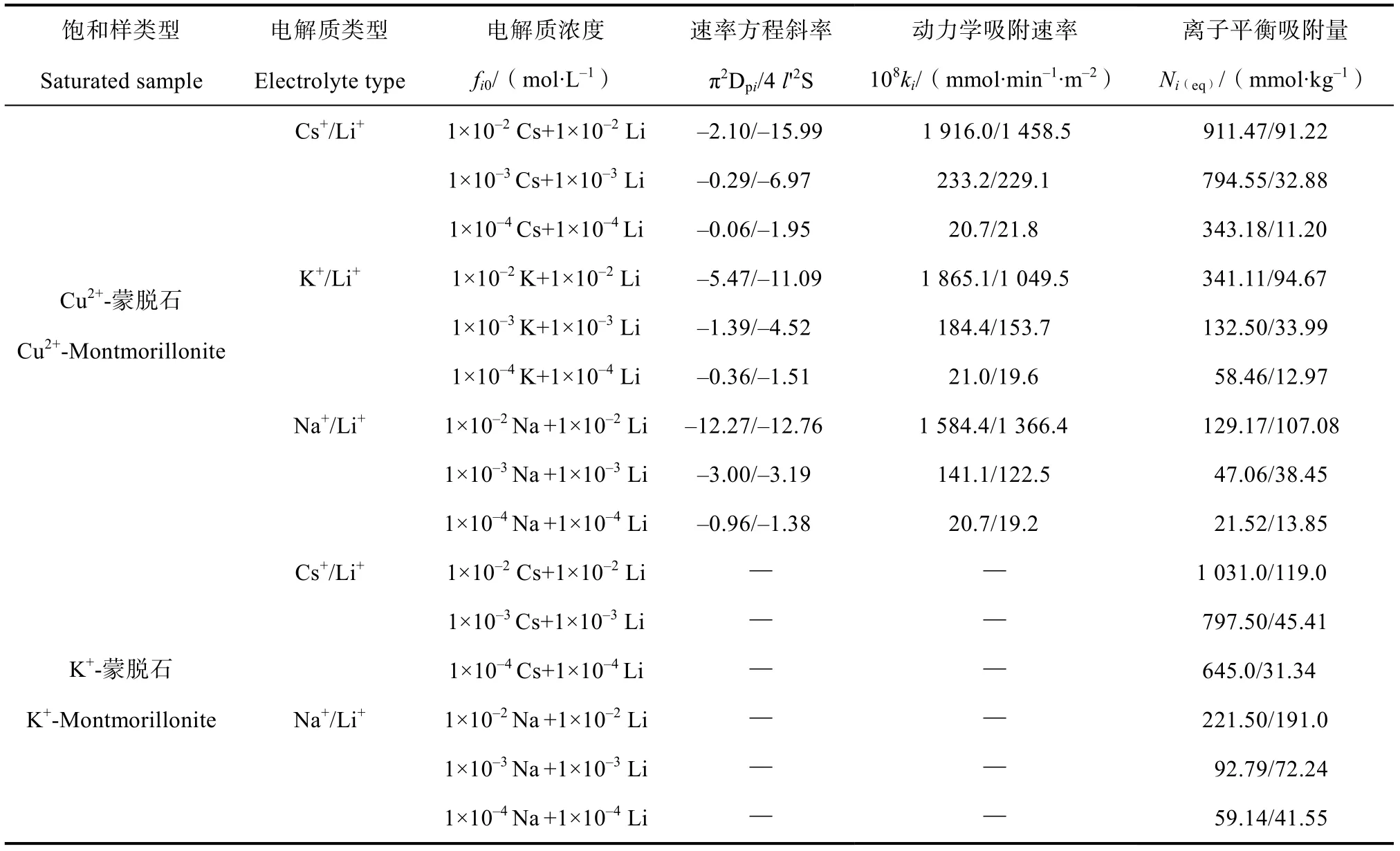
表1 离子吸附速率方程的相关参数Table 1 Relevant parameters in the ion adsorption rate equation
以上实验结果分析表明,碱金属离子在Cu-蒙脱石表面的吸附均出现了Hofmeister 效应,而Hofmeister 效应的发生总是伴随着离子-表面间能量的变化,为此,下文将估算黏土矿物表面的阳离子-表面Hofmeister 能量。
2.2 Hofmeister 能量的计算
根据方程(7)、(8)和(9)计算各体系中离子-表面间经典库伦相互作用能,Hofmeister 能和离子-表面间相互作用总能,计算结果绘于图3 中。在电解质浓度为0.0001,0.001 和0.01 mol·L时,(0)值分别为-15.68、-14.49、-10.22 kJ·mol,(0)值分别为-6.61、-5.88、-5.51 kJ·mol,(0)值分别为-1.87、-0.84、-0.78 kJ·mol。说明在所有实验浓度条件下,离子-表面间的Hofmeister 能呈现出(0)<(0)<(0)的顺序。研究中使用的蒙脱石,表面位置处的电场强度为2.21×10V·m,碱金属的核电荷数和电子层数大小顺序为Cs> K>Na,根据非经典极化理论,外电子层数更多的Cs将更易于受到强电场影响,外电场将更强烈地改变Cs的能量,导致Cs的Hofmeister 能量远高于K和Na。
电解质浓度为0.0001、0.001 和0.01 mol·L时,(Cs+Li)/Cu交换体系,(K+Li)/Cu交换体系,(Na+ Li)/Cu交换体系中的经典库伦能分别为-7.72、-7.55、-7.41 kJ·mol;-8.32、-7.69、-7.56 kJ·mol;-8.59、-8.19、-8.06 kJ·mol。所以,三个交换体系中,在相应电解质浓度条件下总相互作用能分别为-23.40、-22.04、-17.63 kJ·mol;-14.93、-13.57、-13.07 kJ·mol;-10.46、-9.03、-8.84 kJ·mol。根据计算,在0.0001、0.001 和0.01 mol·L电解质浓度条件下,(0)占(0)的比例为67.00、65.71 和58.00%;(0)占(0)的比例为44.24、43.36 和42.19%;(0)占(0)的比例为17.88、9.29、8.82%。由此,可以推测,在Cs-黏土矿物相互作用中,Hofmeister 能为主要贡献者;在K/Na-黏土矿物相互作用中,经典库伦能为主要贡献者。
2.3 表观电荷系数的计算
Li 等研究表明,离子的吸附交换过程与胶体双电层中的扩散过程为同一过程,即外电场作用下的扩散过程。吸附态离子在土壤表面电场的影响下发生非经典极化作用,根据上文分析,离子由此产生了不同于经典库伦能的新能量,即Hofmeister能,据公式(5),Hofmeister 能与经典库伦能的差异可由表观电荷系数直观反映。将实验得到(0)和(0)代入式(5)(图3)可得到表观电荷系数γ。不同电解质浓度条件下得到的表观电荷系数如表2 所示。表2 中同时列出了Du 等通过离子交换吸附实验测得的和,和的均值分别为2.354 和1.112。
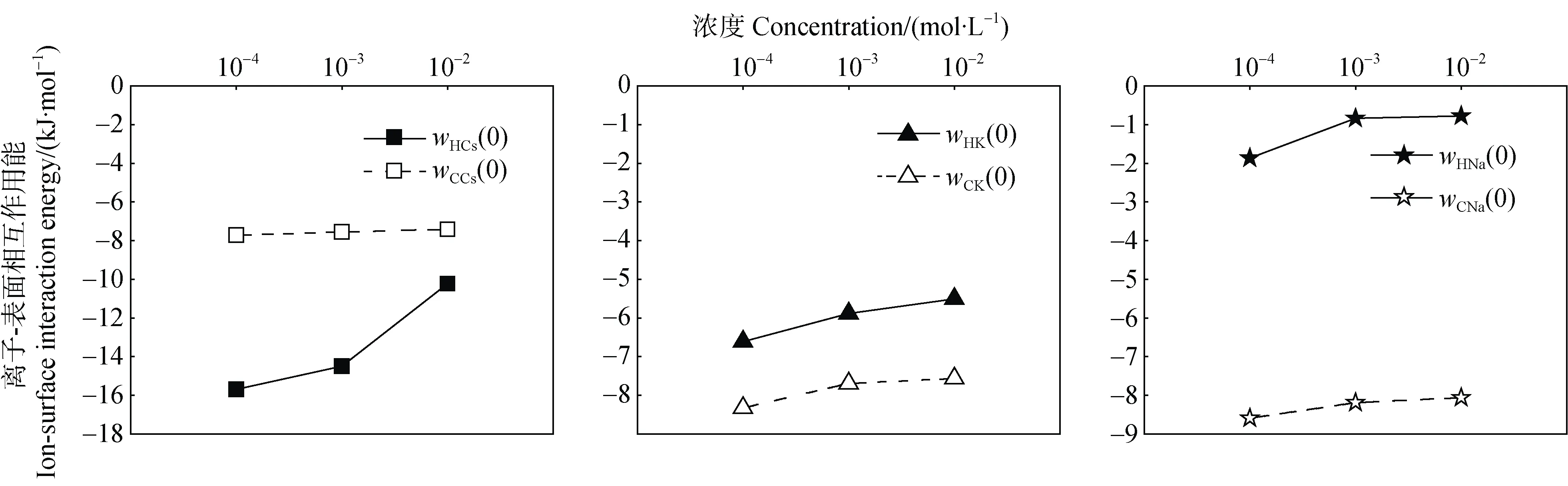
图3 不同电解质浓度条件下Cs+-表面、K+-表面、Na+-表面间相互作用能Fig. 3 Cs+-surface,K+-surface and Na+-surface interaction energy relative to electrolyte concentration
由表2 可以看出:(1)本实验计算所得Cs、K、Na在电解质浓度为0.0001、0.001、0.01 mol·L条件下的表观电荷系数Hofmeister 序列为Cs> K>Na;(2)离子表观电荷系数随着电解质浓度升高而减小。这是由于电解质浓度升高,双电层被压缩而增强了屏蔽电场的能力,扩散层中的电场强度降低,从而导致吸附态离子极化减弱,有效电荷系数减小;(3)Cu-蒙脱石表面的碱金属离子表观电荷系数与K-蒙脱石中的表观电荷系数之间的差值随着电解质浓度升高而减小,这是由两种体系下,作为参照的Li在扩散层中的位置决定的。金属离子在蒙脱石颗粒表面吸附示意图如图4 所示:
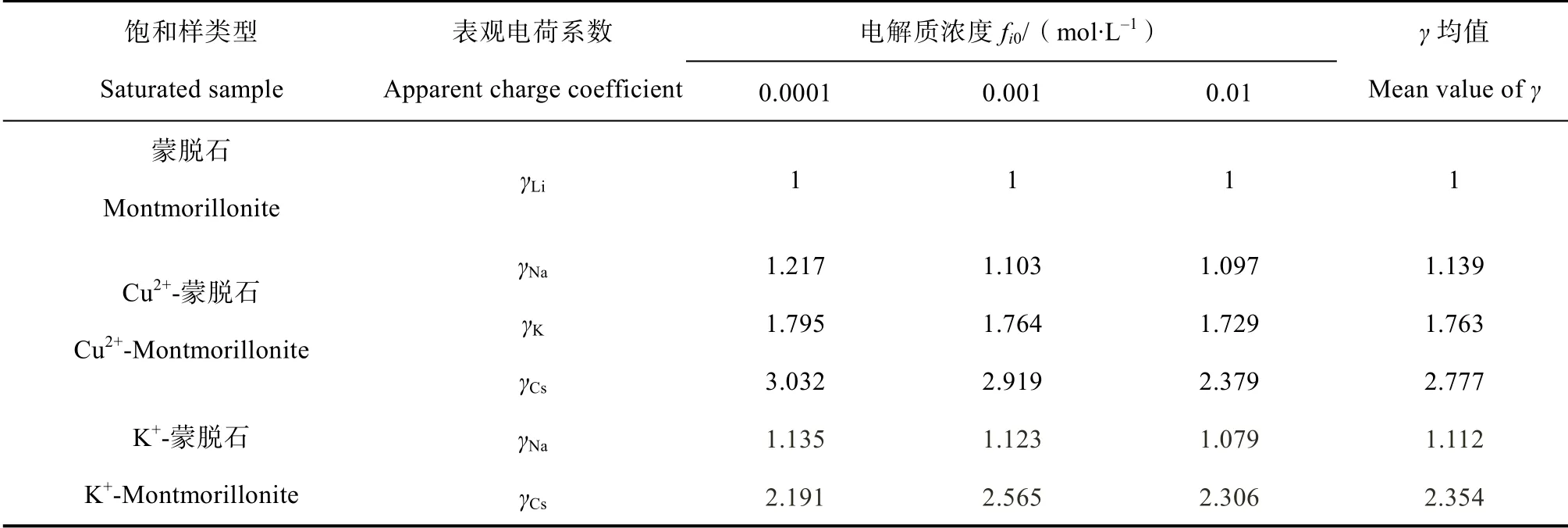
表2 Li+、Na+、K+、Cs+在蒙脱石表面的表观电荷系数Table 2 Apparent charge coefficients of Li+,Na+,K+ and Cs+ on the surface of montmorillonite

图4 Cu2+-蒙脱石表面离子吸附示意图[23]Fig. 4 Schematic diagram of ions adsorption on the surface of Cu2+-montmorillonite
根据Boltzmann 方程,离子在黏土矿物表面的吸附量可表达为:

式中,f()和()分别表示离子本体溶液的浓度和与表面相距处的总能:
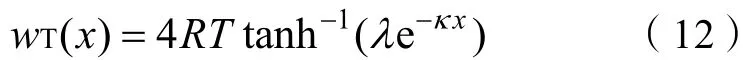
将式(12)代入式(11),化简得
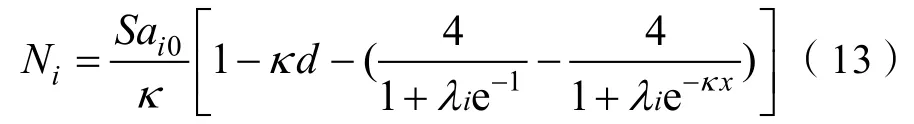
式中,表示平衡吸附时离子能够到达的最远位置,当离子到达黏土矿物表面时0,此时达到离子潜在吸附量的最大值,则式(13)可表示为:

根据式(14)求出各个体系的,代入式(13)得到不同体系中的。
由于在动力学实验中,离子的交换处于亚稳态平衡,交换离子的交换能力受到饱和离子类型的影响。由于Cu的吸附能力强于K,因此Cu-蒙脱石体系中交换离子,如Li离子,更难进入到扩散层的内层空间。例如,不同浓度下Cs、Li分别在Cu-蒙脱石和K-蒙脱石体系扩散层中的位置如图5 所示。
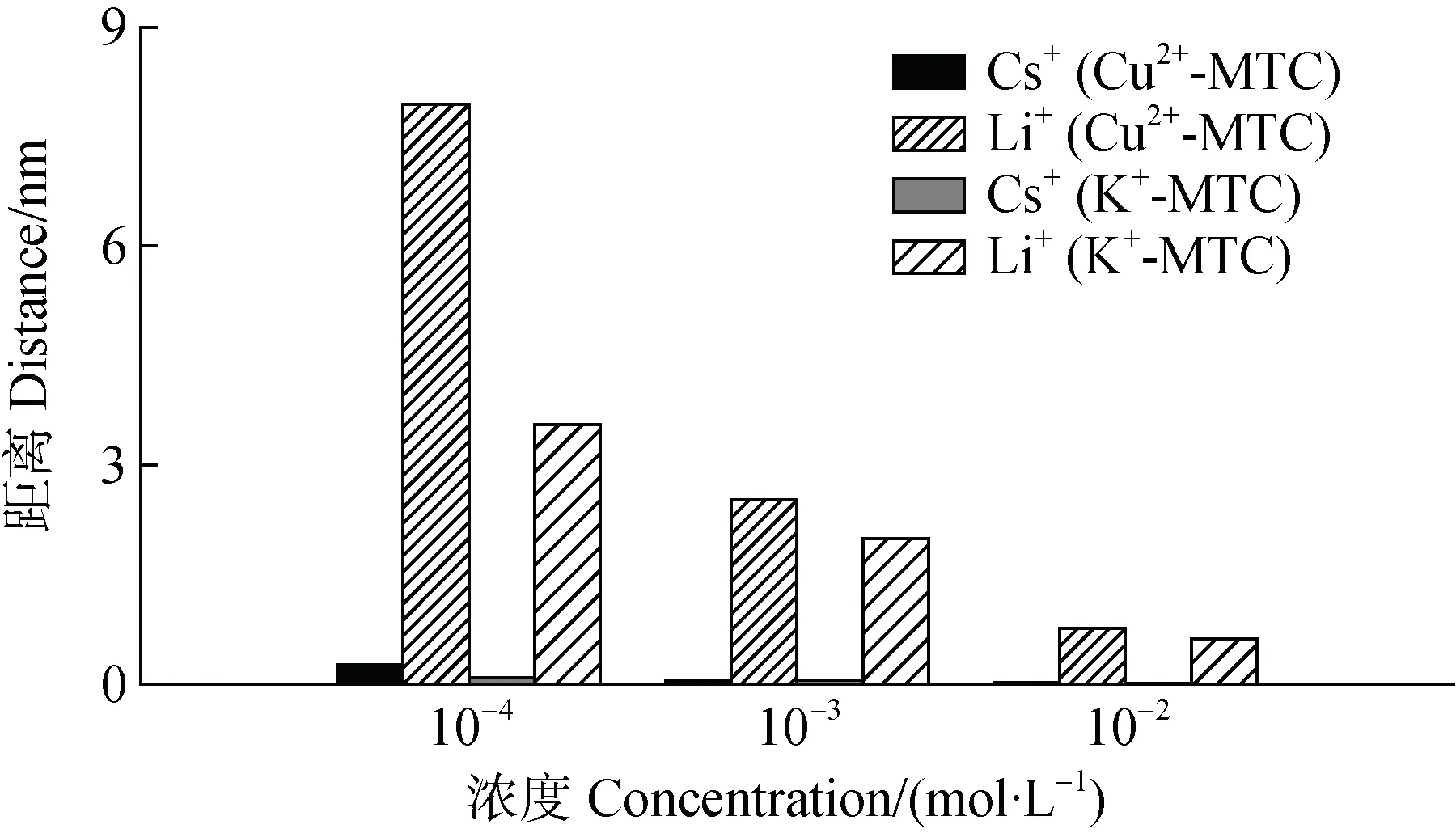
图5 不同电解质浓度条件下Cs+、Li+与Cu2+/K+-蒙脱石矿物表面的距离Fig. 5 Distance of Cs+ and Li+ from the surface of Cu2+/K+-montmorillonite relative to electrolyte concentration
Cs在 K-蒙脱石体系中进入到距离表面更近的位置,而在Cu-蒙脱石体系中稍远一些,此时Cs处于Cu-蒙脱石表面较远的位置,电场较弱而使Cs的极化较弱;另一方面,Li在Cu/K-蒙脱石体系中进入扩散层的位置不同,Li与K-蒙脱石表面距离更近,所得表面电位较Cu-蒙脱石体系高(表3),产生的库伦相互作用能更大,根据式(5)和式(8),此时将导致离子的表观电荷系数减小。二者综合结果,导致Cs在Cu-蒙脱石体系中的表观电荷系数较大。

表3 Cs+、K+、Na+存在时在蒙脱石表面的表面电位Table 3 Surface potential of montmorillonite in the presence of Cs+,K+ and Na+ respectively
本实验计算所得Cs、K、Na在电解质浓度为0.0001、0.001、0.01 mol·L条件下的表观电荷系数Hofmeister 序列为Cs> K> Na。根据上文分析,碱金属离子的表观电荷系数的差异与其在扩散层中的位置相关,如图6 所示,Cs、K、Na在Cu-蒙脱石体系中,三种电解质浓度条件下,离子与蒙脱石矿物的表面距离均表现为:,所以碱金属离子的表观电荷系数呈现Cs> K> Na的趋势。

图6 不同电解质浓度条件下Cs+、K+、Na+与Cu2+-蒙脱石矿物表面的距离Fig. 6 Distance of Cs+,K+ and Na+ from the surface of Cu2+-montmorillonite relative to electrolyte concentration
目前,对于重金属离子在土壤中的吸附行为研究多集中于土壤组分、离子类型以及体系酸碱度等因素,并且常借助其他体系的动力学模型来描述重金属离子的吸附过程。然而,研究表明,黏土矿物表面电场对土壤中重金属离子吸附机理的影响不可忽略。本研究考虑了土壤表面强电场对离子吸附的影响,探索了Hofmeister 效应产生的本质原因,区分了阳离子与黏土矿物表面相互作用能的差异,为进一步阐明土壤离子界面反应机制提供了理论依据。
3 结 论
通过不同浓度碱金属离子(Na、K、Cs)在Cu-蒙脱石表面的吸附动力学行为研究,对平均吸附速率、平衡吸附量、离子-表面相互作用能以及表观电荷系数的定量表征,得出以下结论:(1)Na、K、Cs在Cu-蒙脱石表面的吸附反应均表现出明显的Hofmeister 效应,呈现出Na< K< Cs的趋势;(2)Hofmeister 效应主要来源于离子的非经典极化作用引起的离子与表面相互作用能的差异,Na、K、Cs在Cu-蒙脱石表面的相互作用能呈现出Na<K< Cs的趋势;(3)非经典极化作用显著增大了离子的表观电荷系数,Na、K、Cs的表观电荷数分别从标准的+1 值增加为+1.14、+1.76 和+2.78。
