枸杞果多糖对哮喘小鼠巨噬细胞的免疫调节作用
2022-06-08高小平赵嘉庆
肖 静, 尹 梅, 高小平, 曲 晨, 赵嘉庆
(1.宁夏医科大学基础医学院,银川 750004; 2.宁夏回族自治区医学科学研究所,银川 750004;3.宁夏医科大学总医院心脑血管病医院,银川 750004; 4.宁夏医科大学总医院耳鼻咽喉颈外科,银川 750004;5.宁夏医科大学临床医学院,银川 750004)
枸杞是一种传统的中药,普遍应用于人们的日常保健[1]。可以用来缓解视觉模糊、腹痛、干咳、疲劳、头晕和头痛等症状[2],并且通过抗凋亡、降低DNA 损伤等延缓生物老化,是一种有效的抗衰老剂。枸杞果多糖(lycium barbarum polysaccharide,LBPs)作为枸杞的主要活性成分之一,在生物学上表现为降低血糖和神经保护的功效[3],具有有益健康的生理作用,包括免疫调节、抗病毒和抗氧化的活性[3-4]。
巨噬细胞是机体重要的免疫细胞,当机体发生炎性反应时,巨噬细胞可通过表型转换来调节免疫应答。巨噬细胞以两种极化方式对环境信号作出反应,包括经典的促炎激活(M1)和替代的抗炎激活(M2)[5-8]。M1 巨噬细胞由干扰素-γ(IFNγ)、细菌脂多糖(LPS)或肿瘤坏死因子-α(TNFα)触发,M1 巨噬细胞表达促炎因子,如白细胞介素(IL)-6、IL-1b、诱导型一氧化氮合酶(inducible NOS,INOS)和单核细胞趋化蛋白1(MCP-1)、环氧化酶(COX)-2,促进随后的炎症免疫反应[9-13]。巨噬细胞在机体肺部的表型具有可塑性和复杂性。本课题组前期在动物模型上证实了LBPs 可以通过减轻气道炎症及调节肠道菌群来调节小鼠免疫系统功能,但LBPs 是否具有调节巨噬细胞的功能尚不清楚[14]。炎性反应是一种复杂且高度协调的机制反应,涉及分子、细胞和生理变化,巨噬细胞作为一种固有免疫细胞在炎症发生发展中发挥重要作用[15-16]。本研究以过敏性哮喘小鼠为模型,探究LBPs 对机体巨噬细胞的调节作用,并在LPS 诱导的巨噬细胞炎症模型上进一步探究不同浓度的LBPs 对巨噬细胞的免疫调节作用。
1 材料与方法
1.1 材料与试剂
LBPs(含量为31%,浓度为1 200 mg·mL-1)由森淼公司提供;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的F4/80、藻红蛋白(phycoerythrin,PE)-Cy7 荧光素(PE-Cy7)标记的CD11b,购自eBioscience;流式抗体PE 标记的F4/80、别藻蓝蛋白(allophycocyanin,APC)标记的INOS 购自Biolegend;小鼠RAW264.7 巨噬细胞购自中国科学院典型培养物保存委员会细胞库;Ⅰ型胶原酶、卵清蛋白(ovalbumin,OVA)购自Sigma Aldrich;多聚甲醛购自Absin。
1.2 仪器与设备
高压蒸汽灭菌锅LDZX-75KBS(山东博科科学仪器有限公司);超净工作台SJ-CJ-2FD(苏洁医疗有限公司);光学显微镜BX43(深圳市三利化学品有限公司);GYXH-70 制冰机(厦门国仪科学仪器有限公司);流式细胞仪(BD FACS Celesta)。
1.3 实验方法
1.3.1 实验动物及OVA 诱导的小鼠过敏性哮喘模型 30 只雌性小鼠BALB/C 购于北京维通利华实验动物技术有限公司,随机分为磷酸盐缓冲液(phosphate buffer solution,PBS)对照组、哮喘模型组、LBPs+哮喘模型组,每组10 只。小鼠过敏性哮喘模型的构建共需4 周,前3 周为致敏阶段,第4 周为激发阶段,详细造模方案参考文献资料[14],具体如下。将小鼠置于无菌的饲养条件下适应2 周后开始实验,过敏性哮喘模型组小鼠及LBPs+哮喘模型组小鼠在第0、7、14 天腹腔注射由20 μg 的OVA 和2 mg 的氢氧化铝凝胶配制成的200 μL 致敏液,PBS 组给予等量的PBS作为对照;在第21~28 天每天滴鼻1 mg·mL-1的OVA 激发液50 μL,PBS 组给予等量的PBS 作为对照。此外,LBPs 干预组从开始造模前2 周每天以100 mg·kg-1对小鼠进行LBPs 灌胃直至死亡,PBS 组给予等量的PBS 作为对照。
1.3.2 小鼠肺部组织形态学变化观察 造模完成后取每组6 只小鼠,在第29 天对小鼠使用1%戊巴比妥钠经腹腔注射充分麻醉后,打开胸腔摘取肺组织,使用无菌PBS 将表面的血渍清洗干净后,分出小鼠的左侧肺组织,先用多聚甲醛固定,再进行石蜡包埋组织切片后使用苏木精-伊红(HE)染色20 倍观察小鼠肺部组织形态学变化。
1.3.3 小鼠肺组织单细胞悬液的制备 取出小鼠右肺,浸泡在1 mL 浓度为1 mg·mL-1的Ⅰ型胶原酶溶液中,充分剪碎后,37 ℃、180 r·min-1振荡2 h。经过300 目尼龙网膜过滤后得到单细胞悬液,直接加入3 mL 红细胞裂解液,于冰上放置5 min后,4 ℃离心去除红细胞,调整细胞浓度至1×107个/mL 备用。
1.3.4 流式细胞术检测小鼠肺组织总巨噬细胞以及M1 型巨噬细胞比例
从上述调好浓度的细胞悬液中取出100 μL进行流式细胞术染色。每个样本管中加入1 μL的FITC-F4/80 和1 μL 的PE-Cy7-CD11b 进行表面染色,冰上孵育30 min、室温固定30 min后边破膜边染色,加入1 μL 的别藻蓝蛋白(allophycocyanin,APC)标记的诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)染色30 min后使用缓冲液洗涤2 次,使用流式细胞仪进行检测。
1.4 细胞实验
1.4.1 细胞培养 小鼠RAW264.7 细胞培养于添加10%胎牛血清的高糖(high-glucose dulbecco’s modified eagle’s medium,DMEM)培养液中,不添加抗生素,置于含5%CO2、饱和湿度、37 ℃恒温培养箱中进行培养。每天观察细胞形态,培养基变黄时提示需换液,每2~3 d 传代1 次。
1.4.2 实验分组和处理 实验主要分为5 组,即PBS 对照组,100 ng·mL-1LPS 诱导的M1 巨噬细胞炎症模型组(M1 模型组),50、100、150 μg的LBPs 干预M1 巨噬细胞模型组(50 μg LBPs+M1模型组、100 μg LBPs+M1 模型组、150 μg LBPs+M1模型组)。每组5 个复孔。
以2×106个/孔的细胞铺于6 孔板中,待细胞完全贴壁后在LBPs 干预组中加入对应含量的LBPs 干预,对照组和M1 模型组予以PBS 处理同样的时间。8 h 后换用含有100 ng·mL-1的LPS的完全培养基继续培养24 h,对照组给予等量的PBS 处理。
1.4.3 观察巨噬细胞分化形态变化 正常生长的细胞大部分为圆形,经过LPS 诱导活化后的M1 型细胞呈现不规则的多边形,培养24 h 后,吸尽培养液,使用显微镜观察每组细胞的分化形态变化并对每个孔细胞进行拍照。
1.4.4 流式细胞术检测各分组中M1 巨噬细胞的比例 收集各组细胞的培养上清液,使用无菌PBS将6 孔板洗涤3 次后,每孔加入500 μL提前37 ℃预热的0.25%胰酶放于培养箱消化3 min,显微镜下观察到大量细胞成团块状飘起来时,加入500 μL 提前配制好的完全培养基终止消化,使用移液器将轻柔团块吹成单细胞。牛鲍式计数板计数细胞并调整浓度后取1×106个细胞于流式管,加入1 μL PE 标记的抗小鼠F4/80 染色30 min后室温固定30 min,加入破膜液和1 μL APC 标记的INOS 抗体冰上避光孵育30 min,边破膜边染色,经染色缓冲液洗涤后用300 μL 缓冲液重悬细胞并用流式细胞仪检测M1 细胞(F4/80+INOS)的比例变化。
1.5 统计学方法
数据采用Graph Pad Prism 5.0 软件进行分析并作图,计量资料经正态性检验后符合正态分布,以均数±标准差(±s)表示。多组间均数比较采用单因素方差分析,进一步组内两两比较使用LSD-t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠肺组织病理变化
在PBS 对照组中,小鼠支气管上皮细胞排列整齐,周围无炎性细胞浸润,肺泡细胞上皮壁较薄,支气管管腔平滑松弛,未见明显黏液分泌;而在哮喘模型组中,可以看到支气管和血管周围有大量的炎性细胞浸润,支气管黏膜上皮细胞变形,平滑肌增生明显,管腔狭窄,管壁增厚,大量杯状细胞聚集于肺泡内。在经过LBPs 干预后,肺组织的炎性细胞浸润明显减少、肺组织结构相对完整,黏膜增生程度较哮喘模型组减轻,见图1。
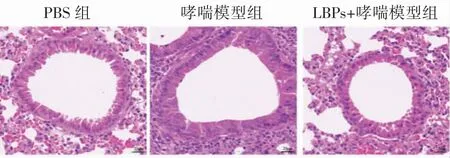
图1 各组小鼠肺组织病理变化(HE×20,Bar=20 μm)
2.2 各组小鼠肺总巨噬细胞数量的变化
与PBS 对照组(4.43%)相比,哮喘模型组肺部总巨噬细胞比例增加至6.99%(P<0.05);与哮喘模型组比较,经过LBPs 干预后,小鼠肺部总巨噬细胞的比例下降至5.51%(P<0.05),见图2。
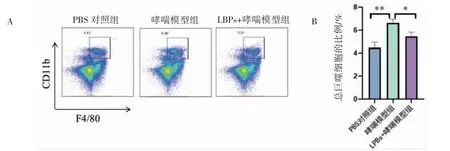
图2 各组小鼠肺部总巨噬细胞数量的变化
2.3 各组小鼠肺部M1 细胞的占比比较
在OVA 诱导的过敏性哮喘小鼠中,INOS 高表达的M1 型巨噬细胞的占比增加。与PBS 对照组相比,哮喘模型组M1 型巨噬细胞占比(7.79%)增加(P<0.05);LBPs+哮喘模型组(4.36%)与PBS对照组M1 型巨噬细胞占比差异无统计学意义(P>0.05);与哮喘模型组相比,LBPs+哮喘模型组的M1 型巨噬细胞的占比下降(P<0.05),见图3。

图3 各组小鼠肺部M1 细胞占比比较
2.4 巨噬细胞分化形态变化
对照组细胞呈圆形,形似葡萄串。与PBS 对照组对比,M1 模型组多数细胞形态呈不规则形状,并且伴有大量触角,分化情况严重;经LBPs干预后的实验组的细胞形态趋于正常,见图4。

图4 巨噬细胞分化形态变化(HE×40)
2.5 各组RAW264.7 巨噬细胞中M1 细胞的比例比较
经过LPS 诱导后,M1 巨噬细胞的占比增加(P<0.05)。在LBPs 干预的实验组中,M1 的细胞比例呈剂量依赖式下降。与PBS 对照组相比,M1模型组和三种剂量LBPs+M1 型巨噬细胞的数量均增加(P 均<0.05);与M1 模型组(57.1%)比较,50、100、150 μg 的LBPs 干预组,M1 细胞的比例分别下降至52.3%、51.4%和46.9%(P均<0.05)。
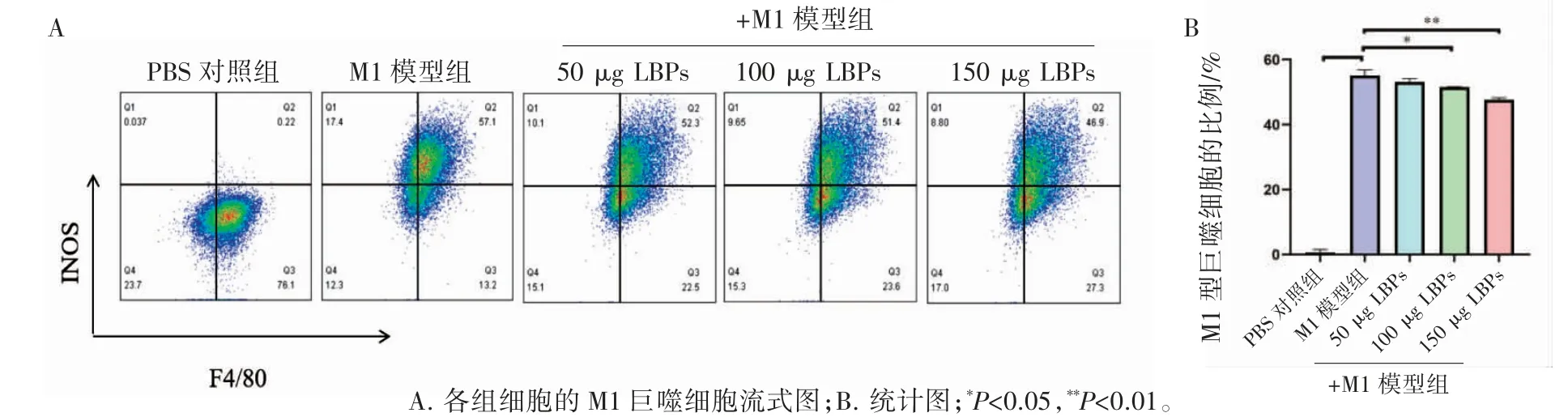
图5 各组RAW264.7 巨噬细胞中M1 细胞占比比较
3 讨论
巨噬细胞是固有免疫和适应性免疫的调控者,作为一种可在肺组织中存在的免疫细胞,能够调控机体免疫平衡和防御病原体。巨噬细胞还是一个极其异质性的群体,在暴露于微环境刺激后可以极化,不同表型的巨噬细胞调节多种疾病中的炎性反应,其中M1 巨噬细胞具有促炎作用,而M2 巨噬细胞与抗炎反应相关,因此巨噬细胞显示出促炎和抗炎功能的两面性[17-18]。巨噬细胞极化伴随着机体环境的变化调控,涉及多种细胞因子、趋化因子、信号分子,在炎症的发生发展中起着关键作用。
哮喘是一种异质性疾病,其特征是患者肺内气流阻塞,临床上表现为呼吸急促、喘息和胸闷,是由可变气流限制导致的[17]。巨噬细胞M1/M2 表型变化在该病发病过程中发挥关键作用,研究[18]表明,在OVA 诱导的哮喘模型中可以通过改变M1 和M2 的细胞比例(具体表现为减少M1 细胞比例和增加M2 细胞比例)来缓解小鼠的哮喘气道炎症。同时有证据[17,19-20]显示,在过敏性疾病中功能失调的巨噬细胞与哮喘的进展密切相关。巨噬细胞作为一种天然免疫细胞,存在于身体的各个部分,是呼吸系统中重要的免疫细胞之一,可以作为机体的第一道防线抵抗微生物的入侵,并且可以通过多种途径参与机体的炎性反应和组织修复[19-21]。此外,哮喘患者使用糖皮质激素治疗可调节气道巨噬细胞功能,其主要原理是通过减少巨噬细胞活性氧(ROS)的形成来降低哮喘气道中的氧化应激[22]。由此可见,在过敏性哮喘中减少巨噬细胞的数量可能是一种有效缓解哮喘症状的措施。
LPS 作为大多数革兰氏阴性细菌细胞壁的主要成分,由于能够触发炎症过程中的级联反应,使得RAW264.7 巨噬细胞极化为促炎表型的经典活化巨噬细胞(M1 巨噬细胞)[23]。其主要的形态学特点为,与未活化的RAW264.7 巨噬细胞相比,其形态变为长梭形或者不规则多边形,而未活化的细胞主要呈现为形态均一的圆形[24]。巨噬细胞中的一氧化氮(nitronic oxide,NO)水平与巨噬细胞的免疫活性密切相关,NO 是活化的巨噬细胞杀死致病性微生物和肿瘤细胞的主要途径,但过量的NO 也会诱导炎性细胞因子的分泌,iNOS 是体内产生NO 的关键酶[25-26]。在本文中,RAW264.7 巨噬细胞可以通过LPS 诱导成高表达iNOS 的M1 细胞表型,M1 细胞作为一种典型的促进炎症的细胞表型,可以分泌大量促炎因子、趋化因子等,从而刺激机体产生急性适应性免疫应答[26-27]。
植物多糖多为大分子多糖,研究[28-29]表明,多糖(仙人掌多糖、羊栖菜多糖等)可以通过调节巨噬细胞炎症相关的分子发挥免疫学功能,植物多糖可以促进细胞因子的释放,具有调节巨噬细胞内信号通路的作用。一项实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)的研究发现[30],黄芪多糖(APS)可以显著抑制巨噬细胞M1 的标记物表达,从而可以改善EAE炎症反应的微环境。本课题组前期以OVA 诱导的哮喘为模型进行LBPs 干预发现,LBPs 可以调节T 细胞的平衡,具体表现为降低哮喘致病机制的Th2 型免疫应答(模型组Th2 细胞比例为7.2%,干预LBPs 后小鼠Th2 比例下降至2.0%)[31]。
本研究结果显示,LBPs 可以缓解过敏性哮喘小鼠肺部炎症水平,减少小鼠肺部总巨噬细胞和M1 巨噬细胞的占比,与课题组前期的研究结论(LBPs 具有的抗炎作用)一致[14,31]。进一步在LPS 诱导的RAW264.7 巨噬细胞炎症水平实验验证了LBPs 可以减少巨噬细胞的M1 巨噬细胞的占比,说明LBPs 具有调节巨噬细胞免疫功能的作用。巨噬细胞是一种机体重要的固有免疫细胞,本研究证实LBPs 能够缓解巨噬细胞的炎症水平,LBPs 缓解巨噬细胞炎症水平的具体机制需进一步研究。
