土人参对铅胁迫的生理响应
2022-06-07董倩李娴
董倩,李娴
(福建技术师范学院a.近海流域环境测控治理福建省高校重点实验室;b.食品与生物工程学院,福建福清 350300)
铅(Pb)在自然界土壤和岩石中广泛分布,土壤中铅含量平均值在15~25 mg/kg 之间[1],而我国土壤铅背景值则接近或高于世界平均值上限.随着我国工业化和城市化进一步加快,使铅不断沉积到土壤中,工矿废弃物、农药化肥、车辆含铅尾气以及有害生活垃圾(如废弃电池、含铅涂料)是城乡铅污染的主要源头[2],导致我国土壤质量恶化更加严重.对人类而言,铅是一种有害的重金属元素[3],可通过食物链进入人体,影响新陈代谢、生长发育和身体健康[4].目前,植物修复技术在土壤重金属污染治理中应用最广,具有绿色高效、低成本,不会破坏土壤环境和造成二次污染的优点[5].土壤中重金属胁迫下,植物体内活性氧的增加,导致DNA、脂类、蛋白质等过氧化,从而造成细胞损伤,生理代谢紊乱[6],一般植物难以正常生长;铅耐受植物则会通过提高抗氧化酶类活性和渗透调节物质含量来提高自身抗性[7],通过根部吸收和特定组织区域富集,以降低铅活性来降低铅的危害[8].因此,治理土壤铅污染的重点和关键是筛选和种植铅耐受植物[9],尤其是筛选适宜的耐铅园林观赏植物,达到治理与美化环境的双赢效果.因此,筛选对铅胁迫环境适应性较强的耐铅园林观赏植物,对环境修复和园林绿化都具有重要意义.
土人参为马齿苋科土人参属,多年生宿根草本植物,株高30 ~70 cm,叶片翠绿油亮,圆锥花序顶生或腋生,具长花序梗,花小而多,粉红色或淡紫红色,红色蒴果近球形,似红色的“小豆点”,整体看非常漂亮,花果期较长,园艺欣赏价值高.现广泛分布于我国中、东部和西南部地区,具有耐热、耐旱、耐贫瘠、病虫害少、生长快和易栽培等特点.以往国内外学者主要对其生物学特性[10]、栽培技术[11-12]、成分药性和药理展开研究[13-16].近期研究也主要集中在生理生化[17-18]、组织培养[19-20]和营养成分提取分析[21-23]等方面,但在其抗性生理尤其是在重金属胁迫和耐受性方面的研究很少.仅仰路希[24]发现土人参对镉有一定的累积能力,生理上表现“低促高抑”的现象,而土人参对铅离子胁迫以及耐受性方面的研究还未见报道.探究铅离子胁迫对土人参生理生化指标的影响,确定土人参对铅的耐受性,为其是否适于种植在铅污染地区提供理论支撑.
1 材料与方法
1.1 供试材料准备
称取土人参种子(4℃干燥保存)约1 g,阳光晾晒2 h,掺入20 倍体积干细沙,拌匀后撒播于育苗盘面上(8 cm 厚湿润育苗营养土),盖1~2 mm 薄层细沙,盖薄膜保湿,置于25℃的培养箱中两周后出苗,揭膜后移至人工气候室中继续培养,培养温度26℃,14 h/10 h光暗周期,光照度为2000 Lx,室内空气湿度60%.待小苗长至高度3~4 cm(3 片真叶)时,挑选健壮苗移栽到21 孔穴的育苗穴盘中,继续培养至苗高10 cm,再次移栽定植到装有营养土的花盆(规格为1 L),室内继续培养2个月后,挑选长势一致的植株开展铅胁迫盆栽实验,培养条件不变.胁迫所用铅供体为无水Pb(CH3CO2)2(国药集团),用去离子水分别配制各浓度铅胁迫处理液.
1.2 铅胁迫时间对土人参的影响
处理前3 d 停止给土人参苗浇水,处理时每盆缓慢浇入1.5 mmol/L 乙酸铅溶液500 mL,对照组则用去离子水500 mL 浇灌.胁迫每两天处理一组,每组5 盆;按处理的先后排序,分别为铅胁迫10 d、8 d、6 d、4 d、2 d、0 d(对照),共设6 组,胁迫试验进行10 d,第11 天取样测定各项生理指标;胁迫期间只定量定时补充去离子水,不施肥.
1.3 铅胁迫浓度对土人参的影响
处理前3 d 停止给土人参苗浇水,处理时每盆缓慢浇入相应浓度的乙酸铅溶液500 mL,对照组则用去离子水500 mL 浇灌.设置铅胁迫浓度分别为0(对照)、0.8、1.5、2.3、3.1、3.8、4.6 mmol/L,共7 组处理,每组处理5 盆.胁迫期间只定量定时补充去离子水,不施肥.胁迫10 d 后取样测定各项生理指标.
1.4 生理生化指标测定
选择土人参+3、+4 叶(生长点下数第3、4 片成熟叶)测定生理生化指标.用分光光度法测定叶绿素含量[25],愈创木酚法测定过氧化物酶(POD)酶活力和硫代巴比妥酸法测定丙二醛(MDA)含量[26].
1.5 数据统计与分析
采用 Excel 2013 和 SPSS 20.0 对数据进行统计分析,采用Duncan's 进行多重比较(α=0.05).
2 结果与分析
2.1 铅胁迫时间对土人参的影响
2.1.1 铅胁迫时间对土人参叶绿素含量的影响由表1 可知,用1.5 mmol/L 浓度的铅胁迫0 ~10 d,土人参的叶绿素总含量变化幅度较小,最大变幅仅为9.43%,变化不显著.叶绿素a(Chl a)含量呈先下降后上升的趋势;叶绿素b(Chl b)则反之,呈先增后减的趋势;Chl a / Chl b 比值在胁迫4 d 内下降,6 d 后上升至对照水平,8 d 后再次下降,10 d 后又少量上升,差异显著,未呈现单一的上升或下降趋势.胁迫2~4 d,Chl a / Chl b 比值显著下降,是由于Chl a 和Chl b 含量较对照发生显著变化,Chl a 含量下降,Chl b 含量上升,Chl a /Chl b 比值达最小(0.69~0.89),表明土人参能对铅胁迫做出快速响应,Chl a / Chl b 比值对铅胁迫比较敏感.任安芝等[27]认为,因为重金属首先破坏Chl a 的缘故,Chl a / Chl b 比值可作为衡量植物对重金属胁迫相对变化敏感的一个生理指标.铅胁迫后土人参Chl a / Chl b比值虽然发生较大的波动,但叶绿素总含量的变化却不显著,可能是该浓度的铅胁迫对土人参并未造成很大的伤害,胁迫造成Chl a 水解和氧化,并没有完全破坏降解,而是通过叶绿素循环又转化为Chl b 和Chl a,使得Chl a 和Chl b 发生相互转化[28],Chl a / Chl b 比值出现波动变化.

表1 铅胁迫时间对土人参叶绿素含量的影响
2.1.2 铅胁迫时间对土人参POD 活性的影响
POD 活性在铅胁迫的前4 d 相差不大,第6 天开始显著上升,于第10 天达到最大值(22.6 U/g),为对照组(7.2 U/g)的3 倍,变化差异显著(图1).结果表明铅胁迫4 d后土人参的应激响应迅速,POD 活性快速提高,开启抗氧化防御机制.POD 活性的维持和提高是植物耐受重金属胁迫的物质基础之一,有利于消除体内活性氧,防止细胞膜受损.铅胁迫6 d 后,由于POD 活性的提高,Chl a 转化合成加快,Chl a / Chl b 比值又恢复到接近胁迫前的水平.

图1 铅胁迫时间对土人参POD 酶活性的影响
2.1.3 铅胁迫时间对土人参MDA 含量的影响
MDA 是膜脂过氧化的产物[29].植物体内MDA 的含量是衡量膜脂质过氧化损伤的重要指标,也是衡量植物对外界逆境抵御能力强弱的指标.铅胁迫对植物体内MDA 含量的影响在植物中的反应较为相似[30-31],但不同植物对铅胁迫有不同的耐受性.
随着铅胁迫时间的延长,土人参叶片中MDA 含量呈先下降后缓慢上升的趋势,10 d后显著增加到最大值43.5 nmol/g(图2).结果表明铅胁迫10 d 内土人参膜脂发生过氧化,但过程比较缓慢.根据铅胁迫期间的观察,土人参生长良好,初步推断其对铅胁迫具有更大的耐受性.比较图1 和图2 发现,MDA 与POD 对铅胁迫的响应变化趋势相似,前4 d 变化较小,土人参可以通过自身的光合生理调节适应短期的铅胁迫,表现出对铅胁迫具有较好的耐受力;而后随着胁迫时间的延长,土人参能较快的通过上调抗氧化酶活性升级保护防御机制,延缓膜脂过氧化进程.综上分析表明,土人参对铅胁迫的应激响应较为快速,生长良好,对铅胁迫具有更大的耐受性.

图2 铅胁迫时间对土人参MDA 的影响
2.2 铅胁迫浓度对土人参的影响
2.2.1 铅胁迫浓度对土人参叶绿素的影响
土人参在不同浓度铅胁迫10 d 后,随胁迫浓度的升高,叶绿素总含量均低于对照,总体呈下降态势(表2). 胁迫浓度为0~3.8 mmol/L 之间时变化不显著;4.6 mmol/L 时,叶绿素总含量显著降低(0.5 mg/g),较对照降低了26.5%(表2). Chl a 含量的变化趋势与叶绿素总含量的变化趋势相同;Chl b 的变化较对照显著降低;但Chl a/Chl b 比值整体保持相对稳定,没有因胁迫浓度的提高而发生显著变化.由此可见,土人参能耐受0 ~3.8 mmol/L浓度的铅胁迫,对该胁迫浓度不敏感,叶绿素含量基本不受影响.
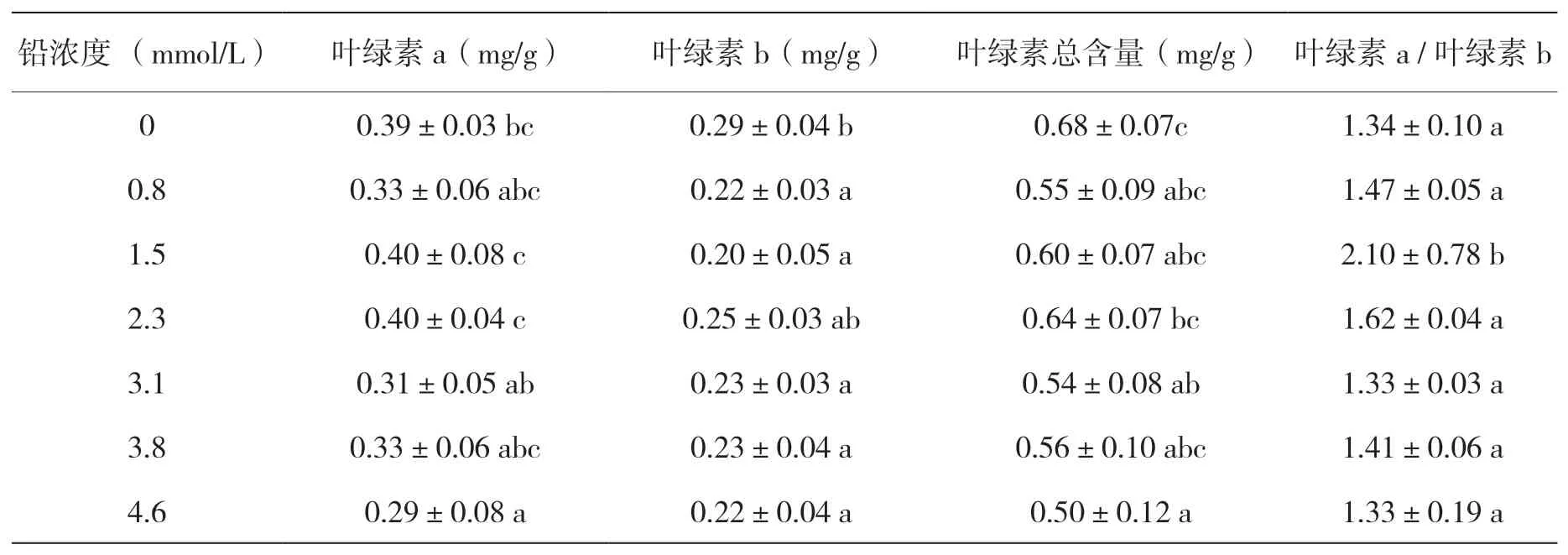
表2 铅胁迫浓度对土人参叶绿素含量的影响
2.2.2 铅胁迫浓度对土人参POD 活性的影响
随铅胁迫浓度的升高,土人参POD 酶活性呈先升后降的趋势(图3).低浓度胁迫(0.8 mmol/L)对土人参的POD 活性影响不显著;中高浓度胁迫(1.5~4.6 mmol/L)使POD 活性较对照显著上升,而此浓度区间内POD 活性变化不显著,胁迫浓度为2.3 mmol/L 时POD酶活最高,约为对照的2 倍,而后缓慢下降;高浓度铅胁迫(4.6 mmol/L)时的酶活依然较高,是对照的2 倍.

图3 不同浓度铅胁迫对土人参POD 活性的影响
POD 活性是对铅毒害相对敏感的指标,一定浓度的铅胁迫会提高其活性,这也是所有植物对各种胁迫的共同响应特征,其活性的增加能提高植物抗氧化能力,与植物耐受性直接相关[32],POD 活性越高植物适应性也就越强.但是,在铅胁迫浓度增高达到其耐受阈值或极限时,植物细胞因膜脂过氧化受到较大损伤,细胞失去正常生理和生物大分子合成机能,预示着POD 的合成和活性受到影响,出现抗氧化保护机能下降的现象[33-34].综上分析表明,2.3 mmol/L可能是土人参对铅胁迫的耐受阈值,土人参能很好地耐受中高度铅污染的土壤环境;高浓度(4.6 mmol/L)铅胁迫10 d 后,POD 活性并没有出现显著下降,表明土人参短期耐铅胁迫的能力更强.
2.2.3 铅胁迫浓度对土人参MDA 含量的影响
MDA 质量浓度总体呈现上升态势,低浓度铅胁迫(0.8 mmol/L)对土人参MDA 含量变化影响不显著,中高浓度铅胁迫(1.5~4.6 mmol/L)对土人参造成明显胁迫,MDA 质量浓度较对照显著增加(图4).当胁迫浓度达到3.1 mmol/L 时,MDA 质量浓度达最大值56.3 nmol/g,约为对照(26.6 nmol/g)的2 倍,差异显著.可见中高浓度铅胁迫使土人参膜脂过氧化水平不断增大,生理受害程度不断增大.

图4 不同浓度铅胁迫对土人参MDA 质量浓度的影响
铅是植物生长的非必需元素,不同植物对铅的耐受性也不同,虽然微量的铅可促进植物生长[33,35-36],但是大量的铅对大部分农作物都是有害的[37];铅通过食物链进入人体,影响人们的身体健康,因此,土壤铅污染是现代社会发展亟待解决的问题.目前,土壤重金属污染应用最广的是植物修复技术,筛选和种植铅耐受植物,在治理解决土壤铅污染中起到至关重要的作用,尤其是筛选适宜的耐铅园林观赏植物,既能实现环境治理又能美化环境.
研究发现土人参对铅胁迫表现出较强的耐受力.在1.5 mmol/L 铅胁迫浓度下,随着胁迫时间的延长,土人参合成自身生长所需叶绿素的量不减反增,说明土人参能够适应该浓度的铅胁迫.当铅胁迫浓度逐步升高,其叶绿素含量有所下降,高浓度铅会抑制土人参叶绿素的合成,这与其它物种上的研究报道相吻合[38-40].在铅胁迫浓度为2.3 mmol/L 时,POD酶活性达到最高,是土人参对铅胁迫的耐受阈值.已有研究表明,POD 酶活随铅胁迫浓度的增加大都呈现出先升后降的趋势[41-43],大部分植物在POD 酶活性下降时均会表现出生长受到抑制甚至损害[33,44-45],因此,可根据POD 活性达到峰值时的铅胁迫浓度高低作为初步判定植物对铅耐受性高低的标准.据此标准分析发现,大多数草本园艺观赏植物的铅耐受浓度区间在0.2~1.0 mmol/L,比如紫茉莉、洋常春藤、东方香蒲和碗莲等园林花卉[45-52],极少数花卉如白雪姬[53]和喜盐鸢尾[54]能达到3.1~5.0 mmol/L.可见,土人参对铅胁迫的耐受力(2.3 mmol/L)优于大部分草本观赏植物,甚至达到部分木本植物的耐受力[55-56].根据《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018)规定,铅污染风险管制值上限为400 mg/kg(1.9 mmol/kg)、水田为1000 mg/kg(4.8 mmol/kg),土人参适宜种植在风险管制值以上的铅污染土壤环境,是极具土壤铅污染修复潜力和开发应用价值的观赏植物.今后可进一步对其各器官吸附和富集铅能力、铅耐受相关基因等进行更深入的研究,以期为铅污染地区的生态修复和土人参的开发利用提供理论支撑.
